最详细地流式细胞仪实验方法
流式细胞仪操作规程

流式细胞仪操作规程流式细胞仪是一种用于单个细胞分析的高通量仪器,广泛应用于生物医学研究、药物开发和临床诊断等领域。
为了确保流式细胞仪的正常运行和准确结果的获取,需要制定一套规范的操作规程。
以下是流式细胞仪操作规程的一些基本要点:一、实验前准备:1.确保流式细胞仪处于稳定状态,并将其连接到电源并打开电源。
2.检查仪器的液氮箱和压力容器,确保液氮和气源充足。
3.准备实验所需的标本样品和相应试剂。
4.检查流束对齐和测量准备:校准激光、确定流速、检查流束质量控制。
二、流式细胞仪样品制备:1.使用无菌技术制备样品,并严格遵循相关操作规范。
2.样品的准备应考虑到细胞的数量和稳定性,避免细胞聚集、损伤或死亡。
3.样品的制备应注意避免氧化和污染的发生,以确保结果的准确性。
三、样品装载和分析:1.使用无菌技术将样品加载到流式细胞仪中,并确保样品注射器和管道清洁和无气泡。
2.对于多个样本的分析,应注意正确的样品顺序和识别,以避免混淆。
3.设置合适的仪器参数和测量条件,例如流速、激发和发射光源、滤光片设置和增益调节等。
4.开始样品分析之前,应进行负空白检测和仪器的系统背景校正。
5.开始实验后,密切观察结果窗口,并根据需要进行相应的数据记录和保存。
四、实验后操作:1.实验结束后,关闭流式细胞仪和相关辅助设备,并进行正常关机程序。
2.将仪器和试剂的残留物清洁干净,并按照相关操作规范进行废弃物的处理。
3.维护仪器的常规保养,例如清洁仪器表面、更换滤光片、标定仪器等。
4.及时记录和整理实验数据,并进行必要的数据分析和结果解释。
五、安全注意事项:1.在操作过程中,应遵守相关的生物安全和化学安全规范,例如穿戴好实验室服装、戴手套、戴眼镜等。
2.对于辐射性或有毒性样品的操作,应采取额外的防护措施,例如使用密封容器、穿戴防护服等。
3.在使用激光和其他高能源光源时,注意防护眼睛和暴露部位,避免直接观察激光光源。
总结:流式细胞仪是一种复杂的仪器,需要严格的操作规范来确保实验结果的准确性和数据的可靠性。
流式细胞术实验技巧及数据分析

流式细胞术应用领域
免疫学研究
用于检测免疫细胞表面标志物、 细胞亚群分类和功能分析等。
生殖医学研究
用于精子分析和胚胎发育监测等 。
血液学研究
用于检测白血病、淋巴瘤等血液 肿瘤细胞的表面抗原和基因表达 。
肿瘤学研究
用于检测肿瘤细胞的生长、凋亡 和转移等生物学特性。
流式细胞术实验技巧 及数据分析
日期:
• 流式细胞术简介 • 流式细胞术实验技巧 • 流式细胞术数据分析 • 流式细胞术实验问题与解决 • 流式细胞术实验案例分享
目录
Part
01
流式细胞术简介
流式细胞术定义
流式细胞术是一种在液流中快速检测和分离单个细胞的生物技术。通过将细胞悬 浮在液流中,并使用激光束照射细胞,可以测量细胞的物理和化学特性,如细胞 大小、颗粒质量和荧光标记等。
物的群体结构、进化关系和生态分布等方面。
THANKS
感谢您的观看
仪器参数,如光电倍增管
电压、滤波器等。
数据采集
3 确保数据采集的完整性和
准确性,避免丢失或重复 采集数据。
Part
03
流式细胞术数据分析
流式细胞术数据分析
• 请输入您的内容
Part
04
流式细胞术实验问题与解决
荧光补偿设置问题
总结词
荧光补偿设置是流式细胞术实验中的 重要环节,用于消除不同荧光染料间 的光谱重叠。
细胞群体识别问题
总结词
细胞群体识别是流式细胞术实验的重要环节,直接影响实验 结果的分析和解读。
详细描述
在流式细胞术实验中,需要准确识别和区分不同的细胞群体 。通过优化抗体标记组合、采用多参数分析等方法,可以提 高细胞群体识别的准确性和可靠性,为后续的数据分析和解 读提供有力支持。
最详细的流式细胞仪实验方法

最详细的流式细胞仪实验方法流式细胞仪(Flow cytometry)是一种高精度的细胞分析技术,可用于快速鉴定和分离多种类型的细胞。
本文将介绍一种常用的流式细胞仪实验方法,包括样品准备、细胞染色、细胞分析和数据分析等步骤。
一、样品准备1.收集细胞:制备单细胞悬液,如细胞培养物等。
2.细胞计数:使用细胞计数器或血细胞计数板等工具,计算细胞密度。
3. 调整浓度:根据流式细胞仪系统的要求,将细胞悬液的浓度调整至适当的浓度(一般建议在1×10^5至1×10^6个细胞/ ml之间)。
二、细胞染色1.封闭非特异结合位点:为了减少非特异性结合,可使用FBS(胎牛血清)或BSA(牛血清蛋白)等以阻断非特异位点。
2.添加荧光染料:选择合适的染料,如草酰胺(CFSE)、丙酮染料(ATTO)或FITC等。
按照厂家说明书中建议的浓度将染料添加到样品中,好洗脱或者可用来鉴定细胞的抗体,如表面标记、核酸染色剂或功能性抗体。
3.染色溶液:在4°C下孵育细胞悬液至少30分钟(具体时间根据实验需要决定)。
4.洗涤:向样本管中加入足够的缓冲液,使细胞悬液稀释五倍,并离心沉积细胞。
5.弃去上清液:将上清液弃去,然后用足够的缓冲液再次洗涤沉积的细胞。
6.重悬:向样品管中加入适量的缓冲液,使细胞形成合适的细胞密度。
三、设置流式细胞仪1.打开仪器:确保仪器已开启并运行正常,各通道和检测器已连接好,并预热至适当温度。
2.校正:根据仪器的手册,对流式细胞仪进行校正和标定,以确保流式细胞仪的准确性和稳定性。
3.样品管固定:将样品管插入到流式细胞仪中相应的槽中,以确保准确读取。
4.设置参数:在计算机或流式细胞仪仪器的界面上设置所需参数,如细胞个数、细胞染色等。
四、细胞分析1.利用流式细胞仪:启动流式细胞仪软件,并确保硬件与软件连接正常。
2.定位细胞:在细胞分析开始前,调整激光位置和侦测器的灵敏度,以确保对准确获取细胞。
流式细胞术活细胞实验步骤

流式细胞术活细胞实验步骤A. 溶液与试剂注:利用反渗透去离子水 (RODI) 或同等级别的水制备溶液。
011X 磷酸盐缓冲盐水(PBS):配制 1 L 的 1X PBS:添加 100 ml 10X PBS至 900 ml 水,然后将其混合。
02抗体稀释缓冲液:购买即用型流式细胞术抗体稀释缓冲液,或在100 ml 1x PBS 中溶解 0.5 g 牛血清白蛋白 (BSA)来制备 0.5% BSA PBS 缓冲液。
4°C 保存。
03推荐的二抗:要检测未偶联的抗体,请选择与一抗(例如兔)的宿主物种匹配的二抗。
注:在您的实验中加入荧光细胞染料(包括活性染料、DNA 染料等)时,请参考所添加的染料产品页,了解建议的实验步骤。
B. 免疫染色注:使用血细胞计数器或备选方法计数细胞。
注:如果使用全血,则需在免疫染色之前裂解红细胞并通过离心分离来洗涤。
注:为防止人 Fc 受体与兔 IgG 或小鼠 Fc 受体与兔或小鼠 IgG 结合,在免疫染色前用 Fc 块预孵育活细胞。
注:理想的离心条件根据细胞类型和试剂容量有所不同。
一般,1-5 分钟 150-300g 将足以使细胞沉淀下来。
01将所需数目的细胞分装入试管或小孔中。
(通常,每次检测用5x10^5至 1x10^6 个细胞)。
02通过离心使细胞沉淀下来,移除上清液。
03在100 µl 稀释的一抗中重悬细胞,这种一抗按建议的稀释度或如通过滴定所确定那样以抗体稀释缓冲液配制。
04在冰上孵育 30 分钟至 1 小时。
避光。
05在抗体稀释缓冲液或 1X PBS 中通过离心洗涤。
弃去上清液。
重复。
如果使用直接偶联抗体,则跳到步骤 9。
06在100 µl 稀释的荧光物质偶联的二抗(按建议稀释度用抗体稀释缓冲液制备)中重悬细胞。
07在冰上孵育 30 分钟。
避光。
08用抗体稀释缓冲液进行离心洗涤。
弃去上清液。
重复。
09在 200-500 μl 抗体稀释缓冲液中重悬细胞后用流式细胞分析仪进行分析。
流式细胞仪检测细胞周期操作步骤
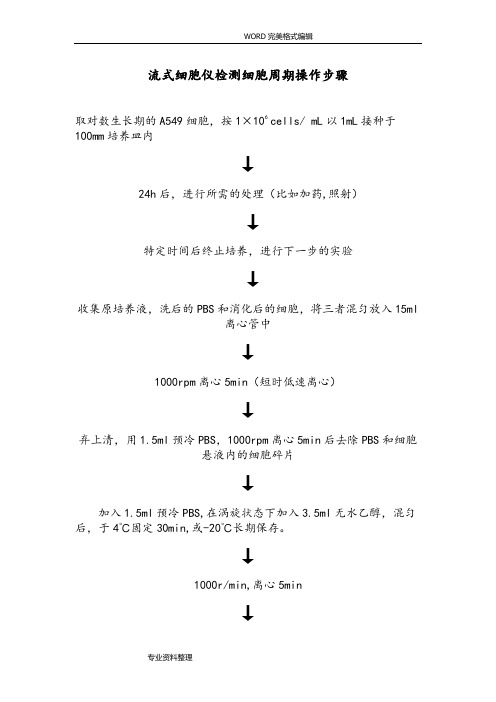
流式细胞仪检测细胞周期操作步骤取对数生长期的A549细胞,按1×106 cells/ mL以1mL接种于100mm培养皿内↓24h后,进行所需的处理(比如加药,照射)↓特定时间后终止培养,进行下一步的实验↓收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml离心管中↓1000rpm离心5min(短时低速离心)↓弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞悬液内的细胞碎片↓加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。
↓1000r/min,离心5min↓将乙醇吸除,加PBS清洗混匀↓1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去↓吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min)↓加入0.5ml的50ug/ml的PI溶液室温下避光染色30min↓将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管↓提前一天网上预约↓开机(先开仪器后开软件)↓流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。
↓检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上↓流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱↓液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激发光源)↓荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例)↓在用第三方软件分析之前,将流式结果按如下所示导出结果分析——Modfit软件分析——Flowjo 软件分析图片拷贝:直接Ctrl+CFCM-DNA 量分析 1 个细胞增殖群时,可将DNA 含量分布组方图分为三部分,即 G0/1、S 、G2M 。
流式细胞仪步骤

流式细胞仪步骤宝子们,今天来唠唠流式细胞仪的步骤呀。
那第一步呢,就是准备样本啦。
这个样本可不能马虎,得处理得妥妥当当的。
比如说细胞样本,要保证细胞是单个分散的状态,要是细胞都黏在一起,那流式细胞仪可就懵圈啦。
这就像咱们排队一样,得一个个排好,不能乱哄哄地挤成一团。
对于血液样本之类的,可能还需要进行一些特殊的处理,像裂解红细胞之类的操作,把那些会干扰检测的东西去掉。
接下来就是给样本标记啦。
这就像是给细胞穿上不同颜色的小衣服,让流式细胞仪能区分它们。
我们会用一些特异性的荧光抗体,这些抗体就像小侦探一样,能找到细胞上特定的蛋白或者标志物,然后紧紧地抱住它们。
不同的抗体带着不同颜色的荧光,这样细胞就被标记得花花绿绿的啦。
不过这一步可得小心哦,抗体的浓度要合适,就像做菜放盐一样,多了少了都不行。
浓度太高,可能会有非特异性结合,就像乱给人贴标签一样;浓度太低呢,又可能检测不到目标。
样本都准备好标记好之后呢,就可以把样本放到流式细胞仪里面啦。
这个时候就像是把精心打扮的小细胞们送上舞台一样。
流式细胞仪里面有个小管道,样本就沿着这个管道慢慢往前走。
在这个过程中呢,激光就会照射到这些细胞上。
激光就像舞台上的聚光灯一样,一照到细胞上,那些被标记的荧光就会发出亮光。
然后呢,仪器就开始检测这些荧光啦。
它会把每个细胞发出的荧光信号都收集起来,然后分析这些信号。
这个分析可厉害啦,它能知道每个细胞上有哪些标记,还能根据这些标记把细胞分成不同的群体。
就像把人群按照不同的特征分成不同的小组一样。
比如说按照细胞的大小、细胞表达的蛋白种类等等。
最后呢,我们就可以得到检测结果啦。
这个结果可以告诉我们好多信息呢,比如样本里不同类型细胞的比例是多少,细胞的状态是不是正常等等。
这就像是我们做了一次细胞世界的小普查,得到了很多有趣的情报。
宝子们,流式细胞仪的步骤大概就是这样啦,是不是还挺好玩的呢 。
流式细胞仪实验方法
流式细胞仪实验方法以下是流式细胞仪实验的一般步骤:1.预实验准备:a.准备所需样本:收集需要分析的细胞样本,如血液、细胞培养物等。
b.确定实验设计:根据实验目标确定分析的参数、染色方法和控制组设置。
2.打开仪器:a.打开流式细胞仪,并按照仪器说明书进行操作。
b.等待仪器预热,并确保仪器处于正常工作状态。
3.样本处理:a.预处理样本:根据实验需求,进行必要的样本预处理,如细胞培养、离心、洗涤等。
b.细胞染色:根据需要,对细胞样本进行染色。
例如,使用荧光标记的抗体来标记感兴趣的细胞表面标记物。
c.染色控制组:设置相应的染色控制组,用于确定背景噪音和染色特异性。
d.染色时间和温度:对于染色的时间和温度进行优化,确保获得最佳标记效果。
e.后续处理:根据实验需求,进行必要的后续处理,如溶解细胞红外染料、染色通道校准等。
4.仪器设置:a.确定分析参数:根据实验目标,选择合适的参数设置,如激光波长、增益和门限等。
b.检查仪器设置:检查仪器设置是否正确,如流速、流式细胞仪通道是否已校准等。
c.校准仪器:根据仪器说明书,进行仪器的标定和校准。
5.获得数据:a.导入样本:将染色的细胞样本装入流式细胞仪的样本装载仓,并设置相关参数。
b.数据获取:根据设置的参数,运行仪器开始数据采集。
收集细胞事件的信息,如散射光强度和荧光强度。
c.数据保存:将获得的数据保存为FCS格式。
d.检查数据质量:检查数据的质量,排除可能的仪器漂移和背景信号差异。
e.数据分析:使用流式细胞仪软件对数据进行分析和解读。
6.数据分析:a.数据清洗:根据需要,清洗数据,并删除可能的噪音和非特异信号。
b.数据解读:根据实验目标,解读数据并分析感兴趣的细胞亚群。
c.统计分析:使用统计方法对数据进行分析和比较。
7.结果呈现:a.数据可视化:使用合适的图表或图像软件绘制结果图,如直方图、散点图或流式图。
b.结果解读和讨论:根据结果进行解读和讨论,进一步分析结果的意义和潜在的影响。
流式fitc和pi四象限
流式fitc和pi四象限流式fitc和pi四象限实验是研究细胞生命周期及死亡等现象的一种常用手段,也是目前生物学研究中不可或缺的分析技术。
下面为大家详细介绍流式fitc和pi四象限的相关内容。
一、什么是流式fitc和pi四象限实验?流式fitc和pi四象限实验是通过流式细胞仪检测荧光素FITC 和PI染色的细胞数量,来分析细胞的生命周期和死亡等现象的一种实验方法。
其中,FITC染色可以反映细胞活性和成分变化,PI染色可以反映细胞核酸含量和形态变化。
二、流式fitc和pi四象限实验的原理及步骤1、实验原理流式fitc和pi四象限实验是基于细胞状况的荧光信号来进行分析,首先通过FITC和PI染色将细胞分类,然后在流式细胞仪中进行检测得到荧光信号。
2、步骤(1)取相应数量的细胞,进行细胞处理,并用PBS冲洗一次去除培养基和残留药物等。
(2)将细胞溶解液均匀加入每个实验管中,加入FITC染液和PI 染液,使细胞达到充分染色。
(3)经过染色后,用PBS进行冲洗,去除残留的染料和重复的细胞。
(4)将实验管放入流式细胞仪中进行检测,得到其中包含的荧光信号。
三、流式fitc和pi四象限实验的应用领域流式fitc和pi四象限实验被广泛应用于生物学研究中,特别是在细胞周期和细胞死亡中的应用更为广泛。
其应用领域包括:(1)研究细胞凋亡、坏死、自噬等现象。
(2)分析细胞周期。
(3)研究细胞中分子、化合物的吸收、转运等。
(4)检测细胞膜的表达。
(5)研究肿瘤、癌症等疾病的发生机制。
以上是流式fitc和pi四象限实验的相关介绍,这种实验方法使得研究者可以更加深入地探究细胞的相关问题,为广大生物学研究者提供了重要的实验手段。
流式细胞仪检测细胞凋亡实验步骤
流式细胞仪检测细胞凋亡实验步骤流式细胞仪是一种用于检测和分析细胞的仪器,可以通过测量细胞的荧光和散射特性来了解细胞的生理状态和功能。
在细胞生物学研究中,流式细胞仪广泛应用于细胞凋亡实验。
细胞凋亡是一种重要的细胞程序性死亡方式,正常情况下是一种维持生态平衡的重要机制,而在疾病发生时,细胞凋亡的失控会导致一系列疾病的发生。
因此,对细胞凋亡的检测和研究具有重要意义。
本文将介绍流式细胞仪检测细胞凋亡的实验步骤。
实验材料和仪器流式细胞仪细胞培养物凋亡诱导剂PBS缓冲液1×绑定缓冲液1×洗涤缓冲液荧光标记的抗体PI(胰岛素脱羧酶)Annexin V-FITC套装实验步骤1.细胞处理首先,将培养好的细胞分到不同的培养皿中,添加凋亡诱导剂,以诱导细胞凋亡。
凋亡诱导剂的种类和浓度应根据实验的需要来确定。
通常可选择小分子化合物、放射线等方式来诱导细胞凋亡。
2.收集细胞处理好的细胞经过一定时间的培养后,使用离心机将细胞沉淀下来,并用PBS缓冲液洗涤细胞,以去除培养基和凋亡诱导剂等杂质。
然后使用1×绑定缓冲液将细胞重悬。
3.细胞计数将细胞悬液加入细胞计数板中,用显微镜或自动细胞计数器计算细胞密度,并将细胞密度调整到合适的浓度。
4.细胞染色将调整好浓度的细胞悬液分到不同的离心管中,添加荧光标记的抗体和PI荧光染料。
荧光标记的抗体通常选择Annexin V-FITC,它可以与凋亡细胞膜表面磷脂酰丝氨酸结合,从而可以用于检测凋亡细胞;PI荧光染料用于检测坏死细胞。
5.混匀和孵育将离心管中的细胞悬液混匀均匀,然后在室温下孵育一定时间,通常为15-30分钟。
期间可以轻轻摇晃管子以保证充分的染色反应。
6.流式细胞仪检测染色反应结束后,将细胞悬液加入流式细胞仪的样品管中,通过流式细胞仪的激光和光电探测器,可以分辨出细胞的荧光和散射信号,从而获得细胞凋亡的信息。
使用流式细胞仪之前需要对仪器进行标定和调试,以确保获得准确和可靠的数据。
流式细胞仪操作步骤(FACSCalibur)
流式细胞仪操作步骤(FACSCalibur)⼀、开机程序:1.检查鞘液桶和废液桶。
确认鞘液充满状态(鞘液为鞘液桶体积的3/4位置,可以连续⼯作3个⼩时左右)、盖紧⿊盖、管道畅通、废液桶有⾜够空间容纳本批标本排弃的废液。
如果要添加鞘液,要先释放鞘液桶中⽓压。
2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印机。
3.⽓压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以排除管路中⽓泡。
⼆、运⾏FACSComp软件、检查仪器状况1.制备三⾊标准微球样本。
⼀般情况向1ml鞘液(或过滤PBS)中加⼊1滴质控⼩微球,也可以根据实际情况调节浓度。
2.机器预热5 min,打开FACSComp软件,选择保持路径。
选择所需校正内容,如果使⽤的微球是新⼀批产品要输⼊微球的批号。
3.在软件界⾯左侧Assay Selection选项中选择质控类型,即实验过程中是否需要清洗样品。
4.上样品,微球溶液上样之前要充分混匀。
功能键设置在“RUN”。
5.仪器⾃动检查,并做电压、补偿等设置。
6.FACSComp软件运⾏完毕,显⽰结果通过测试。
7.做Set up。
8.打印校正结果,退出FACSComp程序。
备注:在质控过程中,如果提⽰收集细胞速度慢可以提⾼细胞收集速度,但是在调节灵敏度(Sens)时,⼀定要⽤“Low”的状态上样,保证仪器灵敏度的准确。
在使⽤仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。
三、样品分析软件:CellQuest Pro软件,选择“联机”。
1.(2)对实验样本进⾏命名;(3)对实验通道进⾏预设(FSC,SSC,FL1-FL4)。
备注:如果界⾯被关闭,重新调出步骤:2.调出质控模板。
3.画图选择画图⼯具(⼀般选择散点图),Inspect界⾯会⾃动弹出,对⼏个常⽤选项进⾏设定:将散点图选中(⽤⿏标点击散点图边框才能够选中图形),将更改横纵坐备注:第⼀个散点图横坐标为FSC,纵坐标为SSC。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流式细胞仪实验方法一、实验准备1.标本制备:2.最小化非特异性结合:二、凋亡1.凋亡的检测方法:和其它2.PI染色法3.Annexin V 法4.TUNNEL法三、细胞因子1.激活的细胞因子2.CBA四、血小板1.活化2.活化检测3.网织血小板五、红细胞1.网织红细胞2.PNH3.胎儿红细胞六、肿瘤学1.DNA 细胞周期2.蛋白3.多药耐药4.微小残留白血病第一部分标本处理一、流式细胞术常规检测时的样品制备(一)直接免疫荧光标记法取一定量细胞(约1X106细胞/ml),在每一管中分别加入50μl的HAB,并充分混匀,于室温中静置1分钟以上(),再直接加入连接有荧光素的抗体进行免疫标记反应(如做双标或多标染色,可把几种标记有不同荧光素的抗体同时加入),。
孵育20-60分钟后,用PBS(pH7.2—7.4)洗1-2次,加入缓冲液重悬,上机检测。
本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。
虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。
(二)间接免疫荧光标记法取一定量的细胞悬液(约1X106细胞/ml),先加入特异的第一抗体,待反应完全后洗去未结合抗体,再加入荧光标记的第二抗体,生成抗原—抗体—抗抗体复合物,以FCM检测其上标记的荧光素被激发后发出的荧光。
本方法费用较低,二抗应用广泛,多用于科研标本的检测。
但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。
所以标本制备时应加入阴性或阳性对照。
另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。
二、最小化非特异性结合的方法1.荧光标记的抗体的浓度应该合适,如果浓度过高,背景会因为非特异性的相互作用的增加而增加。
2.在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白(BSA),脱脂干奶酪,或来自于同一寄主的正常血清来作为标记的第二抗体。
这个步骤通过阻断第一抗体和细胞表面或胞结构的非特异性的交互作用来降低背景。
3.在使用第一抗体之后,将样品与5%至10%的来自于同一寄主的正常血清和作为标记的第二抗体一起培育。
这个步骤会减少不必要的第二抗体与第一抗体、细胞表面或胞结构之间的交互作用。
通过用来自于同样的样品的血清稀释标记过的抗体可以略过此步骤。
此步骤适用于很多方面,但有时候它也会导致已标记的第二抗体和正常血清中的免疫球蛋白的免疫复合体的形成。
这种复合体会优先与一些细胞结构进行结合,或者它们最终会导致期望得到的抗体活性的丢失。
4.使用F(ab’)2片段会使背景决定于第一或第二抗体与FC受体的全分子结合。
大多数的第二抗体的F(ab’)2片段容易利用。
而第一抗体的F(ab’)2存在的条件下,将新鲜组织或片段一般是不能利用或很难制作。
因此,在NaN3细胞与正常血清一起培育应选择优先加入第一抗体。
在此情况下,即使在随后的步骤中用完所有的抗体分子,FC受体决定的背景影响已不再重要。
5.其它:已标记的抗体和其他一些在的免疫球蛋白或加入实验系统中的其它物质的交叉反应也可能会有背景影响。
为了降低背景,在多重标记过程中,所有的已标记的抗体应被吸附,避免其他种类蛋白的交叉反应。
第二部分细胞因子细胞细胞因子的流式细胞仪检测一、简介随着研究的进展,仅仅对细胞进行定量和活性的检测已不能满足需要。
在单细胞水平研究细胞因子的表达能力对研究细胞因子在疾病中的作用越来越显的重要无比。
目前检测单个细胞特定细胞因子的表达手段包括:ELIspot、原位杂交、免疫细胞化学、限制性稀释分析(limiting dilution analysis,LDA)和单细胞PCR,应用原位杂交技术和免疫组化方法观察细胞因子蛋白表达及mRNA 表达可以识别Th1和Th2细胞,此方法可获得较强的细胞信号,但此方法工作量大、主观性强,难以进行大样本检测,且人肉眼识别能力有很大的局限性,而ELISPOT及单细胞PCR技术,技术性强、劳动强度大,难以进行广泛推广。
随着多标记及胞细胞因子标记流式细胞技术的出现,使对细胞细胞因子的研究推向了一个新的阶段。
下面主要对胞细胞因子流式细胞技术作以介绍。
早期细胞因子表达与细胞功能相关性研究是基于特定克隆细胞的激活。
尽管研究应用T淋巴细胞克隆证明了不同细胞因子的合成,如TH1(IL-2,IFN-)与TH2(IL-4,IL-5,IL-10),但这些研究很难外推,因为T细胞克隆与体T细胞功能相关性还未被揭示。
近来,Jung与Picker采用了monensin、PMA等药物预孵,用Brefeldin(BFA)、Monensin阻断了胞高尔基体介导的转运的方法使得细胞因子聚集,蓄积,增强细胞因子信号可被流式细胞仪检测。
因为自然状态下,T淋巴细胞产生少量的细胞因子,通常要对T淋巴细胞体外活化进行研究。
在体外刺激过程中,T淋巴细胞产生的细胞因子已释放出来,胞细胞因子信号较弱,难以进行检测。
这一方法可检测单个细胞多个细胞因子,并可区分表达特定细胞因子的细胞亚群。
在细胞水平该方法证明了人与鼠的淋巴细胞都存在1型与2型分化,且这些分化在特定细胞因子增强时可被逆转。
且这些研究清楚地证明,只有激活的细胞亚群可以表达细胞因子,静止的正常淋巴细胞(T、B、NK)不能分泌细胞因子。
胞流式分析法是用抗细胞因子抗体与细胞表面或胞特定亚群标志组合,即可检测不同细胞亚群细胞因子的分泌,同时采用特殊的化学与抗体选择,确保静止与无细胞因子分泌细胞的最小荧光背景。
具有其它方法难以比拟的优点:➢快速:流式定量检测细胞细胞因子可在一天完成,实验流程需6-8小时,实际操作时间为1-2小时,快速简便;➢简便:无需组织培养,可以全血分析,无需分离PBMCs;➢灵敏度高:高度灵敏的荧光标记与检测系统;➢高效:可以在同一个细胞同时检测两种或更多种细胞因子,也可根据细胞免疫表型区分分泌细胞因子的细胞的亚型,进行多参数相关分析;➢安全:减少样本处理与生物源性污染➢接近生物体的分析条件:全血检测保留细胞及生化微环境更准确反映了体状况。
二、所需仪器1.流式上样管及细胞培养皿或板,37℃孵箱2.25%CO23.混匀振荡器4.离心机5.加样器、Tips6.流式细胞仪三、常用的标本类型和处理方法全血:使用肝素钠抗凝的真空采血管采血,不易采用肝素锂、EDTA和ACD 抗凝剂,血样在8小时分析,超过8小时会导致活性的损失,一般细胞因子阳性细胞会减少5%。
如不能在8小时之检测,应将真空采血管水平室温放置。
自身血浆中外周血单个核细胞(PBMCs):使用肝素钠抗凝的采血后,分离PBMCs,24小时分析。
组织培养基中的外周血单个核细胞(PBMCs):用Ficoll分离PBMCs,将细胞重悬于含10%热灭活胎牛血清(FBS)的RPMI-1640培养基中,调节细胞浓度为2×106细胞/ml。
细胞系与T细胞克隆:调节细胞浓度2×106细胞/mL于新鲜培养基中。
冰冻全血与PBMCs:使用1×红细胞裂解液处理活化的外周血或者PBMCs,用PBS漂洗,并用含1%的BSA及10%的DMSO的PBS重悬,-70℃冻存。
溶化后细胞置于染色管中,加上2~3mL的洗液,离心5分钟后,用破膜剂对细胞进行破膜和染色。
四、所需试剂1、细胞表面染色的荧光标记的单抗试剂依据实验需要选择特殊表面标志CD45圈定所有淋巴细胞CD3 圈定T淋巴细胞CD4 圈定T辅助淋巴细胞亚群CD8 圈定T抑制淋巴细胞亚群CD19/或CD20圈定B淋巴细胞CD56圈定NK淋巴细胞CD14圈定单核细胞2、荧光标记的细胞因子抗体:R&D提供FITC、PE和APC标记的细胞因子抗体3、溶血素:用外周全血检测时需使用溶血素(R&D目录号WL1000用于人或者WL2000用于小鼠;eBioscience目录号00-4333)溶解红细胞4、激活剂①Phorbol 12-Myristate 13 Acetate(PMA)(Alexis,目录号ALX-445-004-M001)A.DMSO中调节浓度0.1mg/mLB.分装(20L),-20℃储存。
勿反复冻融C.每次实验用无菌无叠氮钠PBS 1:100稀释储存液D.PMA终浓度25ng/mL细胞悬液②Ionomycin (Alexis,目录号ALX-450-006-M001)A.于乙醇中配制成浓度0.5mg/mLB.-20℃储存C.每次实验用无菌无叠氮钠PBS 1:10稀释储存液D.Ionomycin终浓度1g/mL细胞悬液③Staphylococcal enterotoxin B(SEB) (Sigma,Catalog No.S-4881)A.无菌无叠氮钠PBS调节浓度0.5mg/mLB.4℃储存C.SEB终浓度10g/mL细胞悬液④CD3:包被在培养板中,在蛋白转运抑制剂存在下活化未稀释的血液细胞⑤CD28:加速不同刺激剂(包括SEB、CD3等)的活化效应,浓度一般为10ug/ml5、阻断剂阻断高尔基体介导的转运作用,使得刺激细胞表达的细胞因子聚集在胞浆① Brefeldin-A(BFA) (eBioscience,目录号00-4506)A. 于DMSO中调节浓度5mg/mLB. 分装(20L),-20℃储存。
勿反复冻融。
C. 每次实验用无菌无叠氮钠PBS 1:10稀释储存液D. 激活最后4-5小时BFA终浓度10g/mL细胞悬液。
注意:BFA过度孵育会导致细胞活力下降② Monensin (eBioscience,目录号00-4505)6、不含谷氨酰胺的RPMI-16407、固定剂:细胞在体外刺激后需要对细胞进行固定。
固定的目的在于通过蛋白的交联和变性一方面使细胞因子固定在细胞,另一方面避免细胞表面抗原丢失。
含4%的多聚甲醛PBS溶液(eBioscience,目录号00-8222)8、破膜剂:含1%皂甙、0.05%叠氮化钠的Hanks溶液(HBBS)(eBioscience,目录号00-8333)将细胞膜穿孔,已利于荧光标记的细胞因子抗体进入细胞,于相应的细胞因子结合9、其它试剂:无菌无叠氮钠PBS,乙醇,含1%多聚甲醛的PBS,4℃储存。
五、细胞培养和刺激的基本方法细胞活化的最终结果是产生细胞因子,根据检测指标和标本的不同,研究人员需要选择不同的刺激剂和刺激时间,以获得最佳的实验结果。
下表提供了检测一些常用细胞因子的推荐的活化方法。
人IFN-人TNF-人IL-1人IL-1人MIP-1/CCL3人MIP-1/CCL4小鼠IFN小鼠TNF-方法9为防止细胞细胞因子分泌到胞外,在培养的最后4-6个小时,需要使用蛋白转运抑制剂 (如3uM monensin,10mg/ml的BFA)方法1: 只使用转染细胞检测方法2: 人的PBMCs使用PMA (10 ng/ml) 和Ionomycin (1 uM) 刺激4-24 小时.方法3: 人的PBMC 使用LPS (0.5 - 1 ug/ml) 刺激24 小时.方法4: 人的PBMCs或者纯化的CD4+细胞在包被人CD3抗体的培养板中,使用含有重组人的IL-2(10 ng/ml,目录号202-IL-010)和IL-4(10 ng/ml,目录号204-IL-005)的培养基培养两天;细胞洗涤后在含有重组人IL-2和IL-4的培养基中继续培养2天;最后收获细胞,使用PMA (10 ng/ml) 和Ionomycin (1 uM)刺激6小时方法5: CD4+ T 细胞使用PHA (10 ng/ml) 刺激4 days方法6: T 细胞使用抗CD3 的单抗、抗CD28的单抗和重组人的IL-1 (Lorre, et al., 1994, Clin Immuno Immunopath 70:1)方法7: 使用PMA (50 ng/ml) 和Ionomycin (500 ng/ml)刺激方法8: PBMCs细胞使用重组人IFN (10 ng/ml,目录号285-IF-100) 刺激2 小时,然后使用IFN (10 ng/ml) + LPS (1 ug/ml) 刺激22小时或者使用相同的方法刺激THP-1 细胞.方法9: EL4 在包被抗小鼠CD3抗体(25 ug/ml) 的培养板中,使用抗CD28 抗体(2 ug/ml) + PMA (5 ng/ml) + Ionomycin (500 ng/ml) 刺激6小时方法10: CD4+T细胞在包被小鼠CD3(25 ug/ ml)抗体的培养板中,使用含有抗小鼠的CD28(2 ug/ml)的抗体,重组小鼠的IL-2(10 ng/ml,目录号402-ML-020)和IL-4(50 ng/ml,目录号404-ML-005)的培养基培养两天;然后在含有重组小鼠IL-2和IL-4的培养基中继续培养3天;最后收获细胞,使用PMA(5 ng/ml)、Ionomycin(500 ng/ml)和monensin刺激6小时。
