药物化学构效关系(第二版 尤启冬 主编)
尤启东《药物化学》讲义

尤启东《药物化学》讲义第一节药物的名称药物可分为非专有名和商标名两大类,学术性期刊上都用非专有名,但医生处方往往用商标名为多。
非专有名源自化学名(1)非专有名(Nonproprietary name)或称通用名称(Genetic name)。
1953年世界卫生组织WHO公布国际非专有药名(International nonproprietary names for pharmaceutical substances),简称INN的命名原则:(1) 发音拼法清晰明了,名词不宜太长(2) 同属一类药理作用的相似药物,适当表明其关系(3) 应避免可能给患者有关解剖学.生理学.病理学.治疗学的暗示举例如下2-Chloro-10-(3-dimethylaminopropyl) phenothiazine取部分字母成为Chlorpromazine氯丙嗪,治疗精神病1-Hydrrazinophthalazine 取部分字母成为Hydralazine肼屈嗪(过去译为肼苯哒嗪),降低血压3,4-dihydroxyphenylalanine取名Dopa 多巴,治疗震颤麻痹症5-(4-Chloropheyl)-6-ethyl-2,4-pyrimidinediamine称Pyrimethamine乙胺嘧啶,治疗疟疾药理作用相似药物Cimetidine 西咪替丁Ranitidine 雷尼替丁Famotidine 法莫替丁局部麻醉药Cocaine 可卡因Procaine 普鲁卡因Lidocaine 利多卡因头孢类抗生素Cefaclor 头孢龙罗Cefradine 头孢柱定Ceftizoxime 头孢唑肟商标名称各公司注册商标的名称,不能冒用非专有名称译名商标名称Pyrimethamine 乙胺嘧啶DaraprimChlorpromazine 氯丙嗪ProzilChloramphenicol 氯霉素ChlormycetinHydralazine 肼屈嗪ApresolineMethadone 美沙酮Dolophine中文译名要求贯彻药政条理,名称要简洁.明确.科学.不准用代号,可以音译,也可意译,也可音意合译。
尤启东《药物化学》讲义

药物化学讲义尤启东药物名称药物可分为非专有名和商标名两大类,学术性期刊上都用非专有名,但医生处方往往用商标名为多。
非专有名源自化学名(1)非专有名(Nonproprietary name)或称通用名称(Genetic name)。
1953年世界卫生组织WHO 公布国际非专有药名(International nonproprietary names for pharmaceutical substances),简称INN 的命名原则: (1) 发音拼法清晰明了,名词不宜太长(2) 同属一类药理作用的相似药物,适当表明其关系(3) 应避免可能给患者有关解剖学.生理学.病理学.治疗学的暗示 举例如下2-Chloro -10-(3-dimethylaminopropyl) phenothiazine 取部分字母成为Chlorpromazine 氯丙嗪,治疗精神病1-Hydrrazinophthalazine 取部分字母成为 Hydralazine 肼屈嗪(过去译为肼苯哒嗪),降低血压3,4-dihydroxyphenylalanine 取名Dopa 多巴,治疗震颤麻痹症5-(4-Chloropheyl)-6-ethyl-2,4-pyrimidinediamine 称Pyrimethamine 乙胺嘧啶,治疗疟疾S N(CH 2)3N(CH 3)2ClNN NHNH 2O H OH C H 2CH NH 2COOH药理作用相似药物Cimetidine 西咪替丁 Ranitidine 雷尼替丁 Famotidine 法莫替丁 局部麻醉药Cocaine 可卡因 Procaine 普鲁卡因 Lidocaine 利多卡因 头孢类抗生素Cefaclor 头孢龙罗 Cefradine 头孢柱定 Ceftizoxime 头孢唑肟商标名称 各公司注册商标的名称,不能冒用非专有名称 译 名 商标名称 Pyrimethamine 乙胺嘧啶 Daraprim Chlorpromazine 氯丙嗪 ProzilChloramphenicol 氯霉素 Chlormycetin Hydralazine 肼屈嗪 Apresoline Methadone 美沙酮 Dolophine 中文译名要求贯彻药政条理,名称要简洁.明确.科学.不准用代号,可以音译,也可意译,也可音意合译。
尤启东《药物化学》讲义

尤启东《药物化学》讲义第一节 药物的名称药物可分为非专有名和商标名两大类,学术性期刊上都用非专有名,但医生处方往往用商标名为多。
非专有名源自化学名(1)非专有名(Nonproprietary name)或称通用名称(Genetic name)。
1953年世界卫生组织WHO 公布国际非专有药名(International nonproprietary names for pharmaceutical substances),简称INN 的命名原则: (1) 发音拼法清晰明了,名词不宜太长(2) 同属一类药理作用的相似药物,适当表明其关系(3) 应避免可能给患者有关解剖学.生理学.病理学.治疗学的暗示 举例如下2-Chloro -10-(3-dimethylaminopropyl) phenothiazine 取部分字母成为Chlorpromazine 氯丙嗪,治疗精神病1-Hydrrazinophthalazine 取部分字母成为 Hydralazine 肼屈嗪(过去译为肼苯哒嗪),降低血压S N(CH 2)3N(CH 3)2Cl3,4-dihydroxyphenylalanine 取名Dopa 多巴,治疗震颤麻痹症5-(4-Chloropheyl)-6-ethyl-2,4-pyrimidinediamine 称Pyrimethamine 乙胺嘧啶,治疗疟疾药理作用相似药物Cimetidine 西咪替丁 Ranitidine 雷尼替丁 Famotidine 法莫替丁 局部麻醉药Cocaine 可卡因 Procaine 普鲁卡因NN NHNH 2O H OH C H 2CH NH 2COOH NNClC 2H 52NH 2Lidocaine 利多卡因头孢类抗生素Cefaclor 头孢龙罗Cefradine 头孢柱定Ceftizoxime 头孢唑肟商标名称各公司注册商标的名称,不能冒用非专有名称译名商标名称Pyrimethamine 乙胺嘧啶DaraprimChlorpromazine 氯丙嗪ProzilChloramphenicol 氯霉素ChlormycetinHydralazine 肼屈嗪ApresolineMethadone 美沙酮Dolophine中文译名要求贯彻药政条理,名称要简洁.明确.科学.不准用代号,可以音译,也可意译,也可音意合译。
药物化学构效关系

药物化学构效关系1.局部麻醉药的构效关系:①亲脂性部分:可变范围较大,可为芳环或芳杂环,但以苯环的作用较强,是局麻药物的必需部位。
当酯类药物苯环的邻位或对位引入给电子集团,如氨基、烷氧基时,局麻作用均较未取代得苯甲酸衍生物强;对氨基苯甲酸酯类苯环的邻位上若再有其他取代基如氯、氨基、烷氧基时,由于位阻作用而延长了酯的水解,因此活性增强,作用时间延长。
②中间连接部分:由羰基部分和烷基部分共同组成。
羰基部分与麻醉药持效时间及作用强度有关,作用持续时间为:酮﹥酰胺﹥硫代酯﹥酯;麻醉作用强度:硫代酯﹥酯﹥酮﹥酰胺。
烷基部分碳原子数以2~3个为好,当烷基部分为—CH2CH2CH2—时,麻醉作用最强。
③亲水性部分:大多数为叔胺,易形成可溶性的盐类。
氮原子上取代基的碳原子总和以3~5时作用最强,也可为酯环胺,其中以哌啶的作用最强。
2. 苯二氮卓类药物的构效关系:① 1、2位拼入三氮唑环,使代谢稳定性增加,提高与受体的亲和力,活性显著增加;② 3位引入手性碳,分子构想更稳定,对受体亲和力增强;③ 4、5位引入恶唑环,增强稳定性;④7位有吸电子取代基时,药物活性明显增强,且吸电子性越强,活性增加越明显,NO2>Br>CF3>Cl;⑤ 5位苯环的2’位引入体积较小的吸电子基团如F、Cl,可使活性增强。
①镇静作用的强度和起效快慢,与药物的理化性质有关。
【酸性解离常数pKa】巴比妥酸和5位取代的巴比妥类有较强的酸性,在生理pH=7.4几乎全都电离成离子状态,不易透过血脑屏障,无镇静催眠作用;5,5-二取代的巴比妥类,酸性减弱,生理pH条件下不易电离,易进入脑中发挥作用,显效快,作用强。
【脂水分配系数】5位无取代基时,分子有一定极性,亲脂性强,不易透过血脑屏障,无镇静催眠作用;5位取代基碳原子总数在7~8之间作用最强,若亲脂性过强,作用下降甚至出现惊厥。
药物有最适当的的脂溶性,有利于药物透过细胞膜和血脑屏障,起效快,作用强。
尤启东《药物化学》讲义

尤启东《药物化学》讲义第一节药物的名称药物可分为非专有名和商标名两大类,学术性期刊上都用非专有名,但医生处方往往用商标名为多。
非专有名源自化学名(1)非专有名(Nonproprietary name)或称通用名称(Genetic name)。
1953年世界卫生组织WHO公布国际非专有药名(International nonproprietary names for pharmaceutical substances),简称INN的命名原则:(1) 发音拼法清晰明了,名词不宜太长(2) 同属一类药理作用的相似药物,适当表明其关系(3) 应避免可能给患者有关解剖学.生理学.病理学.治疗学的暗示举例如下2-Chloro-10-(3-dimethylaminopropyl) phenothiazine取部分字母成为Chlorpromazine氯丙嗪,治疗精神病1-Hydrrazinophthalazine 取部分字母成为 Hydralazine肼屈嗪(过去译为肼苯哒嗪),降低血压3,4-dihydroxyphenylalanine取名Dopa 多巴,治疗震颤麻痹症5-(4-Chloropheyl)-6-ethyl-2,4-pyrimidinediamine称Pyrimethamine乙胺嘧啶,治疗疟疾药理作用相似药物Cimetidine 西咪替丁Ranitidine 雷尼替丁Famotidine 法莫替丁局部麻醉药Cocaine 可卡因Procaine 普鲁卡因Lidocaine 利多卡因头孢类抗生素Cefaclor 头孢龙罗Cefradine 头孢柱定Ceftizoxime 头孢唑肟商标名称各公司注册商标的名称,不能冒用非专有名称译名商标名称Pyrimethamine 乙胺嘧啶 DaraprimChlorpromazine 氯丙嗪 ProzilChloramphenicol 氯霉素 ChlormycetinHydralazine 肼屈嗪 ApresolineMethadone 美沙酮 Dolophine中文译名要求贯彻药政条理,名称要简洁.明确.科学.不准用代号,可以音译,也可意译,也可音意合译。
尤启东《药物化学》讲义

尤启东《药物化学》讲义第一节药物的名称药物可分为非专有名和商标名两大类,学术性期刊上都用非专有名,但医生处方往往用商标名为多。
非专有名源自化学名(1)非专有名(Nonproprietary name)或称通用名称(Genetic name)。
1953年世界卫生组织WHO公布国际非专有药名(International nonproprietary names for pharmaceutical substances),简称INN的命名原则:(1) 发音拼法清晰明了,名词不宜太长(2) 同属一类药理作用的相似药物,适当表明其关系(3) 应避免可能给患者有关解剖学.生理学.病理学.治疗学的暗示举例如下2-Chloro-10-(3-dimethylaminopropyl) phenothiazine取部分字母成为Chlorpromazine氯丙嗪,治疗精神病1-Hydrrazinophthalazine 取部分字母成为 Hydralazine肼屈嗪(过去译为肼苯哒嗪),降低血压3,4-dihydroxyphenylalanine取名Dopa 多巴,治疗震颤麻痹症5-(4-Chloropheyl)-6-ethyl-2,4-pyrimidinediamine称Pyrimethamine乙胺嘧啶,治疗疟疾药理作用相似药物Cimetidine 西咪替丁Ranitidine 雷尼替丁Famotidine 法莫替丁局部麻醉药Cocaine 可卡因Procaine 普鲁卡因Lidocaine 利多卡因头孢类抗生素Cefaclor 头孢龙罗Cefradine 头孢柱定Ceftizoxime 头孢唑肟商标名称各公司注册商标的名称,不能冒用非专有名称译名商标名称Pyrimethamine 乙胺嘧啶 DaraprimChlorpromazine 氯丙嗪 ProzilChloramphenicol 氯霉素 ChlormycetinHydralazine 肼屈嗪 ApresolineMethadone 美沙酮 Dolophine中文译名要求贯彻药政条理,名称要简洁.明确.科学.不准用代号,可以音译,也可意译,也可音意合译。
药物化学的构效关系
H N
O O
O O NO2
为活性必需,变 成吡啶环或六氢 吡啶环活性消失
为活性必需,若为乙酰 基或氰基活性降低,若 为硝基则激活钙通道
邻、间位有吸电子基团时活 性较佳,对位取代活性下降
Penicillins青霉素的构效关系
6位侧链是结构修饰 的主要部位,能产 生各式各样的作用
C-7应为L-构型,而酰胺侧链为 b-构型,C-6、C-7的氢为-构 型,绝对构型为6R,7R C-7为同向(Syn-)肟型或较大的取 代基侧链时,对b-内酰胺酶有较 大稳定性,C-7对向构(Anyi-)型时 则不耐酶
四元环与六元环不在同一 平面,在C-6-N-1处折合
R NH
H
S
O NH
O OH
若以氧原子或亚甲基取 代,不降低活性而得到 另一类型b内酰胺抗生素
b受体阻滞剂(普萘洛尔)结构与活性关系
用S,CH2或NCH3取代, 作用降低
可以是苯、萘、杂环、稠环 和脂肪性不饱和杂环等,可 有甲基、氯、甲氧基、硝基 等取代基,2,4-或2,3,6-同 时取代时活性最佳
S构型异构体活性强, R构型异构体活性降低 或消失
O
N H
CH3 CH3
H OH
以叔丁基和异丙基取代活性最高,
维生素A的构效关系
被甲基、氯原子或含氮 杂环取代,活性增强或 OAc 改变体内药代动力学
双键移位则无活性
磺胺类药物的构效关系
其它芳环或引入其它 基团,活性降低或丧失
H2N
OO SNR H
单取代活性增加,杂环取 代更好,双取代活性丧失
以其它基团取代或置换 可保持或丧失活性,氨 基的游离或潜在的游离 状态是活性的关键
尤启东药物化学》讲义

尤启东《药物化学》讲义第一节药物的名称药物可分为非专有名和商标名两大类,学术性期刊上都用非专有名,但医生处方往往用商标名为多。
非专有名源自化学名(1)非专有名(Nonproprietary name)或称通用名称(Genetic name)。
1953年世界卫生组织WHO公布国际非专有药名(International nonproprietary names for pharmaceutical substances),简称INN的命名原则:(1) 发音拼法清晰明了,名词不宜太长(2) 同属一类药理作用的相似药物,适当表明其关系(3) 应避免可能给患者有关解剖学.生理学.病理学.治疗学的暗示举例如下2-Chloro-10-(3-dimethylaminopropyl) phenothiazine取部分字母成为Chlorpromazine氯丙嗪,治疗精神病1-Hydrrazinophthalazine 取部分字母成为Hydralazine肼屈嗪(过去译为肼苯哒嗪),降低血压3,4-dihydroxyphenylalanine取名Dopa 多巴,治疗震颤麻痹症5-(4-Chloropheyl)-6-ethyl-2,4-pyrimidinediamine称Pyrimethamine乙胺嘧啶,治疗疟疾药理作用相似药物Cimetidine 西咪替丁Ranitidine 雷尼替丁Famotidine 法莫替丁局部麻醉药Cocaine 可卡因Procaine 普鲁卡因Lidocaine 利多卡因头孢类抗生素Cefaclor 头孢龙罗Cefradine 头孢柱定Ceftizoxime 头孢唑肟商标名称各公司注册商标的名称,不能冒用非专有名称译名商标名称Pyrimethamine 乙胺嘧啶DaraprimChlorpromazine 氯丙嗪ProzilChloramphenicol 氯霉素ChlormycetinHydralazine 肼屈嗪ApresolineMethadone 美沙酮Dolophine中文译名要求贯彻药政条理,名称要简洁.明确.科学.不准用代号,可以音译,也可意译,也可音意合译。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗肿瘤作用机理:1、药物在体内能形成缺电子活泼中间体(碳正离子)或其他具有活泼的亲电性基团的化合物,进而与肿瘤细胞的生物大分子(DNA,RNA,酶)中富电子基团(氨基,巯基,羟基等)发生共价结合,使其丧失活性,致肿瘤细胞死亡。
2、属细胞毒类药物,在抑制和毒害增生活跃的肿瘤细胞的同时,对其它增生较快的细胞产生抑制。
如骨髓细胞、肠上皮细胞、毛发细胞和生殖细胞等。
副作用大:影响造血功能和机体免疫功能,恶心、呕吐、骨髓抑制、脱发等。
氮芥类药物脂肪氮芥:氮原子的碱性比较强,在游离状态和生理PH()时,易和β位的氯原子作用生成高度活泼的亚乙基亚胺离子,为亲电性的强烷化剂,极易与细胞成分的,亲核中心发生烷基化反应。
脂肪族氮芥:烷化历程是双分子亲核取代反应(SN2),反应速率取决于烷化剂和亲核中心的浓度。
脂肪氮芥属强烷化剂,对肿瘤细胞的杀伤能力也较大,抗肿瘤谱较广;但选择性比较差,毒性也较大。
芳香族氮芥:氮原子与苯环共轭,减弱了碱性,碳正离子中间体,单分子的亲核取代反应。
氮芥类药物及大多数烷化剂主要是通过和,DNA上鸟嘌呤或胞嘧啶碱基发生烷基化,产生DNA链内、链间交联或DNA蛋白质交联而抑制,DNA的合成,阻止细胞分裂。
【1】β-内酰胺类抗生素的化学结构特点:1分子内有一个四元的β-内酰胺环,除了单环β-内酰胺外,该四元环通过N原子和邻近的第三碳原子与另一个五元环或六元环相稠合。
2除单环β-内酰胺外,与β-内酰胺环稠合的环上都有一个羧基。
3所有β-内酰胺类抗生素的β-内酰胺环羰基α-碳都有一个酰胺基侧链。
4β-内酰胺环为一个平面结构,但两稠环不共平面β-内酰胺类药物可抑制粘肽转肽酶的活性和青霉素结合蛋白【2】青霉素构效关系(1)6位的侧链酰胺基团决定其抗菌谱。
改变其极性,使之易于透过细胞膜可以扩大抗菌谱。
例如,在芳环乙酰氨基的α位上引入-NH2、-COOH、和-SO3H等亲水性基团,可以扩大抗菌谱,增强亲水性有利于对革兰阴性菌的抑制作用并能增强对青霉素结合蛋白的亲和力。
(2)在侧链引入立体位阻较大基团或在6位引入甲氧基等可保护β-内酰胺环不被β-内酰胺酶进攻,而得到耐酶抗生素。
(3)羧基是基本活性基团。
可利用前药原理将羧基制成酯,以增加口服吸收和改善药物代谢动力学性质。
(4)青霉烷酸分子中的3个手性碳的构型对其活性至关重要。
只有绝对构型为2S,5R,6R 具有活性;但噻唑环上的2个甲基不是保持活性的必要基团。
优点:强效的抗生素缺点:不稳定不耐酸不口服不耐酶耐药性抗菌谱窄易过敏【3】半合成头孢菌素构效:(1)7位酰胺基取代基是抗菌谱的决定基团,对其进行结构修饰,可扩大抗菌谱并可提高抗菌活性,增加对β-内酰胺酶的稳定性。
(2)7位氢原子以甲氧基取代可增加β-内酰胺环的稳定性。
(3)环中S原子可影响抗菌效力,将其改为碳或氧可提高抗菌活性。
(4)3位取代基既可提高抗菌活性,又能影响药物代谢动力学性质。
[4]拟肾上腺素药的构效关系(P218)1、必须具有苯乙胺的基本结构,如碳链延长为三个碳原子,则作用强度下降;2、多数β肾上腺素受体激动剂在氨基的β位具有羟基,此β羟基的存在,对活性有显著影响。
3、苯环3,4-二羟基的存在可显著增强α、β激动活性,但此类具儿茶酚结构的药物常常不能口服。
4、侧链氨基氢被非极性烷基取代时,基团的大小与受体的选择性有密切的关系。
在一定范围内,N-取代基越大,对β受体的选择性越大,相对的对α受体的亲和力就越小。
当氨基上的氢被比叔丁基更大的亲脂性基团取代时,则表现为α1受体拮抗活性。
若氨基上的两个氢均被取代,可使活性下降,毒性增大。
5、侧链氨基的α-碳原子上引入甲基,则由于甲基的位阻效应,阻碍单胺氧化酶(MAO)对氨基的氧化代谢脱氨,从而使药物的作用时间延长,例如麻黄碱、间羟胺的作用较持久。
如果引入比甲基更大的烷基,则活性下降或消失。
[5]β受体阻断剂的构效关系1)基本空间结构(的相似性)β受体拮抗剂的基本结构要求与激动剂相似2)芳环部分(见P227)芳香环及环上取代基的结构要求不甚严格。
取代基的位置与β1受体阻断作用的选择性相关。
如苯环4-位取代基含烷氧基醚结构时,如美托洛尔、倍他洛尔和比索洛尔,对β1受体有较高的特异性,为选择性β1受体阻断剂。
在苯环引入极性的甲磺酰氨基或乙酰氨基,可降低脂溶性,避免产生抑制心脏的副作用。
3)侧链部分侧链α-位一般无取代基,如果被烷基或芳基取代后,阻断作用便减弱,且取代基越大,减弱程度越大。
但α-位引入甲基,可增加对β2受体的选择性。
4)N取代基●侧链氨基上取代基对β受体阻断活性的影响大体上与β激动剂相平行。
●氮原子没有任何取代的伯胺化合物活性较小,异丙基和叔丁基取代的活性最高。
活性次序为叔丁基> 异丙基> 仲丁基,异丁基,仲戊基。
●烷基碳原子小于3,或烷基碳链更长,或N,N-双取代的叔胺,均使活性下降。
●用芳基或金刚烷类基团取代的仲胺活性全部丧失。
氮原子季铵化后只有很低【6】磺胺类药物构效(1)芳伯氨基与磺酰氨基在苯环上必须互成对位,邻位及间位异构体均无抑菌作用。
(2)苯环用其他环代替,或在苯环上引入其他基团,都将使抑菌作用降低或消失。
(3)磺酰氨基N-单取代化合物可使抑菌作用增强,而杂环取代时,抑菌作用均明显,双取代化合物一般均丧失活性双取代化合物一般均丧失活性。
(4)如果4位氨基上的取代基在体内可分解为游离氨基,则仍有活性。
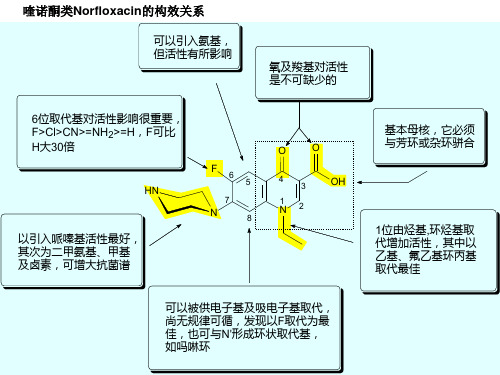
作用机制:磺胺类药物能与细菌生长所必须的对氨基苯甲酸产生竞争性拮抗,干扰细菌正常生长,产生抑菌作用【7】喹诺酮类构效关系1A缓缓是狂进作用必须基本药物集团;2 、B环可以改变;3、1位N\上的取代基对抗菌活像贡献很大;4、2位引入取代基其活性减弱或消失;5、5位取代基以氨基取代活性最高;6、6位引入氟原子抗菌作用增强;7位可取带增强抗菌活性;8位取代以F为好。
作用机制:喹诺酮以DNA螺旋酶和拓扑异构酶IV为靶点,与上述酶结合形成稳定复合物,抑制细菌的生长和分裂【8】H1受体拮抗剂构效不同药物的Ar1和Ar2两个芳环空间位置,决定了药物与受体疏水区和静电吸引区相互作用时质子化氮原子与受体形成氢键的方向,从而影响氢键键合能力,表现出拮抗活性的差异。
【9】H2受体拮抗剂H2受体都有两个药效部位:具有碱性的芳环结构和平面极性基团。
受体上谷氨酸残基阴离子作为碱性芳环共同作用点,平面基团可能与受体发生氢键键合相互作用。
【10】胆碱受体激动剂构效:1氮原子可以是质子化得叔氮原子,季铵盐最佳;2氮原子上取代基烃基大小不能超过甲基;3,、氮原子与酯基的氧原子之间间隔2个碳原子的合适距离;4、a位被甲基取代,阻止胆碱酯酶的作用延长作用时间。
且N样作用大于M作用;5、b位有甲基取代,M作用大于N 作用。
6、酰基可以变成氨甲酰基,保留拟胆碱活性。
【11】局部麻醉药构效亲脂部分为取代的苯环或芳杂环,以苯环作用较强。
(初级药士药物化学辅导精华)中间连接链与局部麻醉药作用持效时间及强度有关。
其麻醉作用时间顺序为-CH2->-NH->-S->-O-,麻醉作用强度顺序为-S->-O->-CH2->-NH-。
亲水部分一般为叔胺,烷基以3~4个碳原子时作用最强。
局部麻醉药结构中的亲水部分和亲脂部分必须有适当的平衡,即有合适的脂水分配系数,才有利于发挥其麻醉活性。
一般来说,具有较高的脂溶性和较低的pKa的局麻药通常具有较快的麻醉作用和较低的毒性。
作用机制:局部麻醉药阻断感觉神经冲动的发生和传导,通过直接作用在神经细胞膜上的钠通道,使其关闭组织Na内流。
【12】吗啡性质:天然吗啡具有左旋光性,由5个环稠合而成的刚性结构。
B/C环呈顺式,C/D环呈反式,C/E环呈顺式,C5,C6,C14上的氢与D环顺势,分子中有5个手性中心(5R,6S,9R,13S,14R)。
化学性质吗啡结构中3位有酚羟基,呈弱酸性;17位的叔氮原子呈碱性;-酸碱两性,临床上常用其盐酸盐(2)稳定性a. 3位酚羟基的存在,使吗啡及其盐的水溶液不稳定,放置过程中,受光催化易被空气中的氧氧化变色,生成毒性大的双吗啡(或称伪吗啡)和N-氧化吗啡。
b. 吗啡的稳定性受pH和温度影响pH=4最稳定,中性和碱性条件下极易被氧化;吗啡与酸性条件加热,经分子重排可生成阿扑吗啡--多巴胺受体的激动剂,可兴奋中枢的呕吐中心,作为催吐剂。
为m阿片受体强激动剂,镇痛作用强,还有一些镇咳和镇静作用,临床上用于抑制剧烈疼痛及麻醉前给药。
吗啡构效关系:1、3位酚羟基被醚化酰化活性及成瘾兴均下降,酚羟基位必须基团;2、6位羟基被羟基化酯化氧化成酮或去除,活性成瘾性均增加;3、7 8位双键可被还原,活性及成瘾性均增加;17位N为阵痛活性的关键,可悲不同取代基取代,可从激动剂转为拮抗剂;A D环是基本药效基团【13】精神病药作用机制药物的抗精神分裂症作用主要与阻断多巴胺受体有关。
由于多巴胺神经还和运动功能有关,阻断了多巴胺受体,也必然损伤运动功能,导致了一些锥外副反应。
【14】吩噻嗪构效关系:①吩噻嗪环上取代,2位取代增强活性,1, 3, 4位取代活性降低;2位取代基的作用强度与其吸电子性能成正比,顺序CF3 > Cl > COCH3 > H > OH ;2位含硫取代基主要用于止吐烷基侧链的改变:母核与侧链氨基之间相隔3个碳原子是基本结构特征,任何碳链的延长或缩短都将导致作用减弱或消失;侧链末端的碱性基团常为叔胺,可为直链的二甲胺基,也可为环状的哌嗪基或哌啶基,其中含哌嗪侧链的作用较强③③吩噻嗪母核的改变,产生新结构类型:母核硫原子可用-O-, -CH2-,-CH=CH-, -CH2CH2-等取代;母核氮原子可用-C=取代,衍生出噻吨类【15】抗抑郁药作用机制丙咪嗪吸收、代谢:口服吸收迅速,主要在肝脏中代谢,生成活性代谢物-地昔帕明,丙咪嗪起效较慢;地昔帕明,是一个强效的去甲肾上腺素重摄取抑制剂,抗抑郁作用更强,目前已经单独成药。
盐酸丙咪嗪作用本品适用于治疗内源性抑郁症反应性抑郁症更年期抑郁症也可用于小儿遗尿氟西汀作用与机制•抑制神经细胞对5-HT的重摄取,提高其在突触间隙中的浓度,改善病人的低落情绪。
选择性5-羟色胺重摄取抑制剂(SSRI),提高5-羟色胺在突触间隙中的浓度,从而改善病人的情绪;用于抗抑郁,选择性强【16】巴比妥类药物临床主要用途:1)镇静:催眠量的1/5-1/3,解除焦虑、烦躁不安等症状。
2)催眠:首选中、短效,效果不佳时用长效。
3)抗惊厥:适当剂量可有抗惊厥作用。
4)麻醉前给药以镇静。
5)解热镇痛药的配合成分,可增强镇痛作用。
缺点:1)用量稍大,次日精神不振、思睡、头晕、无力。
2)少数病人过敏,产生皮疹。
