第四章 酸碱滴定法
第四章 酸碱滴定法

[H ] [A ] [OH ]
平衡常数代入得:
K a [HA] K w [H ] [H ] [H ]
[H ]2 K a [HA] K w
精确式
第四章
酸碱滴定法
化学分析
若 caKa 20K W 时:可忽略Kw,得:
2 Κ Κ a a 4ca Κ a [H ] 2
(黄与红)
(蓝与黄)
特点: 变色敏锐;变色范围窄。
第四章
酸碱滴定法
化学分析
第三节
酸碱滴定法的基本原理
第四章
酸碱滴定法
化学分析
一、强酸(碱)的滴定
强酸与强碱滴定反应:
H+ + OHKt
H2O
1 1 14 1 . 00 10 [H ][OH ] K w
滴定常数(titration constant),Kt Kt值很大,是水溶液中反应程度最完全的酸碱滴定。
(续前 )
第四章
酸碱滴定法
化学分析
注:
实际与理论的变色范围有差别,深色比浅色灵敏
指示剂的变色范围越窄,指示变色越敏锐
例: pKa 甲基橙 3.4 甲基红 5.1 酚酞 9.1 百里酚酞 10.0 理论范围 2.4~4.4 4.1~6.1 8.1~10.1 9.0~11.0 实际范围 3.1~4.4 4.4~6.2 8.0~10.0 9.4~10.6
2K a 2 0.05 ca K a1
,按一元弱酸(碱)
处理:caKa1(b1)≥20Kw,c/Ka1(b1)≥500,用最 简式:[ H ] cKa1 ;[OH ] cKb1
第四章
酸碱滴定法
化学分析
分析化学酸碱第四章酸碱滴定法

HAc
δ0 δ Ac
Ac
cHAc
δ1 δ 0 δ HAc δ Ac
Ac Ka HAc Ac Ka H H K a 1 Ka H K a H
由上式我们可以看出: 值是H+浓度的函数,而与其 分析浓度无关。有了分布系数及分析浓度即可求得溶 液中酸碱各种存在形式的平衡浓度。
二、 溶剂的质子自递反应和水的质子自递常数
在水分子之间也可以发生质子转移作用, 这种仅在 溶剂分子之间发生的质子传递作用,称为溶剂的质子 自递反应。
H2O H2O H3O O H
该反应称为水的质子自递反应。反应的平衡常数称为水 的质子自递常数,以Kw表示。 [H3O+][OH-]= KW 水合质子H3O+常简写为H+,则 +][OH-]= KW [H 这个常数也称为水的离子积,在25℃时, [H+][OH-] = KW=1.0×10-14, pKW=14
4 4 3
NH NH 1
3 4
2、多元弱酸(碱)溶液中各存在形式的分布分数 (1)、二元酸
例如:草酸H2C2O4,在溶液中存在的形式有: H2C2O4 、HC2O4- 、 C O C2O42-,设其分析浓度为 cH ,三种存在形式的分布系数分别 为:δ 、δ 和 δ 2
H C O 2 2 4 1
[H ]2 Ka 1 Ka 1 Ka 2 [H ]2 [H ]Ka1 Ka 1Ka 2 1 [H ] [H ]2
同法可得:
[HC2O4 ] [H ]Ka1 δ 2 HC O c [H ] [H ]Ka1 Ka1Ka 2 2 4 H 2C 2O 4
第四章 酸碱滴定法 (分析化学人民卫生出版社第8版)

1、强酸(Ca )
HA H2O
H++AH + + OH -
[H+]=[A-]+[OH-]
[A-]=Ca
[H+]=Ca+Kw/[H+]
精确式
《 第四章 酸碱滴定法 1 》
- 6/125页 -
当Ca ≥ 20[OH-],忽略水的解离
[H+] ≈Ca
近似式
pH=-lg [H+]=-lgCa
《 第四章 酸碱滴定法 1 》
理论变色范围 pH=2.4~4.4
《 第四章 酸碱滴定法 1 》
- 35/125页 -
常用酸碱指示剂(P46)
人对不同颜色的敏感程度不同,红色易辨别,实际变色 范围与理论变色范围稍有区别。
《 第四章 酸碱滴定法 1 》
- 36/125页 -
注意 : 1、酸碱指示剂的变色范围不一定正好位于pH=7左右 ,
例:计算0.10 mol/L的邻苯二甲酸氢钾溶液的 pH。 解:查表得邻苯二甲酸的pKa1=2.94, pKa2=5.43
cKa2 ≥ 20Kw c≥ 20Ka1
1 mol/L的邻苯二甲酸氢钾溶液的 pH?
《 第四章 酸碱滴定法 1 》
- 22/125页 -
例:分别计算0.05 mol/L的NaH2PO4和3.33×10-2 mol/L的 Na2HPO4溶液的pH。
溶液的颜色随溶液pH的变化而变化,当pH=pKHIn 时 , [In-]=[HIn],这一点的pH称为理论变色点,溶液显酸 式色和碱式色的混合色。
《 第四章 酸碱滴定法 1 》
- 33/125页 -
由于人眼对颜色的辨别能力有限,在一点上不容易观察出,必须有一
《分析化学》-图文课件-第四章

如果cKa2≥10Kw,c/Ka1≥10,即[HCO3-]≈cHCO3-,则水解 离的H+忽略,Ka1与[HCO3-]相加时可忽略,则上式可简化为
(4-7)
第二节 溶液的酸碱度和pH值的计算
【例4-5】
计算0.10 mol·L-1 NaHCO3溶液的pH值。 解:已知H2CO3的Ka1=4.12×10-7,Ka2=5.62×10-11,符合cKa2≥10Kw, c/Ka1≥10。 根据式(4-7)得
因此,同浓度的NH3和CO3-2的碱性:CO3-2>NH3。
第二节 溶液的酸碱度和pH值的计算
一、 溶液的酸碱度
溶液的酸碱度是指溶液中氢离子、氢氧根离子的活度,常用 pH、pOH表示。它与溶液的浓度在概念上是不相同的,但当溶 液浓度不太大时,可用浓度近似地代替活度。溶液酸碱度的表达 式为
(4-3) 当温度为25 ℃时,水溶液Kw=[H+]·[OH-]=10-14,所 以 pH+pOH=pKw=14。 由此可见,pH值越小,酸度越大,溶液的酸性越强;pH越 大,酸度越小,溶液的碱性越强。同理,pOH越小,碱度越大, 溶液碱性越强;pOH越大,碱度越小,溶液的酸性越强。
实际上,酸碱半反应在水溶液中并不能单独进行,一种酸给 出质子的同时,溶液中必须有一种碱来接受。这是因为质子的半 径很小,电荷的密度比较高,游离的质子在水溶液中很难单独存 在。根据酸碱质子理论,各种酸碱反应实质上是共轭酸碱对之间 水合质子的转移过程。例如:
第一节 酸碱滴定法概述
在上述的反应中,溶剂水接受HAc所给出的质子,形成水合质 子H3O+,溶剂水也就起到碱的作用。同样,碱在水溶液中的解离, 也必须有溶剂水参加。以NH3在水溶液中的解离反应为例,NH3分 子中的氮原子上有孤对电子,可接受质子形成NH4+,这时,H2O 便起到酸的作用给出质子。具体反应如下:
第4章 酸碱滴定法

三种酸强弱顺序:HCl>HAC>H2S 在共轭酸碱对中,如果酸愈易给出质子,酸性愈弱,则其共轭碱对质子的亲和 力就愈弱,就愈不容易接受质子碱性就愈弱。 其共轭碱强弱顺序:Cl-1<AC-<HS2.Ka 和 Kb 之间关系: 共轭酸碱相互依存关系 [H + ][A − ] Ka= , [HA] 例: NH 3 + H 2 O Kb= Ka 和 Kb 之间关系 Ka·Kb=Kw NH + 4 + H 2O Ka= NH 3 + H 3 O +
−
δ1 =
[HC 2 O 4 ] [HC 2 O 4 ] = 2c [H 2 C 2 O 4 ] + [HC 2 O 4 ] + [C 2 O 4 ] K a1 [ H + ] = + 2 [ H ] + K a1 [ H + ] + K a1 K a 2
[C O ] [C 2 O 4 ] δ2 = 2 4 = 2c [H 2 C 2 O 4 ] + [HC 2 O 4 ] + [C 2 O 4 ] = K a1 K a 2 [ H ] + K a1 [ H + ] + K a1 K a 2
注意:Ka 和 Kb 之间的对应关系
§4-2 不同 pH 值溶液中酸碱存在形式的分布情况--分布曲线
引言:上次课上我们对酸碱平衡的基础理论进行简要的讨论,从这节课开始我 们介绍酸碱滴定法的有关理论和应用。这堂课我们学习分布曲线,学习它可帮 助我们深入理解酸碱滴定的过程、滴定误差以及分布滴定的可能性,而且对于 了解络合滴定与沉淀反应条件也是有用的。 任意的离解反应: HB + H 2 O 达平衡时 aq 中存在 [H3O+] H 3O + + B− [HB] [B-]
分析化学第4章 酸碱滴定法

[OH ] [ H ] 1010 104 TE % 100% 100% 0.2% CSP 0.05000
例:同上题,若以酚酞为指示剂,滴定至 pH=9为终点,计算终点误差。 解:已知Cb=0.05000mol/L, 终点溶液pH=9, [H+]=10-9mol/L,则[OH-]=10-14/10-9=10-5 mol/L。
(2)一元弱酸碱滴定
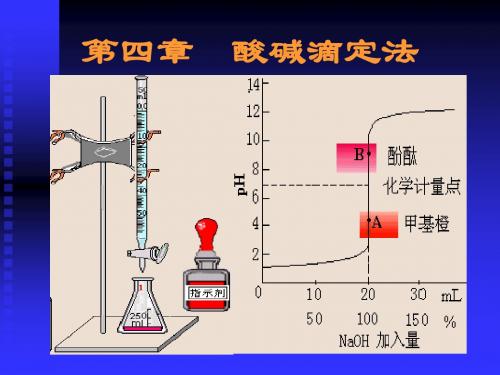
0.1000mol/L NaOH滴定20.00mL 0.1000mol/L HAc
HAC+OH-=AC-+H2O
滴定前:
[ H ] Ca K a
计量点前: HAC-NaAC缓冲系
[ HAC] [H ] Ka [ AC ]
滴入NaOH 19AC ] 20 .00 19 .98
共轭酸碱对概念 例:区分下列物质是酸还是碱?并指出共轭酸碱对
HAc H2CO3 H3PO4 NaAc NaHCO3 NaH2PO4 Na2HPO4 Na3PO4 H2O
NaCO3
酸碱反应的实质
酸碱共轭体系不能单独存在 HAc(酸1)H++Ac-(碱1) H++H2O(碱2) H3O+(酸2)
C C
HAc+OH-
K
b
OH HAc Ac
W
10
14
25C
C
pKa+pKb=pKw
酸的强度与其共轭碱的强度是反比关系。 酸愈强( pKa愈小),其共轭碱愈弱( pKb愈 大 ),反之亦然。
第04章酸碱滴定法

HAc (酸1)+ H2O (碱2)
H3O+(酸2)+Ac- (碱1)
溶剂水起碱的作用
2019年1月26日9时53 分
碱在水溶液中接受质子的过程:
NH3 + H+ H2O NH3 + H2O NH4+ H+ + OH- OH- + NH4+
必须有溶剂水分子参加。在这里,溶剂水起到酸 的作用。 水是一种两性溶剂: H2O + H2O
= 6.80
即
2019年1月26日9时53 分
Kb2=1.6×10 -7
§4.2 不同pH溶液中酸碱存在形式 的分布情况—分布曲线
分布曲线(distribution curve)作用: (1)深入了解酸碱滴定过程; (2)判断多元酸碱分步滴定的可能性。 滴定是溶液pH 与溶液中各物种的量及其比例不断 变化的过程。 分布系数δ (distribution coefficient) :
2019年1月26日9时53 分
例 2:
一元弱酸水溶液,选择HA和H2O为参考水平: HA 的解离反应: HA + H2O 水的质子自递反应: H2O + H2O H3O+ + A-
H3
O+
+ OH
-
质子条件:[H+] = [A- ] + [OH - ]
2019年1月26日9时53 分
例 3:
Na2CO3水溶液,选 CO32- 和 H2O为参考水平: CO3 + H2O
2019年1月26日9时53 分
H3O+ + OH-
水的质子自递常数
在水分子之间存在着的质子传递作用,称为水的 质子自递作用。这种作用的平衡常数称为水的质子自 递常数: Kw = [H3O+][OH-] 或: Kw= [H+][OH-] 在25℃: Kw = 10-14 pKw= 14
4第四章 酸碱滴定法
NH3CH 2COOH的K a1 4.5 103 ; K a 2 2.5 1010 ;
NH 4 a
解:(1) [H ] K a K
Kw Ka Kb
1.8 104 1.0 1014 3.2 107 (mol L1 ) 1.8 105 pH 6.50
•
•
强酸强碱溶液pH值的计算 弱酸弱碱溶液pH值的计算 两性物质溶液(C ) 缓冲溶液pH值的计算
水溶液中[H+]的计算方法: 1. 列出PBE式; 2. 代入有关常数和浓度数据; 3. 计算出[H+]。 注:在计算中可以进行合理的近似处理, 最后用近似式或最简式进行计算。
一、一元酸(碱)溶液的氢离子浓度计算
[ NH ] 4
精确式
[H ] K a1 ( K a 2 K
NH 4 Na H2PO4 Na2HPO4
H
K a1 K a 2 K a1 K a 2
H
H
Ka 2 Ka 3
练习题: (1)计算0.10mol HCOONH4溶液的pH值。 L-1 (2)计算0.10mol L-1氨基乙酸(NH2CH2COOH)溶液的pH 值。 HCOOH的K a 1.8 104 ; NH3的Kb 1.8 105
23 3
2
NH 4 a
[ NH ] 4 [H ] 2- 2[H ] [CO 3 ] 1 1 Ka2 K a1 Kw K
NH 4 a
精确式
[H ] 2 K a 2 K
NH 4 a
最简式***
2. 酸式盐:NH4HCO3
2 [H ] [OH ] [CO3 ] - [H2CO3 ] [NH3 ]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章酸碱滴定法(65题)(一)A型题在以下选项中选出一个最符合题意的答案。
1.酸碱滴定法的标准溶液是()。
A.NaOH B.Na2CO3C.HAcD.NH3·H2O E.Na2B4O7·10H2O2.标定HCl溶液的基准物质是()。
A.NaOH B.Na2CO3C.HAcD.NH3·H2O E.KHC8H4O43. 标定NaOH溶液的基准物质是()。
A.HAc B.Na2CO3C.KHC8H4O4D.NH3·H2O E. NaOH4. 测定HAc含量选用的指示剂为()。
A.石蕊 B. 甲基橙 C. 酚酞D.甲基红 E. 中性红5. 用甲基橙为指示剂测定Na2CO3含量,其HCl与Na2CO3反应完全时,物质的量之比为()。
A.2:1 B. 1:2 C. 1:1D.3:1 E. 1:36. NaOH标准溶液测定HAc含量时,用酚酞为指示剂,终点颜色是()。
A.无色 B. 淡红色 C. 红色D.黄色 E. 橙色7. HCl标准溶液测定NH3·H2O含量,应选择的指示剂是()。
A.甲基橙 B. 酚酞 C. 百里酚酞D.中性红 E. 以上均可8. 可用碱标准液直接测定的物质的条件为()。
A.cKa≥10-8的酸 B. cKb≥10-8的碱 C. NaOHD.NH3·H2O E. H2CO39. 可用酸标准溶液直接测定的物质的条件为()。
A.cKa≥10-8的酸 B. cKb≥10-8的碱 C. NaOHD.NH3·H2O E. H2CO310. 测定硼砂含量实践操作正确的是()。
A.左手控制滴定管活塞流速,右手旋摇锥形瓶B. 右手控制滴定管活塞流速,左手旋摇锥形瓶C. 用托盘天平称取硼砂质量D.用移液管移取谁的体积E. 将硼砂加热溶解后立即加入指示剂11. 在用邻苯二甲酸氢钾基准物标定NaOH的实践操作中,正确的是()。
A.用酸式滴定管盛装NaOH溶液B. 排碱式滴定管尖端气泡时,是将胶管中的玻璃珠往上移动C. 用碱式滴定管盛装NaOH溶液D.排碱式滴定管尖端气泡时,是将胶管中的玻璃珠往下移动E. 选用甲基橙指示剂指示终点12.酚酞指示剂的变色范围及颜色是()。
A.8.0(无色)~10.0(红色) B. 8.0(红色)~10.0(无色)C. 3.1(红色)~4.4(黄色) D.3.1(黄色)~4.4(红色)E. 4.4(红色)~6.2(黄色)13. 甲基橙指示剂的变色范围及颜色是()。
A.8.0(无色)~10.0(红色) B. 8.0(红色)~10.0(无色)C. 3.1(红色)~4.4(黄色) D.3.1(黄色)~4.4(红色)E. 4.4(红色)~6.2(黄色)14. 甲基红指示剂的变色范围及颜色是()。
A.8.0(无色)~10.0(红色) B. 8.0(红色)~10.0(无色)C. 3.1(红色)~4.4(黄色) D.3.1(黄色)~4.4(红色)E. 4.4(红色)~6.2(黄色)15. 酸碱指示剂一般属于()。
A. 无机物B. 有机盐C. 有机酸D. 有机碱E. 有机弱酸或弱碱16. 强酸强碱的滴定,化学计量点的酸碱性是()。
A. pH﹤7B. pH﹥7C. pH=7D. 强酸性E. 强碱性17. 强酸滴定弱碱,化学计量点酸碱性是()A. pH﹤7B. pH﹥7C. pH=7D. 强酸性E. 强碱性18. 强碱滴定弱酸,化学计量点酸碱性是()A. pH﹤7B. pH﹥7C. pH=7D. 强酸性E. 强碱性19. 判断二元弱酸能被滴定,并有两个滴定突跃的条件是()A. cKa2≥10-8 B. Ka1/Ka2≥104 C. cKb2≥10-8D. Kb1/Kb2>104 E. cKa2≥10-8;Ka1/Ka2≥10420. 二元弱碱能被滴定,并有两个滴定突跃的条件是( )A. cKa2≥10-8;Ka1/Ka2≥104 B. Ka1/Ka2≥104C. cKb2≥10-8 D. cKb≥10-8;Kb1/Kb2≥104E. Kb1/Kb2>10421. 酸碱指示剂的变色范围是()A. pH=PKHIn ±0.1 B. pH=PKHIn±0.2 C. pH=PKHIn±1D. pH=PKHIn ±2 E. pH=PKHIn±322. 混合指示剂的优点包括,颜色变化敏锐,变色范围()A. 不一定B. 多样C. 宽D. 窄E. 以上均是23. 标定HCl溶液时用Na2CO3为基准物质,称取Na2CO30.6817g,以甲基橙为指示剂,用去HCl溶液26.50ml,HCl溶液的浓度为()mol/L。
(M=105.99)A. 0.4800 B. 0.4854 C. 0.4850D. 0.048E. 0.48624. 在1.000g粗铵盐中加过量NaOH溶液,产生的氨经蒸馏吸收在50.00ml0.5000 mol/L的盐酸中,过量的酸用0.5000 mol/L NaOH标准溶液滴定,用去1.56ml,该样品中的NH3的质量分数为()A. 0.4140B. 0.4141C. 0.4125D. 0.4122E. 0.412425. OH-的共轭酸是()。
A. H+B. H2O C.H3O+D. O2-E. 以上均不是26. 在下列各组酸碱组分中,不属于共轭酸碱对的是()A. HOAc-NaOAcB. H3PO4-H2PO4-C. +NH3CH2COOH-NH2CH2COO- D. H2CO3-HCO3-E. 以上均不是27. 水溶液中共轭酸碱对K a与K b的关系是()A. K a·K b=1B. K a·K b=K wC. K a/K b=K wD. K b/K a=K wE. 以上均不是28. 浓度相同的下列物质水溶液的pH最高的是()A. NaClB. NH4Cl C. NaHCO3D. Na2CO3E. HCl29. 今有一磷酸盐溶液的pH = 9.78, 则其主要存在形式是()(已知H3PO4的解离常数p K a1 = 2.12,p K a2 = 7.20,p K a3 = 12.36)A. HPO42- B. H2PO4- C. HPO42- + H2PO4D. H2PO4-+ H3PO4E. HPO42-+ H3PO430. 以下溶液稀释10倍时pH改变最小的是()A. 0.1 mol·L-1 NH4OAc溶液B. 0.1 mol·L-1 NaOAc溶液C. 0.1 mol·L-1 HOAc溶液D. 0.1 mol·L-1 HCl溶液E. 0.1 mol·L-1HAc溶液31. 以下溶液稀释10倍时pH改变最大的是()A. 0.1 mol·L-1 NaOAc-0.1 mol·L-1 HAc溶液B. 0.1 mol·L-1 NaAc溶液C. 0.1 mol·L-1 NH4Ac-0.1 mol·L-1 HOAc溶液D. 0.1 mol ·L -1 NH 4Ac 溶液E. 0.1 mol ·L -1 NH 4OAc 溶液32. 欲配制pH=9的缓冲溶液,应选用( ) A. NH 2OH(羟氨) (p K b =8.04) B. NH 3·H 2O (p K b = 4.74) C. CH 3COOH (p K a = 4.74) D. HCOOH (p K a = 3.74) E. 以上均不能选用33. 欲配制pH=5的缓冲溶液,下列物质的共轭酸碱对中最好选择( ) A. 一氯乙酸(K a = 1.4×10-3) B. 甲酸(K a = 1.8×10-4) C. 乙酸(K a = 1.8×10-5) D. 氨水(K b = 1.8×10-5) E. 醋酸34. 用NaOH 滴定某一元酸HA ,在化学计量点时,[H +]的计算式是( )A. a HA K c ⋅B. -B HAa c c K ⋅C.a A w -K c K ⋅ D. -A wa c K K ⋅E.-A ac K 35. 配制HCl 标准溶液用( )法。
A. 直接配制法B.间接配制法C. 置换法D. 滴定法E. A 、B 选项均可 36. 配制NaOH 标准溶液用( )法。
A. 直接配法B.间接配制法C. 置换法D. 滴定法E. A 、B 选项均可 37. NaOH 要先配成饱和溶液是因为( )A .由于固体NaOH 易吸收空气中的H 2O 生成Na 2CO 3。
B. 由于固体NaOH 易吸收空气中的H 2CO 3生成Na 2CO 3。
C. 由于固体NaOH 易吸收空气中的CO 2生成Na 2CO 3。
D.由于固体NaOH易吸收空气中的SO2生成Na2SO4。
E. 由于固体NaOH易吸潮。
38. 血浆中CO2结合力的测,可采用()法。
A. 返滴定法B.间接滴定法C. 置换滴定法D. 直接滴定法E. A、B选项均可(二)B型题备选答案在前,试题在后,每组题均对应同一组备选答案,每题只有一个正确答案,每个备选答案可重复选用,也可不选用。
(39~43题共用备选答案)A.NaOH B.HCl C.靛蓝D.甲基橙 E. 酚酞39. 测定碱类化合物的含量,应使用的标准溶液是()。
40. 测定酸类化合物的含量,应使用的标准溶液是()。
41. 测定弱酸含量,选用的指示剂是()。
42. 测定弱碱含量,选用的指示剂是()。
43. 强碱滴定强酸最好的指示剂是()。
(44~48题共用备选答案)A.8.0(无色)~10.0(红色) B. 6.7(黄色)~8.4(红色)C. 3.1(红色)~4.4(黄色) D.2.9(红色)~4.0(黄色)E. 4.4(红色)~6.2(黄色)44. 酚酞指示剂的变色范围及颜色为()45. 甲基橙指示剂的变色范围及颜色为()46. 甲基红指示剂的变色范围及颜色为()47. 酚红指示剂的变色范围及颜色为()48. 甲基黄指示剂的变色范围及颜色为()(三)X型题每题的备选答案中有2个或2个以上正确答案。
少选或多选均不得分。
49. 可作为酸碱滴定法的标准溶液是()。
A.HCL B.NaOH C.HAcD.H2SO4E.NH3·H2O50. 只能用间接方法配制的标准溶液有()A.AgNO3B.NaOH C.NaClD.HCl E.Na2CO351. 影响滴定弱酸的滴定突跃大小因素有()。
A.滴定程序 B. 酸的浓度 C. 酸的电离常数D.指示剂 E. 滴定速度52. 影响指示剂变色范围大小的因素有()A. 速度B. 温度C. 溶剂D.指示剂的用量 E. 滴定程序53. 酸碱滴定法可直接测定哪些物质的含量()。
