乙炔 教案
乙炔-沪科版高二化学下册教案

乙炔-沪科版高二化学下册教案一、教学目标1.掌握乙炔的化学性质和反应类型。
2.了解乙炔在生产中的应用。
3.通过实验和课堂讨论,引导学生积极思考和探究。
二、教学重难点1.重点:乙炔的化学性质和反应类型。
2.难点:乙炔在生产中的应用。
三、教学过程1. 导入(10分钟)通过生活中,街头巷尾,厂房内部我们所看到的明火等例子,通过比较玄学的方式引出火焰的化学概念,谈论火的颜色和火的颜色的变化,为引出乙炔燃烧提供条件。
2. 讲授(35分钟)2.1 什么是乙炔乙炔是由碳(C)和氢(H)两种元素组成的化合物,化学式为C2H2。
其结构式如下:乙炔结构式乙炔结构式2.2 乙炔的物理性质1.乙炔是一种无色、有刺激性气味的气体。
2.乙炔比空气轻,分子式为C2H2,密度为0.91g/L,易于弥散扩散。
2.3 乙炔的化学性质1.乙炔燃烧:乙炔在氧气(O2)中燃烧,生成水(H2O)和二氧化碳(CO2)。
反应式:C2H2 + 2.5O2 → 2H2O + 2CO22.乙炔和溴水的反应:乙炔在溴水中加热,会生成1,2,4-三溴丁烷。
反应式:C2H2 + 3Br2 → C8H6Br62.4 乙炔在生产中的应用乙炔在生产中被广泛应用于气焊、切割和生产乙炔醛等化学品。
3. 实验(40分钟)小组实验,要求每个组别根据本节课所学知识完成以下操作:1.向一个大气球中通入气体,并听教师、观察气球的变化,判断气球中气体的性质。
2.利用氧气瓶和乙炔瓶,回忆并完成气焊设备的组装,并点燃瓶口,进行焊接实验。
4. 总结(10分钟)通过听取学生总结和课堂讨论,巩固学生对本节课所学知识的理解和掌握。
四、教学反思通过本节课的教学,学生对于乙炔的化学性质和反应类型有了更加深度的理解,对乙炔在工业生产中的应用以及相关设备的操作也有了初步认识。
同时,通过实验和课堂讨论,引导学生积极思考,培养了学生发散性思维和合作精神,提高了课堂效率。
在未来的教学实践中,需要更加注重对乙炔在生产中的应用的讲解和生动形象的引入,以激发学生学习和思考的兴趣。
高中化学必修乙炔教案

高中化学必修乙炔教案教学内容:炔烃的基本概念、结构、性质及生产应用教学目标:1. 了解炔烃的基本结构和性质2. 掌握炔烃的命名方法3. 分析炔烃的化学反应4. 了解炔烃在生产和应用中的作用教学重点:1. 炔烃的结构和性质2. 炔烃的命名方法3. 炔烃的化学反应教学难点:1. 炔烃的不饱和度对其性质的影响2. 炔烃在生产和应用中的作用教学环节:一、导入(5分钟)引导学生思考:什么是炔烃?炔烃有什么特点?二、讲解炔烃的基本概念和结构(15分钟)1. 介绍炔烃的结构和化学式2. 分析炔烃的不饱和度对其性质的影响三、讲解炔烃的命名方法(10分钟)1. 根据炔烃的结构命名其名称2. 介绍常见炔烃的命名方法四、总结炔烃的性质和化学反应(15分钟)1. 分析炔烃和卤代烃的重要性2. 讲解炔烃的化学反应及应用五、探讨炔烃在生产和应用中的作用(10分钟)1. 讨论炔烃在有机合成、工业生产中的应用2. 分析炔烃的重要性六、作业布置(5分钟)布置相关阅读任务:了解炔烃在生产和应用中的具体作用教学反馈:◆通过课堂讨论、问题解答等方式对学生的学习情况进行及时跟进,并针对性地进行答疑。
◆帮助学生巩固所学知识,引导学生独立阅读相关资料,提高学生对炔烃知识的理解和应用能力。
教学延伸:◆鼓励学生主动了解炔烃在日常生活和工业生产中的应用,并进行相应的活动和探究。
◆引导学生进一步深入学习炔烃相关知识,拓展学生的化学视野。
教学资源:1. 课本《高中化学必修》2. PPT课件3. 实验室实验材料教学评估:1. 学生课堂表现2. 作业完成情况3. 考试成绩注:本教案参考了《高中化学必修课程标准》并根据实际教学情况做了适当调整。
高中化学乙炔和炔烃教案

高中化学乙炔和炔烃教案
教学目标:
1. 理解乙炔和炔烃的结构特点及命名规则;
2. 掌握乙炔和炔烃的物理性质和化学性质;
3. 了解乙炔和炔烃在生产和应用中的重要性。
教学重点难点:
1. 乙炔和炔烃的结构特点及命名规则;
2. 乙炔和炔烃的物理性质和化学性质。
教学准备:
1. 实验室设备和药品:乙炔气体、炔烃溶液等;
2. 课件:包括乙炔和炔烃的结构公式图和相关实验现象图;
3. 教学参考资料:化学教材、化学实验手册等。
教学过程:
一、引入
教师通过相关实验现象或图片展示,引出乙炔和炔烃的特点及重要性。
二、知识讲解
1. 乙炔的结构特点和命名规则;
2. 炔烃的结构特点和命名规则;
3. 乙炔和炔烃的物理性质和化学性质介绍。
三、实验操作
教师组织学生进行乙炔和炔烃的实验操作,观察实验现象并记录实验结果。
四、讨论分析
学生根据实验结果,讨论乙炔和炔烃的性质及其应用领域,对比不同炔烃的特点。
五、总结归纳
通过学生讨论和教师引导,总结乙炔和炔烃的特点和重要性,强化学生的记忆和理解。
六、作业布置
布置相关习题,要求学生巩固所学知识。
七、课堂小结
教师对本节课的重点知识做一个小结,并鼓励学生积极参与课堂互动。
教学反思:
通过本节课的教学,学生能够深入了解乙炔和炔烃的结构特点及性质,并能够运用所学知识解决相关问题。
同时,教师应根据学生的掌握情况对教学内容进行适当调整和补充,确保教学效果的实现。
高中化学乙炔优质课教案

高中化学乙炔优质课教案
课时:1课时
教学目标:
1. 了解乙炔的基本性质和结构。
2. 掌握乙炔的合成方法和主要用途。
3. 理解乙炔的燃烧反应和氧化反应。
教学重点:
1. 乙炔的基本性质和结构。
2. 乙炔的合成方法和主要用途。
教学难点:
1. 理解乙炔的燃烧反应和氧化反应。
教学过程:
一、引入
老师通过引入乙炔在生活中的应用和重要性,引发学生对乙炔的兴趣,激发学生的学习热情。
二、乙炔的基本性质和结构
1. 讲解乙炔的化学式和结构式。
2. 探讨乙炔的物理性质和化学性质。
三、乙炔的合成方法和主要用途
1. 简要介绍乙炔的合成方法。
2. 分析乙炔在化工生产中的主要用途。
四、乙炔的燃烧反应和氧化反应
1. 讲解乙炔的燃烧反应和氧化反应的化学方程式。
2. 分析乙炔的燃烧和氧化反应的机理和应用。
五、课堂练习
设计乙炔的相关练习题,巩固学生的学习成果。
六、课堂总结
对本节课的内容进行总结,强调乙炔的重要性以及在化工生产中的应用。
七、作业布置
布置相关习题和阅读材料,并要求学生按时完成和提交。
教学反思:
通过本节课的教学,学生对乙炔的基本性质、结构、合成方法和主要用途有了较为全面的了解,同时也增强了对乙炔燃烧反应和氧化反应的理解。
在教学过程中,要注重培养学生的实验能力和创新意识,引导学生运用所学知识解决实际问题。
高二化学乙炔教案人教版

《乙炔炔烃》知识技术目标:1、掌握乙炔的构造和重要性质。
2、经过球棍模型,培育学生的空间想像能力,培育学生的抽象思想能力3、经过分组实验,培育学生的察看能力、实验能力和解决本质问题的能力。
4、依据构造解说乙炔的化学性质,对学生进行构造决定性质,性质反应构造的教育。
过程与方法目标:1、经过球棍模型,帮助学生理解乙炔的空间构造。
2、经过实验法使学生掌握乙炔的化学性质感情目标:1、经过学生疏组实验,激发学生的学习兴趣;2、经过学生对实验事实的剖析,培育学生谨慎务实的科学态度以及理论联系本质的优秀质量。
3、对学生进行辩证唯心主义看法、实践是查验真谛的独一标准的教育。
要点、难点1、乙炔的构造2、乙炔的化学性质教课过程教师活动学生活动设计企图【信息】 1892 年,美国的威尔森将生阅读信息,提守信息并思虑1、培育学生阅读石灰和煤焦油混淆搁置在电炉中希望信息,演绎推理获得金属钙。
结果获得了一种暗黑色固能力、收集办理体,他将此种固体倒进水中,产生了大学生填写预习纲要并展现信息的能力量气体。
经对此黑色固体剖析确认,发2、提出问题,惹起现此固体为电石,主要成分为碳化钙【回答】学生思虑。
(CaC2),产生的气体中只含有 C、H两一、构造: C2H2种元素,分子量为 26,将它命名为电电子式 H ∶C C∶H石气,别名乙炔。
经过以上信息,你能构造式 H —C≡C—H作出哪些推测?请同学们分类概括、总构造简式 HC ≡ CH结并说明原由。
二、物理性质【板书概括】三、化学性质【过渡】同学们作出了这么多的推测,我们再回过头来对每一部分内容进行详细的研究。
第一从构造下手:我们研究了乙炔的分子构成、电子式、构造式,但乙炔的构造式只表原子在空间的连接方式,其实不表示它的空间构型,要想知道乙炔的空间构型,还要知道什么数【回答】键角据?培育学生的空间想【叙述】科学研究表示,乙炔的键角是象能力。
180°,因此乙炔的空间构型是什么样直线型子?展现乙炔的球棍模型、比率模型与乙烯、甲烷的球棍模型进行比较【指引学生思虑】依据乙炔分子中有-C≡C-叁键的这类构造,你能推测出乙炔拥有什么性质吗?如何证明乙炔分子拥有有不饱和性?【叙述】此刻我们实验室为同学准备了查验乙炔能否拥有不饱和性的实验。
乙炔教案 高中化学
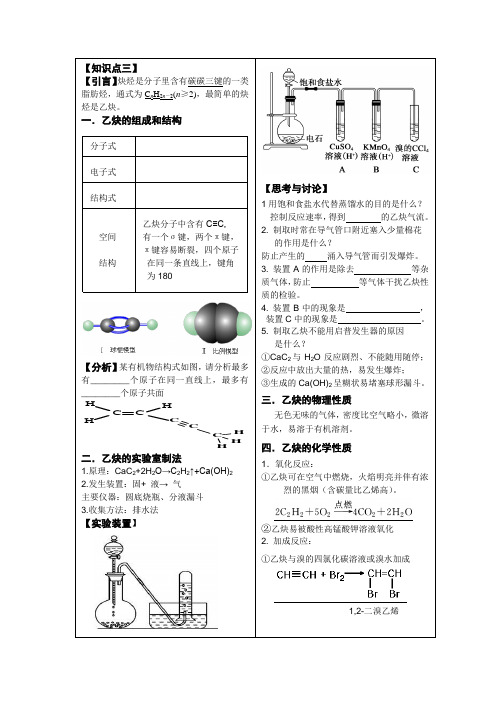
【知识点三】【引言】炔烃是分子里含有碳碳三键的一类脂肪烃,通式为C n H 2n -2(n ≥2),最简单的炔烃是乙炔。
一.乙炔的组成和结构分子式电子式结构式乙炔分子中含有C≡C, 空间 有一个σ键,两个π键, π键容易断裂,四个原子 结构 在同一条直线上,键角 为180°【分析】某有机物结构式如图,请分析最多有________个原子在同一直线上,最多有________个原子共面CCH HHCCC HHH二.乙炔的实验室制法1.原理:CaC 2+2H 2O→C 2H 2↑+Ca(OH)22.发生装置:固+ 液→ 气 主要仪器:圆底烧瓶、分液漏斗3.收集方法:排水法【实验装置】【思考与讨论】1用饱和食盐水代替蒸馏水的目的是什么? 控制反应速率,得到 的乙炔气流。
2. 制取时常在导气管口附近塞入少量棉花的作用是什么?防止产生的 涌入导气管而引发爆炸。
3. 装置A 的作用是除去 等杂质气体,防止 等气体干扰乙炔性质的检验。
4. 装置B 中的现象是 ,装置C 中的现象是 。
5. 制取乙炔不能用启普发生器的原因 是什么?①CaC 2与H 2O 反应剧烈、不能随用随停;②反应中放出大量的热,易发生爆炸;③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
三.乙炔的物理性质 无色无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂。
四.乙炔的化学性质1.氧化反应:①乙炔可在空气中燃烧,火焰明亮并伴有浓烈的黑烟(含碳量比乙烯高)。
②乙炔易被酸性高锰酸钾溶液氧化2. 加成反应:①乙炔与溴的四氯化碳溶液或溴水加成1,2-二溴乙烯1,1,2,2-四溴乙烷②乙炔与氢气加成③与氯化氢加成氯乙烯聚氯乙烯塑料④与水加成乙烯醇乙醛⑤与氢氰酸加成CH≡CH+HCN 催化剂△CH2=CH-CN丙烯晴3.加聚反应聚乙炔【思考与讨论】1.如何鉴别甲烷、乙烯、乙炔三种气体?。
2.用电石、水、氯化氢为原料,怎样制聚氯乙烯?写出反应的化学方程式。
乙炔教案公开课

乙炔教案公开课教案标题:乙炔教案公开课教案目标:1. 了解乙炔的基本性质和特点。
2. 掌握乙炔的制备方法和重要应用。
3. 培养学生的实验操作能力和科学探究能力。
教学重点:1. 乙炔的制备方法和反应性质。
2. 乙炔在工业和实验室中的重要应用。
3. 实验操作的安全性和准确性。
教学难点:1. 理解乙炔的结构和特性。
2. 掌握乙炔的制备方法和反应性质。
3. 理解乙炔在工业和实验室中的重要应用。
教学准备:1. 实验室设备和试剂:酸性氯化钙、乙醇、浓硫酸、乙炔气气瓶、氧气气瓶。
2. 实验操作步骤和安全注意事项。
3. 多媒体投影仪和相关乙炔的图片、视频资料。
教学过程:一、导入(5分钟)1. 利用多媒体投影仪展示乙炔的图片和视频,引起学生的兴趣。
2. 提问:你们对乙炔有什么了解?乙炔有哪些重要应用?二、知识讲解(15分钟)1. 介绍乙炔的基本性质和特点,包括其化学式、结构和物理性质。
2. 说明乙炔的制备方法,重点讲解乙醇脱水法和石灰石电解法。
3. 介绍乙炔的反应性质,包括与氧气的燃烧反应和与卤素的加成反应。
三、实验演示(20分钟)1. 展示乙炔的制备方法:乙醇脱水法。
2. 演示乙炔与氧气的燃烧反应。
3. 演示乙炔与溴水的加成反应。
四、实验操作(30分钟)1. 学生分组进行乙炔的制备实验,注意操作安全和准确性。
2. 学生进行乙炔与氧气的燃烧实验,观察反应现象。
3. 学生进行乙炔与溴水的加成反应实验,观察反应现象。
五、讨论与总结(15分钟)1. 学生讨论实验结果和观察现象,总结乙炔的制备方法和重要应用。
2. 引导学生思考乙炔在实际生活和工业中的应用价值。
六、作业布置(5分钟)1. 布置乙炔相关的练习题,巩固所学知识。
2. 鼓励学生自主探索乙炔在实际生活中的应用,并撰写一篇小论文。
教学反思:1. 通过多媒体展示和实验演示,激发了学生对乙炔的兴趣和好奇心。
2. 实验操作环节能够培养学生的实验操作能力和科学探究能力。
3. 布置作业和小论文,提高学生对乙炔的理解和应用能力。
高中有机化学乙炔教案

高中有机化学乙炔教案一、教学目标:1. 了解乙炔的结构、性质和制备方法。
2. 掌握乙炔的性质及其在化学反应中的应用。
3. 能够运用所学知识解决有机化学乙炔相关问题。
二、教学重点:1. 乙炔的结构和性质。
2. 乙炔的制备方法。
3. 乙炔在化学反应中的应用。
三、教学内容:1. 乙炔的结构和性质1. 结构:C2H22. 物理性质:无色、有刺激性气味、易燃、难溶于水。
3. 化学性质:容易燃烧,可发生加成反应、置换反应等。
2. 乙炔的制备方法1. 乙炔的制备方法:从乙烯进行脱氢得到乙炔。
2. 化学方程式:C2H4 → C2H2 + H23. 乙炔在化学反应中的应用1. 乙炔在卤素加成反应中的应用。
2. 乙炔在重铬酸钾氧化反应中的应用。
3. 乙炔在氢化反应中的应用。
四、教学方法:1. 理论授课:介绍乙炔的结构、性质和制备方法。
2. 实验演示:进行乙炔的制备实验演示。
3. 课堂讨论:讨论乙炔在化学反应中的应用。
4. 案例分析:分析乙炔相关案例,加强学生理解。
五、教学资源:1. PowerPoint课件:乙炔的结构、性质和制备方法。
2. 实验器材:乙炔的制备实验器材。
3. 参考书籍:有机化学相关教材。
六、教学评价:1. 课堂小测验:考察学生对乙炔的结构、性质和制备方法的理解。
2. 实验报告:要求学生撰写乙炔的制备实验报告。
3. 作业布置:布置乙炔相关的思考题,检查学生的学习效果。
以上是一份关于高中有机化学乙炔教案范本,希望能够对您有所帮助。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、用石灰石、食盐、焦碳、水为原料, 写出合成聚氯乙烯的方法。
石灰石→生石灰→碳化钙→乙炔 食盐+ 水→氯气、氢气→氯化氢
氯乙烯→聚氯乙烯
作业
聚乙烯和聚氯乙 烯都是生活中常见的 塑料,请设计合理的 方法鉴别它们。
_______________________________-.
(2) 用试管制取少量乙炔时,在试管上部放置一团疏松的棉花 ,其作用是
_______________________________.
(3) 实 验 室 制 取 下 列 气 体 时 , 不 能 使 用 启 普 发 生 器 的 是 _________
乙炔
键能数据: 碳碳单键; 413KJ/mol
碳双键: 615KJ/mol
碳碳三键: 812KJ/mol
键长数据: 1.54×10-10
1.33 ×10-10
1.20 ×10-10
乙烯的化学性质:
一、加成反应:CH2 CH2 + Br2
CH2 CH2
Br
Br
二、氧化反应: (一)燃烧:C2H4+O2 点燃 CO2+H2O
CaC2+2H2O C2H2↑+Ca(OH)2
与 反应类
溴型
取代反应 加成反应 加成反应
反 应
主产物
一,二,三, 四溴甲烷
1,2-二溴乙烷 1,2-二溴乙烯
1,2,3,4-四溴乙烷
主要用途
气体燃料 合成塑料 气体燃料
乙炔的制备.swf
练习
只用空气鉴别甲烷、乙烯、乙 炔三种气体,可将三种气体分 别——————,观察——————和 ——————。
现象:火焰明亮,有黑烟。
(二)被酸性高锰酸钾氧化;
三、加聚反应:
n CH2
CH2
催化剂
△
CH2
CH2 n
为解决碳化钙与水反应过快, 可采取的方法为:
A:用矿泉水代替纯水。 B:用盐酸代替纯水。 C:用饱和食盐水代替纯水。 D;将电石由块状变为粉末状 。
试验要求
1.设计实验制备乙炔并验证其可能有的 化学性质.
练习
1、某温度和压强下, 将4g由3种炔烃(分 子中只含有一个 碳碳叁键)组成的混合 气体与足量的H2反应, 充分加成后,生成 4.4g 3种对应的烷烃,则所得烷烃中一定 有( )
A. 异丁烷 B. 乙烷 C. 丙烷 D. 丁烷
2、下列是有关实验室制取乙炔的实验问题,按要求回答. (1) 为了控制水与电石的反应速率并得到平稳的气流,采取的 措施是
石,饱和食盐水.
聚氯乙烯合成釜
乙炔的水化
乙烯醇的转化
乙炔的用途
甲烷 乙烯 乙炔
结构特点 单键链状饱和 双键链状不饱和 叁键链状不饱和
所属烃类 的通式
CnH2n+2
CnH2n
CnH2n-2
实验室制 CH3COONa+NaOH
C2H5OH
浓硫酸 170℃
法原理
CH4 ↑ +Na2CO3 H2O+C2H4↑
2.注意所设计实验的合理性和安全性.
3.注意实验过程中操作的规范性.
4.所需信息的来源:a)教材P96和P178 b)相互讨论. c)问老师.
提供的仪器和药品:
仪 器 : 大 试 管 , 单 孔 塞 ( 带 导 管 ),
铁架台(带铁夹),棉花,火柴,水槽,小 试管(若干).
药品:酸性高锰酸钾,溴水,电
