电池简介
电池基础知识介绍

目录
电池分类、动力电池及发展史 电池组成及工作原理 电池术语及电性能 重点 电池结构、组合方式及生产工艺 各种电池简介 电池相关标准及测试 电池公司大汇总
一.电池分类、动力电池及发展史
分类: 按工作性质及存储方式分:原电池,蓄电池,储备(激活)电池,燃料电池; 按电解质性质分:酸性电池,碱性电池,中性电池,有机电解质溶液电池,
电池反应
三.电池常用术语及电性能
1. 电动势:电池两极在断路时处于可逆平衡状态下,两极平衡电极电位之差,是 经过计算的理论值。
2. 开路电压:电池在断路时电池两极的电极电位之差。开路电压是一个实际测量 的值。如锂离子电池的开路电压为4.1V,铅酸蓄电池为2.1V
电动势>开路电压 电池的电动势或开路电压值取决于所组成电池的电极材料与电解质的活度和放
注:图中A区(阴影部分)为电池对外输出的能量;B区为电池自身 损耗的能量。
b.电池的放电温度:温度降低,输出容量减少;
c.电池的放电终止电压:是由用电器以及电池反应本身的限定来设定的, 例如:充电时,终止电压为4.2V,放电时为3 .0V或2 .75V。
d.电池的贮存时间:电池经过长时间贮存后,电池的放电容量会相应减 少。
内阻与SOC的关系。
内阻测量方法。
8. 的电电池量容。量表:征指电一池定储放存Байду номын сангаас能制量度的下能(力在,一单定位的是I放A,hT或放,CV。终容)量,受电很池多所引给素出 的影响,如:放电电流、放电温度等。容量大小是由正负极中活性 物质的数量多少来决定的。
理论容量:活性物质全部参加反应所给出的容量。 实际容量:在一定的放电制度下实际放出的容量。 额定容量:又称公称容量,指电池在设计的放电条件下,电池保证给
锂原电池简介

锂原电池简介锂--二氧化锰电池以金属锂为负极,经过处理的二氧化锰为正极,隔离膜与锂离子电池一样,电解液为高氯酸锂的有机溶液,圆柱式或扣式。
电池需要在超低露点的保护气体氛围下装配,一经注液,就有电,电压3V,自放电率很低,耐储存,可达3年以上。
一般在台式电脑的主板上,有一个扣式的锂电池,提供微弱的电流,可以正常使用3年左右,一些宾馆的门禁卡、仪器仪表等也使用锂--二氧化锰电池,近年来使用量逐年下降。
锂--亚硫酰氯电池以金属锂为负极,正极和电解液为亚硫酰氯(氯化亚砜),圆柱式电池,装配完成即有电,电压3.6V,是工作电压最平稳的电池种类之一,也是目前单位体积(质量)容量最高的电池。
适合在不能经常维护的电子仪器设备上使用,提供细微的电流。
其他锂电池还有锂--硫化亚铁电池、锂--二氧化硫电池等。
锂离子电池的结构锂电池通常有两种外型:圆柱型和方型。
电池内部采用螺旋绕制结构,用一种非常精细而渗透性很强的聚乙烯薄膜隔离材料在正、负极间间隔而成。
正极包括由钴酸锂(或镍钴锰酸锂、锰酸锂、磷酸亚铁锂等)及铝箔组成的电流收集极。
负极由石墨化碳材料和铜箔组成的电流收集极组成。
电池内充有有机电解质溶液。
另外还装有安全阀和PTC元件(部分圆柱式使用),以便电池在不正常状态及输出短路时保护电池不受损坏。
单节锂电池的电压为3.7V(磷酸亚铁锂正极的为3.2V),电池容量也不可能无限大,因此,常常将单节锂电池进行串、并联处理,以满足不同场合的要求。
锂电池的应用随着二十世纪微电子技术的发展,小型化的设备日益增多,对电源提出了很高的要求。
锂电池随之进入了大规模的实用阶段。
最早得以应用的是锂亚原电池,用于心脏起搏器中。
由于锂亚电池的自放电率极低,放电电压十分平缓。
使得起搏器植入人体长期使用成为可能。
锂锰电池一般有高于3.0伏的标称电压,更适合作集成电路电源,广泛用于计算机、计算器、手表中。
现在,锂离子电池大量应用在手机、笔记本电脑、电动工具、电动车、路灯备用电源、航灯、家用小电器上,可以说是最大的应用群体。
固态电池简介

固态电池简介
固态电池是一种使用固体电极和固体电解质的电池技术,与传统的液态电解质锂离子电池相比,具有以下特点:
1.高能量密度:固态电池的电解质通常采用无机物或有机高分子固体,这使得它们能够提供更高的能量密度,达到目前三元锂电池的两倍。
2.安全性好:固态电池内部没有液体电解质,因此不会造成电解液泄漏和内部短路,从而提高了安全性。
3.循环寿命强:固态电池解决了液态电解质在充放电过程中形成SEI膜的问题,抑制了锂枝晶的出现,从而大大提高了循环性能。
4.环境效益:固态电池的使用可以减少电动汽车的碳足迹,如果使用可持续来源的原材料生产,其对环境的影响要小于传统的锂离子电池。
5.制造成本高:固态电池的制造过程中需要技术创新和大量研发投入,目前其制造成本较高。
6.界面阻抗大:固态电解质与电极材料的界面呈固-固状态,导致电解质与电极的有效接触能力弱,影响电池性能。
固态电池的应用领域非常广泛,包括移动设备、储能、汽车等,但目前仍存在一些挑战,如固态电解质制备成本较高,以及需要进一步提升其功率密度和循环寿命。
尽管如此,
固态电池技术被视为可以继承锂离子电池地位的电池技术,随着科学家们不断探索和突破,固态电池技术的商用化进程将会加速,为人类生活带来更多的改变。
电池原理简介1
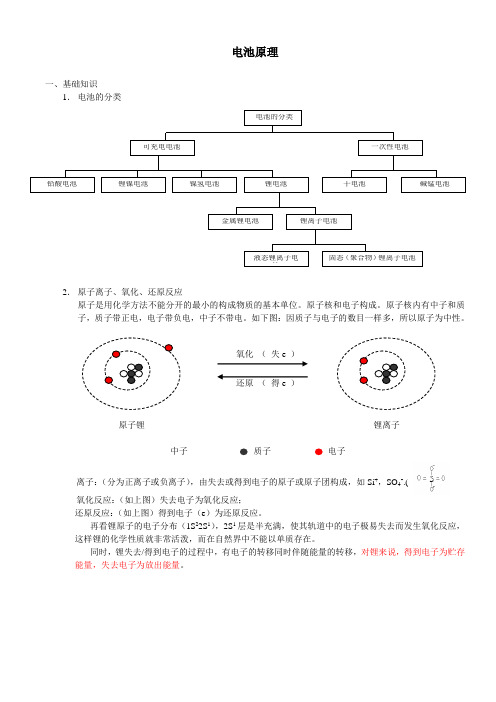
电池原理一、基础知识1. 电池的分类2. 原子离子、氧化、还原反应原子是用化学方法不能分开的最小的构成物质的基本单位。
原子核和电子构成。
原子核内有中子和质子,质子带正电,电子带负电,中子不带电。
如下图:因质子与电子的数目一样多,所以原子为中性。
离子:(分为正离子或负离子),由失去或得到电子的原子或原子团构成,如Si +,SO 4-.( ); )氧化反应:(如上图)失去电子为氧化反应; 还原反应:(如上图)得到电子(e )为还原反应。
再看锂原子的电子分布(1S 22S 1),2S 1层是半充满,使其轨道中的电子极易失去而发生氧化反应,这样锂的化学性质就非常活泼,而在自然界中不能以单质存在。
同时,锂失去/得到电子的过程中,有电子的转移同时伴随能量的转移,对锂来说,得到电子为贮存能量,失去电子为放出能量。
电池的分类可充电电池 一次性电池 干电池 碱锰电池铅酸电池 锂镍电池 锂电池 金属锂电池 锂离子电池液态锂离子电池 固态(聚合物)锂离子电池镍氢电池 氧化 ( 失e ) 还原 ( 得e ) 原子锂 锂离子 中子 质子 电子二、电池的基本原理和构成由于锂的化学性质,它很适合做电池材料,用锂做电池的原理如下:对于我们日常生活所利用的能量方式有热能、动能、电能等。
我们电能的方式是通过导线让电子流经电能的路径,所以我们是以图3的方式来利用Li 做电子式。
图3就是最早锂电池原理图,图3的电池有很多缺点,例如:Li 金属太活泼,要在氩气保护下才能操作,制成电池,而且制成的电池安全性不好,改进的方法就是在电池制备过程中,不能用金属锂。
阴极用能存贮Li + 物质,如石墨,Al 等。
石墨结构如下图:Li Li Li Li Li + Li + Li + Li + 氧化-e释放能量 还原反应贮存能量 (图2) e 充电Li ++e Li ++eLi ++e Li ++e A —A —A —A —Li Li LiLi 金 属 锂 阳极 阴极 (图3) e 放电 (图4)这样电池就变成如图5的结构:以上就是锂电池工作的基本原理。
锂离子动力电池简介

锂离子动力电池简介锂离子动力电池是一种先进的储能装置,具有高能量密度、长寿命、轻量化、无记忆效应等优点。
它在电动汽车、储能系统和便携式电子设备中得到了广泛应用。
本文将介绍锂离子动力电池的基本原理、优点和缺点,以及其在不同领域的应用。
一、基本原理锂离子动力电池是一种充电式电池,其工作原理是通过锂离子在正负极材料之间的迁移来完成电荷和放电过程。
其正极材料通常使用钴酸锂、镍酸锂等化合物,负极材料通常使用石墨等材料。
在充电时,锂离子从正极材料释放,并通过电解质溶液迁移到负极材料中嵌入或吸附;在放电时,锂离子从负极材料释放,并通过电解质溶液迁移到正极材料中嵌入或吸附。
这种迁移过程是可逆的,可以进行多次充放电循环。
二、优点1.高能量密度:锂离子动力电池具有较高的能量密度,可以存储更多的能量,提供更长的使用时间。
2.长寿命:相比于其他类型的电池,锂离子动力电池具有更长的使用寿命。
这是由于其迁移过程是可逆的,不会引起结构损伤。
3.轻量化:锂离子动力电池具有较高的能量密度和较低的重量,使其在移动设备和电动汽车等领域应用广泛。
4.无记忆效应:锂离子动力电池没有记忆效应,使用者可以根据需要进行充电,而无需等待完全放电。
三、缺点1.安全性问题:锂离子动力电池在充电和放电过程中可能会产生热量,进而导致电池过热,甚至起火或爆炸。
因此,安全性一直是锂离子动力电池的一个关键问题。
2.有限的循环寿命:锂离子动力电池的循环寿命是有限的,随着使用次数的增加,其容量会逐渐减少。
四、应用领域1.电动汽车:锂离子动力电池在电动汽车中得到了广泛应用,因为其具有较高的能量密度、长寿命和较低的重量。
它可以提供足够的动力和续航里程。
2.便携式电子设备:如手机、平板电脑和笔记本电脑等便携式电子设备使用锂离子动力电池,因为它具有较高的能量密度和长寿命,可以提供长时间的使用时间。
3.储能系统:锂离子动力电池在储能系统中也得到了广泛应用。
它可以储存太阳能和风能等可再生能源,提供稳定的能量供应。
电池维修手册

电池维修手册导言:本手册旨在为用户提供关于电池维修的详细指导,以保障电池的正常使用和延长其使用寿命。
请您在使用维修方法前仔细阅读本手册,并按照步骤进行操作。
第一章:电池基础知识电池简介:电池是一种将化学能转化为电能的装置,其由正极、负极、电解液和隔膜组成。
了解电池的基本构造对于维修过程至关重要。
1.1 电池类型在维修电池之前,用户需要了解所使用的电池类型。
常见的电池类型包括碱性电池、锂离子电池、镍氢电池等。
根据电池类型的不同,维修方法也会有所差异。
1.2 电池容量电池容量是指电池存储的能量大小。
了解电池容量有助于选择适合的充电时长和维修方案。
1.3 电池维修前的准备在进行电池维修之前,用户需要进行一些准备工作,例如检查电池的连接是否稳固、清洁电池表面以及确保维修工具的安全使用。
第二章:常见电池问题及解决方法2.1 电池无法充电如果电池无法充电,用户可以尝试以下解决方法:- 检查充电器是否正常工作,确认其连接是否牢固;- 检查电池接触点是否有杂质或氧化物,清洁后重新尝试充电;- 如果仍然无法解决问题,可能是电池老化,需要更换新的电池。
2.2 电池电量消耗过快如果电池电量消耗过快,用户可以尝试以下解决方法:- 关闭不必要的背景应用程序,减少电池的能耗;- 调低屏幕亮度,并在不使用时将手机设备放入省电模式;- 按照正确的充电和放电方式使用电池,避免频繁充电。
2.3 电池充电速度过慢如果电池充电速度过慢,用户可以尝试以下解决方法:- 检查充电器的输出功率是否符合要求,更换高功率的充电器;- 检查充电线是否损坏,更换新的充电线;- 清理充电口和电池接触点上的灰尘和杂质,保持良好的电池接触。
第三章:电池维护技巧3.1 充电和放电- 充电:在使用前将电池充满,使用原厂配套的充电器,并选择充电时间合适的充电模式;- 放电:避免将电池完全放空,及时充电,保持电池容量在正常范围内。
3.2 电池存储- 如果电池长时间不使用,建议将其放在干燥、温度适宜的环境中;- 电池存放时应保持约50%的电量,避免存储在充满或放空状态下。
锂离子电池简介

1.锂离子电池哪一年商业化?锂离子电池首次由日本Sony公司在1990年研制成功并实现商业化。
2.锂离子电池工作原理。
以炭为负极,钴酸锂(LiCoO2)为正极为例。
充电过程中,锂离子从正极脱出,释放一个电子,三价钴氧化成四价钴,锂离子通过电解质嵌入负极,维持电荷平衡;放电过程中,电子从负极流经外部电路到达正极,在电池内部,锂离子通过电解液嵌入到正极,正极得到外电路一个电子,四价钴还原成三价钴。
3.锂离子电池的组成。
锂离子电池主要由正极、负极、隔膜、电解液和外包装组成。
其中,正极、负极、隔膜和电解液是锂离子电池的四大主材。
4.锂离子电池正极材料的作用。
锂离子电池正极材料不仅作为电极材料参与电化学反应,还要作为锂离子源。
5.锂离子电池正极材料应该满足哪些条件?①比容量大,这就要求正极材料具有低的相对分子质量,且其宿主结构中能插入大量锂离子;②工作电压高,这就要求体系放电反应的吉布斯自由能负值要大;③高倍率下的充放电性能好,这就要求锂离子在正极材料内部和表面的扩散速率大;④循环寿命长,这就要求锂离子脱出和嵌入正极材料的过程中,正极材料的结构变化要尽可能小;⑤安全性好,这就要求材料具有较高的化学稳定性和热稳定性;⑥容易制备,对环境友好,价格便宜。
6.锂离子电池正极材料有哪些?锂离子电池正极材料一般为含锂的过渡金属氧化物或聚阴离子化合物,包括LiCoO2、LiMnO2、LiFeO4及其相关衍生材料。
含锂的过渡金属氧化物作为锂离子电池正极材料的优势。
过渡金属往往具有多种价态,可以保持锂离子嵌入和脱出过程中的电中性;另外,过渡金属氧化物对锂有较高的电极电势,可以保证电池具有较高的开路电压。
一般来说,对锂电势,过渡金属氧化物>过渡金属硫化物;3d过渡金属氧化物>4d过渡金属氧化物>5d过渡金属氧化物。
3d过渡金属氧化物中,尤其以含Co、Ni、Mn元素的锂金属氧化物为主。
7.锂离子电池负极材料应该满足哪些条件?①低氧化还原电位,以满足锂离子电池具有较高的输出电压;②锂离子脱嵌过程中的电极电位变化较小,以保证充放电的电压波动小;③脱嵌锂离子过程中的结构稳定性和化学稳定性好,以使电池具有较高的循环寿命和安全性;④具有高的可逆比容量;⑤良好的锂离子导电性和电子导电性,以获得较高的充放电倍率和低温充放电性能。
锂电池简介

锂电池概述一、锂离子电池的工作原理锂电池其具体的工作原理如下图1-1所示。
图中的电池是以层状氧化物当作阴极材料,阳极材料是石墨。
在锂电池充电的过程中,锂离子会从正极移动到负极,形成LiC6的化学结构。
与此同时,电子通过设备的外电路,以保证电路中的电荷平衡。
放电时,发生与上述过程是相反的反应。
为了能够客观形象的描述在循环过程锂离子循环往复,人们也将锂电池称之为“摇椅电池”。
以商用电池为例,电池的化学表达式为:(-)C|1mol•L-1LiPF6-EC+DEC|LiCoO2(+)电池反应的表达式为:正极反应:LiCoO2↔Li1-xCoO2+xLi++xe-负极反应:x Li++xe-+6C↔Li x C6总反应:LiCoO2+6C↔Li1-xCoO2+Li x C二、锂离子电池的组成部分锂电池主要包含有正负两极、电解液以及外壳和和隔膜。
1、电解质溶液电解质溶液的作用是在电子转移过程中的转移介质,这是锂电池的关键构成部分,会对电池的性能产生非常明显的影响。
锂电池工作过程中的电压范围在3~4伏左右,在将水作为电解液的体系之中,通常来讲水的分解电压仅仅只有两伏,不能够达到锂离子电池工作的要求,而且金属锂能够和水发生较为剧烈的反应。
因此对于电池来说,所使用的电解液通常属于非水性电解液。
在整个电解质体系之中,锂盐在非水溶剂里的溶解度并不大,不能够当成是有机溶剂所使用。
对于一些阴离子半径更加大的,比如说LiClO4,LiSbF6等。
这些锂盐的负离子分散更加零散,能够更加快速的溶解在有机溶剂内部。
而且氟能够取代一些有机阴离子锂盐,比如说CF3SO3Li,这种物质的阴离子非常的分散,能够溶解在有机溶剂之中。
所以作为新一代的导电盐锂离子电池被学者们所研究。
2、隔膜对于电池组成的关键部分隔膜,对其有着以下特性要求[18]:(1)隔膜具有极强的化学稳定性。
如今绝大部分的电解质都属于非水电解液,因此对于隔膜来说必须要挑选那些能够抗腐蚀且化学稳定性好的材料;(2)隔膜非常的薄。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电池
电池指盛有电解质溶液和金属电极以产生电流的杯、槽或其他容器或复合容器的部分空间,能将化学能转化成电能的装置。
具有正极、负极之分。
随着科技的进步,电池泛指能产生电能的小型装置。
如太阳能电池。
电池的性能参数主要有电动势、容量、比能量和电阻。
利用电池作为能量来源,可以得到具有稳定电压,稳定电流,长时间稳定供电,受外界影响很小的电流,并且电池结构简单,携带方便,充放电操作简便易行,不受外界气候和温度的影响,性能稳定可靠,在现代社会生活中的各个方面发挥有很大作用。
干电池
干电池也叫锰锌电池,所谓干电池是相对于伏打电池而言,所谓锰锌是指其原材料。
针对其它材料的干电池如氧化银电池,镍镉电池而言。
锰锌电池的电压是1.5V。
干电池是消耗化学原料产生电能的。
它的电压不高,所能产生的持续电流不能超过1安培。
电池铅蓄电池
蓄电池是应用最广泛的电池之一。
用一个玻璃槽或塑料槽,注满硫酸,再插入两块铅板,一块与充电机正极相连,一块与充电机负极相连,经过十几小时的充电就形成了一块蓄电池。
它的正负极之间有2伏的电压。
蓄电池的好处是可以反复多次使用。
另外,由于它的内阻极小,所以可以提供很大的电流。
用它给汽车的发动机供电,瞬时电流可达20多安培。
蓄电池充电时是将电能贮存起来,放电时又把化学能转化为电能。
电池锂电池
以锂为负极的电池。
它是60年代以后发展起来的新型高能量电池。
按所用电解质不同分为:
①高温熔融盐锂电池;
②有机电解质锂电池;
③无机非水电解质锂电池;
④固体电解质锂电池;
⑤锂水电池。
锂电池的优点是单体电池电压高,比能量大,储存寿命长(可达10年),高低温性能好,可在-40~150℃使用。
缺点是价格昂贵,安全性不高。
另外电压滞后和安全问题尚待改善。
大力发展动力电池和新的正极材料的出现,特别是磷酸亚铁锂材料的发展,对锂电发展有很大帮助。
