2021学年高中化学第2章烃微专题1烃的燃烧规律及有关计算课件人教版必修3.ppt
合集下载
《烃的燃烧规律》课件

完全燃烧的产物
主要是二氧化碳和水,还 有少量的氮气和硫的氧化 物等。
烃的不完全燃烧
不完全燃烧的定义
在烃的不完全燃烧过程中,烃中 的碳和氢元素未完全转化为二氧 化碳和水,同时释放出的能量也
未达到最大值。
不完全燃烧的原因
通常是由于氧气不足、温度不够高 或反应时间不够长等原因造成的。
不完全燃烧的产物
主要包括一氧化碳、碳黑、多环芳 香烃等有害物质。
烃的燃烧产物
主要产物
01
二氧化碳和水是烃燃烧的主要产物,它们是造成温室效应的主
要物质。
有害产物
02
不完全燃烧会产生一氧化碳、碳黑和多环芳香烃等有害物质,
这些物质对人体健康和环境都有害。
产物处理
03
对于有害的燃烧产物需要进行处理,以减少对环境和人体的危
害。
03 烃的燃烧影响因素
温度的影响
01
温度越高,烃的燃烧越剧烈,燃烧效率越高。
烃的燃烧规律
目录
CONTENTS
• 烃的燃烧概述 • 烃的燃烧规律 • 烃的燃烧影响因素 • 烃的燃烧实验与结果分析 • 烃的燃烧应用与展望
01 烃的燃烧概述
燃烧的定义与过程
燃烧的定义
燃烧是一种放热、发光的化学反应, 涉及可燃物与氧气反应,生成氧化物 。
燃烧的过程
燃烧过程包括可燃物与氧气混合、点 火、燃烧反应进行和热量释放等阶段 。
化学工业
烃在高温下燃烧生成的燃烧产物可以用于合成化学物质,如合成氨 、合成塑料等。
能源利用
烃的燃烧产生的热能可以转化为电能,如燃气轮机发电和内燃机驱动 等。
烃的燃烧在环保领域的应用
污染控制
通过控制烃的燃烧条件和优化燃烧过程,可以降低燃烧过程中产生 的污染物排放,如氮氧化物、硫氧化物和颗粒物等。
第二章 第一节 烷烃-人教版高二化学选择性必修3课件

根据烷烃的分子结构,写出相应的结构简式和分子式,分析他们的相似点。
甲烷 乙烷
丙烷
正丁烷 正戊烷
名称
甲烷 乙烷 丙烷 正丁烷 正戊烷
结构简式
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3 CH3CH2CH2CH2CH3
分子式
CH4 C2H6 C3H8 C4H10 C5H12
碳原子的 杂化方式
ClCH2CH3 CH3CCl3 Cl2CHCHCl2
HCl
ClCH2CH2Cl ClCH2CHCl2 Cl3CCHCl2
CH3CHCl2 Cl3CCH2Cl Cl3CCCl3
5、化学性质 常温下性质稳定,不与强酸、强碱、KMnO4(H+)等强氧化剂反应,
特定条件下会发生化学反应。
(1)氧化反应——燃烧
结构简式
常温下状态 熔点/℃ 沸点/℃
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3 CH3(CH2)3CH3 CH3(CH2)7CH3 CH3(CH2)9CH3 CH3(CH2)14CH3 CH3(CH2)16CH3
气体 气体 气体 气体 液体 液体 液体 液体 固体
-182 -172 -187 -138 -129 -54 -26
或-C6H5,乙烯基:-CH=CH2
丙烷(CH3CH2CH3)分子中有两组处于不同化学环境的氢原子,因
此丙基有两种不同的结构
—CH2CH2CH3 正丙基
—CHCH3 CH3 异丙基
二、烷烃的命名
1、习惯命名法
(1) 1-10个C原子的直链烷烃:称为 甲、乙、丙、丁、戊、己、庚、辛、
壬、癸烷;
(2) 碳原子数大于10时,用实际碳原子数表示:如:C11H24 称为十一烷; (3) 带支链的烷烃:用正、异、新表示。
甲烷 乙烷
丙烷
正丁烷 正戊烷
名称
甲烷 乙烷 丙烷 正丁烷 正戊烷
结构简式
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3 CH3CH2CH2CH2CH3
分子式
CH4 C2H6 C3H8 C4H10 C5H12
碳原子的 杂化方式
ClCH2CH3 CH3CCl3 Cl2CHCHCl2
HCl
ClCH2CH2Cl ClCH2CHCl2 Cl3CCHCl2
CH3CHCl2 Cl3CCH2Cl Cl3CCCl3
5、化学性质 常温下性质稳定,不与强酸、强碱、KMnO4(H+)等强氧化剂反应,
特定条件下会发生化学反应。
(1)氧化反应——燃烧
结构简式
常温下状态 熔点/℃ 沸点/℃
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3 CH3(CH2)3CH3 CH3(CH2)7CH3 CH3(CH2)9CH3 CH3(CH2)14CH3 CH3(CH2)16CH3
气体 气体 气体 气体 液体 液体 液体 液体 固体
-182 -172 -187 -138 -129 -54 -26
或-C6H5,乙烯基:-CH=CH2
丙烷(CH3CH2CH3)分子中有两组处于不同化学环境的氢原子,因
此丙基有两种不同的结构
—CH2CH2CH3 正丙基
—CHCH3 CH3 异丙基
二、烷烃的命名
1、习惯命名法
(1) 1-10个C原子的直链烷烃:称为 甲、乙、丙、丁、戊、己、庚、辛、
壬、癸烷;
(2) 碳原子数大于10时,用实际碳原子数表示:如:C11H24 称为十一烷; (3) 带支链的烷烃:用正、异、新表示。
烃的燃烧规律(课堂PPT)
8
【例题4】 120oC时,1体积某烃和4体积氧
气混合,完全燃烧后恢复到原来的温度和压强,
气体体积不变,则该烃的化学式中所含的碳原 子数不可能是D
A(、析1解) 因为B反、应2前后的温度C(、1230oC)和压强D相、同4,
则生成的水为气态,若烃(CxHy)燃烧反应前后气体体 积不变,即ΔV =0,有
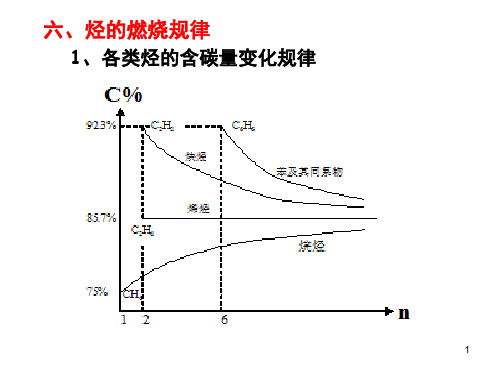
(C成其O值4C2的) O越2量 越等大多取质生。决量成H于的2HxO烃2O/的越y((量C多xHC取。y%)决含完于量全)y燃/值x烧(,时H其%,含值生量越成)大值生,3
(6)分子中具有相同的H原子数或C原子数的两种 有固只(机定要5物,)总以燃最质任烧简量意后式一比生相定混 成同,合 的的完,H有全2O只的机燃要量物烧混或无时合C论,O物2以生的的何成量总比的是物例一C质混O定2的、值合量H2,O 总量及耗氧量是相同的 (7)同系物中随分子里碳原子数的增多,其 含碳质量分数:烷烃增加,烯烃不变,炔烃与苯 的值变同系化物相同减少) 。(完全燃烧后生成CO2与H2O的比
组成,每种组成可能是两种气体也可能是多 种气体。1.0L该混合气体在氧气中充分燃烧 可则获原得混相合同气条体件中下烯的—2烷.0或LC烯O—2和炔2的.4DL体水积蒸比气是, A、3:1 B、1:3 C、2:3 D、3:2
(析解) 由于本题中混合物的组成未定,而且每
种组成中的烃都有哪些烃也未知,但最终只求各类烃的体
4
(8)若烃分子式为CxHy,若反应物和生成物均 为气体时,△V=V后—V前=(y/4—1),则:
①、y=4时,若烃完全燃烧,反应物与生成物的 分子总数相等。在同温同压下反应前后气体体积 不变 (只有CH4、C2H4、C3H4) 。
②、y<4时,烃完全燃烧后所得生成物的分子总5
人教版高中化学课件-烃燃烧规律

返回
4. 烴的混合物計算規律:
(1)若M混<26,則一定有 CH4 ; 若M混<28(烷、烯的混合物),則一定有 CH4 。
(2)若平均分子組成中,存在1<n(C)<2,則一定有CH4 ; 若平均分子組成中,存在2<n(H)<4,則一定有 C2H2 。
例5.某兩種氣態烴的1 L混合氣體,完全燃燒生成 1.4 L CO2和2.0 L水蒸氣(體積均在相同狀況下測得),
量小於水的物質的量,則兩種烴的組合不可能是( D )
A.烷+烷 B.烷+烯 C.烷+苯的同系物 D.烯+烯
3、烴的燃燒規律
燃燒通式: CxHy + (x+y/4) O2
xCO2 + y/2 H2O
(1)物質的量相同的烴CxHy完全燃燒時,耗氧量多少決定
於x+y/4,生成CO2的量多少決定於x的值,生成水量多少 決定於y/2的值 。
瓷管
吸收管I
吸收管II
瓷管 樣品+瓷管 吸收前
50g 53.6g
100g
吸收後 102.7g
吸收前 吸收後 98g 111.2g
瓷管 瓷管 樣品+瓷管 50g 53.9g
吸收管I 吸收前 吸收後 100g 102.7g
吸收管II 吸收前 吸收後
98g 111.2g
(1)烴類樣品在化學反應過程中所用的氧化劑
[延伸拓展]乙烯與乙烷混合氣體共a mol,與b mol的
氧氣共存於一密閉容器中,點燃後充分反應,乙烯和
乙烷全部消耗完,得到CO和CO2的混合氣體和45g水。
求:(1)當a=1時,乙烯和乙烷的物質的量之比
n (C2H4) ﹕ n (C2H6)= 1:1
烃的燃烧有关计算规律课件

PPT学习交流
17
1.根据相对密度确定
例:某烷烃,其蒸汽的密度是相 同条件下氢气密度的36倍,试 确定该烷烃的分子式。
C 5 H 12
PPT学习交流
18
2.根据烃的燃烧通式确定
例:某烃0.1 mol完全燃烧,将产物通人浓硫酸,增重 5.4 g,再通入到NaOH溶液中,增重8.8 g,试确定该 烃的分子式。
•
• 解:根据上述规律,得到结论( y/x)值越大,耗氧 量越多,则对于等质量的上述烃,完全燃烧CH4的 耗氧量最多。
PPT学习交流
7
2、最简式相同的有机物,不论以何种比 例混合,只要混合物总质量一定,完全燃 烧后生成的CO2和H2O及耗氧量就一定。
(1)所有的烯烃:如C2H4和C5H10 等 (2)同分异构体,
PPT学习交流
8
例3.由A、B两种烃组成的混合物,当混合物总质量一定时,
无论A、B以何种比例混合,完全燃烧消耗氧气的质量
为一恒量。对A、B两种烃有下面几种说法:①互为同
分异构体;②互为同系物;③具有相同的最简式;④
两种烃中碳的质量分数相同。正确的结论是(
)
A.①②③④ C.②③④
B.①③④
D.③④
例4:CH4,C2H2,C2H4,C2H6,C3H4,C3H6完全燃烧,反 应后温度为120℃ ,则反应后,体积不变的是哪 种气体?体积减小的是哪种气体?体积增大的是 哪种气体?
体积不变的是CH4,C2H4,C3H4
体积减小的是C2H2
体积增大的是C2H6,C3H6
PPT学习交流
14
练习
1、在压强一定,温度150 ℃ 条件下,某 有机物完全燃烧,反应前后压强不发生变 化,该有机物可能是( AC ) A、CH4 B、C2H6 C、C2H4 D、C2H2
《烃的燃烧规律总结》课件

烃的燃烧规律总结
该PPT课件旨在介绍烃的燃烧规律,包括烃的概念和应用领域。通过深入探讨 燃烧反应及其规律,并分析其在工业和生活中的应用,展示了烃燃烧规律的 重要性和前景。
烃的定义和分类
烃的概念
烃是由碳和氢组成的有机化 合物,广泛存在于天然气和 石油中。
烃的种类和分类
烃根据分子中碳原子的数目 和结构特点进行分类,包括 烷烃、烯烃和炔烃。
部分燃烧和不完全燃烧会产生有害气体,对 环境和人类健康造成威胁。
燃烧规律的应用
工业燃烧和生活燃烧 的区别
工业燃烧追求高效率、低排放, 而生活燃烧更注重舒适和安全。
燃烧反应的优化控制
通过优化燃烧反应条件,可以 提高能量利用效率和减少有害 物质的排放。
燃烧对环境的影响及 其防治
燃烧排放的废气和废水对大气 和水源造成污染,需要采取相 应的环境保护措施。
燃烧规律的实验探究
1 燃烧反应的实验操作和注意事项
实验中需注意安全,控制燃烧反应条件,并 进行恰当的数据记录。
2 燃烧规律的实验结果分析及讨论
通过实验结果的分析和讨论,可以验证和理 解燃烧规律。
总结与展望
1 烃的燃烧反应有哪些特点
烃的燃烧反应具有高温、产烟、放热等特点,对人类社会和环境产生深远影响。
烃的应用领域
烃广泛应用于能源、化工、 医药等领域,是现代社会不 可或缺的重要资源。
燃烧反应及规律
1 燃烧反应的基本式子
燃烧反应是烃与氧气反应产生二氧化碳和水 的化学过程。
2 烷ห้องสมุดไป่ตู้燃烧规律
烷烃在充足氧气条件下燃烧完全,生成二氧 化碳和水。
3 烯烃和炔烃燃烧规律
4 部分燃烧和不完全燃烧
烯烃和炔烃在燃烧过程中会发生不完全燃烧, 形成一氧化碳和碳黑等有害物质。
该PPT课件旨在介绍烃的燃烧规律,包括烃的概念和应用领域。通过深入探讨 燃烧反应及其规律,并分析其在工业和生活中的应用,展示了烃燃烧规律的 重要性和前景。
烃的定义和分类
烃的概念
烃是由碳和氢组成的有机化 合物,广泛存在于天然气和 石油中。
烃的种类和分类
烃根据分子中碳原子的数目 和结构特点进行分类,包括 烷烃、烯烃和炔烃。
部分燃烧和不完全燃烧会产生有害气体,对 环境和人类健康造成威胁。
燃烧规律的应用
工业燃烧和生活燃烧 的区别
工业燃烧追求高效率、低排放, 而生活燃烧更注重舒适和安全。
燃烧反应的优化控制
通过优化燃烧反应条件,可以 提高能量利用效率和减少有害 物质的排放。
燃烧对环境的影响及 其防治
燃烧排放的废气和废水对大气 和水源造成污染,需要采取相 应的环境保护措施。
燃烧规律的实验探究
1 燃烧反应的实验操作和注意事项
实验中需注意安全,控制燃烧反应条件,并 进行恰当的数据记录。
2 燃烧规律的实验结果分析及讨论
通过实验结果的分析和讨论,可以验证和理 解燃烧规律。
总结与展望
1 烃的燃烧反应有哪些特点
烃的燃烧反应具有高温、产烟、放热等特点,对人类社会和环境产生深远影响。
烃的应用领域
烃广泛应用于能源、化工、 医药等领域,是现代社会不 可或缺的重要资源。
燃烧反应及规律
1 燃烧反应的基本式子
燃烧反应是烃与氧气反应产生二氧化碳和水 的化学过程。
2 烷ห้องสมุดไป่ตู้燃烧规律
烷烃在充足氧气条件下燃烧完全,生成二氧 化碳和水。
3 烯烃和炔烃燃烧规律
4 部分燃烧和不完全燃烧
烯烃和炔烃在燃烧过程中会发生不完全燃烧, 形成一氧化碳和碳黑等有害物质。
1.1.2微专题烃燃烧规律课件高二下学期化学选择性必修3

【规律】等物质的量的烃,耗氧量取决于“ x + y/4 ”, 此值越大,耗氧量越多。
合作探究
题型一、烃完全燃烧时耗氧量的比较
2.等质量的烃(CxHy)完全燃烧
[例2]等质量的下列烃完全燃烧时,耗氧量最多的是( A)
A、CH4 B、C2H6 C、C3H6 D、C6H6 [分析] ①等质量的碳元素(C)和氢元素(H),_H___耗氧多; ②等质量的烃中__H__元素质量越大,耗氧量越大。 而:H元素质量=H元素质量分数×烃的质量
题型二.气态烃完全燃烧前后气体体积变化规律
1.温度>100℃ (增加y/4-1 y=4时, ΔV=0 燃烧后气体体积不变(CH4 ,C2H4 ,C3H4) y>4时, ΔV>0 燃烧后气体体积增加(C2H6 ,C3H6) y<4时, ΔV<0 燃烧后气体体积减少(C2H2)
2.温度<100℃ 无论y值为多少,燃烧后气体体积都减小,减少(1+y/4)。
[规律]等质量的烃,耗氧量取决于烃中 氢元素的质量分数, 即“ y/ x ” :此值越大,耗氧量越多。
小结
题型一、烃完全燃烧时耗氧量的比较
等物质的量的烃完全燃烧,耗氧量与C、H原子个数 (x+y/4) 有关 归 纳 等质量的烃完全燃烧,耗氧量与元素质量分数 (H%)有关
1.等质量的任意的烷烃、烯烃、芳香烃耗氧量从大到小排列是:
1
x+y/4
x
y/2
|(y/4-1)|
当y=4时:△V=0, 反应前后气体总体积不变 当y<4时:△V=1-y/4, 反应前后气体总体积减小 当y>4时:△V= y/4-1,反应前后气体总体积增加
教师精讲
题型二、烃完全燃烧前后气体的总体积的变化
合作探究
题型一、烃完全燃烧时耗氧量的比较
2.等质量的烃(CxHy)完全燃烧
[例2]等质量的下列烃完全燃烧时,耗氧量最多的是( A)
A、CH4 B、C2H6 C、C3H6 D、C6H6 [分析] ①等质量的碳元素(C)和氢元素(H),_H___耗氧多; ②等质量的烃中__H__元素质量越大,耗氧量越大。 而:H元素质量=H元素质量分数×烃的质量
题型二.气态烃完全燃烧前后气体体积变化规律
1.温度>100℃ (增加y/4-1 y=4时, ΔV=0 燃烧后气体体积不变(CH4 ,C2H4 ,C3H4) y>4时, ΔV>0 燃烧后气体体积增加(C2H6 ,C3H6) y<4时, ΔV<0 燃烧后气体体积减少(C2H2)
2.温度<100℃ 无论y值为多少,燃烧后气体体积都减小,减少(1+y/4)。
[规律]等质量的烃,耗氧量取决于烃中 氢元素的质量分数, 即“ y/ x ” :此值越大,耗氧量越多。
小结
题型一、烃完全燃烧时耗氧量的比较
等物质的量的烃完全燃烧,耗氧量与C、H原子个数 (x+y/4) 有关 归 纳 等质量的烃完全燃烧,耗氧量与元素质量分数 (H%)有关
1.等质量的任意的烷烃、烯烃、芳香烃耗氧量从大到小排列是:
1
x+y/4
x
y/2
|(y/4-1)|
当y=4时:△V=0, 反应前后气体总体积不变 当y<4时:△V=1-y/4, 反应前后气体总体积减小 当y>4时:△V= y/4-1,反应前后气体总体积增加
教师精讲
题型二、烃完全燃烧前后气体的总体积的变化
2020_2021学年高中化学第二章烃和卤代烃章末专题整合课件

答案:D
(1)(2017 年天津卷节选)
分子中不同化
学环境的氢原子共有______种,共面原子数目最多为______。
(2)异戊二烯分子中最多有____个原子共平面,顺式聚异戊
二烯的结构简式为____________________。
解析:(1)甲苯含有1个甲基,苯环左右对称,则分子中不 同化学环境的氢原子共有4种,苯环为平面形结构,与苯环直 接相连的原子在同一平面上,结合三点确定一个平面,甲基上 可有一个H与苯环共平面,共13个。(2)根据乙烯及甲烷的结构 确定该分子中共同面的原子个数。
(6)等物质的量(体积)的不同烷烃完全燃烧时,分子中碳原
子数越多,耗O2越多。 若碳原子数相同时,氢原子数越多耗O2量越多;若氢原
子数相同时,碳原子数越多,耗O2越多。
(7)等质量的不同烃完全燃烧时,耗 O2 量决定于分子中每 个碳原子分配的氢原子数(即 CHxy中xy的值),氢原子数越多(xy越 大),耗 O2 量越多。含碳(氢)质量分数越高,完全燃烧生成的 CO2(H2O)的量越多。
答案:D
取一定质量的下列各组物质混合后,无论以何种
比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳
和水的是( )
A.C2H2 C2H6
B.CH4 C3H8
C.C3H6 C4H8
D.C2H4 C4H10
解析:满足题意要求的两种物质需具有相同的实验式,且
C、H原子个数之比为1∶2。
答案:C
有机物分子里原子共线、共面问题
(4)1 mol卤素分子只能取代1 mol氢原子,同时生成1 mol HX。
(5)气态烃(CxHy)完全燃烧后生成H2O(g)恢复至原状态时, 反应前后总体积[V(前或后)]变化情况与氢原子数关系有如下规 律:
(1)(2017 年天津卷节选)
分子中不同化
学环境的氢原子共有______种,共面原子数目最多为______。
(2)异戊二烯分子中最多有____个原子共平面,顺式聚异戊
二烯的结构简式为____________________。
解析:(1)甲苯含有1个甲基,苯环左右对称,则分子中不 同化学环境的氢原子共有4种,苯环为平面形结构,与苯环直 接相连的原子在同一平面上,结合三点确定一个平面,甲基上 可有一个H与苯环共平面,共13个。(2)根据乙烯及甲烷的结构 确定该分子中共同面的原子个数。
(6)等物质的量(体积)的不同烷烃完全燃烧时,分子中碳原
子数越多,耗O2越多。 若碳原子数相同时,氢原子数越多耗O2量越多;若氢原
子数相同时,碳原子数越多,耗O2越多。
(7)等质量的不同烃完全燃烧时,耗 O2 量决定于分子中每 个碳原子分配的氢原子数(即 CHxy中xy的值),氢原子数越多(xy越 大),耗 O2 量越多。含碳(氢)质量分数越高,完全燃烧生成的 CO2(H2O)的量越多。
答案:D
取一定质量的下列各组物质混合后,无论以何种
比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳
和水的是( )
A.C2H2 C2H6
B.CH4 C3H8
C.C3H6 C4H8
D.C2H4 C4H10
解析:满足题意要求的两种物质需具有相同的实验式,且
C、H原子个数之比为1∶2。
答案:C
有机物分子里原子共线、共面问题
(4)1 mol卤素分子只能取代1 mol氢原子,同时生成1 mol HX。
(5)气态烃(CxHy)完全燃烧后生成H2O(g)恢复至原状态时, 反应前后总体积[V(前或后)]变化情况与氢原子数关系有如下规 律:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
y=4时,ΔV=0,即反应前后气体体积不变。
y>4时,ΔV<0,即反应后气体体积增大。 y<4时,ΔV>0,即反应后气体体积减小。
②若温度小于 100 ℃,即 H2O 呈非气态,则反应前后气体体积 的变化量 ΔV=1+x+4y-x=1+4y,即气体体积在反应后总是减小的。
2.平均值法确定混合物的组成
由①②③式知,在 25 ℃、101 kPa 时, 1 mL C2H6 完全燃烧,气体会减少1+72-2mL=2.5 mL; 1 mL C2H2 完全燃烧,气体会减少1+52-2mL=1.5 mL; 1 mL C3H6 完全燃烧,气体会减少1+92-3mL=2.5 mL;
设 C2H6 和 C3H6 共 x mL,C2H2 为 y mL,可列方程组: x+y=32 2.5x+1.5y=72 解得 x=24,y=8。 故原混合烃中乙炔的体积分数为382×100%=25%。]
32 mL 与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温
度和压强,气体总体积缩小了 72 mL,原混合烃中乙炔的体积分数
为( )
A.12.5%
B.25%
C.50%
D.75%
B [乙烷、乙炔和丙烯完全燃烧的化学方程式分别为 C2H6+72O2―点―燃→2CO2+3H2O……① C2H2+52O2―点―燃→2CO2+H2O……② C3H6+92O2―点―燃→3CO2+3H2O……③
①对于任何烃混合物,
M
在16~26之间,一定含CH4
(1) M ②对于任何烯烃混合物, M 在28~42之间,一定含C2H4
③对于任何炔烃混合物, M 在26~40之间,一定含C2H2
(2)平均分子式 CxHy 中 x<2 时,烃中一定含 CH4。
25 ℃、101 kPa 时,乙烷、乙炔(CH≡CH)和丙烯组成的混合烃
12 g 1 mol
4g
1 mol
当烃的质量相同时,xy越大,耗氧量越大(最简式相同的烃,无论
以何种比例混合,耗氧量都相同)。
(3)气态烃燃烧时气体体积的变化 ①若温度大于 100 ℃,即 H2O 为气态,则1+x+4y可当作参加 反应的气体体积,x+2y可当作生成的气体体积,故体积变化 ΔV=1 -4y,则当
2.取 10 mL 无论以何种比例混合的两种气态烃的混合气体,在
50 mL 的氧气中充分燃烧生成 CO2 和液态 H2O,燃烧后所得气体的 体积为 35 mL,则该混合气体可能为 ( )
A.C3H6 C4H6 C.C2H4 C3H8
B.C2H6 C3H6 D.C2H2 C2H6
B [设混合烃的分子式为 CxHy,根据烃完全燃烧的通式: CxHy+x+4yO2―点―燃→xCO2+2yH2O(l) ΔV
1.一种气态烷烃和一种气态烯烃组成的混合物共 0.1 mol,完全
燃烧得 0.16 mol 二氧化碳和 3.6 g 水。下列说法正确的是( )
A.一定有甲烷
B.一定是甲烷和乙烯
C.可能有乙烷
D.一定有乙炔
A [3.6 g 水的物质的量为 0.2 mol,则 0.1 mol 混合物中含 0.4 mol H 和 0.16 mol C,混合烃的平均分子式为 C1.6H4。则该混合烃中 一定含有甲烷,可能含有乙烯,不可能含有乙烷和乙炔,综上分析, A 项正确。]
1
x+4y
x
1+4y
10
50
10+50-35
则有1205=1+1 4y,解得 y=6,再结合混合烃完全燃烧,且所提供
O2 体积为烃体积的 5 倍,只有 B 项符合题意。]
3.两种气态烃组成的混合气体完全燃烧后所得到 CO2 和 H2O 的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃 的判断正确的是 ( )
第二章 烃
微专题1 烃的燃烧规律及有关计算
1.烃燃烧的有关规律 CxHy+x+4yO2―点―燃→xCO2+2yH2O (1)烃燃烧时的现象 烃燃烧时,火焰的明亮程度以及是否有黑烟与含碳量有关,烃 中碳元素的质量分数越大,燃烧时火焰越明亮,黑烟越浓。
(2)烃完全燃烧时的耗氧量
①当烃的物质的量相同时,x+4y越大,耗氧量越大。 ②C ~ O2 ~ CO2,4H ~ O2 ~ 2H2O
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙 烷 ⑤可能有甲烷 ⑥可能有乙炔
A.②⑤⑥ C.②④
B.②⑥ D.②③
y>4时,ΔV<0,即反应后气体体积增大。 y<4时,ΔV>0,即反应后气体体积减小。
②若温度小于 100 ℃,即 H2O 呈非气态,则反应前后气体体积 的变化量 ΔV=1+x+4y-x=1+4y,即气体体积在反应后总是减小的。
2.平均值法确定混合物的组成
由①②③式知,在 25 ℃、101 kPa 时, 1 mL C2H6 完全燃烧,气体会减少1+72-2mL=2.5 mL; 1 mL C2H2 完全燃烧,气体会减少1+52-2mL=1.5 mL; 1 mL C3H6 完全燃烧,气体会减少1+92-3mL=2.5 mL;
设 C2H6 和 C3H6 共 x mL,C2H2 为 y mL,可列方程组: x+y=32 2.5x+1.5y=72 解得 x=24,y=8。 故原混合烃中乙炔的体积分数为382×100%=25%。]
32 mL 与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温
度和压强,气体总体积缩小了 72 mL,原混合烃中乙炔的体积分数
为( )
A.12.5%
B.25%
C.50%
D.75%
B [乙烷、乙炔和丙烯完全燃烧的化学方程式分别为 C2H6+72O2―点―燃→2CO2+3H2O……① C2H2+52O2―点―燃→2CO2+H2O……② C3H6+92O2―点―燃→3CO2+3H2O……③
①对于任何烃混合物,
M
在16~26之间,一定含CH4
(1) M ②对于任何烯烃混合物, M 在28~42之间,一定含C2H4
③对于任何炔烃混合物, M 在26~40之间,一定含C2H2
(2)平均分子式 CxHy 中 x<2 时,烃中一定含 CH4。
25 ℃、101 kPa 时,乙烷、乙炔(CH≡CH)和丙烯组成的混合烃
12 g 1 mol
4g
1 mol
当烃的质量相同时,xy越大,耗氧量越大(最简式相同的烃,无论
以何种比例混合,耗氧量都相同)。
(3)气态烃燃烧时气体体积的变化 ①若温度大于 100 ℃,即 H2O 为气态,则1+x+4y可当作参加 反应的气体体积,x+2y可当作生成的气体体积,故体积变化 ΔV=1 -4y,则当
2.取 10 mL 无论以何种比例混合的两种气态烃的混合气体,在
50 mL 的氧气中充分燃烧生成 CO2 和液态 H2O,燃烧后所得气体的 体积为 35 mL,则该混合气体可能为 ( )
A.C3H6 C4H6 C.C2H4 C3H8
B.C2H6 C3H6 D.C2H2 C2H6
B [设混合烃的分子式为 CxHy,根据烃完全燃烧的通式: CxHy+x+4yO2―点―燃→xCO2+2yH2O(l) ΔV
1.一种气态烷烃和一种气态烯烃组成的混合物共 0.1 mol,完全
燃烧得 0.16 mol 二氧化碳和 3.6 g 水。下列说法正确的是( )
A.一定有甲烷
B.一定是甲烷和乙烯
C.可能有乙烷
D.一定有乙炔
A [3.6 g 水的物质的量为 0.2 mol,则 0.1 mol 混合物中含 0.4 mol H 和 0.16 mol C,混合烃的平均分子式为 C1.6H4。则该混合烃中 一定含有甲烷,可能含有乙烯,不可能含有乙烷和乙炔,综上分析, A 项正确。]
1
x+4y
x
1+4y
10
50
10+50-35
则有1205=1+1 4y,解得 y=6,再结合混合烃完全燃烧,且所提供
O2 体积为烃体积的 5 倍,只有 B 项符合题意。]
3.两种气态烃组成的混合气体完全燃烧后所得到 CO2 和 H2O 的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃 的判断正确的是 ( )
第二章 烃
微专题1 烃的燃烧规律及有关计算
1.烃燃烧的有关规律 CxHy+x+4yO2―点―燃→xCO2+2yH2O (1)烃燃烧时的现象 烃燃烧时,火焰的明亮程度以及是否有黑烟与含碳量有关,烃 中碳元素的质量分数越大,燃烧时火焰越明亮,黑烟越浓。
(2)烃完全燃烧时的耗氧量
①当烃的物质的量相同时,x+4y越大,耗氧量越大。 ②C ~ O2 ~ CO2,4H ~ O2 ~ 2H2O
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙 烷 ⑤可能有甲烷 ⑥可能有乙炔
A.②⑤⑥ C.②④
B.②⑥ D.②③
