第三章 离子聚合33 阴离子聚合
合集下载
阴离子聚合

CH2 CH
CH2 CH CH CH2
CH2 C CH CH2 CH3
苯乙烯
丁二烯
异戊二烯
5
二、阴离子聚合的机理和动力学
1.阴离子聚合的引发体系 阴离子聚合的引发剂是电子给体(亲核试剂),
属碱类物质(碱金属,有机金属化合物以及三级胺 等)。根据引发机理可分为电子转移引发和阴离子 引发两类。
6
(1)碱金属 Li、Na、K等碱金属原子最外层近一个价电子,
2
一、阴离子聚合的单体
烯类、羰基化合物、三元含氧杂环和含氮杂环 都有可能进行阴离子聚合,本节主要讨论烯烃的阴 离子聚合。
原则上讲,带有π—π共轭体系的单体都能进 行阴离子聚合。如果同时具有吸电子基,则更易进 行阴离子聚合。吸电子基减少双键上电子云密度, 有利于阴离子进攻,并使形成的碳阴离子的电子云 密度分散而稳定。
12
(3)其他 ROH,H2O ,R3P, R3N等中性亲核试剂中都
含有未共用电子对,能引发很活泼的单体阴离子聚 合,如硝基乙烯、偏二腈乙烯、α—氰基丙烯酸酯 等等。
CN CH2 C C O CH3
O
α—氰基丙烯酸甲酯
13
(4) 阴离子聚合引发剂与单体的匹配 阴离子聚合的单体和引发剂都具有很强的选择
31
7. 丁基锂的缔合现象和定向聚合作用 丁基锂是目前应用最广的阴离子聚合引发剂。
实践中发现若溶剂体系选择不当,丁基锂的引发活 性很低,这可能是由于丁基锂的缔合作用引起。
丁基锂在特定条件下对聚合产物具有定向作用。 (1)丁基锂的缔合现象
丁基锂在非极性溶剂如苯、甲苯、己烷中存在缔 合现象,缔合度2 ~6不等。缔合分子无引发活性。
在增长反应中,单体的加成方向受离子对的限 制,产物的立构规整性较自由基聚合强,但尚不能 控制。
离子聚合和配位聚合课件

高功能性聚合物
通过离子聚合和配位聚合的方法, 合成出具有特殊功能性的聚合物, 如导电聚合物、荧光聚合物等。
绿色合成路径的研究
无毒引发剂
研究无毒、环保的引发剂, 替代传统的有毒引发剂, 降低对环境的污染。
高效催化剂
研究高效、环保的催化剂, 替代传统的有毒催化剂, 降低对环境的污染。
循环利用
研究聚合物的循环利用技 术,实现聚合物的环保处 理和再利用,降低对环境 的污染。
配位聚合可以通过选择不同的 催化剂和聚合条件,实现对聚 合物分子链结构和性能的精细 调控。
配位聚合可以应用于合成高性 能纤维、功能性膜材料、液晶 材料等领域,具有广泛的应用 前景。
03
离子聚合与配位聚合的 比
聚合方式的比 较
离子聚合
通过正负离子之间的相互作用形 成聚合物链,聚合过程中无金属 催化剂参与。
配位聚合的实际应用
高性能聚合物制备
配位聚合可以合成高性能聚合物,如聚酰胺、聚酯等,用于制造 纤维、塑料和复合材料等。
高分子功能材料
通过配位聚合可以制备具有特殊功能的高分子材料,如导电聚合物、 光敏聚合物等,用于传感器、光电转换器件等领域。
高分子药物
配位聚合可以合成具有特定结构和药理性能的高分子药物,用于治 疗癌症、心血管等疾病。
配位聚合
通过过渡金属催化剂与配体形成 活性中心,再与单体进行配位反 应形成聚合物链。
聚合产物的比较
离子聚合
聚合物分子量分布较窄,但可能存在 支链和交联结构。
配位聚合
聚合物分子量分布较宽,但聚合物结 构规整,结晶度高。
应用领域的比较
离子聚合
主要用于合成橡胶、热塑性弹性体等材料。
配位聚合
广泛应用于合成纤维、塑料、涂料等领域。
通过离子聚合和配位聚合的方法, 合成出具有特殊功能性的聚合物, 如导电聚合物、荧光聚合物等。
绿色合成路径的研究
无毒引发剂
研究无毒、环保的引发剂, 替代传统的有毒引发剂, 降低对环境的污染。
高效催化剂
研究高效、环保的催化剂, 替代传统的有毒催化剂, 降低对环境的污染。
循环利用
研究聚合物的循环利用技 术,实现聚合物的环保处 理和再利用,降低对环境 的污染。
配位聚合可以通过选择不同的 催化剂和聚合条件,实现对聚 合物分子链结构和性能的精细 调控。
配位聚合可以应用于合成高性 能纤维、功能性膜材料、液晶 材料等领域,具有广泛的应用 前景。
03
离子聚合与配位聚合的 比
聚合方式的比 较
离子聚合
通过正负离子之间的相互作用形 成聚合物链,聚合过程中无金属 催化剂参与。
配位聚合的实际应用
高性能聚合物制备
配位聚合可以合成高性能聚合物,如聚酰胺、聚酯等,用于制造 纤维、塑料和复合材料等。
高分子功能材料
通过配位聚合可以制备具有特殊功能的高分子材料,如导电聚合物、 光敏聚合物等,用于传感器、光电转换器件等领域。
高分子药物
配位聚合可以合成具有特定结构和药理性能的高分子药物,用于治 疗癌症、心血管等疾病。
配位聚合
通过过渡金属催化剂与配体形成 活性中心,再与单体进行配位反 应形成聚合物链。
聚合产物的比较
离子聚合
聚合物分子量分布较窄,但可能存在 支链和交联结构。
配位聚合
聚合物分子量分布较宽,但聚合物结 构规整,结晶度高。
应用领域的比较
离子聚合
主要用于合成橡胶、热塑性弹性体等材料。
配位聚合
广泛应用于合成纤维、塑料、涂料等领域。
高分子化学第三章

阳离子聚合的特点: 快引发,快增长,难终止和易转移。
(二)阴离子聚合
在链式聚合反应中,活性中心为阴离子的聚 合反应。常用的引发剂有碱金属、丁基锂等亲核 试剂。
阴离子聚合反应的通式可表示如下:
A B M BM A M M n
其中B-为阴离子活性中心,A+为反离子,一般 为金属离子。与阳离子聚合不同,阴离子聚合中 ,活性中心可以是自由离子、离子对,以及处于 缔合状态的阴离子。
酸根的亲核性不能太强,否则会与活性中心结合成 共价键而终止,如HCl
CH3 CH A X
A CH3 CH
X
不同质子酸的酸根的亲核性不同
氢卤酸的X-亲核性太强,不能作为阳离子聚合引发剂, 如HCl引发异丁烯
(CH3)3C Cl
(CH3)3C Cl
HSO4- H2PO4-的亲核性稍差,可得到低聚体。 HClO4,CF3COOH,CCl3COOH的酸根较弱,可生成高聚 物。
Lewis酸引 发
傅-克(俗称Friedel-Grafts催化剂)反应中的各种
金属卤化物,都是电子的接受体,称为Lewis酸。
从工业角度看,是阳离子聚合最重要的引发剂。
Lewis酸包括: 金属卤化物:
BF3 , AlCl3, SnCl4 , TiCl4, SbCl5, PCl5, ZnCl2 金属卤氧化物:
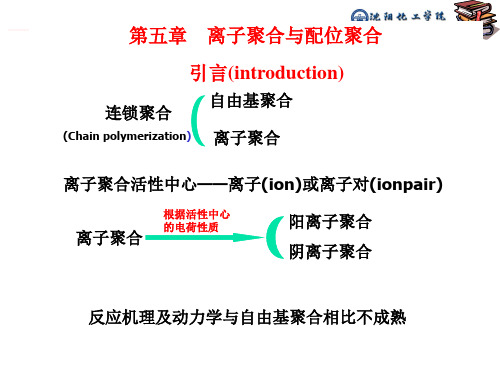
离子聚合:活性中心是离子的聚合。
根据中心离子电荷性质的不同 阳离子聚合 阴离子聚合
离子聚合的理论研究开始于五十年代:
1953年,Ziegler在常温低压下制得PE 1956年,Szwarc发现了“活性聚合物”
多数烯烃单体都能进行自由基聚合,但是 离子聚合却有极高的选择性。 原因: 离子聚合对阳离子和阴离子的稳定性要求 比较严格。
(二)阴离子聚合
在链式聚合反应中,活性中心为阴离子的聚 合反应。常用的引发剂有碱金属、丁基锂等亲核 试剂。
阴离子聚合反应的通式可表示如下:
A B M BM A M M n
其中B-为阴离子活性中心,A+为反离子,一般 为金属离子。与阳离子聚合不同,阴离子聚合中 ,活性中心可以是自由离子、离子对,以及处于 缔合状态的阴离子。
酸根的亲核性不能太强,否则会与活性中心结合成 共价键而终止,如HCl
CH3 CH A X
A CH3 CH
X
不同质子酸的酸根的亲核性不同
氢卤酸的X-亲核性太强,不能作为阳离子聚合引发剂, 如HCl引发异丁烯
(CH3)3C Cl
(CH3)3C Cl
HSO4- H2PO4-的亲核性稍差,可得到低聚体。 HClO4,CF3COOH,CCl3COOH的酸根较弱,可生成高聚 物。
Lewis酸引 发
傅-克(俗称Friedel-Grafts催化剂)反应中的各种
金属卤化物,都是电子的接受体,称为Lewis酸。
从工业角度看,是阳离子聚合最重要的引发剂。
Lewis酸包括: 金属卤化物:
BF3 , AlCl3, SnCl4 , TiCl4, SbCl5, PCl5, ZnCl2 金属卤氧化物:
离子聚合:活性中心是离子的聚合。
根据中心离子电荷性质的不同 阳离子聚合 阴离子聚合
离子聚合的理论研究开始于五十年代:
1953年,Ziegler在常温低压下制得PE 1956年,Szwarc发现了“活性聚合物”
多数烯烃单体都能进行自由基聚合,但是 离子聚合却有极高的选择性。 原因: 离子聚合对阳离子和阴离子的稳定性要求 比较严格。
阴离子聚合反应课件

功能性聚合物的制备
1 2 3
功能高分子
阴离子聚合反应可以用于制备功能性高分子材料 ,如导电聚合物、荧光聚合物、吸附分离聚合物 等。
导电聚合物
通过阴离子聚合反应可以合成聚苯胺、聚吡咯等 导电聚合物,这些材料在电子器件、传感器等领 域具有广泛的应用。
荧光聚合物
利用阴离子聚合反应可以合成荧光聚合物,这些 材料在生物成像、荧光探针等领域具有潜在的应 用价值。
反应机理
引发阶段
01
阴离子聚合反应通常由活性阴离子引发,这些阴离子可以由相
应的阳离子引发剂产生。
增长阶段
02
增长链以负离子形式存在,与单体进行加成反应,不断延长增
长链。
终止阶段
03
当增长链上的活性中心被消去或被其他因素钝化时,聚合反应
终止。
02
CATALOGUE
阴离子聚合反应的影响因素
引发剂
引发剂种类
02
03
04
混合单体和引发剂
按照规定的比例混合单体和引 发剂,确保混合均匀。
加热和搅拌
将混合物加热至规定温度,并 保持适当的搅拌速度以促进反
应进行。
聚合反应监测
通过定时取样和分析,监测聚 合反应的进程和产物性能。
终止反应
当聚合反应达到预定程度时, 加入终止剂终止反应。
安全注意事项与防护措施
防爆措施
特点
阴离子聚合反应具有高活性、高 选择性、高聚合度等优点,广泛 应用于合成高分子材料、功能性 高分子材料等领域。
历史与发展
历史
阴离子聚合反应最早可追溯到20世纪50年代,随着科技的不 断进步,人们对阴离子聚合反应的机理和应用研究越来越深 入。
发展
阴离子聚合
丙烯腈 甲基丙烯腈 甲基丙烯酮
偏二氰乙烯
a-氰基丙烯酸乙酯
硝基乙烯
单体活性
低
中
较高
高
苯乙烯在自由基聚合是活性单体,在阴离子聚合成低活性单体?
四. 阴离子聚合机理
1.机理:引发、增长、終止。
链引发:I
链增长: 链終止:
极快
M-
慢 M nM M n1M
M n1M 难終止
烷基卤化镁RMgX由于其C-Mg键极性弱,不能直 接引发阴离子聚合,但制成格氏试剂后使C-Mg键的 极性增大,可以引发活性较大的单体聚合。
以丁基锂和萘钠最为重要也最为常用的引用剂。
三. 阴离子聚合引发剂和单体的匹配
阴离子聚合与自由基聚合相比,单体对引发剂 有较强的选择性,只有当引发剂与单体活性相 匹配才能得到所需的聚合物。
甲基丙烯酸甲酯
CH3
H2C CH CH CH2
H2C C
CH CH2
苯乙烯
甲基苯乙烯
丁二烯
异戊二烯
乙烯基单体,取代基的吸电子能力越强,双键上的电子云密度 越低,越易与阴离子活性中心加成,聚合反应活性越高。
二. 阴离子聚合引发体系和引发 阴离子聚合引发剂——电子给体,即亲核 试剂,属于碱类。
直接转移引发
一. 阴离子聚合的单体 (1)带吸电子取代基的乙烯基单体
一方面,吸电子性能能使双基上电子云密度降低,有利 于阴离子的进攻,另一方面,形成的碳阴离子活性中心由于 取代基的共轭效应而稳定,因而易阴离子聚合:
H2C CH X
降低电子云密度,易 与富电性活性种结合
H2C CH X
H R CH2 C X
分散负电性,稳定活性中心
强碱性高活性引发剂能引发各种活性的单体,而弱碱 性低活性引发剂只能引发高活性的单体。
离子聚合

CH3 CH2 CH CH CH3 CH2 CH CH CH3 CH3
二级碳阳离子(仲碳阳离子) 三级碳阳离子(叔碳阳离子)
CH3 CH2 CH2 C CH3
阳离子聚合
3. 链转移和链终止
离子聚合的活性种带有电荷,无法双基终止,因此只能 通过单基终止和链转移终止,也可人为添加终止剂终止。 自由基聚合的链转移一般不终止动力学链,而阳离子聚 合的链转移则有可能终止动力学链。因此阳离子聚合的链终 止只可分为动力学链不终止的链终止反应和动力学链终止的 链终止反应两类。
+ XA
ktr,s kp
HMnMA + XCR HMnM NR3(CR)
+
NR3
阳离子聚合
CH3 CH3 (BF3OH) + H2O CH3 CH3 OH + H (BF3OH) H 2O H [ CH2 C ] n CH2 C CH3 CH3 H [ CH2 C ] n CH2 C CH3 CH3
离子聚合
引言
离子聚合是又一类连锁聚合。它的活性中心为离子。根 据活性中心的电荷性质,可分为阳离子聚合和阴离子聚合。 多数烯烃单体都能进行自由基聚合,但是离子聚合却有 极高的选择性。原因是离子聚合对阳离子和阴离子的稳定性 要求比较严格。例如只有带有1,1—二烷基、烷氧基等强推 电子的单体才能进行阳离子聚合;带有腈基、羰基等强吸电 子基的单体才能进行阴离子聚合。但含有共轭体系的单体, 如苯乙烯、丁二烯等,则由于电子流动性大,既可进行阳离 子聚合,也能进行阴离子聚合。
离子聚合
离子聚合的发展导致了活性聚合的诞生。这是高分子发 展史上的重大转折点。通过阴离子活性聚合,可实现高分子 的分子设计,制备预定结构和分子量的聚合物。 阴离子活性聚合在制备特殊结构的嵌段共聚物、接枝共 聚物、星状聚合物等方面有十分重要的作用。 目前,活性聚合领域已扩展到阳离子聚合、自由基聚合 和基团转移聚合。 配位聚合在本质上属于阴离子聚合。
二级碳阳离子(仲碳阳离子) 三级碳阳离子(叔碳阳离子)
CH3 CH2 CH2 C CH3
阳离子聚合
3. 链转移和链终止
离子聚合的活性种带有电荷,无法双基终止,因此只能 通过单基终止和链转移终止,也可人为添加终止剂终止。 自由基聚合的链转移一般不终止动力学链,而阳离子聚 合的链转移则有可能终止动力学链。因此阳离子聚合的链终 止只可分为动力学链不终止的链终止反应和动力学链终止的 链终止反应两类。
+ XA
ktr,s kp
HMnMA + XCR HMnM NR3(CR)
+
NR3
阳离子聚合
CH3 CH3 (BF3OH) + H2O CH3 CH3 OH + H (BF3OH) H 2O H [ CH2 C ] n CH2 C CH3 CH3 H [ CH2 C ] n CH2 C CH3 CH3
离子聚合
引言
离子聚合是又一类连锁聚合。它的活性中心为离子。根 据活性中心的电荷性质,可分为阳离子聚合和阴离子聚合。 多数烯烃单体都能进行自由基聚合,但是离子聚合却有 极高的选择性。原因是离子聚合对阳离子和阴离子的稳定性 要求比较严格。例如只有带有1,1—二烷基、烷氧基等强推 电子的单体才能进行阳离子聚合;带有腈基、羰基等强吸电 子基的单体才能进行阴离子聚合。但含有共轭体系的单体, 如苯乙烯、丁二烯等,则由于电子流动性大,既可进行阳离 子聚合,也能进行阴离子聚合。
离子聚合
离子聚合的发展导致了活性聚合的诞生。这是高分子发 展史上的重大转折点。通过阴离子活性聚合,可实现高分子 的分子设计,制备预定结构和分子量的聚合物。 阴离子活性聚合在制备特殊结构的嵌段共聚物、接枝共 聚物、星状聚合物等方面有十分重要的作用。 目前,活性聚合领域已扩展到阳离子聚合、自由基聚合 和基团转移聚合。 配位聚合在本质上属于阴离子聚合。
阳离子聚合阴离子聚合
1. 连锁聚合的单体
单烯类、共轭双烯类、炔烃、羰基化合物和一些 杂环化合物。
10
2 自由基聚合
(1)自由基聚合反应机理与特征 自由基聚合反应是在引发剂的引发下,产生
单体活性种,按连锁聚合机理反Байду номын сангаас,直到活 性种终止,反应停止。 链引发 链增长 链终止 链转移
11
① 链引发:形成单体自由基活性种的反应 为链引发反应。
8
一 连锁聚合
烃类单体聚合时,首先由引发剂先形成活性种, 再由活性种打开单体的π键与之加成,形成单体活 性种后不断与单体加成,使链增长形成大分子链; 最后大分子链失去活性,使链增长终止。 分为链引发、链增长、链终止等几步基元反应
活性中心 自由基、阳离子或阴离子 自由基聚合、阳离子聚合和阴离子聚合
9
由引发剂、热能、光能、辐射能等的作 用产生
包含两个过程:
12
② 链增长:在链引发阶段生成的单体自 由基能连续不断地和单体分子结合生 成自由基。
13
③ 链终止:自由基活性高有相互作用终止而 失去活性的倾向。链自由基失去活性形成 稳定聚合物的反应称为链终止反应。终止 反应有偶合终止和歧化终止。
14
④ 链转移:在自由基聚合过程中,除发生 上述三步基元反应外,链自由基还可能夺 取体系中的单体、溶剂、引发剂等分子上 的一个原子而终止,而使这些失去原子的 分子成为自由基,继续链的增长,使聚合 反应继续下去。
15
自由基聚合特征:
① 慢引发、快增长、快终止 ② 只有链增长反应才能使聚合度增加 ③ 在聚合过程中,单体浓度逐步降低,聚合
8.1 绪论
一、高分子的基本概念
1. 高分子化合物:指相对分子量高达10000~ 1000000的化合物,简称高分子。 其分为天然高分子和合成高分子两大类。 天然高分子,如棉、麻、皮、毛、植物纤维素、 蛋白质等; 合成高分子(又称高聚物或聚合物),如合成塑 料、合成纤维、合成橡胶、油漆、涂料等。
阴离子聚合要点课件
05
阴离子聚合的应用与实例
高分子合成中的应用
合成橡胶
阴离子聚合可用于合成橡胶,如 丁基橡胶、异戊橡胶等,具有高
弹性、耐油、耐老化等特性。
合成纤维
通过阴离子聚合可以制备高性能纤 维,如聚酯纤维、聚酰胺纤维等, 具有高强度、高模量等特点。
合成粘合剂
阴离子聚合可以合成各种粘合剂, 如聚氨酯、环氧树脂等,具有粘附 力强、耐久性好等特点。
如丙烯、异丁烯等,由于 它们具有不饱和碳-碳双键 ,能够进行阴离子聚合。
共轭烯烃单体
如苯乙烯、丁二烯等,这 些单体在阴离子聚合条件 下可以生成高分子量聚合 物。
环状单体
如环己烯、环戊烯等,这 些单体在阴离子聚合条件 下可以生成环状聚合物。
阴离子聚合的引发剂
烷基锂引发剂
如正丁基锂、苯基锂等, 是常用的阴离子聚合引发 剂。
03
在使用引发剂时,应遵循安全操作规程,避免与空 气和水接触,以免发生危险。
04
阴离子聚合的影响因素
温度的影响
温度对阴离子聚合速率有显著影响。 随着温度的升高,聚合速率通常会增 加,因为高温可以促进活性种的生成 和链增长。
然而,过高的温度可能导致聚合体系 不稳定,引发链转移反应和链断裂, 从而降低聚合物分子量和分子量分布 。
结合形成增长链。
阴离子聚合的机理具有高度的可逆性, 这使得聚合反应可以在较低的温度下进 行,同时也有利于控制聚合产物的分子
量和分子量分布。
阴离子聚合的活性中心可以通过不同的 引发剂来控制,例如有机金属化合物、
碱金属和碱金属化合物等。
阴离子聚合的动力学
阴离子聚合的动力学主要受聚合温度、单体浓度、引发剂浓度等 因素的影响。在聚合过程中,聚合速率随着单体浓度的增加而增 加,但同时也受到引发剂浓度的限制。
活性阴离子聚合
05 活性阴离子聚合的挑战与 前景
聚合反应控制问题
聚合度与分子量分布
活性阴离子聚合的聚合度与分子量分布调控是一个挑战,需要精 确控制反应条件以获得窄分子量分布的高分子量聚合物。
动力学研究
深入理解活性阴离子聚合的动力学机制,有助于更好地控制聚合过 程,实现聚合反应的可预测性和可重复性。
聚合机理
进一步揭示活性阴离子聚合的微观机理,有助于发现新的聚合方法, 提高聚合产物的性能。
物理方法
利用物理手段如光、热、 电等诱导原料转化为目标 单体,具有操作简便和条 件温和的优势。
03 活性阴离子聚合催化剂
催化剂种类
有机金属催化剂
如锂、钠、钾等碱金属催化剂 ,是常见的活性阴离子聚合催
化剂。
烷基锂盐
如丁基锂、苯基锂等,是常用 的引发剂和催化剂。
金属茂化合物பைடு நூலகம்
如二茂铁、二茂钴等,具有较 高的活性和选择性。
生物医学领域应用
生物医用高分子材料
活性阴离子聚合可以用于制备生物医用高分子材料,如医用塑料、生物降解高分 子、组织工程支架等。这些高分子材料具有良好的生物相容性和功能性能,可用 于医疗器械、药物载体、组织工程等领域。
高分子药物合成
通过活性阴离子聚合,可以合成具有特定结构和性质的高分子药物,如高分子前 药、高分子免疫佐剂等。这些高分子药物具有靶向性、长效性、低毒副作用等优 点,在肿瘤治疗、免疫治疗等领域具有广阔的应用前景。
其他过渡金属催化剂
如钛、锆、铪等过渡金属化合 物,也可以用于活性阴离子聚
合。
催化剂选择标准
活性
选择性
催化剂的活性是选择的首要标准,高活性 的催化剂可以降低聚合温度和缩短聚合时 间。
离子聚合离子聚合
5
1)阴离子聚合的烯类单体 原则上:含吸电子基的烯类单体
吸电子基能使 C=C上的电子云
B
δ+
CH2=CH Y
密度降低,有利于阴离子的进攻;
吸电子基也使碳阴离子增长种
的电子云密度分散,能量降低而稳 定。
BCH2
C Y
6
具有π-π共轭体系的烯类单体才能进行阴离子聚
合,如苯乙烯、丙烯酸酯类等。
VC、VAc等单体,P-π共轭效应与诱导效应相
反,减弱了双键电子云密度下降的程度,不利于阴离 子聚合。
环氧乙烷、环氧丙烷、己内酰胺等杂环化合物,
可由阴离子催化剂开环聚合。 Q-e 概念中,e 的正值越大,取代基吸电子性 越强,则单体越易阴离子聚合。若e 值虽不大,但 Q值较大的共轭单体也易阴离子聚合。
32
6.3 阳离子聚合(Cation Polymerization) 反应通式:
A B + M AM B M Mn
A
:阳离子活性中心,通常为碳阳离子或氧翁离子 :紧靠中心离子的引发剂碎片,称反离子(Counterion)
B
阳离子活性中心难以孤立存在,在聚合过 程中,往往与反离子形成离子对。
33
1)阳离子聚合的烯类单体 原则上:取代基为供电基团的烯类单 体原则上有利于阳离子聚合
由萘钠-THF引发得的聚苯乙烯,接近单分散性,这 种聚苯乙烯可用作分子量及其分布测定的标样。
22
D. 活性聚合的应用
制备遥爪聚合物(Telechelic Polymer)
指分子链两端都带有活性官能团的聚合物,两个官 能团遥遥位居于分子链的两端,象两个爪子,故称为遥 爪聚合物。 制备方法:聚合末期在活性链上加入如 CO2、环 氧乙烷、二异氰酸酯等添加剂,使末端带羧基、羟基、 异氰酸根等基团的聚合物,合成遥爪聚合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3O-Na+ + H2C CH X
H3CO CH2 CH Na+ X
3.3.2 引发剂(initiator)
三 有机金属化合物 (加成引发)
Organometallic compounds
2 反应式
Ⅱ类
- + CH3CH2CH2CH2 Li (n-BuLi)
+
H2C CH
initiation
n-BuCH2 CH
H2C CH X
X: -NO2, -CN, -COOR, -Ph, -CH=CH2
H2C CH Cl 氯乙烯
H2C CH O C CH3 O 乙酸乙烯酯
不能阴离子聚合
3.3.1 单体(monomer)
二 主要种类
2 共轭非极性单体—苯乙烯,丁二烯,异戊二烯
Conjugated diene
H2C CH
Initiator(墨绿色)
■ 碱金属活性↑
■ 介质溶剂化↑
■ 络合剂给电子能力↑
3.3.2 引发剂(initiator)
二 碱金属络合物 (电子间接转移引发)
Alkali metal complex
2 反应式
t
Initiation
electron transfer
. CH
2
CH- Na +
+
radical couple dimerize
R
only
Group B and group C
Group A
>>
R , R
>>
R , R, R
+
Initiator should be stronger
3.3.2 引发剂(亲核试剂)(nucleophilic reagent)
一 碱金属 二 碱金属络合物 三 有机金属化合物 四 其它 五 引发剂活性
均相或非均相 homogeneous or heterogeneous
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发) 非均相引发
alkali metal
3 特点 Feature
制备过程:把金属与惰性溶剂加热到金属的熔点以上, 剧烈搅拌,然后冷却得到金属微粒,再加入聚合体系
非均相引发
四 其它
只能引发活泼单体
亲核试剂Nucleophilic initiator
..
R3P
..
R3N
..
ROH
..
HOH
A pair of isolated electrons on the heteroatoms For example:
CN H2C C C OC2H5 O
initiator
+
H2O
POLYMER
2 反应式 Initiation
e Na
+
electron H2C CH transfer
. CH
2
CH- Na +
dimerize radical couple
Na
+ CH
CH2
CH2
CH Na +
双阴离子
Dicarbanion
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发)
Na
+CH CH2 CH2 CH Na +
Dicarbanion
3.3.2 引发剂(initiator)
二 碱金属络合物
Alkali metal complex
(电子间接转移引发) 3 特点 Feature 均相引发 Solubility
soluble in polar solvents only ( such as: ether, THF)
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发)
alkali metal
1 种类 Species
■ Lithium (Li) ■ Sodium (Na)
■ Potassium (K)
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发)
alkali metal
进攻后
R-
H2C CH X
H R CH2 C X
分散负电性,稳定活性中心
降低电子云密度,易 与富电性活性种结合
3.3.1 单体(monomer)
二 主要种类
Olefin with polar substituent
1 带强吸电子取代基的乙烯基单体
H2C CH X
X: -NO2, -CN, -COOR, -Ph, -CH=CH2
三 有机金属化合物 (加成引发)
Organometallic compounds
2 反应式
以KNH 2为例 Ⅰ类 2K + NH3 KNH2 NH2- + H2C CH X 2KNH2 + H2 K+ + NH2H2N CH2 CH X -
2 Na + 2 CH3OH → 2 CH3ONa + H2
CH3
H2 C
CH C N
H2C O
CH N O
H2C
C C O O CH3
Acrylonitrile
Nitroethene
Methyl methacrylate
3.3.1 单体(monomer)
二 主要种类
Olefin with polar substituent
1 带强吸电子取代基的乙烯基单体
H2C
CH3 C
styrene
a-Me-styrene
H2C CH C CH2
H2C CH CH CH2
CH3
butadiene
isoprene
3.3.1 单体(monomer)
二 主要种类
阴离子开环聚合
3 杂环化合物--含氧、氮、硫等杂原子
O O 环氧化合物
NH O 内酰胺
O 内酯
3.3.1 单体(monomer)
三 有机金属化合物 (加成引发)
Organometallic compounds
1 种类 Species
Ⅰ类 ■金属胺基化合物: NaNH2, KNH2
■金属醇盐(RO-)
■金属酚盐(PhO-)
Ⅱ类 ■金属烷基化合物
RLi 最常用
Ⅲ类 ■金属卤代烷基化合物-格氏试剂: RMgX
3.3.2 引发剂(initiator)
(- 0.01)
(- 0.161)
weakest
3.3.2 引发剂(initiator)
五 引发剂活性与匹配
3 Match of initiators and monomers
Table 4-6 (in textbook page 126)活性中心--源自负离子+C
■ sp3杂化 ■影响碳负离子稳定性的因素 (溶剂效应、诱导效应、空间效应)
3.3.1 单体(monomer)
一 要求 二 主要种类 三 活性比较
3.3.1 单体(monomer)
一 要求
A:B
M + - M A B BM- +A
足够活性
+ B- A
...
C
B
M- +A
死聚合物
■ 利于链增长
B CH2
C - +A
CH2
δ+
戴帽剂
足够亲电性 一定稳定性
+ B- A
■利于引发 ■ 避免副反应
CH C O OH +
CH2
δ+
BH
终止
3.3.1 单体(monomer)
二 主要种类
Olefin with polar substituent
1 带强吸电子取代基的乙烯基单体
进攻前 δ+
-
Li
+
Single carbanion
3.3.2 引发剂(initiator)
三 有机金属化合物 (加成引发)
Organometallic compounds
3 特点 Feature
均相引发
soluble in nonpolar solvents only ( such as: cyclohexane, alkane)
反应通式
A:B M + - M A B BM- +A
...
B
M- +A
离子对
死聚合物
反离子
抗衡离子
阴离子引发剂 初始阴离子
单体
活性种
活性中心
Counter-ion ■ 电荷相反 ■ 在活性中心附近
■ 跟随活性中心贯穿 始终,不能漏 写
§3.3 阴离子聚合(anionic polymerization)
引发效率低,分布宽,难控制 扩大表面积 Li, Na升华制镜,Li溶解制镜 均相化 碱金属络合物
3.3.2 引发剂(initiator)
二 碱金属络合物 (电子间接转移引发)
Alkali metal complex
1 组成 Species ■ 组分1-含自由电子:Li, Na, K, Rb, Cs ■组分2-含空轨道:芳烃,酮,腈,偶氮类
CH M X
1 种类 Species 金属 电负性 Met-C性质 活性
Ⅰ类
K
Na
0.8
0.9 1.0 1.2 1.3
离子键
离子键 极性共价键 共价键
很活泼
很活泼 较活泼 不能引发,需改为RMgX 且只能引发活性大的单体
Ⅱ类 Ⅲ类 Ⅳ类
Li Mg Al
H3CO CH2 CH Na+ X
3.3.2 引发剂(initiator)
三 有机金属化合物 (加成引发)
Organometallic compounds
2 反应式
Ⅱ类
- + CH3CH2CH2CH2 Li (n-BuLi)
+
H2C CH
initiation
n-BuCH2 CH
H2C CH X
X: -NO2, -CN, -COOR, -Ph, -CH=CH2
H2C CH Cl 氯乙烯
H2C CH O C CH3 O 乙酸乙烯酯
不能阴离子聚合
3.3.1 单体(monomer)
二 主要种类
2 共轭非极性单体—苯乙烯,丁二烯,异戊二烯
Conjugated diene
H2C CH
Initiator(墨绿色)
■ 碱金属活性↑
■ 介质溶剂化↑
■ 络合剂给电子能力↑
3.3.2 引发剂(initiator)
二 碱金属络合物 (电子间接转移引发)
Alkali metal complex
2 反应式
t
Initiation
electron transfer
. CH
2
CH- Na +
+
radical couple dimerize
R
only
Group B and group C
Group A
>>
R , R
>>
R , R, R
+
Initiator should be stronger
3.3.2 引发剂(亲核试剂)(nucleophilic reagent)
一 碱金属 二 碱金属络合物 三 有机金属化合物 四 其它 五 引发剂活性
均相或非均相 homogeneous or heterogeneous
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发) 非均相引发
alkali metal
3 特点 Feature
制备过程:把金属与惰性溶剂加热到金属的熔点以上, 剧烈搅拌,然后冷却得到金属微粒,再加入聚合体系
非均相引发
四 其它
只能引发活泼单体
亲核试剂Nucleophilic initiator
..
R3P
..
R3N
..
ROH
..
HOH
A pair of isolated electrons on the heteroatoms For example:
CN H2C C C OC2H5 O
initiator
+
H2O
POLYMER
2 反应式 Initiation
e Na
+
electron H2C CH transfer
. CH
2
CH- Na +
dimerize radical couple
Na
+ CH
CH2
CH2
CH Na +
双阴离子
Dicarbanion
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发)
Na
+CH CH2 CH2 CH Na +
Dicarbanion
3.3.2 引发剂(initiator)
二 碱金属络合物
Alkali metal complex
(电子间接转移引发) 3 特点 Feature 均相引发 Solubility
soluble in polar solvents only ( such as: ether, THF)
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发)
alkali metal
1 种类 Species
■ Lithium (Li) ■ Sodium (Na)
■ Potassium (K)
3.3.2 引发剂(initiator)
一 碱金属(电子直接转移引发)
alkali metal
进攻后
R-
H2C CH X
H R CH2 C X
分散负电性,稳定活性中心
降低电子云密度,易 与富电性活性种结合
3.3.1 单体(monomer)
二 主要种类
Olefin with polar substituent
1 带强吸电子取代基的乙烯基单体
H2C CH X
X: -NO2, -CN, -COOR, -Ph, -CH=CH2
三 有机金属化合物 (加成引发)
Organometallic compounds
2 反应式
以KNH 2为例 Ⅰ类 2K + NH3 KNH2 NH2- + H2C CH X 2KNH2 + H2 K+ + NH2H2N CH2 CH X -
2 Na + 2 CH3OH → 2 CH3ONa + H2
CH3
H2 C
CH C N
H2C O
CH N O
H2C
C C O O CH3
Acrylonitrile
Nitroethene
Methyl methacrylate
3.3.1 单体(monomer)
二 主要种类
Olefin with polar substituent
1 带强吸电子取代基的乙烯基单体
H2C
CH3 C
styrene
a-Me-styrene
H2C CH C CH2
H2C CH CH CH2
CH3
butadiene
isoprene
3.3.1 单体(monomer)
二 主要种类
阴离子开环聚合
3 杂环化合物--含氧、氮、硫等杂原子
O O 环氧化合物
NH O 内酰胺
O 内酯
3.3.1 单体(monomer)
三 有机金属化合物 (加成引发)
Organometallic compounds
1 种类 Species
Ⅰ类 ■金属胺基化合物: NaNH2, KNH2
■金属醇盐(RO-)
■金属酚盐(PhO-)
Ⅱ类 ■金属烷基化合物
RLi 最常用
Ⅲ类 ■金属卤代烷基化合物-格氏试剂: RMgX
3.3.2 引发剂(initiator)
(- 0.01)
(- 0.161)
weakest
3.3.2 引发剂(initiator)
五 引发剂活性与匹配
3 Match of initiators and monomers
Table 4-6 (in textbook page 126)活性中心--源自负离子+C
■ sp3杂化 ■影响碳负离子稳定性的因素 (溶剂效应、诱导效应、空间效应)
3.3.1 单体(monomer)
一 要求 二 主要种类 三 活性比较
3.3.1 单体(monomer)
一 要求
A:B
M + - M A B BM- +A
足够活性
+ B- A
...
C
B
M- +A
死聚合物
■ 利于链增长
B CH2
C - +A
CH2
δ+
戴帽剂
足够亲电性 一定稳定性
+ B- A
■利于引发 ■ 避免副反应
CH C O OH +
CH2
δ+
BH
终止
3.3.1 单体(monomer)
二 主要种类
Olefin with polar substituent
1 带强吸电子取代基的乙烯基单体
进攻前 δ+
-
Li
+
Single carbanion
3.3.2 引发剂(initiator)
三 有机金属化合物 (加成引发)
Organometallic compounds
3 特点 Feature
均相引发
soluble in nonpolar solvents only ( such as: cyclohexane, alkane)
反应通式
A:B M + - M A B BM- +A
...
B
M- +A
离子对
死聚合物
反离子
抗衡离子
阴离子引发剂 初始阴离子
单体
活性种
活性中心
Counter-ion ■ 电荷相反 ■ 在活性中心附近
■ 跟随活性中心贯穿 始终,不能漏 写
§3.3 阴离子聚合(anionic polymerization)
引发效率低,分布宽,难控制 扩大表面积 Li, Na升华制镜,Li溶解制镜 均相化 碱金属络合物
3.3.2 引发剂(initiator)
二 碱金属络合物 (电子间接转移引发)
Alkali metal complex
1 组成 Species ■ 组分1-含自由电子:Li, Na, K, Rb, Cs ■组分2-含空轨道:芳烃,酮,腈,偶氮类
CH M X
1 种类 Species 金属 电负性 Met-C性质 活性
Ⅰ类
K
Na
0.8
0.9 1.0 1.2 1.3
离子键
离子键 极性共价键 共价键
很活泼
很活泼 较活泼 不能引发,需改为RMgX 且只能引发活性大的单体
Ⅱ类 Ⅲ类 Ⅳ类
Li Mg Al
