第八章、分子轨道对称性守恒原理及应用—1
物理学中的对称性与守恒定律

物理学中的对称性与守恒定律对称性和守恒定律是物理学中的基本概念,它们在理解和解释自然界中各种物理现象和规律中起着重要作用。
本文将探讨物理学中的对称性和守恒定律,并探讨它们之间的密切关系。
一、对称性在物理学中的意义对称性是物理学中的重要概念,它描述了物理系统在某些变换下保持不变的性质。
在物理学中,对称性可以分为时空对称性和内禀对称性两种。
1. 时空对称性时空对称性是指物理系统在时空变换下保持不变。
在相对论物理学中,洛伦兹变换是描述时空变换的数学工具。
根据洛伦兹变换的不同类型,物理系统可以表现出平移对称性、旋转对称性和洛伦兹对称性等。
平移对称性是指物理系统在空间位置上的平移不会改变其物理性质。
例如,一个均匀介质中的物理规律在空间中的任何位置都是相同的。
旋转对称性是指物理系统在空间方向的旋转下保持不变。
例如,地球的自转周期不会影响物理规律的成立。
洛伦兹对称性是指物理系统在洛伦兹变换下保持不变,包括时间和空间的坐标变换。
相对论物理学中的基本原理就是洛伦兹对称性。
2. 内禀对称性内禀对称性是指物理系统在内部变换下保持不变。
在粒子物理学中,内禀对称性描述了粒子的基本性质。
例如,电荷共轭对称性指粒子与其反粒子具有相同的物理性质。
对称性在物理学中具有广泛的应用。
它不仅可以用于解释物理定律的成因,还可以帮助物理学家发现新的规律和预测新的物理现象。
二、守恒定律与对称性的关系守恒定律是物理学中的基本定律,描述了物理系统在某些变换下某个物理量保持不变的规律。
守恒定律与对称性之间存在着密切的关系。
以能量守恒定律为例,它描述了物理系统的能量在各种变换下保持不变。
能量守恒定律与时间平移对称性密切相关,即物理规律在时间上的平移不变性保证了能量守恒。
动量守恒定律是另一个重要的守恒定律,它描述了物理系统的总动量在某些变换下保持不变。
动量守恒定律与空间平移对称性密切相关,即物理规律在空间上的平移不变性保证了动量守恒。
角动量守恒定律和电荷守恒定律等也与对称性有着密切的联系。
分子轨道对称守恒原理

分子轨道对称守恒原理小资料:守恒原理的诞生。
分子轨道对称守恒原理认为:化学反应是分子轨道进行重新组合的过程,在一个协同反应中,分子轨道的对称性是守恒的,即反应物的分子轨道具有什么样的对称性,产物的分子轨道也应具有什么样的对称性,从原料到产物,分子轨道的对称性始终不变。
因为只有这样,才能用最低的能量形成反应中的过渡态。
因此,分子过渡的对称性控制着整个反应的进程。
能级相关理论:这种方法考虑了所有参与反应的分子轨道,强调了各分子轨道的对称性的分类,建立了反应物分子和产物分子轨道的能级之间相互转化的关系,分析协同反应进行的方式和条件,并且把能转化的能源(包括热能还是光能)定性地加以说明。
能级相关的方法及其应用:(1)画出反应物和产物分子的有关分子轨道,并按能级排列。
(2)选择一个适当的对称元素对反应物和产物分子的分子轨道进行分类,标上轨道的对称类型,而这个对称元素必须在整个反应过程中始终保持有效。
丁二烯顺旋环化反应只有C2轴始终保持有效,而其对旋环化反应,只有m1面才始终保持有效。
(3)用相关线将反应物和产物的分子轨道连接起来。
相连时,必须遵循2条原则:(a)对称守恒原则,即反应物和产物的分子轨道对称性要一致。
只能SS或AA相连,不能SA或AS相连,同时相连的分子轨道的能量要尽可能相近。
只有这样才符合分子轨道对称性守恒原理。
(b)不相交原则,是指对称性相同的两条相关线不能相互交叉。
即两条SS线或AA线不能相交,但SS连线和AA连线可以相交。
这一原则是根据量子力学原理确定的。
对称允许和对称禁阻:丁二烯加热顺旋环化的协同反应,在基态时,反应就可以进行,这种反应称为对称允许反应,反之,加热对旋环化反应,则称为对称禁阻反应。
这里的"允许"和"禁阻"只表示一个协同反应进程的难易程度。
分子轨道对称守恒原理

分子轨道对称守恒原理分子轨道对称守恒原理分子轨道对称守恒原理conservation of molecular orbital symmetry,principle of在协同反应中,反应循着保持分子轨道对称不变的方式进行。
若在协同反应过程中自始至终存在某种对称要素,反应物和产物的分子轨道都可以按这种对称操作分类,则反应物与产物的分子轨道对称性相合时反应就易于发生,而不相合时就难于发生。
单步骤的化学反应称为基元反应。
协同反应是这样一种基元反应,在其反应过程中所涉及的化学键的变动是协同一致地进行的。
一般说来,基元反应都是协同过程。
有机化学家R.B.伍德沃德首先从实验上总结了电环化、环加成、σ迁移、嵌入等周环协同反应的规律性,这些反应的共同特点是在加热和光照的作用下得到不同的立体异构物。
量子化学家R.霍夫曼从理论上对上述规律性进行分析。
1965年两人共同提出了分子轨道对称守恒原理。
这条原理可以用量子化学的能级相关理论,前线轨道理论或麦比乌斯结构理论加以阐明。
分子轨道对称守恒原理已推广到无机、催化、生化反应等许多重要领域,是微观化学反应动力学和量子化学应用的一个里程碑。
电环化反应含有k个π电子的线型共轭体系,在其末端生成一个单键的反应及其逆反应,称为电环化反应。
反应有对旋和顺旋两种情况,从而得到两种异构体(图1 )。
在对旋情况下,反应是以保持一个对称平面为特征;而顺旋过程始终具有一个二重对称轴。
以丁二烯转变为环丁烯为例。
丁二烯有4个π轨道:χ1、χ2、χ3、χ4 ,基态时χ和χ是占据的;环丁烯有一个占据的σ轨道和一个占据的π轨道,还有一个空的σ*轨道和一个空的π*轨道。
按能级相关理论,在对旋和顺旋反应过程中保持轨道的对称性,按不相交规则,即相同对称性的轨道在反应过程中不相交,图 2 是这两个过程的能级相关图。
在顺旋过程中,反应物和产物基态的分子轨道一一相连,因而在加热时丁二烯电环化反应只得到顺旋产物,与实验结果一致。
分子轨道的对称性和反应机理

乙烯加氢反应:
C2H4 H2 C2H6
G0:是热力学允许的反应 乙烯和氢的前线分子轨道:
对称性不匹配,反应很难进行。必须采用催化 剂才能使反应进行。
要想使反应进行,必须借助催化剂。工业上使用
Raney Ni(超细Ni粉) H2 首先吸附在 Ni 表面,Ni 的 d 电子流向 H2 的 1s* 轨道,使氢分子的LUMO变 成HOMO,使氢分子活化解离,就可以反应了。
光照时,电子激发,原来的 LUMO 将成为 HOMO,应分 析LUMO 的相位
例:丁二烯闭环 光照时,考虑LUMO
光照
ψ3
对旋才满足对称性要求
加热时,考虑HOMO 加热
ψ2
顺旋才满足对称性要求
例:己三烯与丁二烯相反,光照顺旋,加热对旋。
轨道形状可以根据 节面个数猜测!红 虚线为节面。
光照,顺旋
R
3 反应条件的判断
若反应物的成键分子轨道只与产物的成键轨道相关 联,则反应是对称性允许的。在这种情况下,反应 物处于基态就可直接转化为产物,活化能低,在加 热()条件下即可进行。 或表述成:反应物与产物的成键轨道中其对称轨道 数目相等,加热即可进行反应。
若反应物的部分成键轨道与产物的反键轨道关联,则 此反应是对称性禁阻的,在这种情况下,反应物必须 处在激发态才能转化为产物的基态,反应的活化能高, 光照才能使反应进行。 或表述成:反应物与产物的成键分子轨道中其对称轨 道数目不相等时,必须在光照下反应才能进行。
S
A
A
S
E
S
A
A
S
S
A
A
C2
S
光照,顺旋
A
A
S
A
A
S
分子轨道对称守恒原理

分子轨道对称守恒原理
分子轨道对称守恒原理是描述分子轨道形成和相互作用的基本规律。
在分子轨
道理论中,分子轨道对称性对于分子结构、光谱性质以及化学反应的理解都具有重要的意义。
本文将从分子轨道对称守恒原理的概念、原理和应用进行阐述。
首先,分子轨道对称守恒原理是指在分子形成过程中,分子轨道的对称性会保
持不变。
这意味着,如果原子轨道的对称性相同,它们将能够相互叠加形成对称性相同的分子轨道。
这一原理是基于量子力学的波函数叠加原理和对称性分析的基础上得出的。
其次,分子轨道对称守恒原理在分子结构和性质的理解中具有重要的作用。
通
过对分子轨道对称性的分析,可以预测分子的形状、键合方式以及分子的光谱性质。
例如,通过对称性分析可以确定分子中存在的π键和σ键的相对能量位置,从而解释分子的化学性质和反应活性。
另外,分子轨道对称守恒原理也在化学反应的研究中发挥着重要的作用。
在分
子轨道理论中,通过对称性分析可以预测分子间的相互作用方式,从而解释化学键的形成和断裂过程。
这对于设计新的催化剂、预测反应的活性以及理解反应机理都具有重要的意义。
总之,分子轨道对称守恒原理是分子轨道理论中的重要概念,它对于理解分子
结构、光谱性质以及化学反应具有重要的意义。
通过对分子轨道对称性的分析,可以预测分子的性质和行为,为理论化学和实验化学的发展提供了重要的指导。
希望本文对于分子轨道对称守恒原理的理解和应用能够有所帮助。
分子轨道的对称性和反应机理
(2)相互作用的HOMO和LUMO能量必须接近(约为6 eV);
+
(
* 2
p
)0
-
+
O2 HOMO
O2 LUMO
-
+
+
-
(
* 2
p
)1
+
-
(
* 2
p
)1
-
+
-
++
O2
+
--
N2
+
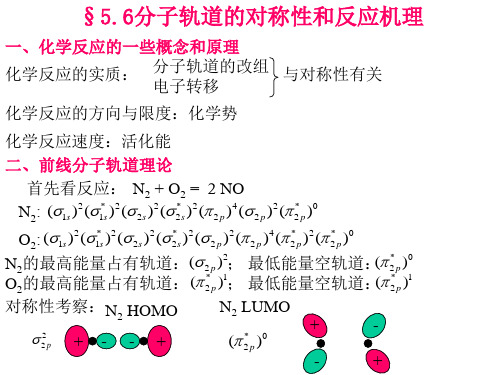
N2的LUMO和O2 的HOMO对称性匹配,但欲使反应进行,电 子需从电负性较高的O向电负性较低的N转移,而当O的电子向反键 轨道转移后,就会增强O2的化学键,反应很难进行。活化能很高。 这说明N2和O2能共存,而且NO也能分解。 前线轨道理论的基本要点:
)0
O2:
(1s
)2
(1*s
)2
(
2s
)2
(
* 2s
)2
(
2
p
)2
(
2
p
)4
(
* 2
p
)2
(
* 2
p
)0
N2的最高能量占有轨道:(
2
p
)2;
最低能量空轨道:(
* 2p
)0
O2的最高能量占有轨道:(
* 2p
)1;
分子轨道对称守恒

分子轨道对称守恒分子轨道对称守恒是化学中一个重要的概念,它对于分子的性质和反应有着重要的影响。
在本文中,我将详细介绍分子轨道对称守恒的概念、原理和应用。
分子轨道对称守恒是指在分子中,当分子发生对称性操作(如旋转、翻转)时,分子中的分子轨道的对称性保持不变。
这个概念可以用来预测分子的性质、解释分子的反应以及设计新的分子材料。
分子轨道对称守恒的原理可以通过对分子的对称性进行分析来理解。
分子的对称性由分子的几何结构决定,而分子的几何结构可以通过分子的轨道来描述。
分子轨道是分子中电子的运动状态,它们具有不同的对称性。
当分子发生对称性操作时,电子的运动状态会发生改变,但是分子轨道的对称性保持不变。
这是因为对称性操作不会改变分子的几何结构,而分子的几何结构决定了分子轨道的对称性。
分子轨道对称守恒在化学中有着广泛的应用。
首先,它可以用来预测分子的性质。
根据分子轨道的对称性,我们可以确定分子的电子结构和能级分布,从而预测分子的化学性质,如反应活性、化学稳定性等。
例如,具有对称轨道的分子通常具有较高的稳定性,而具有非对称轨道的分子通常具有较高的反应活性。
分子轨道对称守恒也可以用来解释分子的反应。
在化学反应中,分子的对称性可以发生改变,从而导致分子轨道的对称性发生改变。
根据分子轨道对称守恒原理,当反应发生时,只有那些保持分子轨道对称性的反应才是可能的。
这可以帮助我们理解为什么一些反应会发生,而另一些反应却不会发生。
分子轨道对称守恒还可以用来设计新的分子材料。
根据分子轨道的对称性,我们可以预测不同分子之间的相互作用,并设计出具有特定性质的分子材料。
例如,通过调控分子轨道的对称性,我们可以设计出具有特定光学、电学或磁学性质的分子材料。
这对于材料科学和纳米技术的发展具有重要的意义。
分子轨道对称守恒是化学中一个重要的概念,它对于分子的性质和反应有着重要的影响。
通过分子轨道对称守恒原理,我们可以预测分子的性质、解释分子的反应以及设计新的分子材料。
物理中的对称性与守恒定律

物理中的对称性与守恒定律在物理学中,对称性与守恒定律是两个非常重要的概念,它们贯穿于整个物理学的各个领域,为我们解释世界的运行规律提供了重要的理论支撑。
对称性和守恒定律之间存在着密切的联系,它们相辅相成,相互促进,共同构成了物理学中的基本框架。
本文将从对称性和守恒定律的基本概念入手,探讨它们在物理学中的重要作用以及彼此之间的内在联系。
## 对称性的基本概念对称性在物理学中是一个非常重要的概念,它指的是系统在某种变换下保持不变的性质。
具体来说,对称性可以分为空间对称性、时间对称性和内禀对称性等多种类型。
在物理学中,对称性通常表现为物理定律在某种变换下保持不变,这种不变性为我们揭示了自然界中隐藏的规律和对称性。
空间对称性是指系统在空间变换下保持不变的性质。
例如,一个物理系统在进行平移、旋转或镜像变换后仍保持不变,那么我们就说这个系统具有相应的空间对称性。
空间对称性的存在为我们提供了研究物理系统的重要线索,帮助我们揭示物质世界的奥秘。
时间对称性是指系统在时间变换下保持不变的性质。
在经典力学中,时间是一个普遍的参量,物理定律在时间平移下保持不变,这就是时间对称性。
时间对称性的存在为我们提供了研究物理系统随时间演化的重要线索,帮助我们理解自然界中的时间规律。
内禀对称性是指系统在内部变换下保持不变的性质。
例如,电荷守恒定律要求电荷在物理过程中保持不变,这就是内禀对称性的体现。
内禀对称性揭示了物理系统内部的稳定性和规律性,为我们理解微观世界提供了重要线索。
## 守恒定律的基本概念守恒定律是物理学中的另一个重要概念,它描述了系统某些物理量在时间演化过程中保持不变的规律。
根据不同的物理量和系统,可以得到不同的守恒定律,如能量守恒定律、动量守恒定律、角动量守恒定律等。
能量守恒定律是物理学中最基本的守恒定律之一,它表明一个封闭系统中能量的总量在时间演化过程中保持不变。
能量可以在不同形式之间转化,但总能量守恒。
能量守恒定律揭示了自然界中能量转化的规律,为我们研究能量转换和利用提供了基本原则。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.环加成反应[HOMO+LUMO]
2.1. [2+4]反应 —— 光-激发态-禁阻、热-基态-允许
LUMO
HOMO
LUMO
[2+4]
热允许
HOMO
基态
基态
热-基态-允许
[2+4]反应 —— 光-激发态-禁阻、热-基态-允许
2
HOMO
激发态
3
光禁阻
+
LUMO
基态
光-激发态-禁阻
1
LUMO
激发态
1.
* ( A)
电环化反应
C2 C2
热允许、光禁阻
4 ( s)
*
( A)
4 ( s)
*
(s)
*
3
( A)
3 ( A)
( s)
( A)
2
(s)
( A)
2 (s)
σ (S)
1 ( A)
(s)
1
( A)
环丁烯
丁二烯
环丁烯
丁二烯
环丁烯的顺旋开环反应的 有关分子轨道及其对称性
A. O.能量相近
A.O.能量分离
分子轨道对称守恒规则 在化学反应中的应用
1.周环反应
4
6
5
3
4
2
3
2
1
1
丁二烯的分子轨道
己三烯的分子轨道
4
LUMO
基态
3
2
LUMO
1
激发态
丁二烯的分子轨道
6
LUMO
5
基态
4
3
LUMO
2
1
激发态
己三烯的分子轨道
一、电环化及其逆反应 反应物或产物中共轭 电子的数目是m
环丁烯的顺旋开环及其 逆反应的能级相关图
m
4 ( A)
m
* ( A)
热禁阻、光允许
( A)
*
-
对旋
4 ( A)
* ( A)
3 ( s)
* ( A)
3 ( s)
( s)
( s)
2 ( A)
2 ( A)
( s)
1 (s)
环丁烯
( s)
光允许、热禁阻 环丁烯
O HO
hv
+
O
4. 螯移变反应
Me Me
SO2
+
SO2
Me
Me
O
hv
CO
+CH2
CH CH
CH
CH
CH2
螯(移)变反应(Cheletropic Reaction) ——连接在同一原子上的两个σ键协同生成或断裂的反应
OMO
LUMO
Í ¬Ãæ 同面 Ö ×· é
HOMO
组分
LUMO
HOMO S
S
第八章、分子轨道对称性守恒原理 及应用
成键时,对称性匹配
A B
A B
A B
+
+
-
+ +
-
+ +
-
S S
A
Px Px
+ + + + + + B
S Px
B
A
-
-
Px Py
Px Pyz
A
对称性不匹配,不能成键
A
-
+ -
B
A
+ S Py
B
-
-
+ + -
B
Px Py
Px Pyz
环丁烯对旋开环生成丁二烯的能级相关图
m镜面
m镜面
* ( A)
* ( A)
4 ( A)
4 ( A)
( A)
*
* ( A)
3 ( s)
3 ( s)
( s)
( s)
2 ( A)
2 ( A)
( s)
( s)
1 (S )
1 (S )
环丁烯 丁二烯
0 r (1 cos )
cos E
0
0
r (1 cos ) 0 cos
E cos
=0
E
此行列式的四个解 E1 、 E2 、 E3 和 E4 是四个分子轨道的能量 E 2E1 2E2
E1 、 E2 随对旋时 角度变化,故 E 也随 变化
2
[3.3]
4
6 1
2
Cope重排
3
3
hv
T1
6
4 3
2
5
1
Ph
Ph CN 1 2
hv
CN 3 CN H 3C
3 2 CN H 1 H
H 3C
2 3 1 H D AcO H D
2 1 3 H AcO H
OCH 2CH
CH2
OH
克莱森重排
CH 2CH CH2
O
光- Fries重排
OH HO O HO OH
3. σ- 键迁移反应
C H D A B H D C
B
A
σ- 键迁移反应
5
LUMO
3
4
3
2
HOMO
2
1
1,3 -σ- 键迁移 1,5 -σ- 键迁移
1
具有构型翻转的σ- 键迁移反应 (原子团)
C
C
hv
C
HOMO
构型保持
C
C
C
HOMO
构型翻转
三、[ i + j ] σ- 键迁移反应
光允许、热禁阻 环丁烯 丁二烯
环丁烯开环生成丁二烯的状态相关图
环丁烯 顺旋
丁二烯
对旋 环丁烯
丁二烯
中国化学家对分子轨道对称守恒原理的贡献
2 1 3 4
唐敖庆院士
丁二烯
丁二烯对旋关环时的分子轨道 C11 C22 C33 C44
相应的久期行列式为
E cos
光 —— 光化学的螯移变反应与热化学的上述规则相反
实
例
Longuet-Higgins能级相关理论
1、能级相关图的构成
构成能级相关图的要点如下:
•
• • •
a) b)
确定反应过程中自始至终存在的对称元素
找出在反应过程中反应物与产物参与反应的分子轨道 根据对称元素确定参与反应的分子轨道的对称性——对称(S)或反称(A) 根据下列原则关联反应物与产物的相关分子轨道,构成能级相关图:
一一对应原则:反应体系的一个分子轨道只能与产物体系的一个分子轨道相关联,否 则可能违背泡利不相容原理 能量相近原则:在不违背轨道对称守恒及一一对应原则的条件下,尽量使能量相近的 轨道相关联
c)
不相交原则:对称性相同轨道的关联线不能相交,因为对称性相同的轨道会产生互相 排斥
•
根据得到的能级相关图,确定该反应在能量上是否有利。若能量有利,则反 应容易进行,是允许的反应;若能量不利,则该反应是禁阻的。
1 (s)
丁二烯
丁二烯
环丁烯的对旋开环反应的 有关分子轨道及其对称性
环丁烯的对旋开环及其 逆反应的能级相关图
2.
环加成反应
[2+2]加成反应
C + C + C C C C C C
x
y
z
对称元素 xy平面 yz平面
AA
热禁阻、光允许
1* 2 *
AA
* * * * 1 2
基态
LUMO
HOMO
热禁阻
[4+4]
HOMO
光允许 LUMO
基态 激发态
同面加成与异面加成
Supra
Supra
Supra
C
antara
C
antara
C
C
[2+2] 反应
LUMO 2
HOMO 1
2s+2s
2a+2a
加成反应的同侧进攻与异侧进攻
热-基态-禁阻
基态反应
HOMO
(激发态)
同面 2s +2s
状态相关理论简介
构成状态相关图的要点:
① 确定反应过程中自始至终存在的对称元素 ② 找出在反应过程中反应物与产物参与反应的分子轨道,根据对称元素确 定其对称性——对称(S)或反称(A) ③ 确定反应物与产物的基态、第一激发态和相应的高级激发态的状态及其 对称性。状态的对称性决定于相应轨道的对称性及其电子充填情况 ④ 依据不相交原则画出状态相关图,决定从反应物的初始状态到产物的相 关状态是否存在能垒,从而判定反应是否容易进行 (若不存在能垒,则 反应允许;若存在能垒,则反应禁阻)
含不对称碳基团的 键迁移反应 (热-基态) 4K 异面 + 构型保持 或 同面 + 构型翻转 hv 同面 + 构型保持 或 异面 + 构型翻转 4K+2 同面 + 构型保持 或 异面 + 构型翻转 hv 异面 + 构型保持 或 同面 + 构型翻转
[1.3]
3 2
4
1
5 6
hv
5
5
4
6 1
O
O
O
O
LUMO O
S O
丁二烯对旋成键 SO2 为同面组分 线型螯移变反应 4n+2, 热允许
丁二烯对旋成键 SO2 为异面组分 线型螯移变反应 4n+2, 热允许
