高一化学推断题习题及答案
完整word版,高一必修一化学期末推断题专练

專題推斷題解題技巧推斷題解題技巧:看其顏色,觀其狀態,察其變化。
1. 常見物質の顏色:多數氣體為無色,多數固體化合物為白色,多數溶液為無色。
2. 一些特殊物質の顏色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亞鐵)藍色:CuSO4•5H2O、Cu(OH)2、含Cu2+ 溶液、液態固態O2(淡藍色)紅色:Cu(亮紅色)、Fe2O3(紅棕色)、紅磷(暗紅色)黃色:硫磺(單質S)、含Fe3+の溶液(棕黃色)綠色:FeSO4•7H2O、含Fe2+の溶液(淺綠色)、堿式碳酸銅[Cu2(OH)2CO3]紫黑色:KMnO4無色氣體:N2、CO2、CO、O2、H2、CH4有色氣體:Cl2(黃綠色)、NO2(紅棕色)有刺激性氣味の氣體:NH3(此氣體可使濕潤pH試紙變藍色)、SO2、HCl有臭雞蛋氣味:H2S產生酸霧:HCl、HNO33. 常見一些變化の判斷:①白色沉澱且不溶於稀硝酸或酸の物質有:BaSO4、AgCl(就這兩種物質)②藍色沉澱:Cu(OH)2、CuCO3③紅褐色沉澱:Fe(OH)3Fe(OH)2為白色絮狀沉澱,在空氣中很快變成灰綠色沉澱,再變成Fe(OH)3紅褐色沉澱④沉澱能溶於酸並且有氣體(CO2)放出の:不溶の碳酸鹽。
例如CaCO3⑤沉澱能溶於酸但沒氣體放出の:不溶の堿。
例如Cu(OH)24. 燃燒時の主要現象①在氧氣中:硫——藍紫色火焰;鐵——火星四射;木炭——發白光。
②在空氣中:鎂帶——耀眼の白光;紅磷——“白煙”;硫、氫氣——淡藍色火焰;CO、CH4——藍色火焰5、酸和對應の酸性氧化物の聯繫:①酸性氧化物和酸都可跟堿反應生成鹽和水:CO2 + 2NaOH = Na2CO3 + H2O(H2CO3 + 2NaOH = Na2CO3 + 2H2O)SO2 + 2KOH = K2SO3 + H2OH2SO3 + 2KOH = K2SO3 + 2H2OSO3 + 2NaOH = Na2SO4 + H2OH2SO4 + 2NaOH = Na2SO4 + 2H2O②酸性氧化物跟水反應生成對應の酸:(各元素の化合價不變)CO2 + H2O = H2CO3 SO2 + H2O = H2SO3SO3 + H2O = H2SO4 N2O5 + H2O = 2HNO3(說明這些酸性氧化物氣體都能使濕潤pH試紙變紅色)6. 堿和對應の鹼性氧化物の聯繫:①鹼性氧化物和堿都可跟酸反應生成鹽和水:CuO + 2HCl = CuCl2 + H2OCu(OH)2 + 2HCl = CuCl2 + 2H2OCaO + 2HCl = CaCl2 + H2OCa(OH)2 + 2HCl = CaCl2 + 2H2O②鹼性氧化物跟水反應生成對應の堿:(生成の堿一定是可溶於水,否則不能發生此反應)K2O + H2O = 2KOH Na2O +H2O = 2NaOHBaO + H2O = Ba(OH)2 CaO + H2O = Ca(OH)2③不溶性堿加熱會分解出對應の氧化物和水:Mg(OH)2 MgO + H2O Cu(OH)2 CuO + H2O2Fe(OH)3 Fe2O3 + 3H2O 2Al(OH)3 Al2O3 + 3H2O1 某實驗室の廢液中,可能含有氯化鐵、氯化鈉、硫酸鈉、鹽酸、氫氧化鈉、硝酸鋇中の一種或幾種。
高考化学《有机合成推断》真题练习含答案

高考化学《有机合成推断》真题练习含答案1.[2024·浙江1月]某研究小组按下列路线合成镇静药物氯硝西泮(部分反应条件已简化)。
已知:CROBrR—Br +HNRCON RN 请回答:(1)化合物E 的含氧官能团名称是 。
(2)化合物C 的结构简式是 。
(3)下列说法不正确的是 。
A .化合物A →D 的转化过程中,采用了保护氨基的措施B .化合物A 的碱性弱于DC .化合物B 与NaOH 水溶液共热,可生成AD .化合物G →氯硝西泮的反应类型是取代反应(4)写出F →G的化学方程式________________________________________________________________________ ________________________________________________________________________。
(5)聚乳酸()是一种可降解高聚物,可通过化合物开环聚合得到。
设计以乙炔为原料合成X的路线(用流程图表示,无机试剂任选)。
(6)写出同时符合下列条件的化合物B的同分异构体的结构简式。
①是苯的二取代物;②1HNMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,无碳氧单键。
答案:(1)硝基、羰基(2)(3)BD(4)(5)(6)解析:A与乙酸发生取代反应生成B,则B的结构简式为;B发生硝化反应生成C,结合D的结构简式可知C为;E发生取代反应生成F,根据F和G的分子式以及氯硝西泮的结构简式,结合题给已知条件可知,F的结构简式为,G的结构简式为。
(3)A→B的过程中,氨基被转化为酰胺基,硝化反应后再水解出氨基,属于氨基的保护,A项正确;硝基为吸电子基团,使化合物中负电荷向硝基偏移,导致氨基中的N原子结合质子的能力减弱,所以碱性:A>D,B项错误;B的结构简式为,在氢氧化钠溶液、加热的条件下,酰胺基发生水解反应,可转化为化合物A,C项正确;G的结构简式为,G中氨基与酮羰基发生脱水缩合反应,生成了氯硝西泮,不属于取代反应,D项错误。
高一化学无机推断试题答案及解析

高一化学无机推断试题答案及解析1.(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。
请填写下列空白:(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为。
反应⑦属于。
A.吸热反应B.放热反应C.置换反应D.氧化还原反应(3)反应⑩的离子方程式为。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。
该反应的化学方程式是:。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为。
【答案】(1)B SO3 E Fe(OH)3;(2) Fe2O3+ 2Al Al2O3+2Fe 。
反应⑦属于BCD 。
(3) 3Fe+2NO3-+8H+ = 3Fe2++2NO↑+4H2O 。
(4) Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
(5) FeS2。
【解析】(1)甲矿石是FeS2,矿石煅烧得到A:SO2和D:Fe2O3;SO2与O2发生反应得到B:SO3,SO3与水作用得到C:硫酸;I是Al,Al与Fe2O3发生铝热反应:Fe2O3+ 2Al Al2O3+2Fe,得到的G的Fe;H是Al2O3。
E是Fe(OH)3;F是Fe2(SO4)3和Fe(NO3)3的混合物,M是Fe(NO3)2.L是NO;K是NO2,J是 HNO3。
(1)B是SO3;E是Fe(OH)3;(2)反应⑦的铝热反应的化学方程式为Fe2O3+ 2Al Al2O3+2Fe,铝热反应是放热反应,因为符合置换反应的定义,所以属于置换反应,有元素的化合价的升高与降低,所以也是氧化反应反应。
因此选项是B、C、D。
高一化学有机合成与推断试题答案及解析

高一化学有机合成与推断试题答案及解析1.(7分)来自石油的有机化工原料A,其产量已作为衡量一个国家石油化工发展水平的标志,A 可以发生如下转化:已知:E是具有果香味的有机物,其分子式为C4H8O2,F是一种高分子化合物。
(1)A的分子式是,C的名称是。
(2)D分子中的官能团名称是,证明该官能团具有酸性的方法是。
(3)反应③的化学方程式是;反应④的类型是反应。
【答案】(1)C2H4(1分)乙醛(1分)(2)羧基(1分);向D中滴加碳酸氢钠溶液,若有无色无味的气体产生,则证明羧基具有酸性(1分)(3)CH3COOH+C2H5OH CH3COOC2H5+H2O (2分)加聚(1分)【解析】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,所以A是H2C=CH2,E是具有果香味的有机物,E是酯,酸和醇反应生成酯,则B和D一种是酸一种是醇,B能被氧化生成C,A反应生成B,碳原子个数不变,所以B是乙醇,D是乙酸,铜作催化剂、加热条件下,乙醇被氧气氧化生成C,所以C是乙醛,A反应生成F,F是一种高聚物,可制成多种包装材料,所以F是聚乙烯,则(1)通过以上分析知,A的分子式为:C2H4,C的名称为乙醛;(2)D分子中的官能团名称是羧基,检验羧基具有酸性的方法是:向D中滴加碳酸氢钠溶液,若有无色无味的气体产生,则证明羧基具有酸性;(3)反应③是酯化反应,方程式为CH3COOH+C2H5OH CH3COOC2H5+H2O。
反应④一定条件下,乙烯发生加聚反应生成聚乙烯,该反应属于加聚反应。
【考点】考查有机物的推断2.一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):回答下列问题:(1)化合物III中所含官能团的名称是、。
(2)化合物III生成化合物IV的副产物为。
(提示:原子利用率100%,即原子全部都转化成产物)(3)CH2=CH2与溴水反应方程式:。
化学推断题专题训练含答案
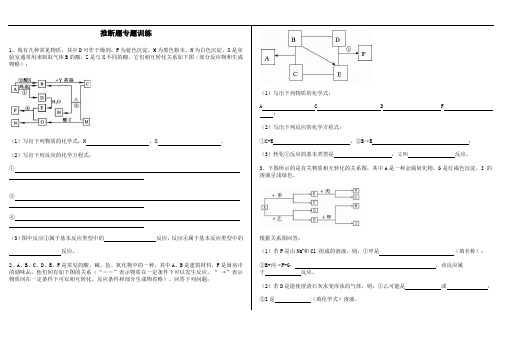
(3)混合物A中,肯定存在的物质是(写化学式)。
(4)写出实验过程④中可能发生的化学反应中的1个化学方程式(只能写1个,多写该空不得分:。
5、A、B、C、D分别是NaNO3、NaOH、HNO3和 四种物质的溶液中的一种。现利用另一种物质X的溶液,用下图所示的方法,即可将它们逐一确定。
④若甲、乙、丙都含有三种元素,且都含有钠和氧元素,甲、乙、丙相对分子质量依次增加,则甲的化学式为,乙→丙反应的方程式为
参考答案
1、(1)BaSO4HCl
(2)①CaCO3 CaO+CO2↑
③CO+CuO Cu+CO2
④Ca(OH)2+CuSO4===Cu(OH)2↓+ CaSO4
(3)分解 复分解
2、(1)A、CaCO3C、CO2D、HCl F、NaCl
(4)NaOH
A.甲、乙是非金属单质
B.物质X一定是H2O
C.物质Y一定是氧化物
D.甲与丙反应能生成X
16.(2011年全国化学竞赛湖北初赛)现有一混合物的水溶液,只可能含有以下离子中的若干种:Na+,NH4+,Ca2+,Ba2+,Cl-,CO32-,SO42-,现用三份该溶液进行如下实验:
(1) 向第一份溶液加入硝酸银溶液,有白色沉淀;
17、甲、乙、丙是初中常见物质,其转化关系如下图所示,试推断:
①若甲、乙的组成元素相同非金属单质,且丙也可以转化为乙,则丙→乙的化学方程式为
③若甲是金属单质,乙是氧化物,则丙物质可能是(填“氧化物”、“单质”、“酸”、“碱”或“盐”),金属甲应满足的条件是
则A是B是C是D是X是
6、实验室中现有一种固体混合物,其中可能含有Cu(OH)2、CuO、NaOH、Na2CO3、CaCl2六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述。
高一化学推断题和离子共存问题分析及习题含答案

1.在碱性溶液中能大量共存且溶液为无色透明的离子组是 B A.K +、Na +、MnO 4-、Cl - B.K +、NO 3-、Na +、CO 32-C.H +、Na +、SO 42-、NO 3- D.Na +、Fe 3+SO 42-、Cl -2.下列溶液中;因氧化—还原反应而不能大量共存的离子组是 D A.K +、Ag +、NO 3-、Cl - B.Ba 2+、Na +、SO 42-、NO 3- C.K +、H +、CO 32-、Cl - D.Mg 2+、Na +、ClO -、I -3.下列离子在溶液中能大量共存;加入OH -能产生白色沉淀的是 C A. Na +、Ca 2+、SO 42-、Cl - B. H +、Mg 2+、CO 32-、Cl - C. K +、Mg 2+、SO 42-、NO 3- D. K +、Na +、NO 3-、CO 32-4. 已知某溶液中存大较多的H +、SO 42-、NO 3-;则该溶液中还能大量存在的离子组是 D A. Al 3+、CH 3COO -、Cl - B. Mg 2+、Ba 2+、Br - C. Cu 2+、Cl -、I - D. Na +、NH 4+、Cl -5.A 、B 、C 和D 分别是NaNO 3、NaOH 、HNO 3和BaNO 32四种溶液中的一种;现利用另一种溶液X;用如下图所示的方法;即可将它们一一确定.. 试确定A 、B 、C 、D 、X 各代表何种溶液..A :_________B :_________C :__________D :__________X :__________6.短周期元素A、B、C、D中;0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子;0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应;A原子核内质子数目与中子数目相等;B元素原子核外M层电子数目比K层多1个;C―比A元素的离子多1个电子层;D元素的原子核外L层比K层多2个电子..1A、B、C、D四种元素的名称分别是、、、 ..2画出C―和D原子的结构示意图3向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液;现象为______________________;写出有关离子方程式_________________________________________________________..参考答案1.B2.D3.C4.D5. A:NaOH B:NaNO3 C:BaNO32D:HNO3X:MgSO46. 1镁、铝、氯、碳;2 、;3Al3++3OH-===AlOH3↓;AlOH3+OH-==AlO2-+2H2O..。
高一化学推断题练习试题集

高一化学推断题练习试题答案及解析1.X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。
已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。
请回答下列问题:(1)X元素的名称是__________,它在周期表中的位置____________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________(3)写出F的电子式______________________________(4)已知X单质、A、B、D均为固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。
请写出X单质、B分别与E反应的化学方程式__________________________________,;B中含有的化学键是;(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
【答案】(1)钠(1分)第三周期第I A族(2分)(2) Na>O>H (2分)【解析】由题可以知道X、Y、Z分别为Na、O、H,A、B、C、D、E分别为NaH、、、、,所以(1)X元素的名称是钠,在周期表中的位置为第三周期第I A族;(2)X、Y、Z的原子半径从大到小的顺序是Na>O>H ;(3)F为NaOH,其电子式为;(4)X单质、B分别与E反应的化学方程式为、,B为,其中含有的化学键是;(5)化合物C制取Y的单质反应的化学方程式为。
【考点】元素周期表点评:本题考查了元素周期表中部分元素的性质及其化合物,该题难度不大。
2.某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
高一化学推断题练习试题集

高一化学推断题练习试题答案及解析1.(6分)已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
(1)A的结构简式为。
(2)D分子中的官能团是,(3)写出下列反应的化学方程式②④【答案】(1)CH2=CH2(1分)(2)羧基或—COOH(1分)(3)②2H3CH2OH+O22H3CHO+2H2O(2分)④ nCH2=CH2。
(2分)【解析】根据题意可知A是乙烯CH2=CH2;B是乙醇CH3CH2OH;C是乙醛CH3CHO;D是乙酸CH3COOH,E是乙酸乙酯CH3COOCH2CH3;F是聚乙烯。
(1)A的结构简式为CH2=CH2;(2)D分子中的官能团是羧基或—COOH;(3)②反应的化学方程式是2H3CH2OH+O22H3CHO+2H2O;④反应的化学方程式是nCH2=CH2。
【考点】考查有机物的结构、性质、转化及方程式的书写的知识。
2.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:(1)写出下列物质的化学式:B_________、丙_________、乙_________。
(2)写出下列反应的离子方程式:反应①_____________________________________________;反应⑤_____________________________________________;反应⑥_____________________________________________。
【答案】(1)Al、HCl、Cl2(2)2Na+2H2O=2Na++2OH-+H2↑;Cl2+2Fe2+=2Fe3++2Cl-;Fe3++3OH-=Fe(OH)3↓【解析】金属A的焰色反应是黄色,说明A是Na。
钠和水反应生成氢氧化钠和氢气,则甲是氢气,D是氢氧化钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.如下图所示,已知:A、E是两种金属单质,其中A在空气中燃烧时,会发出耀眼的白光,同时生成一种白色固体.
试写出上述各步反应的方程式,并写出其基本反应类型.
① ________________ ________;
② ________________ ________;
③ ________________ ________;
④ ________________ ________.
答案:
①Mg+H2SO4(稀)=MgSO4+H2↑;置换;
②H2+CuO Cu+H2O;置换;
③2H2O2H2↑+O2↑;分解;
④2Mg+O22MgO;化合
2.A、B、C、D、E是初中化学中常见的化合物,其中A为白色固体,B为无色气体,E为不溶于稀硝酸的白色沉淀,它们的关系如图所示。
请回答下列问题:
(1)白色沉淀E为:。
(2)若现象I为“生成白色沉淀”,则A的化学式可能为(写出一种即可);反应①的化学方程式为;反应②的化学方程式为。
答案:
(1)氯化银(AgCl)
(2)BaCO3;反应①BaCO3 + 2HCl === BaCl2+ H2O + CO2↑;反应②H2SO4 + BaCl2 ==== Ba SO4↓+ 2HCl
3.A、B、C、D、B、F是初中化学中常见的物质,其中A为黑色固体,D为难溶于水的蓝色固体,F为不
溶于水也不溶于稀硝酸的白色固体,其余均为溶液,它们之间存在如下转化关系:
根据上述转化关系回答问题:
(1)写出物质的化学式:D_________;E_________。
(2)写出上述关系中D转化成C的化学方程式:_________________;其基本反应类型为___________。
答案:
(1)Cu(OH)2;K2SO4
(2)Cu(OH)2+H2SO4==CuSO4+2H2O;复分解反应。
