丙酮酸脱羧酶( pyruvate decarboxylase,PDC )活性测定试剂盒说明书
丙酮酸脱羧酶的化学本质

丙酮酸脱羧酶的化学本质
丙酮酸脱羧酶是一种将丙酮酸转化为丙酮的酶。
它是一种重要的代谢酶,参与细胞呼吸、糖原代谢等生理过程。
它存在于细胞的线粒体内,属于脱羧酶家族。
丙酮酸脱羧酶由两个不同的亚单位组成,分别是E1和E2亚单位。
E1亚单位是一种由亚泊酸钙诱导的二硫键(S-S)稳定的多聚体,总共由60个亚基组成。
每个亚基含有一个催化位点(TPP位点,即硫代硬皮素),可以与丙酮酸结合。
TPP位点能够在酸性环境中促进亲电亚硫酸根(HS-S-)的形成,从而使丙酮酸脱羧。
同时,E1亚单位还能够与E2亚单位发生酰基转移反应,将脱羧后的丙酮酰结构转移至E2亚单位的空腔中。
E2亚单位是一种催化酰基转移的辅酶,由24个亚基组成。
每个亚基含有一个硫化去羟基辅基(LipoVitBd,或称为lipoyl)和一个酰化位点(CoA位点)。
LipoVitBd是具有心形结构的辅基,它可以通过催化酰基转移反应,将丙酮酰结构转移给CoA结构,形成乙酰辅酶A(Acetyl-CoA),同时再次释放出LipoVitBd辅基,以参与下一轮的反应。
丙酮酸脱羧酶的化学本质是通过两个不同的亚单位的协同作用,完成从丙酮酸到乙酰辅酶A的转化过程。
其中,E1亚单位负责催化丙酮酸的脱羧反应,E2亚单位负责催化酰基转移反应。
两个亚单位之间还需要一定的辅助因子,如硫辅酶A等。
丙酮酸脱羧酶对于细胞正常代谢的最终产物——乙酰辅酶A的合成是至关重要的,对健康和生命都有着重要的作用。
代谢木糖生产乙醇的基因工程菌研究进展

代谢木糖生产乙醇的基因工程菌研究进展洪解放 张敏华 刘 成 邹少兰 吴经才(天津大学石油化工技术开发中心,天津,300072)摘 要 木糖广泛存在于林业及农业废弃物中,木糖发酵生产乙醇是再生资源的有效利用。
文中报道了近几年来在利用基因工程菌发酵木糖生产乙醇方面的研究进展。
重点介绍了大肠杆菌、酿酒酵母、树干毕赤酵母及运动发酵单胞菌的基因改造情况。
关键词 木糖发酵,半纤维素,乙醇,基因工程第一作者:硕士研究生。
收稿时间:2004-10-25,改回时间:2004-12-06 20世纪以来人们利用石油作为主要能源和化工原料,为人类社会的发展做出了巨大贡献。
但由于大量开采,消耗过快,石油储备日趋减少,现已面临枯竭的地步。
因此,寻找新的代用品已成为刻不容缓的战略性问题。
地球上每年植物光合作用的生物量可达1145亿t ,其中大部分为木质纤维素类。
木质纤维素是纤维素、半纤维素和木质素等聚合物的复合物,其中半纤维素约占30%。
从总量上看,纤维素、半纤维素和木质素是世界上最广泛的可再生性生物资源。
木质纤维素广泛存在于林业及农业废弃物中,利用酸解或酶解的方法将木质纤维素转化为还原性糖会产生大量的五碳糖(D 2木糖和L 2阿拉伯糖)和六碳糖(葡萄糖、半乳糖和甘露糖),其中六碳糖约占2/3,五碳糖约占1/3。
而在半纤维素的水解产物中,D 2木糖约占90%。
燃料乙醇是一种清洁便捷的可再生能源,是来自可再生资源中最有发展前景的液体燃料,被纳入许多国家的发展战略规划。
木质纤维素水解产物中的六碳糖可由传统酿酒酵母很容易地发酵成酒精,而五碳糖则不能由传统酿酒酵母发酵产生乙醇。
因此,如果能找到一种可以混合糖为原料产乙醇的工程菌,理论上可使乙醇产量提高25%,从而降低生产成本。
现有的产醇发酵菌种中有些虽然具有较强的产醇能力,但可利用碳源范围窄(如运动发酵单胞菌只能以葡萄糖、蔗糖或果糖作为发酵原料;酿酒酵母亦只能利用六碳糖,不能利用五碳糖);有些虽然可利用碳源范围较广(如大肠杆菌可同时利用五碳糖和六碳糖),但产醇能力极为有限。
13-2三羧酸循环

通过与柠檬酸的羧基和羟基相互作用与柠檬酸形成复合物。顺
乌头酸酶有立体专一性,只产生一种异柠檬酸。
顺乌头酸酶是个相当复杂的酶,其中含有由4个铁原子,4个无
机硫原子及4个半胱氨酸硫原子形成的铁硫中心参与底物的去水 和加水反应。这个酶是含铁的非铁卟啉蛋白。
3.异柠檬酸氧化脱羧生成α酮戊二酸和第一个CO2 这是三羧酸循环中第一个氧化脱羧反应,反应由异柠檬酸脱 氢酶催化。
反应1: 二个碳原子以乙酰辅酶A形式进入循环
乙酰CoA与草酰乙酸缩合形成柠檬酸。 由柠檬酸合成酶催化的起始反应是一个类似于醛醇缩合的反应。
CH3
+
柠檬酸合成酶反应机制
B是酶分子中的一个碱 性氨基酸残基
负碳离子
+
柠檬酰辅酶A
乙酰辅酶A上活化的乙酰基的甲基碳在柠檬酸合成酶的作用下丢失一个质子,所产生的负 碳离子对草酰乙酸的羰基碳进行亲核攻击。 这导致缩合产生高度不稳定的柠檬酰辅酶A,可自发水解产生柠檬酸。这个反应是高度放 能的,是整个反应的调节位点。
一。
E.coli丙酮酸脱氢酶 复合体电镜照片
大肠杆菌中丙酮酸脱氢酶的分子量为4600000,是由60条多肽链组成的多面体,直径约
30nm,在电镜下可观察到复合体的存在。 二氢硫辛酸乙酰转移酶位于中心,有24条肽链。丙酮酸脱羧酶也有24条肽链,二氢硫 辛酸脱氢酶由12条肽链组成。
三羧酸循环的途径 三羧酸循环共有八步反应。
盖28埃的距离,两个硫辛酰胺臂就可连接相距56埃的两个功能基团。
第一条硫辛酰胺臂接受了酶1的二碳片段,然后以乙酰基形式转移到第二条臂,再直接转 移到辅酶A上。 带有两个巯基的还原的硫辛酰胺再由酶3氧化,酶3的FAD还原成FADH2。 这些酶(E1,E2和E3)物理上的并列可以保证反应没有不需要的副反应,不使中间物从催化 位点扩散,使反应能顺利进行。 丙酮酸脱氢酶复合体是细胞通过催化连续反应的酶的并列来最经济的实现其功能的例子之
酶的种类以及相关性质

一、氧化还原酶1、乙醇脱氢酶:系统名:乙醇:辅酶I氧化还原酶,英文名:Alcohol dehydrogenase,ADH 底物:乙醇产物:乙醛最适温度:37℃(30-40℃时酶活力较稳定,超过45℃后酶活力急剧下降)最适pH:7.0~10.0,在pH=8.0时酶活力最大Km:0.013mol/L作用:与乙醛脱氢酶构成了乙醇脱氢酶系,参与体内乙醇代谢,是人和动物体内重要的代谢酶。
作为生物体内主要短链醇代谢的关键酶,它在很多生理过程中起着重要作用。
相关病症:乙醇脱氢酶异常会使人更易酒精中毒2、乙醛脱氢酶:英文名:acetaldehyde dehydrogenase,ALDH底物:乙醛产物:乙酸最适温度:37℃左右最适pH:7.0~7.5作用:氧化乙醛为乙酸,可用于预防喝酒脸红相关病症:患有某种遗传病的人,体内无法分泌乙醇脱氢酶,酒精在肝脏处无法分解,乙醛会到达全身,喝醉即是死亡。
例如:阿什美人。
3、黄嘌呤氧化酶:英文名:xanthine oxidase底物:次黄嘌呤,黄嘌呤产物:尿酸最适温度:37℃左右最适pH:8.2Km:0.043mmol/L作用:既能催化次黄嘌呤生成黄嘌呤,进而生成尿酸,又能直接催化黄嘌呤生成尿酸。
相关病症:最近研究发现,黄嘌呤氧化酶活动异常可诱发冠心病,而且其活动异常也会导致肝病发生。
4、葡萄糖氧化酶:英文名:glucose oxidase底物:D-葡萄糖产物:D-葡糖酸最适温度:37℃,在30℃~40℃范围内较稳定最适pH:5.6,在5~7范围内较稳定Km:0.001mol/L级别作用:催化氧化D-葡萄糖为D-葡糖酸和过氧化氢5、氨基酸氧化酶:英文名:amino-acid oxidase底物:氨基酸产物:酮酸最适温度:37℃左右最适pH:7左右Km:0.0033mol/L作用:D-氨基酸氧化酶和L-氨基酸氧化酶分别催化氧化D-氨基酸和L-氨基酸为酮酸6、过氧化氢酶:英文名:catalase底物:过氧化氢产物:氧气和水最适温度:30℃~40℃最适pH:7左右Km:0.025mol/L作用:存在于红细胞及某些组织内的过氧化体中,能催化H2O2分解为H2O 与O2,使得H2O2不至于与O2在铁螯合物作用下反应生成非常有害的-OH二、转移酶1、天冬氨酸转氨基酶:英文名:aspartateaminotransferase,AST底物:天冬氨酸最适温度:37℃左右最适pH:7左右作用:是体内重要的转氨酶,在体内各组织中广泛存在,AST以心脏活性最高,正常人血清中含量甚微。
发酵乳后熟期间嗜热链球菌和保加利亚乳杆菌产乙醛特性

发酵乳后熟期间嗜热链球菌和保加利亚乳杆菌产乙醛特性白娜;于洁;王宏梅;乌仁图雅;秦艳婷;扎木苏;刘文俊;孟和毕力格;张和平【摘要】目的:分析嗜热链球菌和保加利亚乳杆菌在发酵乳后熟期间产乙醛特性,并研究乙醛合成与其关键调控基因表达量之间的关系.方法:以传统发酵乳制品中筛选出的具有优良发酵特性的嗜热链球菌和保加利亚乳杆菌为研究对象,将各试验菌株在复原全脂乳中进行单菌发酵,发酵结束后(pH4.5~4.6)于4℃冷藏后熟,测定48 h 内发酵乳中的乙醛含量;采用反转录定量PCR技术检测乙醛合成关键调控基因pdc、pdh、ald、ldh的表达特征.结果:6株嗜热链球菌产乙醛量介于2.59~14.53 μg/g 之间,6株保加利亚乳杆菌产乙醛量介于9.17~39.45 μg/g之间;乙醛合成量随着基因pdc、ald及pdh表达量的升高而增加,而与基因ldh的表达量呈负相关.结论:发酵乳后熟期间嗜热链球菌和保加利亚乳杆菌不同菌种、不同菌株乙醛产量差异显著,相同菌株在不同后熟时间产乙醛量差异明显,存在菌株特异性和时序变异性;调控基因pdc、pdh及ald具有促进乙醛合成的作用,基因ldh的表达不利于乙醛含量的积累.【期刊名称】《乳业科学与技术》【年(卷),期】2014(037)001【总页数】5页(P1-5)【关键词】发酵乳;嗜热链球菌;保加利亚乳杆菌;乙醛;调控基因【作者】白娜;于洁;王宏梅;乌仁图雅;秦艳婷;扎木苏;刘文俊;孟和毕力格;张和平【作者单位】内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018;内蒙古农业大学乳品生物技术与工程教育部重点实验室,内蒙古呼和浩特 010018【正文语种】中文【中图分类】TS252.54根据2010年我国发酵乳国家标准GB19302―2010《食品安全国家标准:发酵乳》定义,发酵乳(fermented milk)是以生牛(羊)乳或乳粉为原料,经杀菌、发酵后制成pH值较低的产品[1]。
丙酮酸羧化酶(PC)活性检测试剂盒说明书紫外分光光度法

丙酮酸羧化酶(PC)活性检测试剂盒说明书紫外分光光度法丙酮酸羧化酶(PC)活性检测试剂盒说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC0730规格:50T/48S产品内容:提取液:液体110mL×1瓶,4℃保存;试剂一:液体30mL×1瓶,4℃保存;试剂二:液体10mL×1瓶,4℃保存;试剂三:粉剂×1瓶,-20℃保存;临用前加入5mL蒸馏水溶解;可分装后-20℃保存,避免反复冻融;试剂四:粉剂×1瓶,-20℃保存;临用前加入5mL蒸馏水溶解;可分装后-20℃保存,避免反复冻融;试剂五:液体5mL×1瓶,4℃保存;试剂六:液体10μL×1支,4℃保存;试剂六稀释液:液体10mL×1支,4℃保存。
产品简介:丙酮酸羧化酶(pyruvate carboxylase,PC,EC 6.4.1.1)广泛存在于动物、霉菌和酵母的线粒体中,但在植物体和大部分细菌中却不含此酶。
是供给草酰乙酸的主要补充反应,是糖异生过程的第一个限速酶。
和水生成草酰乙酸、ADP和Pi,苹果酸脱氢酶进一步催化草酰乙酸PC不可逆的催化丙酮酸、ATP、CO2和NADH生成苹果酸和NAD+,在340nm下测定NADH氧化速率,即可反映PC活性。
试验中所需的仪器和试剂:紫外分光光度计、低温离心机、水浴锅、1mL石英比色皿、可调式移液枪、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、粗酶液提取:1称取约0.1g组织或收集500万细胞,加入1mL提取液,用冰浴匀浆器或研钵匀浆。
24℃1000g离心10min。
3将上清液移至另一离心管中,4℃11000g离心15min。
4上清液即胞浆提取物,可用于测定从线粒体泄漏的PC(此步可选做,可以判断线粒体提取效果)。
5在沉淀中加入1mL提取液,超声波破碎(功率20%,超声5秒,间隔10秒,重复12次),用于PC活性测定,并且用于蛋白含量测定。
丙酮酸脱羧酶(PDC)活性检测试剂盒说明书紫外分光光度法

丙酮酸脱羧酶(PDC)活性检测试剂盒说明书紫外分光光度法丙酮酸脱羧酶(PDC)活性检测试剂盒说明书紫外分光光度法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC1070规格:50T/48S产品内容:提取液:液体50mL×1瓶,4℃保存。
试剂一:液体36mL×1瓶,4℃保存。
试剂二:液体20mL×1瓶,4℃保存。
试剂三:粉剂×1支,﹣20℃保存。
试剂四:粉剂×1支,﹣20℃保存。
混合试剂:临用前配制,将试剂三和试剂四用适量试剂二溶解后再全部转移到试剂二中备用。
试剂五:液体5mL×1瓶,4℃保存。
产品说明:PDC主要存在于酵母中,是乙醇发酵的关键酶之一,催化丙酮酸脱羧生成乙醛。
PDC催化丙酮酸脱羧生成乙醛,添加乙醇脱氢酶(ADH)来进一步催化NADH还原乙醛生成乙醇和NAD+;NADH在340nm有吸收峰,而NAD+没有;通过测定340nm光吸收下降速率,来计算PDC 活性。
试验中所需的仪器和试剂:台式离心机、紫外分光光度计、水浴锅、1mL石英比色皿、可调式移液枪、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、粗酶液提取:1、细胞或微生物样品的制备:先收集细胞或微生物样品到离心管内,弃上清,按照每500万细胞或微生物加入1mL提取液,超声波破碎细菌或细胞(功率20%,超声3s,间隔10s,重复30次)。
10000rpm,4℃离心20min,取上清,置冰上待测。
2、组织样品:称取约0.1g组织,加入1mL提取液,冰上充分研磨。
16000g4℃离心20min,取上清,置冰上待测。
3、血清(浆)样品:直接检测。
二、测定步骤:1、紫外分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2、试剂一37℃(哺乳动物)或25℃(其他物种)水浴提前预热30min。
3、操作表:试剂名称(μL)测定管空白管试剂一700700试剂五100100混合试剂100100样本100-蒸馏水-100迅速混匀后于340nm比色,记录10s和70s的吸光值,测定管的记为A1和A2,空白管的记为A3和A4,计算ΔA=(A1-A2)-(A3-A4)。
淹水胁迫对不同丝瓜品种根系呼吸生理和通气组织的影响
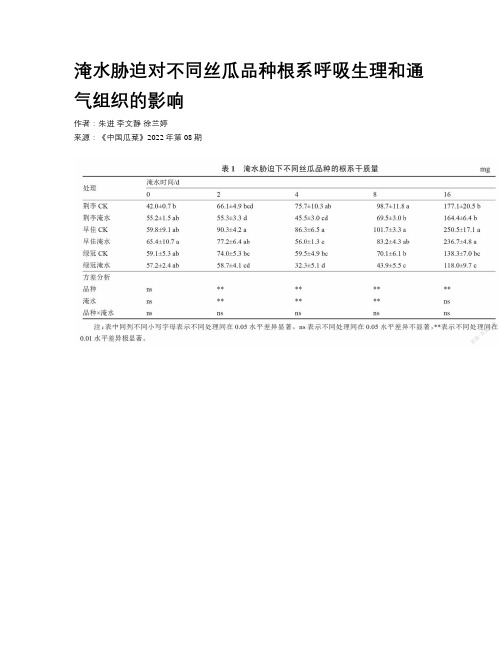
淹水胁迫对不同丝瓜品种根系呼吸生理和通气组织的影响作者:朱进李文静徐兰婷来源:《中国瓜菜》2022年第08期摘要:為筛选耐涝丝瓜砧木,探讨丝瓜耐涝机制,采用双因素完全随机设计研究了淹水胁迫对3个丝瓜品种根系呼吸生理和通气组织的影响。
结果表明,淹水胁迫4 d,3个丝瓜品种的根系干质量均显著低于对照;淹水胁迫4~16 d,3个丝瓜品种主根根系活力均显著低于对照;淹水胁迫8~16 d,3个丝瓜品种不定根的根系活力均显著高于对照。
淹水胁迫2~16 d,3个丝瓜品种主根的乳酸脱氢酶(LDH)、丙酮酸脱羧酶(PDC)活性均显著高于对照;淹水胁迫2~16 d开始,除绿冠丝瓜与对照差异不显著外,其他2个品种主根中乙醇脱氢酶(ADH)活性均显著高于对照。
3个丝瓜品种不定根中均形成了通气组织。
在淹水胁迫下,早佳丝瓜根系干质量最大,达到236.7 mg,分别比荆李和绿冠高出43.98%和100.59%;最早形成不定根,通气组织最发达;不定根的根系活力最强,达到7.73 mg·g-1·h-1,分别比荆李和绿冠高出22.40%和64.44%;不定根的PDC活性和ADH活性应急反应最快,淹水胁迫2 d就显著高于对照,分别比荆李和绿冠早2 d和6 d。
因此,3个丝瓜品种均耐淹,早佳丝瓜最耐淹水,是较理想的耐涝丝瓜砧木。
关键词:丝瓜;淹水胁迫;无氧呼吸;通气组织中图分类号:S642.4 文献标志码:A 文章编号:1673-2871(2022)08-062-08Waterlogging stress affects root respiration physiology and aerenchyma of different luffa varietiesZHU Jin1, 2, LI Wenjing1, XU Lanting1(1. College of Horticulture and Gardening, Yangtze University, Jingzhou 434025,Hubei, China; 2. Hubei Key Laboratory of Vegetable Germplasm Enhancement and Genetic Improvement, Wuhan 430070, Hubei, China)Abstract: In order to screen waterlogging-resistant luffa rootstocks and explore the mechanism of waterlogging-resistant luffa, the effects of waterlogging stress on root respiratory physiology and aerated tissue of three luffa varieties were studied by two-factor completely random design. The results showed that the root dry weight of the three varieties of luffa was significantly lower than that of the control after 4 days of waterlogging stress. After 4 to 16 days of waterlogging stress, the root activity of the main root of the three varieties of luffa was significantly lower than that of the control. Root activity of adventitious roots of the three luffa cultivars was significantly higher than that of the control during 8 to 16 days of waterlogging stress. The activity of lactate dehydrogenase (LDH)and pyruvate decarboxylase (PDC) of the main roots of the three varieties of luffa were significantly higher than those of the control during 2 to 16 days of waterlogging stress. The activity of ethanol dehydrogenase (ADH) in the main root of luffa was significantly higher than that of the control except that there was no significant difference between Lüguan luffa and the control from 2 to 16 days after waterlogging stress. Aerenchyma was formed in adventitious roots of three luffa varieties. Among the three varieties, the root dry weight of Zaojia luffa was the highest, reaching 236.7 mg, 43.98% and 100.59% higher than that of Jingli and Lüguan, respectively. Adventitious roots were first formed and aerenchyma was most developed. The root activity of adventitious roots were 7.73 mg·g-1·h-1, 22.40% and 64.44% higher than that of Jingli and Lüguan, respectively. The PDC activity and ADH activity of adventitious roots were the fastest in emergency response. The PDC activity and ADH activity of adventitious roots were significantly higher than those of the control at 2 d under waterlogging stress, and were 2 d and 6 d earlier than those of Jingli andLüguan, respectively. Therefore, the three luffa varieties are all waterlogging resistant, among which, Zaojia luffa is the most waterlogging resistant rootstock.Key words: Luffa; Waterlogging stress; Anaerobic respiration; Aerenchyma淹水胁迫是植物生长发育过程中会面临的最具有破坏性的不利环境条件之一[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
货号: QS1006 规格:50管/48样丙酮酸脱羧酶( pyruvate decarboxylase,PDC )
活性测定试剂盒说明书
紫外分光光度法
注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:
PDC主要存在于酵母中,是乙醇发酵的关键酶之一,催化丙酮酸脱羧生成乙醛。
测定原理:
PDC催化丙酮酸脱羧生成乙醛,添加乙醇脱氢酶(ADH)来进一步催化 NADH还原乙醛生成乙醇和NAD+;NADH在340 nm有吸收峰,而NAD+没有;通过测定340 nm光吸收下降速率,来计算PDC活性。
自备实验用品及仪器:
研钵、冰、台式离心机、紫外分光光度计、1mL石英比色皿、可调式移液枪和蒸馏水。
试剂组成和配制:
试剂一:液体50mL×1瓶,4℃保存。
试剂二:液体36mL×1瓶,4℃保存。
试剂三:液体5mL×1瓶,4℃保存。
试剂四:粉剂×1支,﹣20℃保存。
试剂五:液体60μL×1支,﹣20℃保存。
混合试剂:临用前配制,将试剂四和试剂五转移至试剂三中充分溶解待用,用不完的试剂分装后-20℃保存,禁止反复冻融。
试剂六:液体5mL×1瓶,4℃保存。
粗酶液提取:
1、细菌或细胞处理:收集细菌或细胞到离心管内,离心后弃上清;按照每200万细菌或细胞加入400μL试剂一,超声波破碎细菌或细胞(功率200W,工作3s,间歇10s,工作35次),16000g 4℃离心20min,取上清,置冰上待测。
2、组织处理:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆,16000g 4℃离心20min,取上清,置冰上待测。
3、血清(浆)等液体样品:直接检测。
PDC测定操作:
1. 分光光度计预热30min,调节波长到340 nm,蒸馏水调零。
2. 试剂二置于25℃水浴中预热30 min。
3. 空白管:依次在1mL石英比色皿中加入100μL蒸馏水、100μL混合试剂、700μL试剂二和100μL试剂六,迅速混匀后于340nm比色,记录15s和75s的吸光值,分别记为A1和A2。
4. 测定管:依次在1mL石英比色皿中加入100μL上清液、100μL混合试剂、700μL试剂二和100μL试剂六,迅速混匀后于340nm比色,记录15s和75s的吸光值,分别记为A3和A4。
注意:空白管只需测定一次。
PDC活性计算公式:
第1页,共2页
(1)按照蛋白浓度计算
活性单位定义:25℃中,每毫克蛋白每分钟催化1μmol NADH 氧化为1个酶活单位。
PDC (μmol/min/mg prot) ={[(A3-A4)-(A1-A2)]÷ε÷d×V总×106}÷(Cpr×V样) ÷T
=1.61×[(A3-A4)-(A1-A2)]÷Cpr
(2)按照样本质量计算
活性单位定义:25℃中,每克组织每分钟催化1μmol NADH 氧化为1个酶活单位。
PDC (μmol/min /g鲜重) ={[(A3-A4)-(A1-A2)]÷ε÷d×V总×106}÷(W×V样÷V样总) ÷T
=1.61×[(A3-A4)-(A1-A2)]÷W
(3)按细胞数量计算
活性单位定义:25℃中,每104个细胞每分钟催化1μmol NADH 氧化为1个酶活单位。
PDC (μmol/min/104cell) ={[(A3-A4)-(A1-A2)]÷ε÷d×V总×106}÷(细胞数量×V样÷V
样总) ÷T
=1.61×[(A3-A4)-(A1-A2)]÷细胞数量
(4)按血清(浆)体积计算
活性单位定义:25℃中,每毫升血清(浆)每分钟催化1μmol NADH 氧化为1个酶活单位。
PDC (μmol/min /mL) ={[(A3-A4)-(A1-A2)]÷ε÷d×V总×106}÷V样÷÷T
=1.61×[(A3-A4)-(A1-A2)]
ε:NADH摩尔消光系数,6.22×103L/mol/cm;d:比色皿光径,1cm;V总:反应体系总体积,1mL=0.001 L,V样:加入反应体系中上清液体积,0.1mL;Cpr:蛋白浓度(mg/mL),需要另外测定,建议使用本公司BCA蛋白质含量试剂盒;W:样本质量,g ;V样总:加入提取液体积,1mL;T:反应时间,1 min。
第2页,共2页。
