高三化学一轮复习 训练题:元素或物质推断题
高三化学一轮复习——元素或物质推断题
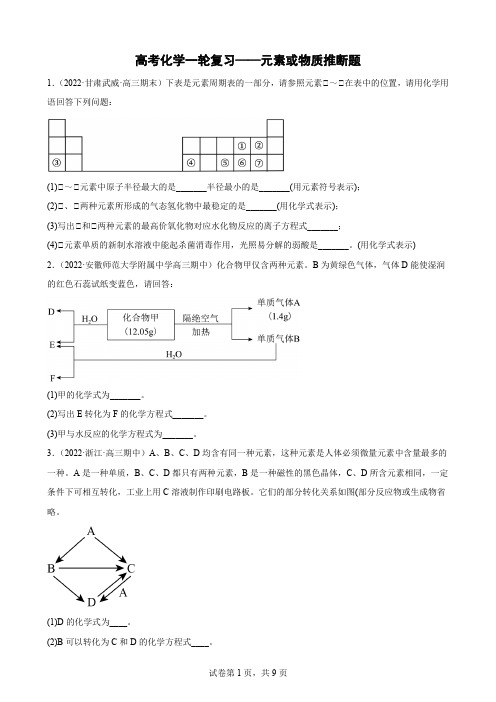
高考化学一轮复习——元素或物质推断题1.(2022·甘肃武威·高三期末)下表是元素周期表的一部分,请参照元素①~①在表中的位置,请用化学用语回答下列问题:(1)①~①元素中原子半径最大的是_______半径最小的是_______(用元素符号表示);(2)①、①两种元素所形成的气态氢化物中最稳定的是_______(用化学式表示);(3)写出①和①两种元素的最高价氧化物对应水化物反应的离子方程式_______;(4)①元素单质的新制水溶液中能起杀菌消毒作用,光照易分解的弱酸是_______。
(用化学式表示) 2.(2022·安徽师范大学附属中学高三期中)化合物甲仅含两种元素。
B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色,请回答:(1)甲的化学式为_______。
(2)写出E转化为F的化学方程式_______。
(3)甲与水反应的化学方程式为_______。
3.(2022·浙江·高三期中)A、B、C、D均含有同一种元素,这种元素是人体必须微量元素中含量最多的一种。
A是一种单质,B、C、D都只有两种元素,B是一种磁性的黑色晶体,C、D所含元素相同,一定条件下可相互转化,工业上用C溶液制作印刷电路板。
它们的部分转化关系如图(部分反应物或生成物省略。
(1)D的化学式为____。
(2)B可以转化为C和D的化学方程式____。
试卷第1页,共9页(3)工业上用C制作印刷电路板的原理用离子方程式表示为_____。
(4)检验C中阳离子的离子方程式_____。
4.(2022·浙江·高三期中)某兴趣小组对物质X(仅含2种常见元素)进行如下探究分析已知:溶液A的焰色试验为黄色,且A溶液恰好被含0.1molHCl的盐酸中和;红棕色粉末B是某铁矿石的主要成分。
请回答以下问题:(1)X中所含的金属元素是_______(填元素符号),X的化学式为_______。
高三化学一轮复习题:元素或物质推断题

高考化学一轮复习题:元素或物质推断题1.(2022·上海市吴淞中学高三期中)下列粒子(分子或离子)均含有18个电子: 粒子 +A 2-B C D E F组成特点 单核离子 化合物,双核分子 单质,双核分子 化合物,三核分子 化合物,四核分子请回答下列问题:(1)A 的元素符号是_______________,A 元素的焰色反应呈现___________色。
(2)2-B 的结构示意图是_____________,F 的水溶液常用于消毒剂,F 的化学式是__________。
(3)工业上用C 的水溶液与漂白粉混合制取次氯酸,发生反应的化学方程式为____________。
(4)E 的水溶液可以和氯气反应,生成C 和一种单质,发生反应的化学方程式为_____________。
2.(2023·江苏·常州高级中学高三期中)人类对原子结构的认识是研究物质微观结构的重要方面。
(1)1897年,英国物理学家__________发现原子中存在电子,于是提出了原子结构模型,称为__________。
(2)1~17号元素X 、Y 、Z 、W 、R 的原子序数依次增大,原子最外层电子数之和为23,其中X 、Y 、Z 三种元素的简单离子的核外电子数相同,X 与Z 在周期表中的位置如图所示,已知W 元素原子K 层和M 层电子总数等于其L 层电子数,请完成下列问题:①写出Y 元素形成的阳离子的结构示意图__________。
①写出由X 、Z 元素形成的化合物与氢氧化钾反应的化学方程式____________________。
3.(2022·福建·厦门一中高三期中)某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.11mol L -⋅(忽略水的电离)。
阳离子 K +、Ag +、2Mg +、2Cu +、4NH +阴离子Cl -、23CO -、3HCO -、24SO -、OH - 甲同学欲探究废水的组成,进行了如下实验:①、取该无色溶液5mL ,滴加一滴氨水(主要成分为32NH H O ⋅)有沉淀生成,且离子种类增加。
高考化学一轮专复习练习元素或物质推断

元素或物质推断题1.(2022·黑龙江·哈九中高三期末)下表列出了①~①所代表的十种元素在周期表中的位置,按要求填写下列空白:(1)①、①按原子个数比为3:1组成的分子的电子式_______。
当今,考古工作者是利用①的一种核素_______(请写出其核素符号)衰变测定装置,对文物进行年代的测定和研究。
①①①三种元素的简单离子半径从大到小排序_______(用离子符号表示),元素X与①同一主族,X原子比①原子多一个电子层,X的原子结构示意图为_______。
元素Y与①同一主族,位于周期表第四周期,其氢化物的化学式为_______。
(2)以下组合的原子间反应最容易形成离子键的是_______(选填A、B、C、D)A.①和①B.①和①C.①和①D.①和①非金属性最强的元素的氢化物在水中的电离方程式为_______。
(3)写出①元素的最高价氧化物与氢氧化钠溶液反应的化学方程式_______﹔磁性氧化铁溶解于元素①的氢化物的浓溶液发生反应的离子方程式为_______。
(4)高铁的快速发展方便了人们的出行,工业上利用①的单质参与的反应焊接钢轨间的缝隙,反应的化学方程式为_______。
其中①的单质发生_______(填:氧化或还原)反应。
(5)只含元素①和元素①的化合物可在野外作供氢剂。
请写出该化合物跟水反应的化学方程式_______。
1 mol 该化合物溶于足量水中完全反应,共转移_______mol电子。
2.(2022·辽宁·沈阳市第三十一中学高三阶段练习)下图表示各物质之间的转化关系。
已知:常温下B、D、F、G、I、J是气体,F、G是空气中的主要成分,D是一种碱性气体;A中阴、阳离子个数比是1:1,E是一种黑色氧化物,H是紫红色金属单质(部分生成物和反应条件省略)请按要求填空:(1)A物质是______________;X物质是________________;K物质是________________(均写化学式)(2)反应①的化学方程式是_______________________________________________;(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是__________________________;(4)反应①的化学反应方程式为__________________________________________________________,其中作氧化剂的是_________________________;(5)检验溶液A中阳离子的方法是_______________________;3.(2022·重庆八中高三期末)图为元素周期表的部分,请参照元素①-①在表中的位置,回答下列问题。
高三化学一轮专题复习-------元素或物质推断题专题训练

高考化学一轮专题复习-------元素或物质推断题专题训练1.已知A为金属单质,下列物质相互转化如图所示:试回答:(1)写出B的化学式________,D的化学式_________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中阳离子的试剂为__,写出发生反应的离子方程式____________。
(4)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式__________________,____________。
2.下表是元素周期表的一部分,表中所列序号分别代表短周期中的一种元素:①①①①①①①①①①(1)元素①的原子结构示意图是_______。
(2)元素①在周期表中的位置是_______。
(3)①①①最高价氧化物对应水化物中的碱性最强的是(用电子式表示)_______。
(4)①①①的氢化物中稳定性最好的是(用电子式表示)_______。
(5)①①的最高价氧化物对应水化物的酸性顺序(用化学式表示)_______。
(6)化合物X由①①①三种元素组成,化合物Y是元素①的最高价氧化物,将标准状况下11.2L Y通入到200mL3mol/L 的X溶液中完全被吸收。
通过计算判断所得溶液组成的化学式及质量(不用写出计算过程):_______。
3.现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见的无色无味液体,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是“84”消毒液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
请回答下列问题:(1)写出H 的化学式:_______,C 的化学式:_______。
(2)化合物A 中非金属元素的化合价是_______,物质M 的名称是_______。
高三化学一轮专题复习---元素或物质推断题专题训练

高考化学一轮专题复习---元素或物质推断题专题训练1.由两种短周期元素以原子个数比1:9组成的化合物M是一种高爆炸性物质,撞击M爆炸时发生分解反应生成气体单质A和化合物B。
8.20gB与足量NaOH溶液反应,生成4.48L(标况)能使湿润的红色石蕊试纸变蓝色的气体C;所得溶液滴加稀硫酸至过量,先产生白色胶状沉淀D,后沉淀逐渐消失。
请回答下列问题:(1)气体C的电子式为_______。
(2)M→A+B的化学方程式为_______。
(3)下列说法正确的是_______A.气体A和O2在一定条件下反应生成的氧化物能形成酸雨B.化合物B与NaOH溶液反应不属于氧化还原反应C.工业制备C时宜采用高温低压,以提高反应物的转化率D.沉淀D可溶于气体C的水溶液2.X、Y、Z、E、F五种元素的原子序数依次递增。
已知:①F位于周期表中第四周期IB族,其余的均为短周期主族元素;①E的氧化物是光导纤维的主要成分;①Y的核外电子总数是E的一半;①X与E在同一主族;①Z原子P 轨道的电子数为4。
请回答下列问题:(1)Y原子价层电子的轨道表达式(电子排布图)为___________。
(2)X、Y、E三种元素的第一电离能数值由小到大的顺序为___________。
(填元素符号)。
(3)常温下X、Z和氢元素可以形成XH2Z,该物质分子中X原子轨道的杂化类型为___________。
(4)F2+与NH3反应能生成[F(NH3)4]2+离子,[F(NH3)4]2+中的配位原子为___________(填元素符号)。
(5)1个F2Z晶胞结构如图所示,F原子个数为___________个。
晶胞中F的配位数为___________。
(6)若晶胞边长为a pm,N A为阿伏伽德罗常数,请算出该晶胞的密度ρ=___________(用a、N A表示,列出计算式即可)。
3.化合物A、B是中学常见的物质,其阴阳离子可从表中选择.阳离子K+、Na+、NH4+、Fe2+、Ba2+、Cu2+阴离子OH﹣、I﹣、NO3﹣、AlO2﹣、HCO3﹣、HSO4﹣(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则:①A中的化学键类型为_________(填“离子键”、“共价键”).①A、B溶液混合后加热呈中性,该反应的离子方程__________________________ .(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则:①A的化学式为__________________________.①经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)①._______________________.①._________________________.①请用一简易方法证明上述溶液变黄的原因_________________________.①利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_.4.原子序数依次增大的短周期主族元素a、b、c、d、e中,a的最外层电子数为其周期数的2倍;b的-2价离子比d的-2价离子少8个电子;c的+1价离子比e的-1价离子少8个电子。
高三化学一轮专题复习题—元素或物质推断题

高考化学一轮专题复习题—元素或物质推断题1.(2022·吉林吉林·高三阶段练习)“价—类”二维图是基于核心元素的化合价和物质类别研究物质。
如图是硫元素的常见化合价与部分物质类别的对应关系:(1)硫元素在周期表的位置____。
(2)A 的电子式为____。
(3)图中A 、B 、D 三种物质中,属于电解质的是____(用化学式表示)。
(4)实验室可用Cu 与E 的浓溶液反应制取D ,该反应的化学方程式为____。
(5)将D 通入酸性高锰酸钾溶液中,观察到溶液褪色,体现了D 的____。
(填标号)a.漂白性b.氧化性c.还原性(6)G 在医疗上可用作石膏绷带,关于它的用途还有____。
(填标号)a.在食品中,可用来作营养强化剂b.在工业上,可来调节水泥的硬化速率c.在美术上,可用来制作各种模型2.(2022·湖北·高三阶段练习)现有A 、B 、C 、D 、E 五种元素,其对应的原子序数(前20号)依次增大。
①A 单质可以在D 单质中燃烧,生成AD ,燃烧时火焰的颜色为苍白色;①22A B 是常见的氧化剂,且易分解;①C 单质与沸水缓慢反应,在二氧化碳中可以燃烧;①E 的原子序数=C 的原子序数+8倍A 的原子序数。
回答下列问题:(1)A 、B 、C 、D 、E 元素符号分别为____、____、____、____、____。
(2)将AD 溶液滴入碳酸钠溶液中,没有气泡产生,离子方程式为_______。
(3)请写出22A B 生活中的一种用途____;向硫酸亚铁溶液中加入22A B 溶液产生红褐色沉淀的离子方程式为_______。
(4)C 单质在二氧化碳中燃烧的化学方程式为_______。
(5)E 的氧化物有多种,其氧化物中氧元素为1 价的化学式为_______;该氧化物与水反应的化学方程式为_______。
3.(2022·河北沧州·高三阶段练习)物质之间的转化关系如图,部分生成物省略。
高三化学备考一轮复习 训练题:元素或物质推断题

高考化学备考一轮训练题:元素或物质推断题1.(2022·内蒙古赤峰·高三期末)A、B、C、D、E为原子序数依次增大的短周期元素,A是周期表中原子半径最小的元素,B是形成有机物的必备元素,C的最外层电子数是次外层的3倍,D与水能剧烈反应产生一种化合物X和H2,E的最高价氧化物的水化物是二元强酸。
(1)B在元素周期表中的位置___________;(2)B、E两元素形成的各原子均达8电子稳定结构的化合物的结构式为___________ ;(3)A和C两元素形成一种具有强氧化性的化合物Y,其电子式___________ ;(4)元素的非金属性:E____C。
(填“强于”或“弱于”),其实验依据是_____ (用化学方程式表示);(5)A、B、C三种元素可形成多种化合物,其中Z、W是生活中常见的有机物,Z是食醋的成分,一定浓度的W的水溶液可用于消毒。
Z、W和浓硫酸在加热条件下发生反应的化学方程式为____;2.(2022·四川南充·高三期末)下图是元素周期表的一部分。
根据图中标注的9种元素,用化学符号填写下列空格:族IA0周期1IIA IIIA IV A V A VIA VIIA④2④④④3④④④④④以上9种元素中,(1)单质的化学性质最不活泼的元素是_______;常温下,会在浓硫酸中发生钝化的金属是_______。
(2)金属性最强的元素是_______非金属性最强的元素是_______。
(3)最高价氧化物对应的水化物,碱性最强的是_______,酸性最强的是_______。
(4)④的原子结构示意图是_______。
(5)④的最高价氧化物的电子式是_______,其所含化学键类型为_______(填“极性键”或“非极性键”)。
(6)④和④分别形成的最简单氢化物更稳定的是_______。
(7)④的最高价氧化物形成的水化物与④的最高价氧化物反应的离子方程式为_______。
2023届高三化学一轮复习 训练专题——元素或物质推断题

2023届高考化学一轮训练专题——元素或物质推断题1.(2022·河南郑州·一模)Q、W、X、Y、Z 是位于不同主族的五种短周期元素,其原子序数依次增大。
①W 的氢化物与W 最高价氧化物对应水化物反应生成化合物甲。
①X、Y、Z 的最高价氧化物对应水化物之间两两反应均可生成盐和水。
①常温下,Q 的最高价气态氧化物与化合物X2O2发生反应生成盐乙。
请回答下列各题:(1)甲的水溶液呈酸性,用离子方程式表示其原因____________________________________________________________________________。
(2)①中反应的化学方程式为_________________________________________________________________________________________。
(3)已知:ZO3n-+M2++H+→Z-+M4+ + H2O(M 为金属元素,方程式未配平)由上述信息可推测Z 在周期表中位置为____________________________________________________________________________________。
(4)Y 形成的难溶半导体材料CuYO2可溶于稀硝酸,同时生成NO。
写出此反应的离子方秳式_____________________________。
2.(2022·上海杨浦·一模)科学家合成了一种新化合物(如图所示),其中X、Y是第三周期的非金属元素,各原子均满足8电子稳定结构。
完成下列填空:(1)硅原子最外电子层有________种运动状态不同的电子,占据______个轨道。
(2)由题意可推知Y是Cl,推得此结论的依据是__________________。
X和Si之间共用电子对偏离________。
(3)SiCl4和CCl4分子空间结构相同,则SiCl4中键角是_________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学一轮训练题:元素或物质推断题1.(2022·江西省丰城中学高三期中)已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:回答下列问题:(1)请写出YM的电子式:_______。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______。
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:_______。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
下列有关说法正确的是_______。
a. Ga位于元素周期表第四周期IV A族b. GaN为新型无机非金属材料c. Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强d. 酸性:H3AsO4>H3PO4>HNO3(5)YZM4是有机合成的重要还原剂,其合成路线如图所示利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为_______。
①现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是_______(填编号)。
①取样品ag,若实验测得氢气的体积为V L(标准状态),则YZM4样品纯度为_______(用代数式表示)。
2.(2022·上海交大附中高三期中)A、B、C、D、E五种元素的原子序数均小于18,其原子的电子层结构的信息如下表,请根据信息回答下列问题:(1)C 的元素名称是_______。
(2)元素B 形成的正离子的结构示意图_______。
(3)元素E 负离子的电子式可能是_______、_______(4)写出比A 离子的电子少8个的两核负离子和五核正离子的化学式_______、_______(5)元素D 与氮元素形成化合物的化学式32D N ,将此化合物投入水中,发生复分解反应,此反应的化学方程式是_______。
(6)若将32D N 投入50 mL 1.8 mol/L 盐酸中,生成两种盐。
写出该两种盐的化学式:_______、_______ (7)向23B CO 溶液中逐滴加入4BHSO 溶液,未看到有气泡产生,但溶液中()23n CO -减小,此过程中反生的化学方程式是_______。
继续滴加4BHSO 溶液,有气体放出,写出此时反生的化学方程式:_______。
3.(2022·广东·华南师大附中高三期中)利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。
回答下列问题:(1)丙的化学式为_______;丁属于_______(“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是_______(填化学式);根据氯元素的化合价判断,乙物质的性质_______(填标号)。
a.只有氧化性b.既有氧化性又有还原性c.只有还原性(3)物质己的化学式为HClO 4,电解甲溶液制备己的化学反应为:22H O H +−−−→+↑通电甲已(未配平),配平后参与反应的甲与H 2O 的微粒个数之比是_______。
(4)庚是家庭中常用消毒液的有效成分NaClO ,用乙制取庚的化学方程式为_______。
庚与洁厕灵(主要成分盐酸)同时使用会产生有毒的氯气,写出反应的离子方程式:_______。
(5)辛在MnO 2催化下受热分解可用于制备氧气,每生成1.204×1024氧气分子,转移e -的个数为_______ (6)工业上可以用草酸(H 2C 2O 4,二元弱酸)还原辛的方法生产丙,草酸被氧化为CO 2,请写出该反应的离子方程式_______。
4.(2022·河南许昌·高三阶段练习)已知A 是生产生活中用量最大的金属,B 为淡黄色粉末。
在常温下C 为无色液体,E 、G 、H 、I 、J 为气体,其中H 为黄绿色,其它为无色。
J 能使湿润的红色石蕊试纸变蓝(图中部分产物略去) 请填写下列空白:(1)写出化学式:D_______,K_______。
(2)写出①的离子方程式_______。
(3)反应①不属于下列何种反应类型_______(填字母序号)。
A .化合反应B .氧化还原反应C .离子反应D .置换反应(4)常温下,H 与过量的J 反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式_______。
5.(2022·浙江嘉兴·高三期中)有A 、B 、C 、D 四种物质的溶液,在进行焰色试验时,火焰都呈黄色,它们之间可发生如图所示的转化。
(1)B物质的化学式为_______。
(2)C物质为钠盐,所属类别为_______。
A.酸式盐B.碱式盐C.正盐(3)D转化为A的离子方程式_______。
(4)下列说法不正确的是_______。
A.A与C能进行化学反应B.上述反应均不属于氧化还原反应C.往固体B中加少量水,会发生放热现象D.等质量的B和C与足量盐酸反应,产生的二氧化碳一样多6.(2022·新疆·乌鲁木齐市第六十八中学高三期中)①.下列图示中,A为一种常见的单质,B、C、D、E 是含A元素的常见化合物,它们的焰色反应均为黄色。
请填写下列空白:(1)以上反应中,不属于氧化还原反应的有_______(填写编号)。
(2)写出A→C反应的化学方程式:_______,C和E反应的离子方程式:_______。
①.某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成;设计了下图的实验装置。
B中盛有饱和碳酸氢钠溶液,E为收集氧气装置。
(3)装置A中盛放盐酸的仪器名称是_______,装置C中盛放的试剂是的_______(4)指出装置E的错误_______。
(5)若有标准状况下6.72L的氧气生成,此时反应中转移的电子的物质的量为_______。
7.(2022·四川·高三竞赛)①.颜料是指不溶解、只能以微粒状态分散于粘合剂中的着色剂。
颜料混合时的三原色是红、黄、蓝,通过三原色可以调出其他所有颜色。
物质A ,B ,C 的溶液颜色类似于这三种颜色。
含铁物质X 与HSCN 和NaSCN 反应得到A(反应①),将固体A 置于浓24H SO 上方,会逐渐失去9分子结晶水(失重23.51%)。
X 与含铁物质Y 以及KOH 反应得到B(反应①),X 与HCl 反应得到C(反应①),固体C 为六水合物,其无水形式可以由单质反应生成。
含铁的物质X 和Y 可以反应生成不溶于水的蓝色物质Z(()Fe 45.50%ω=,反应①)。
1.000gY 可以得到1.327gZ ,用相同质量的Y 可以得到1.42gB .Y 在空气中放置也会生成Z ,同时产生剧毒物质(反应①)。
(1)①推出物质A ,B ,C ,X ,Y ,Z 的化学式,A______,B______,C______,X______,Y______,Z______ ①写出反应①、①、①、①的方程式。
①______,①______,①______,①______ (2)指出物质A 、B 、C 的颜色。
A______,B______,C______,①.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。
2Ni(OH)、227K Cr O 、()32Pb CH COO 分别经一步反应生成D(青绿色,反应①)、E(紫色,反应①)、F(黄色,反应①)。
化合物D ,E ,F 的颜色类似于将红,绿,蓝色的光两两混合后得到。
物质D 和E 为结晶水合物,F 为不含氧的二元化合物,其金属元素的质量分数为44.95%。
物质D(()ωH =3.27%,()ωC =13.00%)的溶液能与银氨溶液发生反应(反应①)。
物质E 为复盐,50g2.50%的E 溶液与过量硝酸钡溶液反应,生成1.165g 不溶于酸和碱的白色沉淀。
(3)①通过计算和推理写出物质D 、E 、F 的化学式。
D______,E______,F______, ①写出反应①的方程式。
______(4)对物质D ,E ,F ,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。
______,8.(2022·湖南·雅礼中学高三期中)A~H 为中学化学中常见的物质,转化关系如下图所示,其中圆圈“○”内物质是化合物,方框“□”内的物质是单质,A 为医学上治疗胃酸过多的一种药剂,G 为淡黄色固体,C 在通常状况下为无色液体。
请回答下列问题: (1)C 的化学式为_______。
(2)反应①①①①中_______(填序号)属于氧化还原反应。
(3)在反应①中,每生成1个E,该反应转移电子_______个;列举G物质的一个用途_______。
(4)检验H中阳离子的常用方法和现象:_______。
(5)写出下列反应的离子方程式:A与少量澄清石灰水反应:_______。
(6)若固体D中混有少量的A,请用化学方程式表示提纯D的方法:_______。
9.(2022·陕西·延安市第一中学高三期中)现有部分短周期元素的性质或原子结构如表:(1)元素X的一种核素可用于测定文物年代,这种核素的符号是_______。
(2)元素Y与氢元素形成一种离子YH+4,写出某溶液中含该微粒的检验方法:_______。
(3)元素Z与元素T相比,原子得电子能力较强的是_______(用元素符号表示),下列表述中能证明这一事实的是_______(填序号)。
①常温下Z的单质和T的单质状态不同;①Z的氢化物比T的氢化物稳定①一定条件下Z和T的单质都能与氢氧化钠溶液反应(4)探寻物质的性质差异性是学习的重要方法之一。
T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是_______(填化学式),理由是_______。
10.(2022·河南·油田第一中学高三阶段练习)将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、SO24-、OH-、CO23-和Cl-,取该溶液进行如下实验:I.取少量溶液滴入紫色石蕊试液,溶液呈蓝色。
II.取少许溶液滴入BaCl2溶液,无白色沉淀产生。
III.取少许溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。
IV.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
