电解质和非电解质ppt
合集下载
【人教版】高中化学必修一:2.2.1《电解质和非电解质》ppt课件

目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
2.电解质的判断 (1)从物质分类角度:电解质与非电解质都属于化合物。单质、混 合物既不是电解质,也不是非电解质。 (2)从物质性质角度:电解质在一定条件下能导电。电解质导电的 条件是电解质溶于水或熔融状态,二者具备其一即可。有些电解质 溶于水导电,但熔融状态下不导电,如HCl气体;有些电解质只在熔 融状态下才能导电,如Al2O3。 (3)溶于水能导电的化合物不一定是电解质。如CO2水溶液能导 电,但不是CO2分子本身直接电离产生离子,而是它与水反应生成的 H2CO3电离出自由移动的离子而导电,H2CO3是电解质,CO2是非电 解质。 (4)某化合物是否属于电解质与溶解性无关。如蔗糖易溶于水,但 蔗糖是非电解质;BaSO4、CaCO3难溶于水,但它们是电解质。
一二三
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
三、电离和电解质溶液导电的关系 电解质在水溶液中发生了电离,产生了能够自由移动的离子,离
子带正、负电荷,在外加电场作用下发生定向移动,从而导电。
-8-
M 第1课时 电解质和非电解质
目标导航
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
三、电离方程式的书写要点 1.质量守恒:“ ”两边原子种类、数目、质量不变。 2.电荷守恒:正电荷总数=负电荷总数。 3.电离过程中,原子团并不拆开。 4.元素或原子团的正价数等于形成的阳离子所带的正电荷数。 同理,元素或原子团的负价数等于形成的阴离子所带的负电荷数。 离子的个数用阿拉伯数字标在离子符号之前。
电解质和非电解质 课件

知识点 2 电解质的电离与溶液的导电性
【例题2】 下列叙述正确的是( ) A.NaCl溶液在电流作用下电离成Na+和ClB.NaCl是电解质,故NaCl晶体能导电 C.氯化氢溶于水能导电,但液态氯化氢不能导电 D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液 里自由移动离子数目多 解析:NaCl固体溶于水,在水分子的作用下,电离出自由移动的Na+ 和Cl-,而不是电流的作用,A错误;NaCl是电解质,但晶体中Na+和Cl不能自由移动,故NaCl晶体不导电,B错误;HCl液态时不导电,但溶 于水能电离出H+和Cl-,故C正确;溶液导电性强弱与离子的浓度和 离子所带电荷多少有关,而非离子数目,D错误。 答案:C
CO2和SO2的水溶液均导电,它们是电解质吗? 提示:不是。电解质必须是在水溶液里或熔融状态下自身发生电 离的化合物,而CO2和SO2的水溶液之所以导电,是因为它们与水反 应生成了电解质H2CO3和H2SO3,所以CO2和SO2是非电解质。
二、电解质的电离
1.定义
电解质在水溶液里或熔融状态下离解成自由移动离子的过程。
三、电离方程式的书写要点 1.质量守恒:“ ”两边原子种类、数目、质量不变。 2.电荷守恒:正电荷总数=负电荷总数。 3.电离过程中,原子团并不拆开。 4.元素或原子团的正价数等于形成的阳离子所带的正电荷数。 同理,元素或原子团的负价数等于形成的阴离子所带的负电荷数。 离子的个数用阿拉伯数字标在离子符号之前。
点拨电解质的电离与是否有外加电流没有关系,电解质电离的外 部条件是将电解质溶于水或者将电解质熔化。
知识点 3 电离方程式的书写
【例题 3】 下列电离方程式书写正确的是( )
A.NaOH B.NaOH
电解质和非电解质课件

03
CHAPTER
非电解质的分类和特性
有机非电解质
有机非电解质是指分子结构中不含离 子键的有机化合物。
有机非电解质的溶解性通常与溶剂的 性质有关,它们在水中具有一定的溶 解度,但在有机溶剂中的溶解度更大 。
这类化合物通常由碳、氢、氧、氮等 元素组成,常见的有机非电解质包括 乙醇、乙酸、蔗糖等。
有机非电解质在化学反应中通常表现 出较弱的酸性或碱性,因此对酸碱指 示剂的颜色变化不明显。
电解质的电离平衡
总结词
在一定条件下,电解质在水中电离和结合成离子的速率相等 ,达到动态平衡状态,称为电离平衡。
详细描述
当电解质在水中电离时,会有一部分离子重新结合成分子。 在一定的温度下,电离和结合的速率相等,溶液中的离子浓 度不再发生变化,此时达到电离平衡状态。温度、浓度等因 素会影响电解质的电离平衡状态。
非电解质
非电解质是指在溶液或熔融状态 下不能导电的化合物。
分类
电解质分类
强电解质和弱电解质。
非电解质分类
有机非电解质和无机非电解质。
特性
电解质特性
在溶液中能电离出自由移动的离子, 具有导电性。
非电解质特性
在溶液中不能电离出自由移动的离子 ,不具有导电性。
02
CHAPTER
电解质的分类和特性
强电解质
联系
都属于化合物
电解质和非电解质都是化合物,不是单质或混合物。
水溶液中可能存在电离平衡
电解质在水中可以发生电离,形成自由移动的离子;非电解质在水 中可能也会发生某种程度的电离或水解。
都可能具有导电性
某些非电解质在特定条件下,如溶解在有机溶剂中,也可能表现出 一定的导电性。
应用场景
电解质和非电解质PPT课件
在溶液中 的存在形
式
本身能电离
阴阳离子 可能存在分子
本身不能电离 只有分子
包含的物质种 类
非金属氧化物、某 酸、碱、盐、水、 些非金属氢化物 活泼金属氧化物 (如: NH3 )、绝
大多数有机物(如 酒精、蔗糖)等
课堂练习二
判断正误
(1)NaCl溶液导电,所以NaCl溶液是电解质;
(2)固体NaCl不导电,但NaCl是电解质;
氯化钠溶液导电性实验
几种物质的导电性试验结果
物质
状态 水溶液 熔化状
态
食盐 NaCl
能 能
氢氧 化钾 KOH
能
能
氯化 氢 HCl 能
不能
一、电解质
1、电解质:在水溶液里或熔融状态
下能够导电的化合物叫做电解质。
联想·质疑
问题1 金属导电的原因是什么?
金属导电是因为存在自由移动 的电子。
联想·质疑
是 ③⑨
;
(3问题1 身体有汗的人为何接触使
用着的电器容易发生触电事故?
汗液为电解质溶液可导电,所以 易发生触电事故。
问题2 1、电离与通电有关吗?
2、电离的条件。 答:1、电离与通电与否无关。 2、溶于水或熔融可导致电离。
课后作业
课课练p6
谢谢!!!
蔗电解质非电解质相同点本质区别在溶液中的存在形本身能电离本身不能电离阴阳离子可能存在分子只有分子活泼金属氧化物非金属氧化物某些非金属氢化物大多数有机物如酒精蔗糖等化合物化合物课堂练习二判断正误1nacl溶液导电所以nacl溶液是电解质
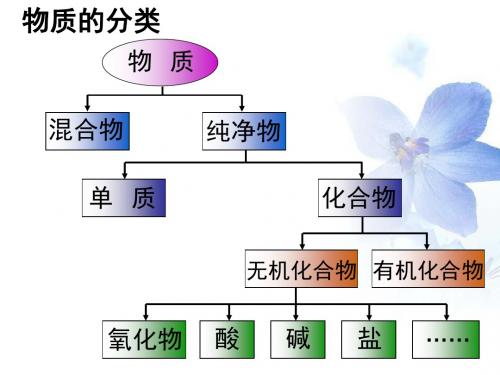
物质的分类
物质
混合物
纯净物
单质
化合物
无机化合物 有机化合物
氧化物 酸 碱 盐 ……
高一化学电解质与非电解质精品PPT课件
两天之后,天上果真降下大雨,村民都纷纷来朝拜石佛,而把右边的石头当成了台阶,踩踏跪拜,夜深的时候,两块石头开始了他们的对话。 右边石头说:我们俩同样都是一个山上的石头,论时间、外形、机会我都胜过你。而现在你却高高在上,接受人们的膜拜,这些人却踩着我的身体去朝拜你,把口水吐在我身上,太不公平了。 石佛(左边的石头)笑了笑说:兄弟:其实一切都是公平的,从小我就知道,论资质我不如你好,当我们同样被采集下山的时候,石匠说要把你雕成佛像,你怕疼不肯让身上留下凿痕,可是我就想为老百姓带来幸福和美好,要我的生命我都愿意,所以我接受了千锤百炼,才变成佛像的。
练习1:判断下列物质是否属于电解质?
HCl气体、 KNO3固体 、 CaCO3 固体 、 CO2 、NH3 、KOH溶液 、金刚石、石墨 、蔗糖、 酒精、铝
电解质: HCl气体、 KNO3固体 、 CaCO3 固体
非电解质:
CO2 、NH3 、蔗糖、酒精、
1、电解质、非电解质都是化合物。单质和混合物既 不是电解质,也不是非电解质。
①H2CO3② Ba(OH)2 ③BaSO4 ④CaCO3 ⑤ NaOH溶液 ⑥ 金属铜 ⑦ 盐酸
⑧酒精 ⑨蔗糖 ⑩ CO2 上述物质中能导电的有__⑤___⑥__⑦________
2020/1/1
有人说,人的一生是要经历许多阶段的 有一个小山村,很久很久都没有下雨了,老百姓吃完了粮食,吃草根,吃完了草根,吃树皮,到最后没有任何东西能填饱肚子,无数身边的人离开了,老人死去了,弱小的孩子死去了,村里的年青人不知如何是好。 于是他们就去找智慧老人,智慧老人说,这是对神灵的不敬,需要派人去采集光滑,有灵性,中间有缝,左右对称的卵石,取其中的一块,雕刻成佛,让石佛保佑众生,村里人都去找卵石了,采集卵石非常难,翻山、过河、找不到合适的石头,其中有一个年轻人在采集的过程中又饥又饿,年青人想放弃,躺在石头上想休息,忽然间发现,他躺得这块石头非常的光滑,左右对称,与其他的石头不一样,难道这就是孪生石?
练习1:判断下列物质是否属于电解质?
HCl气体、 KNO3固体 、 CaCO3 固体 、 CO2 、NH3 、KOH溶液 、金刚石、石墨 、蔗糖、 酒精、铝
电解质: HCl气体、 KNO3固体 、 CaCO3 固体
非电解质:
CO2 、NH3 、蔗糖、酒精、
1、电解质、非电解质都是化合物。单质和混合物既 不是电解质,也不是非电解质。
①H2CO3② Ba(OH)2 ③BaSO4 ④CaCO3 ⑤ NaOH溶液 ⑥ 金属铜 ⑦ 盐酸
⑧酒精 ⑨蔗糖 ⑩ CO2 上述物质中能导电的有__⑤___⑥__⑦________
2020/1/1
有人说,人的一生是要经历许多阶段的 有一个小山村,很久很久都没有下雨了,老百姓吃完了粮食,吃草根,吃完了草根,吃树皮,到最后没有任何东西能填饱肚子,无数身边的人离开了,老人死去了,弱小的孩子死去了,村里的年青人不知如何是好。 于是他们就去找智慧老人,智慧老人说,这是对神灵的不敬,需要派人去采集光滑,有灵性,中间有缝,左右对称的卵石,取其中的一块,雕刻成佛,让石佛保佑众生,村里人都去找卵石了,采集卵石非常难,翻山、过河、找不到合适的石头,其中有一个年轻人在采集的过程中又饥又饿,年青人想放弃,躺在石头上想休息,忽然间发现,他躺得这块石头非常的光滑,左右对称,与其他的石头不一样,难道这就是孪生石?
《电解质与非电解质》课件

电解质与非电解质的比较
电解质
能在溶液中产生离子
非电解质
不能产生离子
电解质与非电解质的溶解性
电解质
可溶于水和其他极性溶剂
非电解质
通常溶于非极性溶剂
电解质的导电性
1 电解质溶液能导电
2 非电解质不能导电
因为离子在溶液中能自由移动,带电荷的 离子能够传导电流。
因为非电解质溶液中没有离子可以传导电 流。
2 分为强电解质和弱电解质
电解质在溶液中能迅速分解成离子,并导 电。
强电解质在溶液中完全离解生成离子,如 强酸和强碱;弱电解质在溶液中只部分离 解生成离子,如弱酸和弱碱。
非电解质的特点与分类
1 不能产生离子Biblioteka 2 分为有机和无机非电解质
非电解质溶解时不会产生离子,不导电。
有机非电解质是由碳和氢组成的化合物, 如脂肪、糖类和醇类;无机非电解质是其 他类型的化合物,如水和二氧化碳。
电解质与非电解质在生活中的应用
电解质应用
用于制作电池、电解过程和水处理。
非电解质应用
用于食物加工、药物制备和化妆品生产。
《电解质与非电解质》 PPT课件
本PPT课件将介绍电解质与非电解质的定义,电解质的特点与分类,非电解 质的特点与分类,以及它们在生活中的应用。
电解质与非电解质的定义
电解质是能在溶液中产生离子的化合物,如盐类和酸碱物质;非电解质是不 能产生离子的化合物,如脂肪、糖类和醇类物质。
电解质的特点与分类
1 离子形成能力强
电解质和非电解质PPT课件
以下是氢氧化钠,氢氧化钡的电离方程 式
阳离子
阴 盐在水溶液中可电离出金属阳离子和酸根 阴离子。 zxxkw
• 盐的电离通式:盐=金属离子+酸根离子 • 以下是氯化钠,碳酸钠,硫酸铜的电离方
程式
阳离子
阴离子
2021
14
2.电解质是指化合物本质(纯净物),而不是指它的溶 液,它的溶液可称为电解质溶液(混合物)如:盐酸。
3.C它O们2 本、身SO不2 是、电NH解3等质物,而质是的非水电溶解液质虽. 然能导电,但
4.电解质本身不一定能导电,能导电的不一定是电解 质.
2021
2
【问题解决】
判断下列说法是否正确。
× A:NaCl溶液导电,所以NaCl溶液是电解质;
2021
6
书写电离方程式时应特别注意
①写出物质正确的化学式是正确书写电离方程式的 基础。
zxxkw
②要正确书写出电离的阳离子、阴离子的符号。 ③含有原子团的物质电离时,原子团应作为一个整
体,不能分开。 ④表示离子数目的数字要写在离子符号的前面, ⑤在电离方程式中,阴阳离子所带正负电荷的总数
必须相等。
电解质和非电解质
1、电解质和非电解质
zxxkw
学科网
在水溶液中或熔化状态下能导电 学.科.网 的化合物,叫做电解质。
在水溶液中和熔 化状态下都不能 导电的化合物, 叫做非电解质。
2021
1
• 电解质:酸、碱、盐、水、部分金属氧化物等 • 非电解质:多数有机物、非金属氧化物等。
• 概念理解注意点:
1.电解质必须是化合物,一切单质既不是电解质也不 是非电解质。
• ⑩蔗糖(C12H2学2科网O11)
电解质: ② ⑤ ⑧ ⑨ 非电解质: ③ ④ ⑩
阳离子
阴 盐在水溶液中可电离出金属阳离子和酸根 阴离子。 zxxkw
• 盐的电离通式:盐=金属离子+酸根离子 • 以下是氯化钠,碳酸钠,硫酸铜的电离方
程式
阳离子
阴离子
2021
14
2.电解质是指化合物本质(纯净物),而不是指它的溶 液,它的溶液可称为电解质溶液(混合物)如:盐酸。
3.C它O们2 本、身SO不2 是、电NH解3等质物,而质是的非水电溶解液质虽. 然能导电,但
4.电解质本身不一定能导电,能导电的不一定是电解 质.
2021
2
【问题解决】
判断下列说法是否正确。
× A:NaCl溶液导电,所以NaCl溶液是电解质;
2021
6
书写电离方程式时应特别注意
①写出物质正确的化学式是正确书写电离方程式的 基础。
zxxkw
②要正确书写出电离的阳离子、阴离子的符号。 ③含有原子团的物质电离时,原子团应作为一个整
体,不能分开。 ④表示离子数目的数字要写在离子符号的前面, ⑤在电离方程式中,阴阳离子所带正负电荷的总数
必须相等。
电解质和非电解质
1、电解质和非电解质
zxxkw
学科网
在水溶液中或熔化状态下能导电 学.科.网 的化合物,叫做电解质。
在水溶液中和熔 化状态下都不能 导电的化合物, 叫做非电解质。
2021
1
• 电解质:酸、碱、盐、水、部分金属氧化物等 • 非电解质:多数有机物、非金属氧化物等。
• 概念理解注意点:
1.电解质必须是化合物,一切单质既不是电解质也不 是非电解质。
• ⑩蔗糖(C12H2学2科网O11)
电解质: ② ⑤ ⑧ ⑨ 非电解质: ③ ④ ⑩
第八课电解质和非电解质(共11张PPT)
水
非电解质:多数非金属氧化物(SO2、CO2、CO等) 多数有机物(蔗糖、CH3CH2OH等)
第5页,共11页。
熔融状态下能导电化合物:
1、活泼金属氧化物
2、强碱
3、盐
第6页,共11页。
例题:
①铝 ②石墨 ③氯气 ④BaSO4 ⑤纯硫酸 ⑥氨气⑦石灰水
⑧乙醇 ⑨熔融KNO 非 极电少解数质 盐: :在 (C水H3溶C液OO和H在)2熔Pb融(醋状酸态铅下)均不能导电的化3合物
属于电解质的是 熔融状态下能导电化合物:第八课Βιβλιοθήκη 解质和非电解质④ ⑤ ⑨;
属于非电解质的是 ⑥ ⑧ ; 既不是电解质也不是非电解质的是
。
请写出H2SO4、H2CO3、Ba(OH)2、Fe(OH)3、 NaHCO3、 NaHSO4的电离方程式。
既不是电解质也不是非电解质的是 单质和混合物既不是电解质,也不是非电解质
HClO4(高氯酸)、HBr、HI等
极少数盐:(CH3COOH)2Pb(醋酸铅)
问:其中能导电的是 ① ② ⑦;⑨ 1、相同条件下:按体积比为1:2:1所组成的N2、O2、CO2;
电解质:在水溶液或在熔融状态下本身能产生自由移动的离子的化合物
①铝 ②石墨 ③氯气 ④BaSO4 ⑤纯硫酸 ⑥氨气⑦石灰水 ⑧乙醇 ⑨熔融KNO3
2、相同条件下,已知和CO组成的混合气体密度是氢气的倍; 熔融状态下能导电化合物:
① ②。③ ⑦
属于非电解质的是
;
多数有机物(蔗糖、CH3CH2OH等)
多数有机物(蔗糖、CH3CH2OH等)
电解质:在水溶液或在熔融状态下能导电的化合物
强碱:NaOH、Ba(OH)2等
第7页,共11页。
电解质
非电解质:多数非金属氧化物(SO2、CO2、CO等) 多数有机物(蔗糖、CH3CH2OH等)
第5页,共11页。
熔融状态下能导电化合物:
1、活泼金属氧化物
2、强碱
3、盐
第6页,共11页。
例题:
①铝 ②石墨 ③氯气 ④BaSO4 ⑤纯硫酸 ⑥氨气⑦石灰水
⑧乙醇 ⑨熔融KNO 非 极电少解数质 盐: :在 (C水H3溶C液OO和H在)2熔Pb融(醋状酸态铅下)均不能导电的化3合物
属于电解质的是 熔融状态下能导电化合物:第八课Βιβλιοθήκη 解质和非电解质④ ⑤ ⑨;
属于非电解质的是 ⑥ ⑧ ; 既不是电解质也不是非电解质的是
。
请写出H2SO4、H2CO3、Ba(OH)2、Fe(OH)3、 NaHCO3、 NaHSO4的电离方程式。
既不是电解质也不是非电解质的是 单质和混合物既不是电解质,也不是非电解质
HClO4(高氯酸)、HBr、HI等
极少数盐:(CH3COOH)2Pb(醋酸铅)
问:其中能导电的是 ① ② ⑦;⑨ 1、相同条件下:按体积比为1:2:1所组成的N2、O2、CO2;
电解质:在水溶液或在熔融状态下本身能产生自由移动的离子的化合物
①铝 ②石墨 ③氯气 ④BaSO4 ⑤纯硫酸 ⑥氨气⑦石灰水 ⑧乙醇 ⑨熔融KNO3
2、相同条件下,已知和CO组成的混合气体密度是氢气的倍; 熔融状态下能导电化合物:
① ②。③ ⑦
属于非电解质的是
;
多数有机物(蔗糖、CH3CH2OH等)
多数有机物(蔗糖、CH3CH2OH等)
电解质:在水溶液或在熔融状态下能导电的化合物
强碱:NaOH、Ba(OH)2等
第7页,共11页。
电解质
(一)电解质和非电解质
程式 1、Fe和CuSO4溶液反应 、 和 2、醋酸溶液与氢氧化钠溶液反应 、 3、盐酸和氢氧化钙溶液反应 、 4、硫酸和氢氧化钡溶液反应 、 5、氯气与水反应 、 6、过氧化钠与水反应 、 7、醋酸溶液与氨水反应 、 8、氯气与氢氧化钠溶液反应 、
*酸、碱、盐的溶解性: 酸 盐的溶解性 (1)除硅酸 2SiO3)外,其余酸都可溶。 除硅酸(H 外 其余酸都可溶。 除硅酸 其余酸都可溶 (2)NaOH、KOH、Ba(OH)2、NH3.H2O可 、 可 、 ( ) 溶,Ca(OH)2微溶,其余碱不溶。 微溶 其余碱不溶。 其余碱不溶 (3) 钾、钠、硝、氨盐可溶。 氨盐可溶。 盐酸盐除银盐、亚汞盐 盐酸盐除银盐、亚汞盐AgCl、Hg2Cl2 、 硫酸盐除钡盐、铅盐 硫酸盐除钡盐、铅盐BaSO4、PbSO4(CaSO4、 Ag2SO4微溶) 微溶) 碳酸、磷酸盐大多不溶。 碳酸、磷酸盐大多不溶。
四、强、弱电解质 (一)电解质和非电解质 电解质 定义 物质种类 能否电离 非电解质
在水溶液里或 在水溶液和 在水溶液里或熔化 在水溶液和熔化状 都不导电的 状态下能够导电的 态都不导电的化合 化合物 物 酸、碱、盐等化合 大多数有机化合物、 大多数有机化合物、 物及水 CO2、SO2、NH3等 能 否 只有分子
例:下列各组离子中的离子,能在溶液中大量共存 下列各组离子中的离子, 的是 ( ) A、Na+、Mg2+ 、 Cl—、OH— 、 B、H+ 、 Ca2+ 、 CO32—、NO3— 、 C、Cu2+ 、 K+ 、 SO42—、NO3— 、 D、Na+ 、 HCO3—、OH—、Ca2+ 、
*离子共存: 离子共存: 离子共存
(
)
*酸、碱、盐的溶解性: 酸 盐的溶解性 (1)除硅酸 2SiO3)外,其余酸都可溶。 除硅酸(H 外 其余酸都可溶。 除硅酸 其余酸都可溶 (2)NaOH、KOH、Ba(OH)2、NH3.H2O可 、 可 、 ( ) 溶,Ca(OH)2微溶,其余碱不溶。 微溶 其余碱不溶。 其余碱不溶 (3) 钾、钠、硝、氨盐可溶。 氨盐可溶。 盐酸盐除银盐、亚汞盐 盐酸盐除银盐、亚汞盐AgCl、Hg2Cl2 、 硫酸盐除钡盐、铅盐 硫酸盐除钡盐、铅盐BaSO4、PbSO4(CaSO4、 Ag2SO4微溶) 微溶) 碳酸、磷酸盐大多不溶。 碳酸、磷酸盐大多不溶。
四、强、弱电解质 (一)电解质和非电解质 电解质 定义 物质种类 能否电离 非电解质
在水溶液里或 在水溶液和 在水溶液里或熔化 在水溶液和熔化状 都不导电的 状态下能够导电的 态都不导电的化合 化合物 物 酸、碱、盐等化合 大多数有机化合物、 大多数有机化合物、 物及水 CO2、SO2、NH3等 能 否 只有分子
例:下列各组离子中的离子,能在溶液中大量共存 下列各组离子中的离子, 的是 ( ) A、Na+、Mg2+ 、 Cl—、OH— 、 B、H+ 、 Ca2+ 、 CO32—、NO3— 、 C、Cu2+ 、 K+ 、 SO42—、NO3— 、 D、Na+ 、 HCO3—、OH—、Ca2+ 、
*离子共存: 离子共存: 离子共存
(
)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的强电解质有哪些
(1)强酸: HCl、H2SO4、HNO3、HClO4、HBr、HI
(2)强碱: NaOH 、 KOH 、 Ba(OH)2 、 Ca(OH)2 (3)大部分盐: 如NaCl等,包括部分难溶的盐 。 如: CaCO3、BaSO4、AgCl等
2:弱电解质
在水溶液中部分电离成离子的电解质
电解质和非电解质
一、物质的分类
溶液 分散质直径小于1nm
混合物
物质
浊液 分散质直径大于1nm 胶体 分散质直径介于于1nm—100nm
纯净物
单质 化合物
电解质 非电解质
二、电解质和非电解质 1、电解质:
在水溶液中或熔融状态下能导电的化合物。 酸、碱、盐、水、活泼金属的氧化物 2、非电极质 在水溶液中或熔融状态下都不能导电的化合物。
0.1mol/L HCl
溶液pH大小
1
0.1 mol/L CH3COOH
3
相同浓度的醋酸和盐酸pH不同能说明什么? 说明盐酸和醋酸溶液中的H+浓度是不同的。
定性 定量
验证方法1:
1. 测试相同浓度的盐酸和醋酸溶液的导电 能力。 溶液导电性强弱是由什么决定的?
理论支撑:溶液导电性强弱是由溶液中自由移
动的离子浓度和离子所带电荷数目 决定的
判断依据:通过观察小灯泡的明亮度Байду номын сангаас说明 那种酸电离出的自由移动的离子的浓度大。
实验结论:相同浓度的盐酸和醋酸溶液,
盐酸的灯泡亮,盐酸溶液里的离子多。
(4) 极少量的盐 Fe(SCN)3、
四、电离和电解质溶液导电
1、电离: 电解质溶于水或在熔融状态下产生自由移动离子的 过程。 2、离子化合物,熔融状态或溶于水电离
强碱、大多数盐、活泼金属的氧化物 共价化合物中的酸,溶于水电离
3、溶液导电性分析 (1)物质导电的先决条件:
存在自由移动的电子(金属单质和石墨)或自由移动 的离子
大多数有机物、SO3、CO2,NH3等
【练习】判断以下几种说法是否正确,并说明原因
1.石墨能导电,所以是电解质。 × 2.由于BaSO4不溶于水,所以不是电解质 × 3.盐酸能导电,所以盐酸是电解质。 ×
4.Cl2、SO2、NH3、Na2O溶于水可导电,所以均为电
解质。 ×
【注意】
1. 单质
混合物
特点:微弱电离,溶液中分子多,离子少
CH3COOH
CH3COO - + H+
NH3·H2O
H2CO3 HCO3-
Fe(OH)3
NH4+ + OH-
H+ + HCO3H+ + CO32-
Fe3++ 3OH-
常见的弱电解质有哪些 (1)弱酸: 如CH3COOH、H2CO3、H2SiO3、 (2)弱碱: 如NH3.H2O、Al(OH)3、Fe(OH)3等 (3) 水
既不是电解质也不是非电解质
2.CO2、NH3等溶于水得到的水溶液能导电,但它们是 非电解质,因为导电的离子不是其本身电离出来的。
3.难溶的盐(BaSO4等)虽然水溶液不能导电,
但是在融化时能导电,也是电解质。
【学生活动】P40实验3—1,并把实验结果填到教材上
0.1mol/L HCl
与镁条反 应的现象
验证方法2:
对比实验:等体积、等浓度的盐酸、醋酸与等量 镁条的反应。
0.1mol/L HCl
0.1 mol/L CH3COOH
与镁开始反应 剧烈
现象
相对缓慢些
思考:镁条和酸的反应的实质是什么?影响
反应速率的因素是什么?反应现象说明什么 ?,H+浓度不同,说明什么?
验证方法3: 测定相同浓度的盐酸和醋酸溶液的pH
溶液的PH
速度快 1
C(H+)
0.1mol/L
电离程度 完全电离
0.1mol/L CH3COOH
速度慢
3
0.001mol/L
部分电离
三、强电解质和弱电解质 1.定义:
在水溶液中全部电离成离子的电解质。 特点:完全电离,无溶质分子
Na2SO4 =2 Na+ + SO42— NaHCO3= Na+ +HCO3—
(2)离子浓度或离子所带电荷
判断物质是离子化合物还是共价化合物
熔融状态是否导电
【思考1】
如何判断醋酸和盐酸的酸性强弱?
判断方法
对比实验:
1. 测试相同浓度的盐酸和醋酸溶 液的导电能力是否相同。
2. 观察等体积、等浓度的盐酸、醋 酸与镁条的反应的剧烈程度。
3. 测定相同浓度的盐酸和醋酸 溶溶液的pH
