视网膜色素变性(DOC)
视网膜色素变性

视网膜色素变性文章目录*一、视网膜色素变性的概述*二、视网膜色素变性的典型症状*三、视网膜色素变性的病因病机*四、视网膜色素变性的检查诊断鉴别方法*五、视网膜色素变性的并发症*六、视网膜色素变性的防治方案视网膜色素变性的概述1、定义原发性视网膜色素变性(RP),也称为毯层视网膜变性,是一种进行性、遗传性、营养不良性退行性病变,主要表现为慢性进行性视野缺失,夜盲,色素性视网膜病变和视网膜电图异常,最终可导致视力下降。
2、别称毯层视网膜变性3、发病部位眼4、传染性无传染性5、高发人群近亲结婚者的子女6、科室眼科视网膜色素变性的典型症状1、视网膜色素变性的典型症状本病特点:很早就有夜盲,暗适应减低,中心视力可保持很久,但视野逐渐缩小,及至晚期中心视力减退,视野呈管状,病人行动困难,工作和生活均感不便。
2、视网膜色素变性的分类无分类。
视网膜色素变性的病因病机目前认为视网膜色素变性是由于色素上皮内高度发育的吞噬酶系统有缺陷致使光感受器细胞外节的吞噬作用出现缺陷,影响了外节的新陈代谢,脱落的盘膜堆积,可能成为自身性抗原,发生自身免疫反应。
这种色素上皮的缺陷与遗传有关。
此外,尚有内分泌障碍,微量元素铜铁代谢异常,营养障碍及视网膜脉络膜硬化等假说。
视网膜色素变性的检查诊断鉴别方法视网膜电图(ERG)异常,通常出现在临床表现之前。
眼电图(EOG)亦不正常,甚至消失。
荧光血管造影表现为:色素上皮:在视网膜动脉前期或动脉早期出现弥漫的斑点状强荧光区。
脉络膜:造影早期可见斑块状的脉络膜毛细血管无灌注区或延迟灌注区。
视网膜血管:视网膜中央动脉充盈时间显著迟缓,血管的渗透性增强,造成视盘及其周围强荧光。
视网膜色素变性的并发症后极性白内障是本病常见的并发症。
约1%~3%病例并发青光眼,多为开角,闭角性少见。
约有50%的病例伴有近视。
聋哑病兼患本病者亦高达19.4%。
视网膜与内耳Corti器官均源于神经上皮,所以二者的进行性变性可能来自同一基因。
什么是视网膜色素变性会带来哪些症状

什么是视网膜色素变性会带来哪些症状在我们的眼睛这个精妙的器官中,视网膜扮演着至关重要的角色。
然而,有一种疾病会悄悄地侵袭视网膜,给我们的视力带来严重的影响,那就是视网膜色素变性。
视网膜色素变性,这是一种遗传性的眼部疾病,它会导致视网膜中的感光细胞逐渐受损和死亡。
简单来说,视网膜就像是我们眼睛内的“底片”,而感光细胞则是这张“底片”上的关键元素。
当这些感光细胞出现问题时,我们的视力也就会随之出现障碍。
那么,视网膜色素变性会带来哪些具体的症状呢?夜盲往往是视网膜色素变性最早出现的症状之一。
在昏暗的环境中,比如夜晚或者光线较暗的地方,患者会发现自己的视力明显下降,难以看清周围的物体。
这是因为视网膜中的视杆细胞,它们对于光线较弱的环境特别敏感,而在视网膜色素变性中,视杆细胞往往是最先受到损害的。
所以,当夜幕降临,其他人能够正常行走和活动时,患者可能会感到步履维艰,甚至需要依靠他人的帮助。
随着病情的进展,患者的视野会逐渐缩小。
想象一下,我们的视野原本就像一个宽阔的全景画面,但由于视网膜色素变性,这个画面好像被一只无形的手从四周向中心挤压。
患者可能会发现自己只能看到正前方的一小部分物体,而周围的景象则变得模糊不清,甚至完全看不见。
这种视野的缩小会严重影响日常生活,比如过马路时无法看到两侧来车,在房间里容易碰撞到家具等等。
视力下降也是不可避免的症状之一。
一开始,可能只是轻微的视力模糊,但随着时间的推移,视力会越来越差,最终可能导致失明。
这对于患者的生活和工作无疑是巨大的打击,读书、看报、看电视等日常活动都会变得异常困难。
除了上述这些主要的症状,视网膜色素变性还可能引起其他一些问题。
例如,患者对颜色的感知能力可能会下降,原本鲜艳的色彩在他们眼中变得暗淡无光。
还有,眼睛对强光的敏感度可能会增加,在阳光明媚的日子里,患者可能会感到眼睛刺痛、不适。
视网膜色素变性的症状通常是逐渐加重的,而且这个过程可能非常缓慢,以至于患者在早期很难察觉到明显的变化。
视网膜色素变性的遗传方式与早期症状

视网膜色素变性的遗传方式与早期症状*导读:视网膜色素变性病因不明,是一种视网膜神经上皮的原发性遗传性疾病。
由于视网膜外层组织,特别是视细胞层的原发性进行性营养不良及逐渐退变和消失,使视网膜色素上皮细胞及神经胶质增生所致。
随着病情的进展,视网膜血管外壁增厚,以致发生闭塞性血管硬化。
……
视网膜色素变性是一种遗传性疾病。
有三种遗传方式,即常染色体隐性遗传、常染色体显性遗传以及性连锁隐性遗传。
临床上以常染色体显性遗传与常染色体隐性遗传较为多见,性连锁隐性型少见,但损害最为严重。
临床上也有不少病例没有遗传证据。
视网膜色素变性患者早期自觉症状为夜盲,而且夜盲每多发生在视网膜出现色素病变之前。
此时检查可发现暗适应减退,视野可表现为部分的或环状暗点,这主要是由于视网膜的赤道部首先出现环状退行变性之故。
患者中心视力早期不受影响。
199视网膜色素变性的发病原因是什么,多发生于什么年龄?
视网膜色素变性病因不明,是一种视网膜神经上皮的原发性遗传性疾病。
由于视网膜外层组织,特别是视细胞层的原发性进行性营养不良及逐渐退变和消失,使视网膜色素上皮细胞及神经胶质增生所致。
随着病情的进展,视网膜血管外壁增厚,以致发生闭塞性血管硬化。
中医学认为本病的发生为先天禀赋不足,肝肾脾虚血滞,血脉枯
涩,目失所养,以致神光衰微,夜不见物,视野缩窄。
本病的发病年龄,一般多发生于10岁左右或10~20岁的青年,也有的发生较早。
什么是视网膜色素变性会带来哪些症状

什么是视网膜色素变性会带来哪些症状在我们的眼睛这个神奇的器官中,视网膜扮演着至关重要的角色,它就像一部超级相机的底片,负责接收和处理光线信息,让我们能够看清这个五彩斑斓的世界。
然而,有一种疾病却会对视网膜造成严重损害,那就是视网膜色素变性。
视网膜色素变性是一种遗传性、进行性的视网膜疾病。
简单来说,就是视网膜上的一些细胞逐渐出现了病变和功能障碍。
这种疾病通常是由基因突变引起的,而且具有家族遗传性,这意味着如果家族中有亲人患有这种疾病,那么其他成员患病的风险可能会增加。
那么,视网膜色素变性会带来哪些症状呢?这得从它对我们视觉的影响说起。
最初,患者可能会感觉到在黑暗环境中视力下降,也就是夜盲。
这是因为视网膜上负责感受暗光的细胞最先受到了损害。
想象一下,当夜幕降临,别人能轻松看清周围的环境,而患者却像走进了一个模糊不清的世界,行动变得小心翼翼。
随着病情的发展,患者的周边视力会逐渐丧失。
周边视力就像是我们眼睛的“广角镜头”,能让我们看到周围的事物而不仅仅是正前方。
当周边视力受损时,患者的视野会逐渐变窄,仿佛通过一个狭窄的管道看世界,这被形象地称为“管状视野”。
他们可能无法看到旁边的人或物体,甚至在过马路时都难以察觉两侧的车辆,给日常生活带来极大的不便和安全隐患。
不仅如此,视网膜色素变性还会影响患者的中心视力。
中心视力对于我们看清细节、阅读和辨认人脸等非常重要。
当中心视力受到影响时,患者可能会出现视物模糊、变形,甚至完全失明。
这意味着他们可能无法再欣赏美丽的风景、阅读喜欢的书籍或者看清亲人的面容,生活质量严重下降。
除了视力方面的症状,视网膜色素变性还可能导致一些其他的问题。
例如,由于视力受损,患者的平衡感和空间感可能会受到影响,走路容易摔跤或撞到东西。
在心理方面,长期的视力障碍可能会引发焦虑、抑郁等情绪问题,让患者感到孤独和无助。
此外,视网膜色素变性的症状在不同患者之间可能会有所差异。
有些患者病情进展较为缓慢,而有些则可能在较短的时间内就出现严重的视力丧失。
视网膜色素变性症状
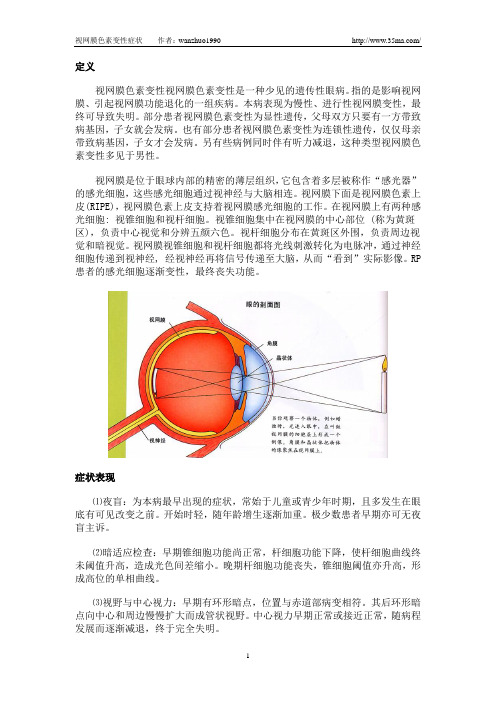
定义视网膜色素变性视网膜色素变性是一种少见的遗传性眼病。
指的是影响视网膜、引起视网膜功能退化的一组疾病。
本病表现为慢性、进行性视网膜变性,最终可导致失明。
部分患者视网膜色素变性为显性遗传,父母双方只要有一方带致病基因,子女就会发病。
也有部分患者视网膜色素变性为连锁性遗传,仅仅母亲带致病基因,子女才会发病。
另有些病例同时伴有听力减退,这种类型视网膜色素变性多见于男性。
视网膜是位于眼球内部的精密的薄层组织,它包含着多层被称作“感光器”的感光细胞,这些感光细胞通过视神经与大脑相连。
视网膜下面是视网膜色素上皮(RIPE),视网膜色素上皮支持着视网膜感光细胞的工作。
在视网膜上有两种感光细胞: 视锥细胞和视杆细胞。
视锥细胞集中在视网膜的中心部位 (称为黄斑区),负责中心视觉和分辨五颜六色。
视杆细胞分布在黄斑区外围,负责周边视觉和暗视觉。
视网膜视锥细胞和视杆细胞都将光线刺激转化为电脉冲,通过神经细胞传递到视神经, 经视神经再将信号传递至大脑,从而“看到”实际影像。
RP 患者的感光细胞逐渐变性,最终丧失功能。
症状表现⑴夜盲:为本病最早出现的症状,常始于儿童或青少年时期,且多发生在眼底有可见改变之前。
开始时轻,随年龄增生逐渐加重。
极少数患者早期亦可无夜盲主诉。
⑵暗适应检查:早期锥细胞功能尚正常,杆细胞功能下降,使杆细胞曲线终未阈值升高,造成光色间差缩小。
晚期杆细胞功能丧失,锥细胞阈值亦升高,形成高位的单相曲线。
⑶视野与中心视力:早期有环形暗点,位置与赤道部病变相符。
其后环形暗点向中心和周边慢慢扩大而成管状视野。
中心视力早期正常或接近正常,随病程发展而逐渐减退,终于完全失明。
⑷视觉电生理:ERG无反应,尤其b波消失是本病的典型改变,其改变常早于眼底出现改变。
EOG LP/DT明显降低或熄灭,即使在早期,当视野、暗适应、甚至ERG等改变尚不明显时,已可查出。
故EOG对本病诊断比ERG更为灵敏。
⑸色觉:多数患者童年时色觉正常,其后渐显异常。
视网膜色素变性病的治疗新进展

视网膜色素变性病的治疗新进展视网膜色素变性病(retinitis pigmentosa,RP)是一种遗传性视网膜疾病,其特征是视网膜色素层变性和萎缩,导致渐进性视力丧失。
该疾病是不可逆的,目前尚无根治方法。
传统治疗方法主要是辅助性治疗,如佩戴视力辅助器、使用药物、手术治疗等。
近年来,随着基因治疗和干细胞技术的发展,视网膜色素变性病的治疗也迎来了新的进展。
一、基因治疗视网膜色素变性病的发病机理与多种遗传突变相关。
因此,基因治疗成为治疗RP的新方向。
基因治疗是利用基因工程技术将正常基因或修复性基因导入病人体内,通过激活或抑制某些功能,达到治疗目的。
目前,基因治疗主要分为替换型、增强型和修复型三种。
替换型基因治疗是利用载体将正常基因导入视网膜内,使其恢复正常功能。
增强型基因治疗是增强已有基因的功能。
修复型基因治疗是通过基因编辑技术修复病变基因。
已有许多基因治疗试验证明,基因治疗是治疗RP的有效方法。
例如AVXS-201和UPC-2A等途径,均使RP患者的视力得到显著改善。
基因治疗的发展将为RP患者带来更为广阔的治疗前景。
二、干细胞技术干细胞技术也是治疗RP的新方向之一。
干细胞是一类全能性细胞,可分化成各种类型的细胞。
RP导致视网膜细胞死亡和萎缩,如果通过干细胞能够重建视网膜的组织结构,就有望恢复视力。
目前,干细胞技术主要分为胚胎干细胞和诱导多能性干细胞两类。
胚胎干细胞来源于胚胎的内细胞团,目前仍存在一些伦理和法律问题。
因此,诱导多能性干细胞成为RP治疗中备受关注的一个方向。
诱导多能性干细胞是指通过基因重编程和特定培养条件将成体细胞转化为全能性干细胞。
通过这种技术,RP患者的皮肤细胞、血液细胞等常见组织中提取的细胞就能转化为干细胞,再实现分化成视网膜细胞。
对于RP的治疗,干细胞技术的精准度和可操作性是其最大的优势。
但需要注意的是,干细胞技术更为复杂,仍存在不少技术难题待解决。
三、治疗前景目前,基因治疗和干细胞技术的发展仍处于探索阶段,临床应用还需要时间的检验和积累。
视网膜色素变性的症状和治疗方法
视网膜色素变性的症状和治疗方法视网膜色素变性是一种常见的眼疾,是指眼内的视网膜色素上皮细胞受损导致视网膜功能逐渐下降的疾病。
它常常在中老年人中发生,并逐渐影响视力。
本文将介绍视网膜色素变性的症状和治疗方法,希望对读者了解并应对此疾病有所帮助。
一、症状视网膜色素变性的症状会随着疾病的进展而逐渐显现,主要包括以下几个方面:1. 视力下降:患者会逐渐发现视力模糊,尤其是在看近距离的物体时更为明显,导致阅读困难,甚至完全看不清楚。
2. 视力下降区域:患者可能会出现中心视力模糊的情况,也就是我们常说的中央视力缺失。
这种情况会导致看东西时无法将目光集中在物体中央,而偏向物体的周围,从而影响对物体的准确观察。
3. 颜色感知异常:视网膜色素变性可能会导致对颜色的感知产生问题。
患者常常会注意到颜色变得更加黯淡,或者出现颜色浓度不均匀的情况,例如黄斑区域出现黑点。
4. 夜间视力下降:视网膜色素变性还常常导致夜间视力下降,这是由于视网膜色素上皮细胞的损伤而引起的。
患者可能会遇到夜晚行走困难、看不清楚周围物体的问题。
二、治疗方法目前,视网膜色素变性没有根治的方法,但是一些治疗手段可以帮助患者缓解症状,并延缓疾病的进展。
以下是一些常用的治疗方法:1. 药物治疗:一些抗氧化剂和维生素可以帮助保护视网膜细胞,减缓疾病的进展。
例如维生素C、维生素E、葡萄籽提取物等,这些药物可以增强眼部组织的抗氧化能力,减少对细胞的损伤。
2. 注射治疗:一些药物可以通过眼内注射的方式,直接作用于视网膜细胞,起到保护和修复的作用。
这些药物通常需要在医生的指导下进行,以确保注射技术的安全和准确性。
3. 手术治疗:对于某些严重的视网膜色素变性病例,手术治疗可能是一种选择。
例如,视网膜色素变性合并黄斑区裂孔,可以通过手术修复来提高视力。
4. 康复训练:对于已经出现视力下降的患者,康复训练可以帮助他们更好地适应生活。
通过视觉训练、辅助器具的使用等方式,提高患者的视觉功能,减少在生活中的困扰。
视网膜色素变性的原因
视网膜色素变性的原因文章目录*一、视网膜色素变性的简介*二、视网膜色素变性的原因*三、视网膜色素变性的危害*四、视网膜色素变性的高发人群*五、视网膜色素变性的预防方法视网膜色素变性的简介原发性视网膜色素变性(RP),也称为毯层视网膜变性视网膜变性,是一种进行性、遗传性、营养不良性退行性病变,主要表现为慢性进行性视野缺失,夜盲,色素性视网膜病变和视网膜电图异常,最终可导致视力下降。
视网膜色素变性的原因本病为遗传性疾病。
其遗传方式有常染色体隐性、显性与X性连锁隐性三种。
以常染色体隐性遗传最多;显性次之;性连锁隐性遗传最小。
双基因和线粒体遗传也有报道。
生物化学研究发现氨基乙磺酸缺乏可引起猫产生视网膜色素变性,氨基乙磺酸是一种含硫氨基酸,在视网膜中含量很高,有可能是一种神经介质因子,起保护作用。
铜、锌和维生素A异常也可能与RP发病有关。
也有越来越多的证据表明体液免疫和细胞免疫参与RP的发病。
Brinkman发现视网膜色素上皮变性患者的淋巴细胞可被牛的视网膜视杆细胞外节盘和人类可溶性视网膜抗原激活。
其他的免疫系统异常包括T淋巴细胞减少,免疫抑制能力下降及血清免疫球蛋白水平升高。
Hooks发现RP患者外周淋巴细胞缺乏产生γ-干扰素的能力。
因此认为RP可能是一种自身免疫性疾病。
视网膜色素变性的危害视网膜色素变性可引发青光眼,多为宽角,闭角性少见。
有人从统计学角度研究,认为青光眼是与本病伴发而非并发症。
约有50%的病例伴有近视。
近视多见于常染色体隐性及性连锁性隐性遗传患者。
亦可见于家族中其他成员。
一般从儿童青少年期就发病,有些到成年才发病,临床上有夜盲盲,视野逐渐缩小,视力逐渐下降,眼底可见视盘蜡黄,视网膜污浊,血管变细,骨细胞样色素沉着,晶体后囊浑浊,玻璃体浑浊,视神经萎缩等并发症,最后导致失明。
视网膜色素变性的高发人群遗传性疾病有显性遗传和隐性遗传之分。
显性遗传的特点是患者的父母至少有一方是该病患者,所生子女至少有1/2出现该病。
视网膜变性
视网膜变性一概述视网膜变性(retinal degeneration), 属于视锥、视杆营养不良,是一组遗传病,以夜盲、视野缩小、眼底骨细胞样色素沉着和光感受器功能不良为特征。
性连锁隐性遗传、常染色体隐性或者显性遗传均可以见到,也有散发的。
目前包括药物、手术在内的治疗手段对视网膜变性均只有改善、缓解作用。
二病因部分患者视网膜色素变性为显性遗传,父母双方只要有一方带致病基因,子女就会发病。
也有部分患者视网膜色素变性为性连锁遗传,仅仅母亲带致病基因,子女才会发病。
三鉴别诊断1.白点状视网膜变性视力正常或稍减退,可有周边视野向心性缩小,眼底特点是在视网膜上布满大小一致的白点,这些白点多位于视网膜血管后深层。
2.梅毒性脉络膜视网膜炎有梅毒病史或临床表现,可有视物变形,玻璃体混浊,眼底可见色素的分布和形态不规则,且位于视网膜血管下,看不到骨细胞样色素形态,可见视网膜脉络膜萎缩斑。
3.结晶样视网膜变性本病多在20~40岁发病,其眼底在较长时间里视神经乳头颜色正常。
视网膜血管正常,病史长者动脉可变细,后极部网膜污灰色,散布着很多结晶样,闪辉的亮晶,愈近黄斑区越密集,视网膜色素为暗褐色和不规则形,晚期脉络膜血管绽露,呈硬化状,部分患者有色觉障碍。
四检查1.视网膜色素沉着2.视网膜血管改变血管一致性狭窄,随病程进展而加重,尤以动脉为显著。
3.荧光血管眼底造影所见背景荧光大片无荧光区,提示脉络膜毛细血管层萎缩。
视网膜血管可有闭塞,有时还可见到后极部或周边部斑驳状荧光斑。
五治疗原则1.有试用血管扩张剂、维生素A及B1、组织疗法、各种激素、中草药、针灸等方法,或可避免视功能迅速恶化。
2.检查视网膜色素变性和黄斑变性患者的视网膜发现,他们的视网膜叶黄素含量比正常人低得多,实验证明,通过补充叶黄素可以增加视网膜的色素密度。
叶黄素除了可以保护视网膜免受光线和自由基的损害,还具有血管扩张的功能,打断血管狭窄进程,软化和扩张血管,改善眼底微循环。
视网膜色素变性的护理要点
视网膜色素变性的护理要点简介视网膜色素变性是一种常见的视网膜疾病,主要由于视网膜色素上皮细胞退行性改变导致。
这种疾病常常会导致视力下降,严重者可能导致失明。
因此,对于视网膜色素变性患者的护理非常重要。
本文将介绍视网膜色素变性的护理要点,希望能够帮助患者更好地管理自己的疾病,提高生活质量。
护理要点1. 定期复查视网膜色素变性的进展速度因人而异,因此定期复查非常重要。
一般建议每6个月到1年进行一次视网膜检查,以及视力测试。
这样可以及早发现病情的变化,采取相应的治疗措施。
2. 控制高血压和高血脂高血压和高血脂是导致视网膜色素变性的重要因素之一。
因此,患者需要控制自己的血压和血脂水平。
一般来说,通过饮食调理和药物治疗可以有效地控制高血压和高血脂,建议患者按时服药,并定期监测血压和血脂水平。
3. 合理饮食良好的饮食习惯对于改善视网膜色素变性患者的病情非常重要。
建议患者摄入富含维生素C、维生素E、叶酸、锌等营养物质的食物,如深色蔬菜、水果、全谷类食物和富含植物油的食物。
同时,需要减少高脂肪、高糖和高盐的食物摄入,避免熏煮食品、油炸食品以及过度加工的食品。
4. 戒烟限酒吸烟和饮酒是导致视网膜色素变性加重的危险因素。
因此,患者需要坚决戒烟限酒。
戒烟可以改善视网膜循环,减少视网膜色素变性的进展。
而饮酒过量会导致视网膜血管扩张,加剧病情。
5. 避免眼部损伤视网膜色素变性患者的视功能已经受损,因此需要特别注意保护眼睛,避免进一步的损伤。
建议患者避免用力揉眼睛,避免长时间盯着电脑、手机等电子屏幕,避免拿重物过度用力,还需注意避免受到眼部外伤。
6. 注意光照强烈的光线对于视网膜色素变性患者来说可能产生刺激和损伤。
因此,建议患者在户外活动时佩戴合适的太阳镜,避免直接暴露在阳光下。
室内也需要注意避免强烈的光源,保持适宜的照明环境。
7. 注意休息和调整心态视网膜色素变性患者的视力已经受损,因此需要更充足的休息,以减轻疲劳。
患者还需要积极调整心态,不要过分焦虑和担忧。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
视网膜色素变性的药物治疗研究进展视网膜色素变性(RP)是一组视网膜进行性营养不良性退行病变,大部分是遗传性疾病。
病理过程首先是视杆细胞的损害,其后是视锥细胞亦受到损害。
感光细胞的损害主要是通过凋亡进行的,细胞神经营养因子的缺乏是凋亡发生的一个重要原因。
RP的实质是基因缺陷导致的感光细胞及视网膜色素上皮的变性,从而引起夜盲、进行性视野缩小、视力下降、眼底特征性改变及视网膜电图波形振幅减低或熄灭。
RP是发达国家最主要的致盲原因之一,根据世界各地的调查资料,全球人口群体患病率约为1/3000~1/5000(1990年爱尔兰第六届RP会议报道)。
据此估计,全球的RP患者约有150万人,在中国约有40万人。
RP多于幼年或青春期发现,常双眼发病,也有病变仅发生在单眼者,具有遗传倾向。
本病遗传学分型可分为常染色体显性遗传、常染色体隐性遗传、X性连锁隐性遗传及散发型。
临床上以常染色体隐性遗传与常染色体显性遗传较为多见。
RP的目前主要治疗方法可分为:药物治疗(包括神经营养因子)、基因治疗、视网膜移植手术治疗等。
视网膜移植手术治疗有视网膜感光细胞、干细胞、色素上皮细胞及虹膜色素上皮细胞的移植,其治疗的技术不成熟,容易产生严重并发症,疗效亦不确切。
十余年来,数个国家的一百多例人类临床(手术)移植研究却发现术后效果并不明显[1-2],这使国际临床眼科界对用视网膜(细胞)移植手术治疗视网膜色素变性的兴趣大减,从而将研究重点转向如何延缓光感受器细胞变性、延长病人有用视力时间的临床方法研究。
基因治疗在理论上应该是最理想的治疗方法,但由于RP具有遗传异质性及多效性,因此基因改变与视网膜色素变性临床表现之间的关系非常复杂。
目前还难以阐明这种关系[3],使对该病的基因治疗难以找到切入点,因此对该病的基因治疗难以得到有关机构的批准,何况已有临床基因治疗导致病人死亡的报导[4-5],因此在解决基因治疗的切入点及安全性问题以前,临床上对视网膜色素变性的基因治疗还不现实。
目前及未来10年在临床上能真正得到应用的治疗方法,只有药物治疗。
本文就目前的临床、临床试验性及实验性药物治疗方法研究进展作如下综述。
一、维生素A维生素A是人体不可缺少的脂溶性维生素,在视网膜中Vitamin A通过其衍生物-视黄醛与视蛋白结合形成视紫红质,参与光电转化反应。
Vitamin A缺乏首先引起视杆细胞敏感度下降,并最终出现视杆和视锥细胞的外节盘膜丢失。
Maw 等[6]发现部分RP病人视网膜细胞内编码脱氢视黄醛结合蛋白的基因发生变异时,会导致11-顺-视黄醛和11-顺脱氢视黄醛不能有效地被转运,从而引起眼局部Vitamin A代谢异常。
Debra等[7]认为基因突变引起的眼局部Vitamin A代谢异常是导致RP发病的重要分子学发病机制,即Vitamin A代谢异常进一步导致视网膜细胞的氧自由基损害增加,引起感光细胞及视网膜色素上皮细胞的凋亡。
Berson等[8]对一组不同遗传型的RP病人进行Vitamin A治疗后发现表明,通过补充每日15000IU的维生素A,RP的视网膜变性(用ERG的丢失而不是视野来评估)能被延缓,且服用大剂量Vitamin A组(15000IU/d)的视网膜功能明显优于低剂量Vitamin A组(751IU/d)。
然而,每日补充400IU的维生素E与补充维生素A的病人的ERG丢失有显著统计性增加。
有证据表明,这是由于维生素E减少了到达眼部维生素A的数量(可能是通过竞争蛋白结合的结果)。
在补充维生素E而没有补充维生素A的病人中,血清的维生素A 的水平下降。
重要的是,Berson的研究也包括同时补充维生素E、A的病人。
Berson等已发表了关于维生素A与E之间竞争结合效应的预示,但没有同时涉及到这一问题的解决。
这一问题的疏忽导致了这样一个没必要的争辩,即对于RP病人不用维生素E还是联合维生素A 使用。
二、神经营养因子神经营养因子存在于神经组织内,对神经元生存、发育和凋亡有重要的调节作用[9]。
神经营养因子主要是通过抑制视网膜细胞凋亡而达到对RP的治疗效果。
现已证实眼组织内存在的神经营养因子包括:睫状神经营养因子(CNTF)、成纤维细胞生长因子(FGF)、胶质细胞源性神经营养因子(GDNF)、转化生长因子-α、β(TGF-α、β)及血小板源性生长因子(PDGE)等[10-12]。
它们主要由RPE及Muller细胞产生。
目前研究较多的是碱性成纤维细胞生长因子(bFGF)。
Faktorovich等[13]首先在Rcs鼠视网膜下腔和玻璃体内分别注射bFGF,结果表明它可以有效地挽救Rcs 鼠的感光细胞,维持时间约2个月,而且玻璃体内注射的挽救效果更好。
Perry 等[14]在Rcs 鼠玻璃体内注射不同浓度的bFGF,发现较高剂量(1000ng/ml)的保护效果最好。
尽管玻璃体内注射bFGF是有效的,但bFGF不能口服、作用时间短暂,而且高浓度的bFGF反复玻璃体内注射易导致视网膜出血和脱离、感染、白内障及新生血管形成等诸多并发症[14]。
因此,神经营养因子多与基因治疗相结合。
Akimoto等[15]应用带有CMV增强子和bFGF基因的腺病毒悬液注射到视网膜下腔的实验表明,病毒转导以较小的体内分泌量到达bFGF较大蛋白注射量的同等挽救效果,同时降低了较大蛋白注射量引起的副作用。
Lau等[16]应用带有CMV 增强子的无致病性腺相关病毒(rAA V)携带bFGF目的基因注射到转基因鼠的视网膜下腔,结果表明在注射60天后,感光细胞的外核层厚度比对照组显著要厚,病理组织学检查未发现明显的新生血管形成。
另外,为解决直接应用神经营养因子容易产生并发症这一难题,2000年有学者开始对雪旺氏细胞在视网膜变性治疗中的作用进行研究,因为雪旺氏细胞可产生几种光感受器细胞所必需的神经营养因子如碱性成纤维细胞生长因子[17]、睫状神经营养因子[18]、脑源性神经营养因子[19]等,结果显示将自体雪旺氏细胞移植到RCS鼠的脉络膜下腔可延缓光感受器细胞的变性、延长光感受器细胞的存活,光感受器细胞对光的感觉功能明显增加。
这被认为是由于雪旺氏细胞释放神经营养因子直接营养光感受器细胞及通过刺激RPE的吞噬功能而间接起作用所致[20]。
玻璃体内注射CNTF的类似物可以对感光细胞产生明显的保护作用[21]。
rd 小鼠视网膜下注射胶质细胞源性神经营养因子(GDNF)的实验表明它对感光细胞亦有保护作用[22]。
此外,脑源性神经营养因子(BDNF)、IL-1、IL-6等生长因子对RP的治疗作用,也实验报告。
三、抗凋亡药物Tatton等人[23]发现抗帕金森病药物eldepry1的代谢物desmethldeprenyl能引起bcl-2的过量表达和bax基因的抑制。
bcl-2的过量表达也就是bcl-2蛋白量的提高,通过bcl-2蛋白粘附到线粒体膜外而抑制PTP的开放来抑制凋亡。
另一个抗凋亡物质即环胞霉素A也通过类似机制起作用。
研究表明eldepry1的应用浓度大约为1-2mg/100Kg/天,也就是治疗帕金森病浓度的1/10。
在Berkeley和加利佛尼亚技术学院的一个联合研究中发现了在RP转基因模型中bcl-2的过量表达能预防或是减慢凋亡[24]。
根据这些发现,看来应用1-2mg/100Kg/天剂量的deprenyl可以通过抑制凋亡而对RP有作用。
测试这一假说的临床研究正在被Ianus基金计划[25]。
四、氨基乙磺酸(牛磺酸)氨基乙磺酸是一种氨基硫酸盐,在视网膜中含量很丰富,主要存在于RPE 及感光细胞中。
它对视网膜的发育、正常结构和功能维护有重要的生理作用。
Lombardini JB[26]研究表明,视网膜中氨基乙磺酸的作用包括:①保护感光细胞。
视杆细胞外节中的氨基乙磺酸对光及化学物质有屏蔽作用,也可以抵抗感光细胞的氧自由基反应。
②调节Ca2+运输。
它在有或无ATP的情况下都能调节的Ca2+外流。
③控制信号转导。
它对蛋白质的磷酸化有抑制作用。
Okada M,等[27]检测了4-23周龄的RCS鼠视网膜中的多巴胺、乙酰胆碱、γ-氨酪酸及氨基乙磺酸的浓度,结果表明RCS鼠视网膜中的氨基乙磺酸的浓度下降可能是视网膜细胞变性最早期的病理生理迹象。
Pasantes-Morales H等[28]的临床治疗研究表明,对RP 病人应用氨基乙磺酸能降低视野缩小的速率。
五、二十二碳六烯酸(DHA)DHA是人体中一种有重要功能的长链不饱和脂肪酸,其前体物质-α亚麻酸在体内不能合成,只有从外界直接摄取。
DHA具有的高度不饱和性直接影响生物膜的流动性,进而影响蛋白质活性、生物信号传递及受体功能。
DHA在视网膜中含量很丰富,主要存在于视杆细胞的外节中。
有研究者观察到在各种遗传型RP 病人血浆中的DHA浓度下降[29]。
红细胞磷脂膜中的脂肪酸含量最能反映神经细胞中的脂肪酸含量。
特此,Simonelli F,等[29]对RP病人红细胞中的DHA进行研究表明,红细胞磷脂膜中的脂肪酸含量减少是脂质代谢异常的指示,能破坏视网膜细胞膜的完整性。
有研究者认为视杆细胞外节中的DHA含量下降是由于基因突变导致代谢异常的结果[30]。
但近来对P23H鼠给予DHA治疗的研究表明,虽然视杆细胞外节中的DHA含量提高了,但感光细胞的功能并没有改变[31]。
六、钙离子通道阻滞剂Ca2+通道阻滞剂作为防治心血管疾病的有效药物广泛应用于临床,在青光眼的视神经保护药物中,也正被广泛研究。
Ca2+通道阻滞剂可以直接阻断神经细胞的钙离子通道,并可通过松弛视网膜血管平滑肌、扩张血管,改善视网膜的血流灌注,从而阻断缺血所诱发的细胞凋亡,还可以加快视网膜局部代谢产物的清除,达到挽救感光细胞的目的。
在RP动物模型中,目前研究较多的是地尔硫卓(diltiazem)。
Rd鼠是由于编码视杆细胞cGMP磷酸二酯酶β亚单位的基因突变,cGMP无法水解,局部浓度过高而引起感光细胞凋亡。
正常生理条件下,开放的cGMP门控Ca2+通道数量很少,因此通过该通道进入细胞内的Ca2+量很少[32]。
cGMP浓度增加时,导致cGMP门控Ca2+通道大量开放,过多的Ca2+进入细胞质中,从而导致线粒体内Ca2+增加,进一步引起线粒体大孔(PTP)的开放,线粒体向细胞质内释放细胞色素C及其他能激活凋亡的酶蛋白,触发细胞的凋亡[33-34]。
有报道称对Rd鼠腹腔注射地尔硫卓,结果表明视网膜内残留视杆和视锥细胞数量、ERG 中的a和b波振幅均较对照组增多[35]。
但最近Pearce-Kelling SE等[36]的对PDE6B 基因突变的狗RP模型应用地尔硫卓治疗实验结果表明,用ERG 和组织病理学检测,并没有发现地尔硫卓对感光细胞有积极的作用。
