写出下列反应的化学方程式共20页
有机化学方程式汇总(详)

39. 乙醇脱水(分子内、分子间) CH3CH2OH
CH2=CH2 ↑+H2O(消去反应)
2CH3CH2OH 浓 H2SO4 CH3CH2—O—CH2CH3+ H2O (取代反应)
140℃
40. 苯酚的电离方程式
电离 OH
O- + H+
41. 苯酚与 NaOH 溶液反应
OH + NaOH
ONa + H2O
4. 甲烷的热分解 CH4 高温 C+2H2
5. 烷烃的热分解 C4H10 △ C2H4+C2H6 C4H10 △ CH4 + C3H6
6. 乙烯实验室制法 CH3CH2OH
H2O + CH2=CH2 ↑
(浓硫酸:催化剂,脱水剂)
7. 乙烯的燃烧
点燃
CH2=CH2 + 3O2
2CO2 + 2H2O
8. 乙烯通入溴水中 CH2=CH2 + Br2
19. 乙炔通入溴水中 HC CH + Br Br
HCCH Br Br
1, 2 - 二溴乙烷
HCCH + Br Br
Br Br
Br Br HCCH
Br Br
1, 1 , 2 , 2 - 四溴乙烷
20. 乙炔与氢气的加成反应
催化剂 HC CH+ H2 △ H2C CH2
21. 乙炔水化制备乙醛
O
催化剂
NO2 2,4,6-三硝基甲苯
(TNT)
32. 甲苯和氢气的加成反应
CH3
CH3
Ni + 3 H2 △
33. 溴乙烷水解 CH3CH2Br + NaOH H2O,△ 4. 溴乙烷消去反应 CH3CH2Br +NaOH 醇 CH2=CH2↑ + NaBr + H2O
写出下列反应的化学方程式:(1)...

(2010?昆明)写出下列反应的化学方程式:
(1)二氧化碳和水反应;
(2)电解水;
(3)一氧化碳高温还原磁铁矿(主要成分Fe3 O4);
(4)乙烯(C2H4)燃烧生成二氧化碳和水;
(5)向空中播撒碘化银(AgI)微粒可进行人工降雨,碘化银在光照条件下可分解为碘单质(I2)和银单质.
【答案】分析:(1)根据二氧化碳和水会发生化合反应生成碳酸进行书写,
(2)根据水在通电的条件下生成氢气和氧气进行书写,
(3)根据一氧化碳还原氧化铁的原理书写方程式,
(4)根据有机物燃烧会生成二氧化碳和水进行书写,
(5)根据碘化银分解的原理进行书写.
根据题中给出的叙述确定反应物、生成物以及反应条件,依据书写方程式的原则进行书写方程式.
解答:解:(1)二氧化碳和水反应生活成碳酸,所以方程式为:CO2+H2O=H2CO3,
(2)水在通电的条件下生成氢气和氧气,所以方程式为:2H2O2H2↑+O2↑,
(3)一氧化碳和四氧化三铁在高温的条件下生成铁和二氧化碳,所以方程式为:4CO+Fe3O43Fe+4CO2,
(4)反应物是乙烯和氧气,生成物是水和二氧化碳,反应条件是点燃,所以方程式为:C2H4+3O22CO2+2H2O,
(5)反应物是碘化银,生成物是银和碘单质,反应条件是光照,所以方程式为:2AgI2Ag+I2.
点评:依据题中所给的条件书写方程式是考试的热点问题,在平时的学习中要加强这方面的记忆.。
初中化学总化学方程式

初中化学总化学方程式
1. 化合反应(Combustion Reactions)
镁在空气中燃烧:
12Mg + O₂→ 2MgO
铁在氧气中燃烧:
13Fe + 2O₂→ Fe₃O₄
氢气在空气中燃烧:
12H₂ + O₂→ 2H₂O
硫磺在空气中燃烧:
1S + O₂→ SO₂
红磷在空气中燃烧:
14P + 5O₂→ 2P₂O₅
碳充分燃烧:
1C + O₂→ CO₂
碳不充分燃烧:
12C + O₂→ 2CO
2. 分解反应(Decomposition Reactions)
水电解分解:
12H₂O → 2H₂↑ + O₂↑(通电条件下)
3. 酸碱反应(Acid-Base Reactions / Neutralization Reactions)
盐酸与氢氧化钠反应:
1HCl + NaOH → NaCl + H₂O
稀硫酸与氢氧化钡反应生成沉淀:
1H₂SO₄ + Ba(OH)₂→ BaSO₄↓ + 2H₂O 4. 金属与非金属或酸的反应
铁与稀盐酸反应:
1Fe + 2HCl → FeCl₂ + H₂↑
镁与稀盐酸反应:
1Mg + 2HCl → MgCl₂ + H₂↑
锌与稀硫酸反应:
1Zn + H₂SO₄→ ZnSO₄ + H₂↑
5. 其他类型反应
二氧化碳通过灼热碳层:
1CO₂ + C → 2CO (高温下)
一氧化碳在氧气中燃烧:
12CO + O₂→ 2CO₂
6. 复分解反应(Double Displacement Reactions)
澄清石灰水中通入二氧化碳:
1Ca(OH)₂ + CO₂→ CaCO₃↓ + H₂O。
高中化学方程式大全(完整版)

高中化学方程式大全(完整版) 高中化学方程式总结第1页共21页第一章卤素第一节氯气1、2Na + Cl2 → 2NaCl2、Cu + Cl2 → CuCl23、2Fe + 3Cl2 → 2FeCl3 (点燃)4、H2 + Cl2 → 2HCl5、2P + 3Cl2 → 2PCl3 (点燃)6、PCl3 + Cl2 → PCl57、Cl2 + H2O → HCl + HClO8、2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9、Ca(ClO)2 + CO2 + H2O → CaCO3↓ + 2HClO10、2NaOH + Cl2 → NaClO + NaCl + H2O (点燃)11、MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑12、2KMnO4 + 16HCl (浓) → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O13、2HClO → 2HCl + O2↑第二节氯化氢14、NaHSO4 + HCl↑ → NaCl + H2SO415、NaCl + H2SO4 (浓) → Na2SO4 + HCl↑16、2NaCl + H2SO4 (浓) → Na2SO4 + 2HCl↑ (14、15结合)17、HCl + AgNO3 → AgCl↓ + HNO318、NaCl + AgNO3 → AgCl↓ + NaNO319、KCl + AgNO3 → AgCl↓ + KNO320、2HCl + CaCO3 → CaCl2 + H2O + CO2↑第三节氧化还原反应21、CuO + H2 → Cu + H2O22、C + 4HNO3 → CO2↑ + 4NO2↑ + 2H2O23、4Zn + 10HNO3 (极稀) + NH4NO3 → 4Zn(NO3)2 + NH4Cl + 3H2O24、11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 +15H2SO425、KClO3 + 6HCl (浓) → 3Cl2↑ + KCl + 3H2O26、4Mg + 10HNO3 (极稀) + NH4NO3 → 4Mg(NO3)2 + NH4Cl + 3H2O27、K2Cr2O7 + 6Fe3O4 + 8H2SO4 → 3Fe2(SO4)3 +Cr2(SO4)3 + K2SO4 + 8H2O31H2SO4和9Fe(2SO4)3和2K2SO4反应生成Cr(2SO4)3.这是一种化学反应方程式。
2015_2019年湖北省中考化学试题分类汇编------专题34 气体的制备与净化(PDF版)
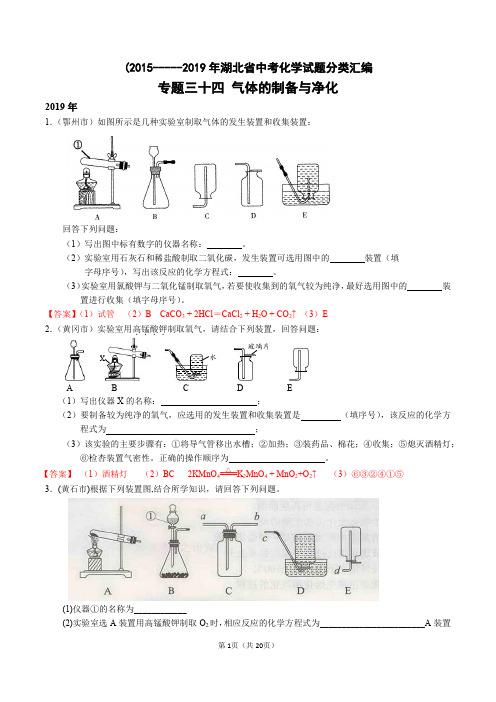
【答案】(1)集气瓶;(2)A;二氧化碳密度比空气大而且能溶于水;(3)AC。
17.(十堰市)掌握实验室制取常见气体的方法是初中生必备的化学素养,实验室里现有氯酸钾、二氧化锰、
锌粒、稀硫酸、石灰石和稀盐酸,以及下列仪器:
(1)利用上述仪器可以制取二氧化碳,你选择的仪器是
(填序号)。
(2)若补充一种仪器
8.(随州市)请根据装置回答下列问题。
水—
A
B
C
D
E
F
(1)写出图中仪器 a 的名称
。
(2)实验室用加热氯酸钾和二氧化锰混合物的方法制取并收集纯净的氧气,应选用的装置为
(填字母,在 A~E 中选取),反应的化学方程式为
。
(3)若用 F 装置收集一瓶干燥的某气体,则该气体可能是
(填字母序号)。
A.NH3 B.H2 C.O2 D.CO2
(填字母序号,下同);
(3)制取气体:实验室用高锰酸钾制取氧气的化学方程式是
,用该原理制取氧气时,除上述
仪器外,还缺少一种仪器的名称是
,用向上排空气法收集氧气时,检验氧气是否收集满
的方法是
。
(4)分离物质:实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式是
,充分反应后,
分离剩余的物质需进行过滤,过滤需选择的仪器是
(1)用装置 B 和 E 制取氧气,其反应的化学方程式是_____________________。
(2)现需要制取并收集一瓶氢气,在装置 A、B、C、D、E 中,应选择的装置组合是____________________。
(3)C、D、E、F 都是实验室制取气体的收集装置,其中装置 C 和装置 E 不能用来收集二氧化碳,则
13.(恩施州)某化学兴趣小组用一定浓度的稀盐酸和含杂质 5%(杂质不与盐酸反应)的石灰石制备 CO2, 他们选择的制取和收集装置如图所示。请按要求回答问题和探究:
2023年河南省南阳市名校联谊中考化学第一次联考试卷(含解析)

2023年河南省南阳市名校联谊中考化学第一次联考试卷得分注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
1. 厨房里发生的下列变化中,不涉及化学变化的是( )A. 铁锅生锈B. 蒸鸡蛋羹C. 面粉发酵D. 刀拍黄瓜2. 开封灌汤包是开封市的一道传统特色美食,该菜品历史悠久,风味独特。
制作灌汤包的原料瘦肉富含的营养素是( )A. 油脂B. 维生素C. 蛋白质D. 糖类3. 现代社会对能源的需求量越来越大.如图所示中,不是利用环保新能源发电的是( )A. 太阳能发电B. 风力发电C. 潮汐发电D. 火力发电4. 材料与人类生活密切相关。
下列物品的主要成分属于有机合成材料的是( )A. 黄金面具B. 尼龙线绳C. 蚕丝被褥D. 钢筋混凝土5. “人间四月芳菲尽,山寺桃花始盛开。
”要使桃树花红叶绿、抗病虫害,应施用复合肥,下列属于复合肥的是( )A. KNO3B. Ca(H2PO4)2C. CO(NH2)2D. K2SO46. 物质由微观粒子构成。
下列物质由原子构成的是( )A. 硫酸铜B. 液氮C. 金刚石D. 干冰7. “爆竹声中一岁除,春风送暖入屠苏。
”制作鞭炮的火药中含有KNO3,其中氮元素的化合价是( )A. +2B. +3C. +4D. +58. 正确的实验操作是实验成功的保证。
下列实验操作正确的是( )A. 塞紧橡胶塞B. 移走蒸发皿C. 连接仪器D. 放置滴管9. 芝麻油是选用优质芝麻种子经压榨而成的,芝麻酚(C7H6O3)是芝麻油中重要的香气成分,也是芝麻油中重要的品质稳定剂。
下列有关表述正确的是( )A. 芝麻酚由3个元素组成B. 芝麻酚属于氧化物C. 芝麻酚中氧元素的质量分数最小D. 芝麻酚的相对分子质量是13810. 2023年“中国水周”的活动主题为“强化依法治水,携手共护母亲河”。
2023年福州初中一检化学试卷
2023年福州初中一检化学试卷学校:___________姓名:___________班级:___________考号:___________第I卷(选择题)一、单选题(本大题共10小题,共30.0分)1.下列属于有机物的是()A.C60B.CH4C.COD.H2CO32.公交车里的装备用到了多种材料,下列装备中用到合成材料的是()A.纯棉椅套B.塑料扶手C.玻璃车窗D.金属救生锤3.临近中考,小明妈妈为他准备了以下美食:红烧牛肉、蒸鸡蛋、粉丝汤、米饭。
从营养均衡的角度分析,还需要补充的食物是()A.炸鸡腿B.粉蒸肉C.麻婆豆腐D.炒青菜4.合理饮食,有利健康。
下列是一些常见食物的近似pH,胃酸过多的人空腹时最适宜吃的食物是()A.苹果(2.9~3.3)B.玉米粥(6.8~8.0)C.橘子(3.0~4.0)D.番茄汁(3.5~4.5)5.下列有关硫酸的实验操作正确的是()A.滴加稀硫酸B.测定稀硫酸的pHC.稀释浓硫酸D.干燥氧气6.不同温度下,100g水中最多溶解蔗糖的质量如下表。
下列说法不正确的是()温度/℃0204060蔗糖质量/g182204238287A.降低温度,蔗糖溶液中溶质的质量分数一定减小B.在0~60℃时,蔗糖的溶解度随温度的升高而增大C.60℃时,蔗糖的饱和溶液中还能溶解氯化钠D.20℃时,蔗糖的溶解度为204g7.下列对部分化学知识归纳正确的是()A、化学中的判断推理B、对定量实验的认识活泼金属能和稀盐酸反应放出气体,则能和稀盐酸反应放出气体的一定是活泼金属配制100g溶质质量分数为20%的盐酸:将20g浓盐酸加入80g水中,充分搅拌C、用“化学”眼光分析D、化学与生活喝汽水打嗝是因为气体溶解度随温度升高而减少利用汽油和洗洁精都能除去油污,其除油原理相同A.AB.BC.CD.D8.下列图像与其对应描述相符的是()A.高温煅烧一定质量的碳酸钙固体B.把NaOH和NH4NO3固体分别溶于水C.浓盐酸在空气中敞口放置一段时间D.向一定量稀盐酸中加水进行稀释A.AB.BC.CD.D9.如图是用U形管改进后的创新实验装置,同时取下U形管两端的橡胶塞,开始反应。
高中必修一化学方程式

高中必修一化学方程式高中必修一化学方程式最新归纳高中化学要好好学习化学方程式哦!其实,化学方程式也称为化学反应方程式,是用化学式表示化学反应的式子。
化学方程式反映的是客观事实。
下面小编为大家带来高中必修一化学方程式,希望对您有所帮助!必修一化学方程式1、金属钠投到硫酸铜溶液中的化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+Na2SO4(先冒气泡再蓝色沉淀)2、金属钠与盐酸的化学方程式:2Na+2HCl=2NaCl+H2↑3、氢氧化钠方在空气中变质的化学方程式:2NaOH+CO2=Na2CO3+H2ONa2CO3+10H2O=Na2CO3·10H2O4、金属钠放在空气的氧化:4Na+O2=2Na2O(银白色变暗)5、金属钠在空气燃烧:2Na+O2=Na2O2Δ(生成淡黄色粉末)6、过氧化钠在空气中变质:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O27、过氧化钠与酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑8、氧化钠在空气中变质:Na2O+H2O=2NaOHNa2O+CO2=Na2CO39、氧化钠与酸反应:Na2O+2HCl=2NaCl+H2O10、氧化钠在空气中燃烧:2Na2O+O2=2Na2O211、氯气与铁的反应方程式:2Fe+3Cl2=2FeCl3点燃(红棕色的烟)12、氯气与铜的反应方程式:Cu+Cl2=CuCl2点燃(棕黄色的烟)13、氯气与氢气的反应方程式:Cl2+H2=2HCl点燃(苍白色火焰,生成白雾)14、氯气与钠单质的反应方程式:2Na+Cl2=2NaCl点燃(淡黄色的烟)15、工业制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(为Ca(OH)2石灰乳)16、氯气与水的方程式:Cl2+H2O=HCl+HClO17、消毒、处理多余的氯气、制84消毒液:Cl2+2NaOH=NaClO+NaCl+H2O18、次氯酸钠在空气中变质:2NaClO+CO2+H2O=2HClO+Na2CO3NaClO+CO2+H2O=HClO+NaHCO319、漂白粉在空气中变质:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO20、次氯酸见光分解:2HClO=2HCl+O2↑光照21、氯化铁通入沸水中制氢氧化铁胶体:FeCl3+3H2O=Fe(OH)3(胶体)+3HClΔ22、碳酸钠与盐酸的反应方程式:Na2CO3+2HCl(过)=2NaCl+CO2↑+H2ONa2CO3+HCl(少)=NaHCO3+NaCl23、碳酸氢钠与盐酸的反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑24、碳酸氢钠与碱反应方程式:NaHCO3+NaOH=Na2CO3+H2ONaHCO3+Ca(OH)2=2H2O+Na2CO3+CaCO3↓25、碳酸氢钠受热易分解:2NaHCO3=Na2CO3+CO2↑+H2OΔ26、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2+H2O=2NaHCO327、浑浊石灰水变澄清:CO2+CaCO3+H2O=Ca(HCO3)228、碳酸氢钙受热分解:Ca(HCO3)2=CO2↑+CaCO3+H2OΔ29、氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)3(由白色沉淀变成灰绿色再变成红褐色沉淀)30、泡沫灭火器原理:Na2CO3+2HCl=2NaCl+ H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体31、制造印刷线路板:2FeCl3+Cu=2FeCl2+CuCl22Fe3++Cu=2Fe2++Cu2+32、2FeCl2+Cl2=2FeCl32Fe2++Cl2=2Fe3++2Cl-33、Fe2O3+3CO=2Fe+3CO2高温34、Ba2++SO42+=BaSO4↓Ag++Cl-=AgCl↓35、Zn+Cu2+=Zn2++CuZn+Fe2+=Zn2++Fe36、溶洞的形成:CO2+CaCO3+H2O=Ca(HCO3)2Ca(HCO3)2=CO2↑+CaCO3+H2OΔ37、NaHCO3+BaCl2?不反应(一般情况下,强酸才能制弱酸)38、工业上制取水煤气:C+H2O(g)=CO+H2高温39、自然界通过放电把氮气转化为一氧化氮:N2+O22NO放电(NO 无色、难溶于水)40、工业上制备氨气:N2+3H22NH3高温、高压、催化剂41、一氧化氮在常温下被氧化:2NO+O2=2NO2(NO2红棕色、有刺激性气味的有毒气体、易溶于水)42、工业上制取硝酸、二氧化氮溶于水生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO43、氨溶解于水:NH3+H2ONH3·H2O(一水合氨、弱碱性、能使酚酞溶液变红)44、一水合氨的电离:NH3·H2ONH4++OH-45、氨与盐酸的反应:NH3+HCl=NH4Cl46、工业上制备硝酸需要的一氧化氮的方程式:4NH3+5O2=4NO+6H2O高温催化剂47、碳酸氢铵受热分解:NH4HCO3=NH3↑+CO2↑+H2OΔ(密封保存在阴凉处、施肥时埋在土下)48、氯化铵受热分解:NH4Cl=NH3↑+HCl↑Δ49、铵态氮肥不能与碱(如草木灰)混合施用:NH4++OH-=NH3↑+H2OΔ50、实验室制氨气:2NH4Cl+Ca(OH)2=2N H3↑+CaCl2+2H2OΔ(向上排空气法收集、湿润的红色石蕊试纸)51、硝酸受热分解:4HNO3=4NO2↑+O2↑+2H2O受热或见光(应保存在棕色试剂瓶中、阴凉处)52、铜与硝酸的反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(遇浓硝酸生成二氧化氮) 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(遇稀硝酸生成一氧化氮)53、浓硝酸与木炭的反应:4HNO3(浓)+C=CO2↑+4NO2↑+2H2OΔ54、硫单质铁的反应:Fe+S=FeSΔ(硫单质的氧化性、S黄色或淡黄色固体,不溶水、微溶酒精、易溶CS2)55、硫单质与氧气的反应:S+O2=SO2点燃(硫单质的还原性、SO2有刺激性气味的有毒气体、易溶于水)56、硫粉遇碱发生歧化反应:3S+6NaOH=2Na2S+Na2SO3+3H2OΔ57、黑火药爆炸的化学方程式:S+2KNO3+3C=K2S+3CO2↑+N2↑58、二氧化硫被氧气氧化:2SO2+O22SO3催化剂Δ59、二氧化硫与硫化氢发生归中反应:SO2+2H2S=3S↓+2H2O(H2S 臭鸡蛋气味)60、浓硫酸与铜加热发生反应:2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2OΔ61、浓硫酸与木炭加热发生反应:2H2SO4(浓)+C=2SO2↑+CO2↑+2H2OΔ62、二氧化硫能使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3↓+H2O63、二氧化硫与氯气发生氧化还原反应:SO2+Cl2+2H2O=H2SO4+2HCl64、酸雨的形成:2SO2+O22SO3粉尘等催化SO3+H2O=H2SO4SO2+H2OH2SO32H2SO3+O2=2H2SO465、海水提镁第一步:Mg+2H+=Mg2++H2↑(盐酸、稀硫酸)66、镁与氮气的反应:3Mg+N2=Mg3N2点燃67、镁与二氧化碳反应:2Mg+CO2=2MgO+C点燃(镁着火不能用二氧化碳扑灭)68、海水提溴单质:2Br-+Cl2=Br2+2Cl-69、半导体硅与氧气的反应:Si+O2=SiO2Δ(自然界没有游离态的硅)70、工业上制粗硅:SiO2+2C=Si+2CO↑高温(光导纤维、沙子和石英的主要成分是SiO2)71、硅与氟气的反应:Si+2F2=SiF472、硅与氢氟酸的反应:Si+4HF=SiF4+2H273、制作黏合剂:Si+2NaOH+H2O=Na2SiO3+2H2↑74、玻璃与烧碱反应:SiO2+2NaOH=Na2SiO3+H2O(Na2SiO3的水溶液称为水玻璃)75、二氧化硅与碱性氧化物的反应:SiO2+CaO=CaSiO3高温76、刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O77、工业制玻璃:CaCO3+SiO2=CaSiO3+CO2↑高温Na2CO3+SiO2=Na2SiO3+CO2↑高温78、金属铝在氧气中燃烧:4Al+3O2=2Al2O3点燃79、铝热反应:2Al+Fe2O3=Al2O3+2Fe高温(铝粉与氧化铁粉的混合物称为铝热剂,用于焊接钢轨)80、金属铝与酸的反应:2Al+6HCl=2AlCl3+3H2↑81、金属铝与碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑(四羟基合铝酸钠)82、实验室制氢氧化铝:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl(白色沉淀)83、氢氧化铝溶于强酸中:Al(OH)3+3H+=Al3++3H2O84、氢氧化铝溶于强碱中:Al(OH)3+OH-=[Al(OH)4]-(四羟基合铝酸根离子)85、氧化铝溶于强酸:Al2O3+6H+=2Al3++3H2O(氧化铝为两性氧化物)86、氧化铝溶于强碱:Al2O3+2OH-+3H2O=2[Al(OH)4]-87、碱式碳酸铜的制取:2Cu+O2+H2O+CO2=Cu2(OH)2CO3(绿色)88、铜与氧气的反应:Cu+O2=2CuOΔ89、铜与硫粉的反应:2Cu+S=Cu2SΔ90、4CuO=2Cu2O+O2↑高温(黑色物质变为红色物质)91、CuSO4·5H2O=CuSO4+5H2O↑Δ(蓝色晶体变为白色粉末)92、氯化铝与少量的氢氧化钠反应:Al3++3OH-=Al(OH)3↓93、氯化铝与过量的氢氧化钠反应:Al3++4OH-=[Al(OH)4]-94、四羟基合铝酸根离子与酸的反应:[Al(OH)4]-+H+=H2O+Al(OH)3↓95、实验室制取氯气:4HCl(浓)+MnO2=MnCl2+Cl2↑+2H2OΔ(黄绿色气体、有毒、密度比空气大)96、实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑(无色无味、密度比空气大,溶于水) 97、水垢形成、钟乳石的形成:2NaHCO3ΔNa2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体98、甲烷和天然气的燃烧:2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体高考化学解题有什么方法1、高考化学解题抓住关键,以新联旧填空题形式新颖,思维巧妙,很富有思考性,综合性程度很高,内容跨度大,知识的串联性强,只要抓住关键,搞清题目的条件和要求,在此基础上题目的新要求与学过的旧知识联系,进行有关知识的整体思维,答案就能顺利推出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③铜片 硫酸镁溶液 ④铜丝 硫酸锌溶液
无明显现象 无明显现象
Cu+MgSO4≠ Cu+ZnSO4≠
⑤锌片
锌片:银白色→红色
硫酸铜溶液 溶液:蓝色→无色
Zn+CuSO4=ZnSO4+Cu
2、化学性质
(1)盐 + 金属
新 盐+新 金 属
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
先与水反应
置换反应发生的条件:
1.必须是盐溶液;
2.在金属活动性顺序中,只有前面的金属可把后 面的金属从它的盐溶液中置换出来。
练习:
快速判断下列反应能否进行
Cu投入AgNO3溶液中 Al投入NaNO3溶液中 Zn投入FeSO4溶液中 Fe和AgCl的反应
Cu+2AgNO3=2Ag+Cu(NO3)2 Zn+FeSO4=Fe+ZnSO4
写出下列反应的化学方程式
1、战鼓一响,法律无声。——英国 2、任何法律的根本;不,不成文法本 身就是 讲道理 ……法 律,也 ----即 明示道 理。— —爱·科 克
3、法律是最保险的头盔。——爱·科 克 4、一个国家如果纲纪不正,其国风一 定颓败 。—— 塞内加 5、法律不能使人人平等,但是在法律 面前人 人是平 等的。 ——波 洛克
写出下列反应的化学方程式 1.铁和硫酸铜溶液反应; 2.碳酸钠和稀盐酸反应; 3.碳酸钠溶液和澄清石灰水反应; 4.氯化钠溶液和硝酸银溶液反应。
Fe+ CuSO4 = Cu+FeSO4 Na2CO3+2HCl =2NaCl+H2O+CO2↑ Ca(OH)2+Na2CO3 =CaCO3↓+2NaOH NaCl+AgNO3=AgCl↓+NaNO3
(3)盐(可溶)+碱(可溶)
新盐+新碱
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ FeCl3+3NaOH=3NaCl+Fe(OH)3↓
练习 CuCl2 + 2KOH = Cu(OH)2↓+2KCl
Ba(OH)2 + Na2SO4 = BaSO4↓+2NaOH
(4)盐(可溶)+盐(可溶)
45、自己的饭量自己知道。——苏联
A、X>Y>Z
B、 Y>Z>X
C、 Y>X>Z
D、Z>Y>X
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
↓BaCO3
AgNO3
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
实验
现象
结论(化学方程式表示)
①铁片
铁片:银白色→红色
硫酸铜溶液 溶液:蓝色→浅绿色
Fe+CuSO4=Cu+FeSO4
②铜片 硝酸汞溶液
铜片:红色→银白色 溶液:无色→蓝色
Cu+Hg(NO3)2=Hg+Cu(NO3)2
A、氯化镁溶液
B、氯化钡溶液
C、碳酸钾溶液
D、硝酸钡溶液
3、下列物质既能和盐酸反应,又能与碳酸钠反应的是 (B )
A、 硫酸 B、氢氧化钙 C、氢氧化钠 D、氯化钙
4、X、Y、Z三种金属,将Y、Z分别放入稀硫酸中,Y溶
解,Z不溶解;将Z放入X的盐溶液里,Z表面有X析出。
则这三种金属的活动性由强到弱的顺序是( ) B
(2) 盐+酸 新盐+新酸
A g N O 3 H C l A g C l H N O 3
N a 2 C O 3 H 2 S O 4 N a 2 S O 4 H 2 O C O 2
练习: B a C O 3 2 H C l B a C l2 H 2 O C O 2
H 2 S O 4 H B a 2 2 S C O l2 4 4 B H a 2 S C O l2 2 4 4 B B a 2 a S C H O l C 2 4 4 l B 2 a S H O C 4 l 2 H C l
沉淀 气体
水
AgCl,BaSO4 , CaCO3等 CO2等
生成物有沉淀、气体、水 之一
作业:⑴课本P176 6,7 ⑵预习下一节内容
1、跟盐酸不反应,但能和硝酸银溶液反应的物是(A )
A、铜片 B、铁丝 C、碳酸钠溶液 D、氢氧化铜
2、下列物质中滴加硝酸银溶液或硫酸钾溶液都有白色沉
淀生成的是( B )
新盐+新盐
实验
1.硝酸银溶液和氯化钠溶液混合
AgNO3 +NaCl=AgCl ↓ + NaNO3
2. 硫酸钠溶液与氯化钡溶液混合
Na2SO4 +BaCl2 =2NaCl +BaSO4↓
盐
金属
酸
碱
盐
+ + +
+
金
盐
盐
盐
属酸碱源自盐盐酸、碱、盐等物质之间发生复分解反 应的条件是什么?
KCl AgNO3 AgCl KNO3 H2SO4 BaCl2 BaSO4 2HCl 2NaOH CuCl2 Cu(OH)2 2NaCl Na2CO3 CaCl2 CaCO3 2NaCl Na2CO32HCl 2NaClH2OCO2 BaCO32HCl BaCl2 H2OCO2 Na2S2HCl2NaClH2S
硫酸铜晶体
硫酸钙晶体
常
见
的
氯化钠晶体
碳酸钠晶体
盐
盐的性质
1、物理性质
(1)大多数盐在常温下都是晶体 (2)盐在水中的溶解性
盐的溶解性规律
钾钠铵盐硝酸盐, 都能溶于水中间。
盐酸不溶氯化银, 硫酸难溶有钡铅。
碳酸磷酸多不溶, 溶者只有钾钠铵。
判断下列物质是否溶于水
↓AgCl
MgSO4
↓BaSO4
Na2CO 3
