无菌药品生产检查要点--顿昕
药典无菌检查方法验证及操作要点

•
1、
功的路 。20.11.520.11.5Thursday, November 05, 2020
成功源于不懈的努力,人生最大的敌人是自己怯懦
•
2、
。0 8:28:32 08:28:3 208:281 1/5/20 20 8:28:32 AM
每天只看目标,别老想障碍
•
3、
。20.1 1.508:2 8:3208: 28Nov-205-Nov-20
(1) 无菌检查试验所用的设备及环境的微生物监控 结果不符合无菌检查法的要求;
(2) 回顾无菌试验过程,发现有可能引起微生物污 染的因素;
(3) 阴性对照管有菌生长;
(4)供试品管中生长的微生物经鉴定后,确证是因 无菌试验中所使用的物品和(或)无菌操作技术不当 引起的。
每一个成功者都有一个开始。勇于开始,才能找到成
。2 020年1 1月5日 星期四 上午8 时28分3 2秒08:2 8:3220. 11.5
人生就像骑单车,想保持平衡就得往前走
•
7、
。202 0年11 月上午8 时28分 20.11.5 08:28Novembe r 5, 2020
•
8、业余生活要有意义,不要越轨。20 20年11 月5日 星期四8 时28分 32秒08 :28:325 November 2020
4.5 结果判断
与对照管比较,如含供试品各容器中的 试验菌均生长良好,则供试品的该检验量在 该检验条件下无抑菌作用或其抑菌作用可以 忽略不计,照此检查法和检验条件进行供试 品的无菌检查。
如含供试品的任一容器中微生物生长微 弱、缓慢或不生长,则供试品的该检验量在 该检验条件下有抑菌作用,可采用1)增加冲 洗量,或增加培养基的用量,2)使用中和剂 ,或更换滤膜品种等方法,消除供试品的抑 菌作用,并重新进行方法验证。
DA如何进行无菌药品生产检查

DA如何进行无菌药品生产检查引言在药品生产和质量控制过程中,无菌药品的生产和检查是至关重要的环节。
无菌药品的生产不仅需要遵循一系列严格的工艺流程和标准操作规程,还需要进行定期的检查和验证以确保产品的无菌性。
本文将介绍DA(药物管理局)在无菌药品生产检查方面的要求和方法。
1. 无菌药品生产检查的目的无菌药品生产检查的目的是保证药品在制造过程中不受微生物污染,从而确保药品的质量和安全性。
无菌药品生产检查主要包括以下方面的内容:•生产环境的洁净度检查;•生产设备的清洁和无菌状况检查;•员工的操作规范和无菌操作技术培训检查;•原料和容器的无菌性检查;•内容物的无菌性检查。
2. 检查前的准备工作在进行无菌药品生产检查之前,需要进行充分的准备工作,以确保检查的顺利进行。
主要包括以下几个方面:2.1 制定检查计划制定详细的检查计划,明确检查的范围、对象、时间和人员。
根据不同的检查内容和要求,制定相应的检查表格和记录表,以便记录检查结果和问题。
2.2 准备所需的检查工具和设备根据检查计划的内容和要求,准备好所需的检查工具和设备。
例如,洁净度检查需要使用洁净度检测器,清洁和无菌状况检查需要使用无菌测试装置,员工操作规范和无菌操作技术培训检查需要使用培训记录和培训材料等。
2.3 培训检查人员对参与检查的人员进行培训,使其熟悉检查要求和方法。
确保检查人员具备必要的知识和技能,并能正确使用检查工具和设备。
2.4 检查前的准备工作在进行检查之前,需要对待检查的生产环境、设备、员工和原料进行彻底的清洁和消毒。
清洁工作需要按照相应的清洁程序和标准操作规程进行,以避免污染和交叉感染。
3. 无菌药品生产检查的方法和步骤3.1 生产环境的洁净度检查生产环境的洁净度检查是无菌药品生产检查的重要环节。
主要包括空气洁净度检查和表面洁净度检查。
•空气洁净度检查:使用洁净度检测器对生产车间或实验室的空气洁净度进行检测。
根据国家药典或相关标准规定的要求,检测空气中的微生物总数和菌落总数,确保其符合规定的限度。
中国药典2020无菌检查法

中国药典2020无菌检查法无菌检查法是药品生产过程中非常重要的一项质量控制检测方法,它主要用于检测药品是否受微生物污染,确保药品的无菌状况符合规定的标准。
中国药典2020年版中对无菌检查法进行了详细的规定和说明,本文将对中国药典2020版中关于无菌检查法的要点进行介绍。
一、无菌检查法的概述无菌检查法是指通过将药品接种于特定培养基上,经过一定时间的培养和观察,判断药品中是否存在微生物污染。
它是一种定性的检测方法,可较为准确地判断药品为无菌状态还是受菌状态。
二、无菌检查法的适用范围无菌检查法适用于各类药品的无菌检测,包括注射剂、眼用制剂、气雾剂、洗眼液等。
不同药品的无菌检查方法可能存在一定差异,药企在进行检测时应参照中国药典2020版中的规定进行操作。
三、无菌检查法的操作步骤1. 准备好所需器材和培养基:包括培养皿、无菌针、无菌培养基等。
根据具体的检测要求选择相应的培养基。
2. 无菌操作:操作人员需穿戴无菌手套、无菌帽等无菌防护用品,采用无菌环境进行操作,以尽量降低外界污染。
3. 取样并接种:根据药品的不同形式,采取适当的方法进行取样,并将样品接种于培养基上。
4. 培养和观察:将接种好的培养基置于适宜的温度和条件下进行培养,在规定时间内观察培养皿中是否有微生物生长。
四、无菌检查法的结果解读无菌检查法的结果由操作人员根据培养皿中的生长情况进行判读,一般可分为以下几种情况:1. 无菌:培养皿中无任何菌落生长。
2. 受菌:培养皿中存在微生物的生长,可能意味着药品受到了微生物污染。
3. 有疑似菌落:培养皿中存在一些不明确的菌落,需要进行进一步的鉴定和确认。
五、无菌检查法的注意事项1. 操作人员应严格遵循无菌操作规范,避免外界污染。
2. 选择合适的培养基和培养条件,以确保对不同种类微生物的检测灵敏性和准确性。
3. 对存在疑似菌落的样品进行进一步的鉴定,以确定是否存在真正的微生物污染。
4. 注意培养基的保存和贮存条件,保证培养基的质量和可靠性。
药品无菌检查

洁净室不是绝对无菌的。
概念不等于无菌室(命名需准确)
洁净实验室
ISO14644---按悬浮粒子大小划分了洁净室的级别(等级1-9级)
03
01
02
洁净实验室
洁净实验室
各国不同法规对于洁净室污染控制的要求对比 美国联邦标准FED-STD-209E:率先建立了由悬浮粒子含量规定空气洁净度的分级标准,以每立方英尺空气所含最大允许微粒的数量确定,分为1、10、100、1000、10000、100000六个级别。 国际标准ISO14644-1:空气洁净度分为9个级别,比美国联邦标准多出3个。 美国FDA《无菌工艺药品CGMP工业指南》:以动态期间在物料漏置临近处所测数据为依据,强调了动态概念,对微生物进行了控制,100、1000、10000、100000对应ISO5、6、7、8 美国药典《1116》:根据美国联邦标准改编,M1-M7 欧盟GMP:A、B、C、D,静态、动态监测、强调了粒子的在线监测 2010年版GMP:等同于欧盟
药品无菌检查法
检验数量:一次试验所用供试品最小包装容器的数量
出厂产品按表1,上市产品监督检验按表2
最少检验数量不包括阳性对照用的。
检验量:按表3,采用薄膜过滤法时,只要供试品特性允 许,应将所有容器内的全部内容物过滤。
供试品的无菌检查
药品无菌检查法
药品无菌检查法
2015年版药典的变化
方法适用性实验:
2015年版药典的变化
菌种的培养条件改变
无菌检查实验条件
和以前的100级、10000级的区别?需要怎么控制环境?
由“万级下的局部百级”修订为“B+A”
2015年版药典的变化
01
02
03
04
无菌药品生产日常监督检查要点

生产管理
5、查无菌药品的批产品记录、工艺验证、管理文 件及现场,药液从配制到灭菌或除菌过滤、无 菌药液到分灌装的时间间隔、待冻干中间产品 的滞留时间等是否有规定,是否在验证确定的 范围内,实际生产过程中有无超过规定时间。 6、无菌过滤器完整性试验是否按规定每批次进行, 起泡点试验压力是否达到要求,并纳入批生产 记录。
3、查管理文件及记录,无菌室是否有专用的清 洁规程,清洁消毒方法、消毒周期、认可标 准是否符合要求并执行;环境监控是否定期 进行,监测结果出现偏差的处理措施是否恰 当;高效过滤器的监测更换标准、周期及其 验证执行情况如何。所有记录是否齐全。
厂房与设施
4、查取样规程及取样现场,无菌药品原、辅料、直 接接触药品的包装材料取样环境的空气洁净等级是 否与生产要求相一致,如最终灭菌注射剂用于浓配 物料取样环境应至少在100000级;用于稀配物料取 样环境应至少在10000级;粉针剂无菌原料取样应 在100级或10000级背景下的局部100级。 5、检查与药品直接接触的干燥用空气、压缩气体和 惰性气体等净化及其过滤器完整性测试、更换是否 按规定执行。
设
备
1、抽查来菌柜的验证文件、查批记录及现场: 检查灭菌柜容量是否与生产批量适应,主要 查灭菌柜的容量是多少,一批药品要分几柜 次灭菌,药液从配制到灭菌进间是否超过规 定,灭菌柜装载量是否超过规定,灭菌柜是 否有自动监测装置及记录装置,记录是否归 档批生产记录。
设
备
2、查制水系统验证文件、现场及记录,纯化水、 注射用水的制备、储存和分配是否有能防止微 生物的滋生和污染的制度和措施,在线监测和 周期性全检是否按规定进行,是否有记录;注 射用水储罐温度、送回水温度是否符合录,注 射用水系统是否定期用纯蒸汽灭菌。增加用水 点后,是否进行了文件补充、验证等相关工作, 管道、阀门等材质及安装是否符合要求。 3、关键设备的增加、调整等变更是否经过验证和 批准。
无菌产品GMP检查要点

无菌产品GMP检查通常要看的内容一、厂房设施厂房设施现场看一下1.按照从物料,包装容器,密封系统,中间物料,产品的顺序看厂房设施的设计是否可防止污染。
2.检查地板,墙,吊顶是否表面光滑,坚硬,且易于清洁3.检查硬件是否可充分控制压差,微生物,灰尘,温湿度。
4.检查高效过滤器的控制(完整性测试,维护等)二、人员在关键和控制区域观察人员的行为方式1.检查人员的培训记录:关于GMP和无菌生产技术的2.检查人员的资质确认包括更衣资质确认3.检查更衣要求是否适当,更衣程序是否得到了严格的遵守4.检查预先包装好的无菌服的情况5.检查无菌区操作人员的培训程序和培训记录6.检查再培训的情况三、物料,容器和包材密封系统检查储存条件1.检查是否物料,药品容器及密封系统的处理和储存可有效防止污染。
2.检查是否原料容器的开封,取样和再封口的处理方式可防止其内容物受到污染。
3.必要时检查无菌设备和无菌取样技术的应用方式。
4.检查是否每个物料,容器和包材密封系统按照书面的质量标准进行了所有必要的检验。
5.检查是否每批需要进行微生物检查的物料,药品容器或容器密封系统在使用前进行了微生物检查。
6.必要时检查微生物负载和或热原负载的数据。
7.评价药品容器和包材密封系统在使用前进行了清洗,灭菌和去除热原的处理。
8.评价是否药品包材是否有书面的质量标准,检测方法,清洗方法,灭菌方法和去除热原的方法,且实际是按照这些规程进行操作的。
9.评价是否容器和包材的清洗清洁程序进行了验证10.评价是否容器和包材的灭菌工艺进行了验证11.评价是否容器和包材的除热原程序进行了验证12.检查所有物料,容器和包材的不合格报告(首次和最终的调查,要在限定的时间完成,且有必要的整改预防措施)13.检查容器密封系统的完整性测试,检查容器密封系统的完整性验证四、设备现场检查所有关键生产设备1.评价是否设备器具的清洁,维护,消毒规定有适当的时间间隔限制以防止污染。
无菌药品GMP检查

无菌药品GMP检查无菌药品范围及特性无菌药品要求不能含有活性微生物,必须符合内毒素的限度要求特性:无菌无热原或细菌内毒素无不溶性微粒/可见异物GMP(专家修订稿)附录1:无菌药品第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括非经肠道制剂、无菌的软膏剂、眼膏剂、混悬剂、乳剂及滴眼剂。
无菌药品的生产方法无菌药品的生产有两种基本方法◆一种是最终灭菌方式。
这种方式假定产品存在活微生物污染,并且,设定的工艺能够在对灌装到最终容器的产品处理中将其消灭掉。
大容量注射剂、小容量注射剂。
重要的工艺参数:—灭菌前的生物负荷—灭菌时间—灭菌温度及压力◆另一种方法是无菌工艺(除菌过滤)粉针剂、冻干粉针剂·该工艺,包括保护暴露产品、保护产品接触表面免受微生物污染·通常微生物污染来自人员、表面或工艺环境·没有测量方法对无菌状态产生不利影响的条件进行定义,并且也不易检测和控制·如果发生了无菌性失败或内毒素失败,由于现有的取样、测试方法缺乏灵敏度,污染被检出的可能性非常有限·因此,无菌工艺过程的结果,缺乏可预见性,并且存在固有的高风险GMP(专家修订稿)附录1:无菌药品第五条无菌药品按照生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品:部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
无菌药品GMP的基本原则GMP(专家修订稿)附录1:无菌药品第四条无菌药品的生产须满足其质量和预订用途的要求,最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其他质量特性绝不能只依赖于任何形式的最终处理或成品检验。
生产工艺检查要点无菌灌装工序◆关键操作区和生产设备·清洁、消毒或灭菌·动态环境的监控◆无菌灌装用各类物料、器具的准备或灭菌处理◆生产用气体◆人员的无菌操作◆装量控制◆培养基模拟灌装验证◆无菌检验样品的取样国内企业常见缺陷无菌灌装工序—关键操作区空气流向为乱流,而不是流层—关键操作区不便于在洁净区外进行监控—人员的无菌操作不规范—不做或未定期做培养基模拟基模拟灌装验证—培养模拟灌装验证的合格标准设定不正确—培养基模拟灌装未模拟最差生产条件—未对培养基模拟灌装阳性样品进行调查冻干生产在无菌药品生产中,冻干药品的生产面临了无菌灌装相关的全部困难和风险,还受到需将药品从冻干机中放入和取出的额外影响。
无菌药品生产企业监督检查要点
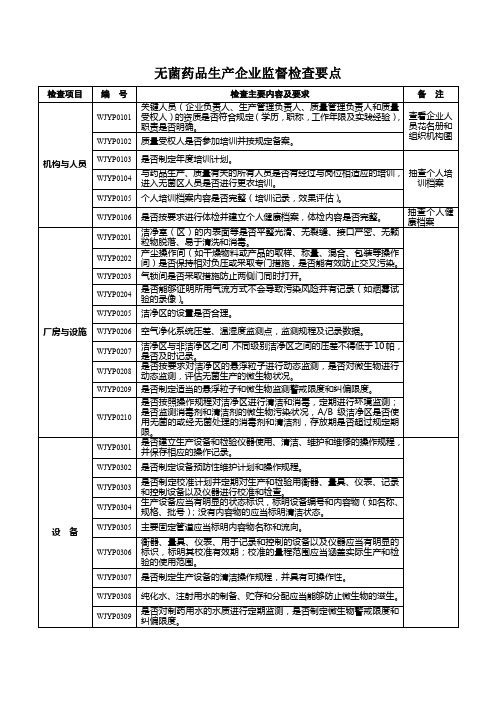
灭菌工艺是否与注册批准的要求相一致,是否经过验证,并定期对灭菌工艺的有效性进行再验证。
WJYP0506
影响产品质量的主要因素发生变更时是否进行确认与验证。
WJYP0507
非最终灭菌的无菌生产工艺的验证是否包括培养基模拟灌装试验。
WJYP0508
清洁验证的内容是否完整,是否考虑(设备使用情况、所使用的清洁剂和消毒剂、取样方法、位置和共线生产)等因素。
是否能够证明所用气流方式不会导致污染风险并有记录(如烟雾试验的录像)。
WJYP0205
洁净区的设置是否合理。
WJYP0206
空气净化系统压差、温湿度监测点,监测规程及记录数据。
WJYP0207
洁净区与非洁净区之间,不同级别洁净区之间的压差不得低于10帕,是否及时记录。
WJYP0208
是否按要求对洁净区的悬浮粒子进行动态监测,是否对微生物进行动态监测,评估无菌生产的微生物状况。
WJYP0209
是否制定适当的悬浮粒子和微生物监测警戒限度和纠偏限度。
WJYP0210
是否按照操作规程对洁净区进行清洁和消毒,定期进行环境监测;是否监测消毒剂和清洁剂的微生物污染状况,A/B级洁净区是否使用无菌的或经无菌处理消毒剂和清洁剂,存放期是否超过规定期限。
设 备
WJYP0301
是否建立生产设备和检验仪器使用、清洁、维护和维修的操作规程,并保存相应的操作记录。
WJYP0509
是否定期进行再验证。
生产管理
WJYP0601
是否建立划分产品生产批次的操作规程,药品批号的编制是否合理。
WJYP0602
是否建立药液从开始配制到灭菌(或除菌过滤)的间隔时间控制标准;是否建立包装材料、容器和设备的清洗、干燥和灭菌的间隔时间以及灭菌至使用的间隔时间控制标准。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无菌药品的污染来源与控制
------无菌药品生产检查要点
顿昕 顾问 dunxin@
1
GMP的原则----无菌药品检查的核心
第三条 本规范作为质量管理体系的一部分,是药品生产管理 和质量控制的基本要求,旨在最大限度地降低药品生产过程 中污染、交叉污染以及混淆、差错等风险,确保持续稳定地 生产出符合预定用途和注册要求的药品。
湿热灭菌
湿热灭菌中“被灭菌物品应当用合适的材料适当包扎”的 “合适的材料”如何理解?
1/100 英寸厚的气体层 1/4 英寸的水层 12.9 英寸的铁墙
6
2015/5/28
湿热灭菌
第六十五条 所有的待灭菌物品均须按规定的要求处理, 以获得良好的灭菌效果,灭菌工艺的设计应当保证符合 灭菌要求。 第六十六条 应当通过验证确认灭菌设备腔室内待灭菌产 品和物品的装载方式。
United States None
Europe
DMF Drug application
CEP application Drug application
No special review procedure for excipients Type of Review Reviewed in reference to drug. New and import excipeint – SFDA Excipients with 国家standard – Provincial FDA. New and import excipeint. Excipients with standard. Supplemental registration and change. Re-registration. CP National Standard Local standard Food standard(GB) GMP Requirements Official GMP, mandatory? New excipient review with drug. New excipient review Excipients which have been with drug. used or in USP, not reviewed CEP review process. commonly. DMF Drug with new excipient USP-NF -GRAS, FAP, etc Non-official GMP CEP Drug with new excipient EP National Pharmacopeia in EU Not archived in EP Non-official GMP
-浮游粒子通过HEPA过滤 -接触地方清洗和灭菌 -水纯化系统
活性 (微生物)
-细菌 -霉菌 支原体 病毒
-限制无菌核心干扰 -浮游粒子通过HEPA过滤 -液体无菌过滤(0.2um) -组分蒸汽灭菌或辐射灭菌
内毒素 (通常和浮游细菌不相 关)
-来自某种生 物(通常为水 生)的细胞壁 残渣
-热氢氧化钠溶液 -高温(>200℃)根据时间决定
1
2015/5/28
摘自ISPE
污染种类
污染类型 示例 来源: (举例) -设备 -员工服装 -外界空气 -水供应 -人员 -水 -外界空气 -设备,工具,内 包材 -辅料,原料药 -暴露一段时候之 后的湿设备更换零 部件或者容器/密 封装置 处理方法: (举例)
生
锈
非活性 (粒子)
-金属斑点 -服装纤维
控制洁净区进入人数的措施
超高射频读取
4
2015/5/28
无菌操作
污染的来源与控制-----机
16:04
Grade”B”
0.36-0.54 m/s
产品经过除菌过滤
Grade”A”
M 直接包材 接触部 灭菌
M
10
5
2015/5/28
湿热灭菌
胶塞清洗机 灌装机
冻干机
洗瓶机
轧盖机 干热隧道 容器SIP
11
TR 13
In order to ensure a consistently acceptable production environment, a comprehensive environmental control program should be supported by: (a) sound facility design and maintenance, (b) documentation systems, (c) validated/qualified sanitization/disinfection procedures, (d) reliable process controls, (e) good housekeeping practices, (f) effective area access controls, (g) effective training, certification/qualification and evaluation programs and (h) quality assurance of materials and equipment.
14
2015/5/28
原辅料/硼砂 退火 批号 清洗
15
2015/5/28
16:04
第五十九条 无菌生产所用的包装材料、容器、设备和任何 其它物品都应当灭菌,并通过双扉灭菌柜进入无菌生产区 ,或以其它方式进入无菌生产区,但应当避免引入污染。
31
16:04
无菌连接 产品的转运 物料的转运
32
16
2015/5/28
不能杀孢子; 并不总是对TB有效; 使用不匹配化学品后活性受影响
20
2015/5/28
化学主份
过氧化氢/过乙 酸混合物
优点
局限
对软金属有腐蚀性 需要预先清洁 对温度敏感 刺激性气味(醋) 要求预先清洁; 对温度和光敏感; 与氯气共用存在安全隐患; 对眼睛和皮肤有腐蚀性; 在有机物存在时可生成THM
浓度过低容易导致: 无法彻底杀灭微生物 产生耐药菌株 虚假的“安全感” 清洁效果不理想
系统就位并开始操作照片
44
22
2015/5/28
3)环境监控数据意味着什么?
一个车间,从现场的观察发现: 1)厂房设计不太合理,例如送回风口位置 2)人员没有很好的培训,操作过程 3)物流交叉口 4)清洁程序, 5)消毒剂配制 但从环境监控的结果显示,A,B,C级区的环境监控培养碟 结果都是阴性。 企业说:由于环境监控数据证明上述不合理不会给产品带来 污染。 我们应该怎麽看?
19
2015/5/28
洁净区域中的微生物组成 分类 革兰氏阳性球菌 产芽孢、革兰氏阳性杆菌 革兰氏阳性杆菌 氧化酶阳性、革兰氏阴性杆菌(非发 酵) 氧化酶阴性、革兰氏阴性杆菌(发酵) 酵母菌 霉菌
39
发现概率 75 - 90%
10 – 25%
1 - 2%
分类与局限
化学主份
表面消毒常用试剂 优点
醇类 无残留; 容易挥发
Cd
In
Sn
Sb
Te
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
23 Elem ental
China Approved Excipients Pattern of Regulation Establishing DMF(consideration) Drug application IID
快速、广谱活性,可杀孢子 ; 表面消毒常用试剂 同效果相当的氧化剂相比腐蚀性小 ; 对人员较安全 ;
次氯酸钠
800ppm-1000ppm时可杀孢子; 对软金属和不锈钢有腐蚀性
臭氧
无残留; 杀菌广谱(包括孢子); 灭菌时间短
强氧化性,使铜出现绿色锈斑, 氧化橡胶,漂白织物 经济方便; 可以喷雾、熏蒸等方式使用
“包装我,别影响我”
• 客户抱怨胶塞存在外观不洁净,微粒多。药用胶塞况。 • 在药品临床使用时,出现胶塞掉屑现象。客户抱怨产品时有混淆 情况出现。药用胶塞生产采用多品种多批次生产管理模式,现场 管理较为混乱。产品质量一致性差。 在药品灌装生产时,药用胶塞的外形尺寸公差、弹性等质量性能上 存在批内、批间差异。 药品生产企业需求多样性,另外订单不稳定,生产计划性不强,经 常发生插单生产的现象,导致生产管理难度加大,容易出现生产计 划延误、质量均一性等诸多质量问题。例如中班和夜班有N个规格 在同时生产,较容易出现混淆情况发生。药用胶塞企业生产组批困 难,批量变化范围较大,从几万到几百万不等;
16:04
灭菌曲线
1
Air removal Sterilisation plateau
0
Drying - 1
I t e m d d r Temperatu re h o t y a n
Heat –up
by steam condensation
Drying
by condensate evaporation
Pressure
- 1
vacuum pulse steam inject ion
Sterilis ation plateau final drying
14
7
2015/5/28
洗瓶机风险控制措施
洗瓶机
空气压力和水的压力确认 水温的确认 水的循环次数
隧道式灭菌干燥机风险控制措施
隧道式
热分布 压差: 层流质量和泄漏实验 去热源验证
洁净区设计
16:04
35
抗生素瓶冻干粉针剂布局案例-分析、直线型
18
2015/5/28
