从铜氨废液中回收铜
铜氨废液中铜回收的新工艺流程

铜氨废液中铜回收的新工艺流程铜氨废液是一种常见的含铜废水,通常产生于电镀、冶炼和化学制剂生产等工业过程中。
传统的铜氨废液处理方法主要是通过化学还原、溶解、电析和电积等步骤将废液中的铜回收。
然而,这些方法存在着许多问题,包括操作复杂、设备投资高、产生大量废物等。
为了解决这些问题,近年来出现了一种新的铜回收工艺流程,该工艺使用离子液体作为溶剂,并借助离子液体的独特性质实现高效的铜回收。
离子液体是一类由有机阳离子和无机阴离子组成的液体。
其具有低熔点、广阔的电化学窗口、优异的溶解性能和良好的可重复使用性等特点,因此在废液处理等领域具有广泛的应用前景。
对于铜氨废液处理而言,离子液体可以替代传统的有机溶剂,与废液中的铜离子发生配位反应并形成络合物,实现铜的有效回收。
基于离子液体的铜回收工艺流程一般包括以下几个步骤:1. 提取:首先将铜氨废液与适量的离子液体混合,通过相分离技术将铜络合物从废液中提取到离子液体相中。
2. 洗涤:将离子液体相中的铜络合物用水或酸性溶液进行洗涤,去除其中的杂质和离子液体残留。
3. 脱水:通过蒸发或其他适当方法将洗涤后的溶液中的水分脱除,得到含有高浓度铜络合物的浓缩液。
4. 还原:将浓缩液与适量的还原剂反应,将铜络合物转化为可溶性的金属铜。
5. 结晶/电积:通过结晶或电积等方法将金属铜从溶液中回收,得到高纯度的铜产品。
可以看出,基于离子液体的铜回收工艺流程相比传统的方法具有以下优势:1. 高效:离子液体作为溶剂,能够与废液中的铜离子快速发生配位反应,并形成稳定的络合物,提高了铜的提取效率。
2. 环保:离子液体具有低挥发性和低溶解性有机物的特点,因此在铜回收过程中几乎没有挥发物和废气排放,达到了绿色环保的要求。
3. 经济:离子液体的可重复使用性和稳定性很高,可以降低处理成本,并减少废物的产生。
4. 高纯度:离子液体的溶解性能良好,可以实现对铜的高效分离和纯化,得到高纯度的铜产品。
总结起来,基于离子液体的铜回收工艺流程是一种具有广泛应用前景的新型工艺。
专题八 大题题空逐空突破(十一) 化工流程题中的曲线分析

1.从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO2-3等中回收铜的工艺流程如图:步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为______________________________,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为______。
答案2[Cu(NH3)4]2++Cl-+5H++3H2O===Cu2(OH)3Cl↓+8NH+46(或5.5~6.5)解析步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为2[Cu(NH3)4]2++Cl-+5H++3H2O===Cu2(OH)3Cl↓+8NH+4,由图可知为尽可能提高铜的回收率,需控制的pH约为6(或5.5~6.5)。
2.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn 的工艺流程如图所示。
“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
则适宜的浸出时间和液固比分别为________、________。
答案 3MnO 2+2Fe +12H +===3Mn 2++2Fe 3++6H 2O 60 min 3∶1(或3)解析 “酸浸”时,MnO 2将Fe 氧化为Fe 3+,自身变为Mn 2+,其反应的离子方程式为3MnO 2+2Fe +12H +===3Mn 2++2Fe 3++6H 2O ;该过程中浸出时间60 min 达到80%,以后浸出率不再上升,液固比等于3时锰浸出率最大,因此适宜的浸出时间和液固比分别为60 min 、3∶1(或3)。
3.金属钛在航天、潜海和医疗方面应用广泛。
以钛铁矿[主要成分为钛酸亚铁(FeTiO 3),含少量Fe 2O 3]为原料制备钛的工艺流程如图所示。
从铜氨溶液中萃取分离铜的试验研究

第5期2008年10月 矿产综合利用M ulti purpose Utili za ti on of M i n era l Resources No .5O ct .2008从铜氨溶液中萃取分离铜的试验研究徐建林,史光大,钟庆文,李元坤,余平(中国地质科学院矿产综合利用研究所,四川 成都 610041) 摘要:采用N902萃取剂从氨2氯化铵体系浸出液中萃取分离二价铜,考察了萃取剂浓度、萃取相比和振荡时间对铜萃取率的影响。
结果表明:在单级萃取中,铜萃取率平均为98.60%;在两级萃取中,铜萃取率大于99.99%,而且铜离子也得到了富集。
关键词:萃取;铜;氨溶液;N902中图分类号:TF111.3 文献标识码:A 文章编号:100026532(2008)0520007203 我国铜矿资源呈富矿少、贫矿多和矿石品位低的特点,而且低品位难处理氧化铜矿占有的比例较大。
随着铜矿石品位的逐年下降和近年铜价的上涨,使处理低品位铜矿的浸出-萃取-电积这一湿法冶金工艺日益受到人们的重视[1]。
在对低品位氧化铜矿采用浸出-萃取-电积工艺时,对氨-铵体系浸出液进行萃取分离和富集铜是其中重要的一道工序。
从铜氨溶液中萃取分离铜的萃取剂有多种,如N902,L ix984N 和L ix54-100等。
国内的华南师范大学[2]、北京矿冶研究总院[3]等都对从氨-铵体系浸出液中萃取分离铜进行了研究。
本文介绍了采用N902萃取剂对氨-氯化铵体系浸出液中的铜进行萃取分离和富集铜的试验研究,经过对萃取试验条件的探索,在二级萃取流程试验中,铜离子萃取率大于99.99%,负载有机相中铜浓度较浸出液中提高了近4倍。
1 试验原理及方法1.1 试验原理试验采用N902为萃取剂,它是由中国科学院上海有机化学研究所研制的。
N902萃取剂外观为琥珀色液体,无可见杂质,密度0.95~0.97g/L,粘度<190CP,闪点>62℃。
N902萃取剂是一种类似M5640的萃取铜的螯合萃取剂,主要活性成分为2-羟基-5-壬基水杨醛肟,属于醛肟类铜萃取剂[4]。
2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)(解析版)

2023年高三化学对接新高考全真模拟试卷(一)(云南,安徽,黑龙江,山西,吉林五省通用)(考试时间:50分钟 试卷满分:100分)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回可能用到的相对原子质量:H 1 C12 N14 O16 Na 23 Mg 24 P 31 S 32 Cl 35.5 Cr52 Fe 56 Cu 64 Ag 108一、选择题:本题共7个小题,每小题6分。
共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2022·江苏·海门中学高三阶段练习)我国承诺在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。
下列措施中对促进“碳中和”最直接有效的是A .将重质油裂解为轻质油作为燃料B .大规模开采可燃冰作为新能源C .通过清洁煤技术减少煤燃烧污染D .研究推广将二氧化碳转化为淀粉 【答案】D【详解】A .将重质油裂解为轻质油作为燃料,轻质油燃烧仍会产生CO 2,无法有效促进碳中和,A 错误;B .可燃冰成分为甲烷等,甲烷燃烧产生CO 2,无法有效促进碳中和,B 错误;C .通过清洁煤技术减少煤燃烧污染,只是减小了SO 2的排放,并没有减少CO 2的排放,C 错误;D .将二氧化碳转化为淀粉,可减少二氧化碳的排放,对促进碳中和最直接有效,D 正确;故答案选D 。
2.(2022·黑龙江·大庆实验中学高三开学考试)设A N 为阿伏加德罗常数的值,下列说法正确的是A .227.8gNa O 和2Na S 混合物中所含的阴离子总数为A 0.15NB .-12271L 0.1molL K Cr O 溶液中2-27Cr O 离子数为A 0.1NC .常温常压下,124g P 4中所含P-P 键的数目为A 4ND .向密闭容器中充入2molNO 与21mol O 充分反应后容器内的分子数小于A 2N 【答案】D【详解】A .过氧化钠是由1个钠离子和1个过氧根离子构成的、硫化钠是由1个钠离子和1个硫离子构成的,1分子中均含有3个离子,且两者的相对分子质量均为78;则227.8gNa O 和2Na S 混合物可看作NaM ,且物质的量为0.1mol ,其所含的阴离子总数为A 0.1N ,A 错误;B .-12271L 0.1molL K Cr O 溶液中存在Cr 2O 27-+H 2O CrO 24-+2H +,导致2-27Cr O 离子数小于A 0.1N ,B 错误;C .1分子P 4中存在6个P -P 键,常温常压下,124g P 4(物质的量为1mol )中所含P-P 键的数目为A 6N ,C 错误;D .向密闭容器中充入2molNO 与21mol O 充分反应后生成2molNO 2,二氧化氮会发生反应2NO 2N 2O 4,故容器内的分子数小于A 2N ,D 正确;故选D 。
废液中金属铜的回收方法

废液中金属铜的回收方法1. 嘿,你知道吗?可以用置换反应来回收废液中的金属铜呀!就像你拿一个宝贝去换另一个更棒的宝贝一样。
比如说,把铁放进含铜离子的废液中,铜离子就会跑出来和铁结合,这不就把铜给置换出来啦!是不是很神奇?2. 哇塞,还可以用电解法回收金属铜呢!这就好比给废液通上电流,让铜乖乖地出来集合。
就像你引导一群小朋友排好队一样,让铜离子顺着电流的方向聚集到电极上,太有趣啦!比如在一些工厂里就是这么干的呢!3. 嘿呀,沉淀法也是个好办法哟!把能和铜离子反应生成沉淀的物质加进去,让铜沉淀下来。
这就好像捕鱼一样,把铜一网打尽!像加入氢氧化钠,就能看到铜离子变成好看的蓝色沉淀啦,你不想试试吗?4. 哈哈,吸附法也不错呀!找些能吸附铜的东西,把铜吸附住带出来。
就好像一个小魔术贴,紧紧地把铜抓住。
比如活性炭就能干这个事儿,厉害吧?5. 哎呀,利用膜分离技术也能回收铜呢!这就像是给铜建造了特别的通道,让它单独通过。
真的好神奇呀!在一些高科技的地方就会用到这样高端的手段哦。
6. 哟呵,溶剂萃取法了解一下呀!就好像把铜从废液这个大部队里挑选出来,专门带到另一个地方。
就像你在人群中一眼认出你的好朋友一样,精准地把铜弄出来,是不是很牛?7. 嘿,微生物法也很有意思哦!让微生物去和铜打交道,把铜弄出来。
这多像小动物们帮我们干活呀!有些微生物还真的很厉害呢,能把铜吃得死死的。
8. 哇哦,离子交换法也能行!这就像是给铜准备了特殊的座位,让它乖乖坐上去。
是不是很形象?就像在实验室里经常会用到这样的方法来得到纯纯的铜呢!9. 总之,回收废液中金属铜的方法好多呀,各有各的奇妙之处!我们可以根据实际情况选择最合适的方法,让那些铜都能被有效地利用起来,而不是白白浪费掉呀!发挥我们的聪明才智,把铜都好好回收吧!。
高中化学 二轮复习 化学工艺流程图题 专项训练
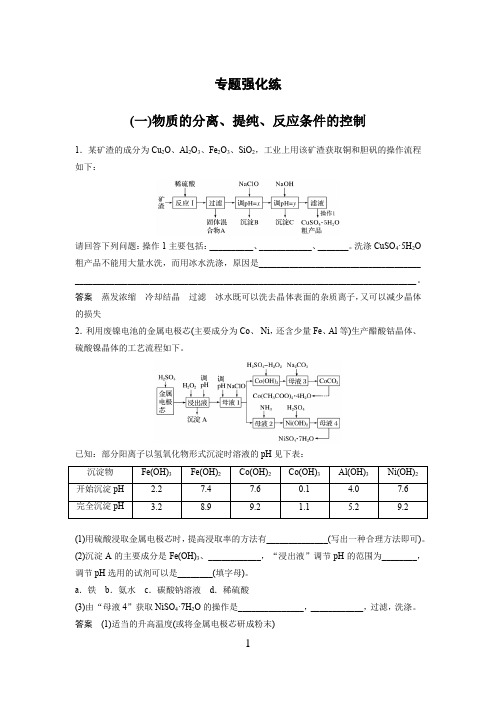
专题强化练(一)物质的分离、提纯、反应条件的控制1.某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:请回答下列问题:操作1主要包括:__________、____________、_______。
洗涤CuSO4·5H2O 粗产品不能用大量水洗,而用冰水洗涤,原因是_____________________________________ ______________________________________________________________________________。
答案蒸发浓缩冷却结晶过滤冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失2.利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Co(OH)3Al(OH)3Ni(OH)2开始沉淀pH 2.27.47.60.1 4.07.6完全沉淀pH 3.28.99.2 1.1 5.29.2(1)用硫酸浸取金属电极芯时,提高浸取率的方法有______________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、____________,“浸出液”调节pH的范围为________,调节pH选用的试剂可以是________(填字母)。
a.铁b.氨水c.碳酸钠溶液d.稀硫酸(3)由“母液4”获取NiSO4·7H2O的操作是_______________,____________,过滤,洗涤。
答案(1)适当的升高温度(或将金属电极芯研成粉末)(2)Al(OH)3 5.2≤pH<7.6 bc(3)蒸发浓缩 冷却结晶解析 (2)金属电极芯中的主要成分是Co 、Ni ,还含少量Fe 、Al 等,加入稀硫酸酸浸时,金属单质都转化为金属离子(Ni 2+、Co 2+、Fe 2+、Al 3+),浸出液中加入过氧化氢的作用是氧化亚铁离子为铁离子,由流程图中最终产物可知,调节pH 的作用是除去溶液中的Fe 3+、Al 3+,故沉淀A 的主要成分是Fe(OH)3、Al(OH)3;为了保证Fe 3+、Al 3+沉淀完全而Ni 2+、Co 2+不沉淀,由表格数据可知,要调节pH 的范围为5.2≤pH<7.6;调节pH 时不能加入铁,因为铁能还原铁离子为亚铁离子,不能加入稀硫酸,因为要将溶液的pH 调大,由流程图中后续所加试剂可知,调节pH 选用的试剂可以是氨水、碳酸钠溶液。
醋酸铜氨废液中铜的回收与综合处理

Cu (NO3 ) 2 + H2 SO4
CuSO4 + 2HNO3
5 实验部分
511 仪器和试剂 主要仪器 :ZD22 型自动电位滴定计 ;721 型分光光度计 : PHS22 型酸度计 ;71512DM 控温仪 ;电热套 ;
电动搅拌器 ;空气压缩机 主要试剂 :浓硫酸 ( G. R) ;浓硝酸 (A. R) ;硫化钠 (C. P) ;三氯甲烷 (A. R) ;2 ,92二甲基21 ,102菲口罗 啉
2Cu (NH3 ) 4Ac2 + H2O + Q
如果同时采取吹脱方式 ,不仅可以最大限度的降低游离氨在废液中的浓度 ,而且能使废液中 CO 氧化成
CO2 直接放空. 由于加热吹脱使废液体积缩小 ,铜离子浓度增加而有利于用沉降方法除铜. 312 Cu2 + 的解吸
由于[ Cu (NH3 ) 4 ]2 + 较稳定 ,我们采取在加入足量硫酸的条件下破坏其稳定性 ,使其转化成为简单的
1 前 言
炼油厂催化氢化过程需纯化氢气 ,常采用按一定比例的低价铜离子 (或称亚铜离子) 和高价铜离子 配合的醋酸铜氨溶液除去氢气中的 CO ,CO2 ,O2 , H2 S 等气体. 虽然醋酸铜氨溶液可再生使用 ,但反复使
用其活性也会逐渐降低 ,最终成为醋酸铜氨废液 (简称废液) ,按文献[ 1 ]方法测得该废液含铜量为 11013 克/ 升 ,同时废液呈碱性含有大量游离氨 ,故具有较强的腐蚀性和刺激性. 目前多采用按一定比例加浓硫 酸沉降分离得硫酸铜和在酸性条件下用铁将铜离子置换成海绵金属铜粉等方法处理[2~3] ,但排除的废 液中含铜离子仍在 0101 克/ 升左右 ,这不但对环境造成严重的污染 ,也损失了大量的贵重金属铜. 经实 验我们探索出了中和法和硫化法相结合的方法处理该废液收到了满意的效果.
醋酸铜氨废液中铜的回收及其废水处理研究

醋酸铜氨废液中铜的回收及其废水处理研究醋酸铜氨废液中铜的回收及其废水处理研究摘要:本研究旨在探究醋酸铜氨废液中铜的回收及其废水处理方法。
通过实验研究,我们确定了一种有效的回收铜离子的方法,并成功实现了废水的处理。
实验结果表明,在一定条件下,通过电解法可以有效地回收废液中的铜离子,并且可将废水处理后达到国家排放标准,具有良好的经济效益和环境效益。
关键词:醋酸铜氨废液;铜离子回收;废水处理1. 引言随着工业化的快速发展,铜在许多领域被广泛应用,如电子、建筑、冶金等。
然而,大量生产和使用铜也导致了大量废液的产生,这些废液中富含高浓度的铜离子,对环境造成了严重的污染。
因此,如何有效地回收废液中的铜离子并进行废水处理,成为一个重要的课题。
2. 实验方法2.1 样品收集我们在工业生产过程中收集了醋酸铜氨废液样品作为研究对象。
废液中铜离子的浓度为50 g/L。
2.2 铜离子回收法实验中,我们采用了电解法进行铜离子的回收。
废液样品中的铜离子经过过滤和预处理后,注入电解池中作为阳极,同时,我们还在电解池中设置了一对不锈钢板作为阴极。
经过一定时间的电解过程后,废液中的铜离子将在阳极上析出。
2.3 废水处理法为了达到废水处理的目的,我们采用了沉淀法。
首先,我们向废液中加入硫化钠,与废液中的铜离子发生反应,生成CuS沉淀。
然后,经过过滤和烘干处理,得到固态的CuS。
最后,将废液进行中和处理,使其达到国家排放标准。
3. 实验结果与分析3.1 铜离子回收效果经过一定时间的电解过程后,我们观察到阳极上析出了大量的铜离子。
通过称量阳极上的铜的质量,我们计算得到铜离子的回收率为90%。
3.2 废水处理效果在进行废水处理实验后,我们对处理后的废水样品进行了分析。
结果表明,经过沉淀和中和处理后,废水中的铜离子浓度被降低到10 mg/L以下,大大低于国家排放标准。
4. 经济效益分析本实验中,我们成功地回收了醋酸铜氨废液样品中的铜离子,并达到了废水处理的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
图 3 N aC l加入量对铜回收率的影响
再考察铜氨废液经硫酸酸化后电解 4 h的铜回 收效果。硫酸酸化对重金属去除率的影响 见表 2。 由表 2可见, 电解液经硫酸酸化后, 不需投加其他添 加剂, 电解 4 h后铜回收率可达 90% 以上, 相当于 N aC l加入量为 70 g /L 左右时的水平。
过测定铜氨废液处理前后溶液中 C u2+ 的质量浓度, 计算铜回收率。
2 结果与讨论
2. 1 化学沉淀法回收铜 铜氨废液的 pH 大致在 8. 0~ 9. 0之间, 当以体
积比为 1 B1的盐酸调节 pH 时, H+ 能破坏铜氨络离 子的稳定结构, 释放出 NH4 + , 进而生成碱式氯化铜 沉淀, 其反应方程式见式 ( 1)。
3. Co llege of Chem istry and E nvironm en tal Science, H ebei U n iversity, B aod ing H ebei 071000, C h ina)
Abstract: Copper in copper-amm onia w aste liquo r, w hich is generated in filtra tion separation o f ferrite produced by hydro therm al synthesis from electrop la ting sludg e, w as reco vered re spective ly by e lectro lysis and chem ical prec ip ita tion. T he experim enta l resu lts show tha:t W ith the chem ical prec ip ita tion pro cess, w hen the pH o f copper-amm onia w aste liquo r is adjusted to 5. 4-6. 4 using hydroch lo ric ac id w ith 1 B1 o f v o lum e f ract ion, so lid Cu2C l( OH ) 3 can be precipitated w ith over 98% o f copper reco very, 5. 83 g o f Cu2C l( OH ) 3 ( 3. 50 g co pper) can be recovered from 1 L o f copperamm onia w aste liquo r; W ith the electro ly sis process, under the conditions o f current density 250 A /m2, e lectro lysis tim e 5 h and e lectro ly sis tem perature 60 e , 3. 54 g o f copper pow der can be recovered from 1 L o f copper-amm onia w aste liquo r w ith ov er 99% o f copper recov ery; T he size and purity o f reco vered copper pow der can m eet the nationa l standardsGB 5246-85. Key words: electrop la ting sludg e; w aste liquo r; chem ica l precip ita tion; electro ly sis; reco very; copper; com prehensive utilization
图 1 铜氨废液的 pH 对化学沉淀法铜回收率的影响
图 2 化学沉淀法沉淀物的 X 射线衍射谱图 C u2 C l( OH ) 3
# 160#
化工 环保 ENV IRO NM EN TAL PRO TECT ION O F CHEM ICA L INDU STRY
2008年第 28卷
2. 2 电解法回收铜 2. 2. 1 添加剂的选择
[摘要 ] 分别采用化学沉淀法和电解法从电镀污泥水热合成铁氧体后过滤分离的铜 氨废液中回收铜。实验结果表
明: 采用化学沉淀法处理铜氨废液, 以体积比为 1 B1的 盐酸调 节铜氨废 液 pH 为 5. 4 ~ 6. 4, 沉 淀出碱 式氯化 铜固
体, 铜回收率在 98% 以上, 1 L 铜氨废液可回收碱式氯化铜 5. 83 g( 合铜 3. 50 g ); 采用电 解法处 理铜氨废 液, 在电
采用调节 pH 使铜氨废液中的铜氨络离子沉淀 的方法回收铜, 即以体积比为 1 B1的盐酸溶液调节 pH 至 4. 0~ 7. 2, 滤出沉淀物, 以去离子水洗涤 6~ 8 次后 在 70 e 下 干 燥 15 h, 即 得 到 较 为 纯 净 的 C u2 C l( OH ) 3固体。 1. 2. 2 电解法
电镀污泥含大量重金属, 如 C u, C r, Pb, N ,i Z n 等 [ 1, 2] , 其中 Cu是一种具有高附加值的回收资源。 电镀污泥水热处理合成铁氧体被证明 是一种消纳
电镀污泥的有效方法。采用水及合适的沉淀剂, 可 将电镀污泥合成铁氧体后分离液中的 C u2+ 富集至 上清液中 [ 3] 。在文献 [ 3] 的基础上, 通过合理处置 将 C u2+ 回收, 对于电镀污泥最大资源化具有很大意
第 2期
陈丹等. 从铜氨废液中回收铜
# 159#
化学法、物化法和生物法, 各种方法之 间的优缺点 也相对明显 [ 4~ 8] 。经多年研究, 国内外多采用化学 法处理含铜废水, 但存在操 作过程复杂、成本较高 等缺点, 同时也很难实现重 金属的一步分 离, 且所 得产品质量不高 [ 9~ 12 ] 。
在 25 e 、电流密度 200 A /m 2、电解时间 4 h的 条件下进行铜氨废液的电解实验, N aC l加入量对铜 回收率的 影响见图 3。当向溶液 中投加强 电解质 N aC l后, 能迅速完全电离生成 N a+ , 承担电荷的传 递, 提高电导率, 增大电流效率, 铜回收率也随之增 加。从图 3可见, 当 N aC l质量浓度为 70 g /L 时标识码 ] A
[文章编号 ] 1006- 1878( 2008) 02- 0158- 04
R ecovery of Copper from Copper-am monia W aste L iquor
Chen D an 1, Yu Y izhong 1, Z hu Hua jun 2, W ang Le i2, Q in Zhe3
表 2 硫酸酸化对重金属去除率的影响
义。含铜废水的处理技 术繁多, 主要包括物理法、
[收稿日期 ] 2007- 09- 18; [修订日 期 ] 2007- 12- 07。 [作者简介 ] 陈丹 ( 1974) ), 女, 浙 江省 瑞安 市 人, 博士, 讲 师, 主 要从 事固 体废 弃物 处理 与资 源化 研究。 电话: 02156338094; 电邮: y izhong - yu@ 163. com。 [基金项目 ] 国家自然科学基 金资助项 目 ( 50704023); 上海 市教委 青年基金资助项目 ( 2006A Z 109)。
图 4 电流密度对铜回收率的影响
2. 2. 3 电解温度的确定 在硫酸加入量 4 mL、电流密度 250 A /m 2、电解
时间 4 h的条件下进行铜氨废液的电解实验, 电解 温度对铜回收率的影响见图 5。由图 5可见, 当温 度达到 50~ 60 e 时, 铜回收率达到 98% 。因此, 确 定电解温度为 60 e 。
本工作采用的铜 氨废液是电镀污 泥水热合成
铁氧体后的含铜分离液。考虑到该液成分较单一、
其他重金属干扰小等特点, 分别采用化学沉淀法和 电解法, 以碱式氯化铜 ( C u2C l( OH ) 3 ) 或单质铜粉 的形式实现铜的一步分离, 为工业处理电镀污泥铜 氨废液提供技术支持。
1 实验部分
1. 1 材料、试剂和仪器 铜氨废液由上海危险废物处理中心提供, 其中
以 100 m L 铜氨废液为电解原液, 石墨为阳极, 铜片为阴极, 极距 10 mm。通过投加一定量的添加 剂增强溶液导电性。电解后以去离子 水洗涤阴极 铜片上的刮取物 6~ 8次, 在真空 25 e 下干燥 15 h, 即得单质铜粉。 1. 3 分析方法
铜氨废液中的重 金属浓度采用 IC P - AES 测 定; 沉淀物的物相组成采用 X 射线衍射仪测定。通
2[ C u( N H3 ) 4 ] 2+ + C l- + 5H+ + 3H2 O
Cu2 C l( O H ) 3 |
+
8
NH
+ 4
( 1)
铜氨废液的 pH 对化学沉淀法铜回收率的影响 见图 1。由图 1可见, 当调节铜氨废液 pH 为 5. 4~ 6. 4时, 铜的回收 率较高, 均在 98% 以 上。由此 可 见, 化学沉淀法回收铜的最佳 pH 为 6. 0 左右, pH 过高或过低都不利于 C u2C l( OH ) 3 的沉淀, pH 过低 会导致 C u2C l( OH ) 3 的复溶, pH 过高则难以破坏铜 氨络离子稳定的配位键。沉淀物的 X 射 线衍射谱 图见图 2。通过分析图 2中的衍射峰, 可 判断沉淀 物为 C u2C l( O H ) 3。 100 m L 铜氨废液经化学 沉淀 法处理后可回收 C u2C l( OH ) 3 5. 83 g, 合铜 3. 50 g。
流密度 250 A /m2、电解时间 5 h、电解温度 60 e 的条件下, 1 L 铜 氨废液可回收 3. 54 g铜粉, 铜回收率超过 99% , 铜
粉的粒径和纯度均可达到 G B5246) 855电解铜粉 6的要求。
