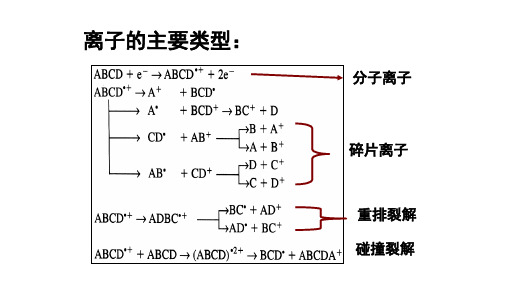
偶电子离子裂解规律
有机分子的裂解规律

- H2C
-H2O
CH2 H2C CH R
M - (Alkene + H2O) M-46
H - H2C C CH3
-H2O
HC CH3 CH2
H2C CH R
M-60
R
H2C H2 C CH
H C H
CH2
- H2C
CH2
H2 R C CH M-76
CH2
酸
H2 C OH C H2 H CH2
- H2O
57
100 90 80 %O B S P A F AE E K 70 60 50 40 30 20 10 0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150
CH3(CH2)7CHO 44
MW 142
M-44 M-43 M-CH2CH2 M-H2O M-1 M
2.化学式的确定
由于高分辨的质谱仪可以非常精确地测定分子离子或碎片离 子的质荷比(误差可小于10-5),则利用表21-3中的确切质 则利用表21 子的质荷比(误差可小于10 ),则利用表 量求算出其元素组成。 量求算出其元素组成。 如CO与N2两者的质量数都是28但从表21-3可算出其确切质 CO与 两者的质量数都是28但从表 但从表21 量为27.9949与28.0061,若质谱仪测得的质行比为28.0040 量为27.9949与28.0061,若质谱仪测得的质行比为28.0040 则可推断其为N 同样,复杂分子的化学式也可算出。 则可推断其为N2。同样,复杂分子的化学式也可算出。
C7 113 C8 C9 C10
C12
M M 15 C16
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210220230
断裂机理-不同类型化合物谱图-2016年
脱离掉的中性小分子及所产生的重排离子均符合氮规 则。 从离子的质量数的奇、偶性可区分经简单断裂所产生 的碎片离子和脱离中性小分子所产生的重排离子。
重排离子质量数为偶数。
麦氏重排条件:
· 含有C=O, C=N,C=S及碳碳双键 · 与双键相连的链上有碳,并在 碳有H原子(氢) · 六圆环过度,H 转移到杂原子上,同时 键发生断裂,
④ 腙:
R H H C N N(CH3)2 R C CH2 H N m/z =86 N(CH3)2
⑤ 环氧化合物:
H O HO
m/z = 58
⑥ 不饱和醇:
C2H5 CH HC H O H2 C2H5 C C CH2 H m/z = 70
⑦ 羧酸:
R CH H O OH OH m/z = 60 OH
(2) 环状化合物的裂解
逆Diels-Alder反应(Retro-Diels-Alder, RDA) 当分子中存在含一个 键的六员环时,可发生RAD反应。
+ +
e
.
+
.
+
.
m/z 54
说明:该重排正好是Diels-Alder反应的逆反应; 含原双键的部分带正电荷的可能性大些; 当环上有取代基时,正电荷也有可能在烯的碎片上
不饱和烃类化合物
R1 HC CH CH2 R2 R1 CH CH CH2 -e R1 R1 CH CH CH2
- R2
R2
CH CH
CH2
从热力学角度出发,在分子离子断裂过程中,能够生成 稳定碎片离子的过程总是优先进行,观测到的碎片离子 丰度也高。
烷基苯化合物
CH2
R
CH2 -e -R
质谱解析入门-基本规律

mi 1 [M (i 1)M H ] /(i 1)
将MH=1代入以上两个公式,可以得出 i (mi 1 1) /(mi mi 1 ) 取1060和1131两个质荷比代入上式计算: i=(1060-1)/(1131-1060)=1059/71=14.9≈15 M=15×1131-15=16950。 该蛋白质为马心肌红蛋白除去血红素辅基后剩下的 肽链部分(153个氨基酸)。
某蛋白质的质谱图如上图,如何计算该蛋白质分子 量?
27
Shimadzu International Trading (Shanghai) Co. Limited
蛋白质分子量计算过程
假设M代表分子量,i代表电荷数,mi代表带i个电荷 的离子的质荷比,MH代表质子的分子量,则有:
mi [M iM H ] / i
未知化合物的质谱解析
找到准分子离子峰和加合离子峰 推断出单同位素分子量 根据同位素丰度、氮规则等推断元素个数 根据环加双键值、碎片离子和其他已知信息推断结构 高分辨质谱、核磁共振确证
7
Shimadzu International Trading (Shanghai) Co. Limited
14
Shimadzu International Trading (Shanghai) Co. Limited
寡核苷酸产生的离子的命名
磷酸二酯键的4种可能的裂解产生8种离子,含5’-OH的离子称an 、bn 、cn和dn而含3’OH的离子称wn 、xn 、yn和zn。下标n指示其裂解位置。碱基的进一步丢失用括号表示, 如a3-B3(A)表示键的开裂发生在3位的磷酸二酯基的核糖碳原子和氧原子之间并在同 一位置进一步丢失了腺苷碱基。
质谱裂解机理中的特征裂解方式

质谱裂解机理中的特征裂解方式有机质谱中的裂解是极其复杂的,但是通过对其质谱裂解方式和机理的探讨研究,我们可以发现有一些特征结构裂解方式在有机质谱的裂解中是普遍存在的,是世界上的大量质谱学家通过对大量的有机质谱裂解方式进行观察、研究后的概括性总结。
所以其具有很重要的参考价值和应用价值,所以在有机质谱解析过程中,必须予以遵循,如此方能得到合理的质谱裂解方式和解析结果。
通过概括总结我们发现有机质谱中大部分化合物具有以下几种特征裂解方式:α裂解、苄基裂解、烯丙基裂解、麦氏重排裂解、DRA裂解(逆狄尔斯阿尔德反应),几种特征裂解方式的强弱顺序如下:苄基裂解>α裂解、i裂解>麦氏重排裂解、DRA裂解>烯丙基裂解当然这种顺序不是一成不变的,随着化合物的结构发生改变,这些特征裂解方式的顺序有可能会发生改变,有机化合物质谱裂解大致可以分为两类α裂解(均裂)、β裂解,我们上面所讲的苄基裂解、烯丙基裂解、麦氏重排裂解、DRA裂解都属于β裂解。
下面我们对几种特征裂解方式做以说明。
1、特征裂解方式1、α裂解α裂解是指凡具有C-X单键基团和C=X双键基团(其中X=C、O、S、Cl等)的有机分子,与该基团原子相连接的单键、称之为α键,在电子轰击条件下,该键很容易断裂因而称之为α断裂。
断键时成键的两个原子各自收回一个电子,这是由游离基中心引发的反应,原动力来自游离基的电子强烈配对倾向,所以α断裂属于均裂。
其裂解的机理及通式如下:I饱和中心II不饱和杂原子几类化合物的α裂解(1)(2)(3)(4)引发α断裂的倾向是由游离基中心给电子的能力决定的,一般来讲N>S、O、π、烷基>Cl、Br>H,同时α断裂遵循最大烷基游离基丢失的原则。
2、苄基裂解通常烷基苯、烷基吲哚、烷基萘、烷基喹啉等化合物具有苄基断裂的特征裂解方式,苄基裂解也属于α裂解。
以丙基苯为例对其裂解机理做以说明在电子的轰击下,苯环上的一对π电子被电离,游离基中心定域到苯环上,诱导α键发生断裂,形成α键的一对电子中的单电子与被电离后的π键的孤电子形成新键,失去烷基自由基,生成偶电子离子。
波谱解析复习——名词解析

波谱学:波谱学是涉及电池辐射与物质量子化的能态间的相互作用,其理论基础是量子化的能量从辐射场向物质转移。
电池辐射区域:γ射线区,X射线区,远紫外,紫外,可见光区,近红外,红外,远红外区,微波区和射频区。
紫外光谱1.助色团:通常把那些本身在紫外或可见光区域吸收带不产生吸收带但与生色团相连后,能使生色团的吸收带向长波方向移动的基团称为助色团(将含有未公用电子对的杂原子基团称为助色团)发色团:有机化合物分子结构中有能吸收紫外光或可见光的基团,此类基团称为发色团。
2.红移:由于化学环境的变化而导致吸收峰长波方向移动的现象叫做红移。
3.蓝移:导致吸收峰向短波方向移动的现象叫做蓝移。
4.增色效应:使紫外吸收强度增加的作用。
5.减色效应:使紫外吸收强度降低的作用。
红外光谱红外吸收:一定波长的红外光照射被研究物质的分子,若辐射能等于振动基态的能级与第一振动激发态的能级之间的能量差时,则分子可吸收能量,由振动基态跃迁到第一振动激发态。
IR选律:在红外光的作用下,只有偶极矩(∆μ)发生变化的振动,即在振动过程中∆μ≠0时,才会产生红外吸收。
1.费米(Fermi)共振:由频率相近的倍频峰和基频峰相互作用产生,结果使倍频峰的强度增大或发生裂分。
2.伸缩振动:沿键轴方向发生周期性变化的振动称为伸缩振动。
3.弯曲振动:沿键角发生周期性变化的振动称为弯曲振动。
4.基频峰:从基态跃迁到第一激发态时将产生一个强的吸收峰,即基频峰。
5.倍频峰:从基态跃迁到第二激发态,第三激发时将产生相应弱的吸收峰,即倍频峰。
6.振动自由度:将多原子分子的复杂振动分解成若干个简单的基本振动,这些基本振动的数目称为分子的振动自由度。
7.指纹区:在红外光谱中,波数在1330~667cm-1 范围内称为指纹区。
8.振动偶合效应:当两个相同的基团在分子中靠得很近时,其相应的特征峰常发生分裂,形成两个峰,这种现象叫作振动偶合。
质谱:是化合物分子在真空条件下受电子流的“轰击”或强电场等其他方法的作用,电离成离子,同时发生某些化学键有规律的断裂,生成具有不同质量的带正电荷的离子,这些离子按质荷比的大小被收集记录的谱。
质谱技术裂解机理的初步认识

质谱技术中裂解机理的初步认识摘要质谱,即质量的谱图,物质的分子在高真空下,经物理作用或化学反应等途径形成带电粒子,某些带电粒了可进一步断裂。
每一离子的质量与所带电荷的比称为质荷比(m/z ,曾用m/e)。
不同质荷比的离子经质量分离器一一分离后,由检测器测定每一离子的质荷比及相对强度,由此得出的谱图称为质谱,本文从质谱的裂解机理,质谱的裂解方式和质朴中的离子类型三方面进行了介绍,对质谱有了更深的理解。
一、质谱裂解机理离子的裂解并不是随意裂解,它必须按“偶电子规则”进行裂解,当含有奇数个电子的离子裂解时,可以产生游离基与一个偶数个电子的离子,或含偶数个电子的中性分子与一个奇数个电子的离子;当含有偶数个电子的离子裂解时,只能产生偶数个电子的离子和中性分子,而不会产生游离基OE EF+R (断1个键)OE OE+Nee (断2个键)EE EE+ Nee (断2个键)EE OE+R (断1个键)(极少产生)注意:奇电子离子有两个活泼的反应中心,即电荷中心和游离基中心;偶电荷离子只有电荷中心。
分子离子的裂解和产物离子的进一步裂解都是由这些中心引发的。
二、质谱裂解的方式(一)简单裂解1.游离基中心引发的断裂反应(α断裂)分子失去电子,形成游离基离子,它的电子有强烈的成对倾向,电子转移与邻近原子形成一个新键,同时邻近原子的α键断裂。
因此,这种断裂通常称为“α”断裂反应,以下分别举例说明各种化合物α断裂过程。
R2R+CR2YR杂原子(Y)的孤对电子电离能较低,很容易去失,形成游离基离子,进而发生α断裂,如αR2O R'R+CH2O R'2. σ键的断裂化合物中某个单键失去电子,则在此处易进一步发生断裂反应,例如烷烃。
R +RCR 3CR 3CR 3σ 能够稳定正电荷的离子丰度较高,如CH 3CH 2CH 3-e CH 3 32CH 33C 33C CH 2CH 3σ+3、电荷中心引发的反应(诱导断裂,i )① 奇电子离子(OE) a. 饱合中心 R Y R'R +i YR上述反应由正电荷对一对电子的吸引所推动,反应发生的难易与该元素的诱导效应有关,一般为卤素>O 、S >> N 、C ;许多碘代烷烃,溴代仲和叔烷烃及氯代叔烷烃,较易产生这个反应。
有机质谱中的裂解反应

α
α
CH2 = O
R2 + R1
醇:
+ OH
+ + OH
α
胺:
R1 H N + R2
R1
H N = CH2 + R2 +
α
H CH2 = N +
R2 + R1
② 异裂—正电荷引发裂解—i 裂解
正电荷引发的i断裂反应:是由正电荷引发的碎裂过程,它涉及两个 电子的转移,动力来自于电荷的诱导。
R1
酮:
R2
C
O
+
i
R1
+
+ R2
C
O
氯代物:
+ Cl
i
+ (CH3)2CH + CH2 = C l
酯:
+ O O i + +
O C O
i断裂与α 断裂小结
1、杂原子为单键时,i断裂和α 断裂所引起的断键位置是不同的。杂 原子为重键时,i断裂并不导致重建的断裂。 2、产物的电荷稳定通常比游离基稳定更重要,因此不同的物质断键
R
C O
a
R
C
a
R'
R . + 'R C
O+
2. 烃类化合物的裂解规律 烃类化合物的裂解优先失去大的基团生成稳定的正碳离子
+ CH2 > H2C CH + + + + + CH2 > CR3 >CHR2>CH2R >CH3
m/z = 91, tropylium
H2C CH
+ CH2
有机质谱中的裂解反应

4. 羰基化合物的裂解
自由基引发的均裂及正电荷诱导的异裂。 自由基引发的均裂及正电荷诱导的异裂。
5. 逆 Diels-Alder 反应( retro- Diels-Alder ) 反应(
6. 氢的重排反应
1) Mclafferty 重排 )
2)自由基引发或正电荷诱导,经过四、五、六元环过渡氢的重排 )自由基引发或正电荷诱导,经过四、
正癸烷
100 % O F BASE PEAK 90 80
m/z=43 C3 C4 m/z=57
n-Hexadecane
70 60 50 40 m/z=29 C2 30 20 10 m/z=85 C6 99 169 183 197 C7 113 127 141 155 C8 C C C1 1 C1 2 C1 3 C1 4 10 9 C5 m/z=71
异裂
半异裂: 半异裂: X
Y
X+ . Y
X+
+
.Y
简单开裂从裂解机制可分为以下主要三种: 简单开裂从裂解机制可分为以下主要三种: (1) α-裂解 ) 裂解 由自由基引发的、由自由基重新组成新键而在α 由自由基引发的、由自由基重新组成新键而在α位导致碎裂的过程称为α 裂解 位导致碎裂的过程称为α-裂解。 碎裂的过程称为 裂解。
各类有机化合物的质谱
1. 烷烃
直链烷烃: )显示弱的分子离子峰。 直链烷烃:1)显示弱的分子离子峰。 2)由一系列峰簇组成,峰簇之间差14个单位。 )由一系列峰簇组成,峰簇之间差 个单位 个单位。 (29、43、57、71、85、99…) 、 、 、 、 、 ) 3)各峰簇的顶端形成一平滑曲线,最高点在C3或C4。 )各峰簇的顶端形成一平滑曲线,最高点在 4)比 M+. 峰质量数低的下一个峰簇顶点是 M-29。 ) - 。 而有甲基分枝的烷烃将有 M-15,这是直链烷烃 - , 与带有甲基分枝的烷烃相区别的重要标志。 与带有甲基分枝的烷烃相区别的重要标志。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)
O
O C N C O N H N C N H O
(3)
(4)
专业质谱培训机构
(5)
2 级MS
O C N N C O H N + NH3
测量值
O
i
O
O
C N
N C O
H N
+
[M+H] +- 17
C N
N C O
H N +
O
O
80
M+ H 195 448
+
O CH3OOC O OCH3 H C
60
(M+Na)+ 631
M+H + m/z 609
40
115
20
365
577
专业质谱培训机构
ESI 源内 CID
m/z 609 m/z 397
ESI In-source CID
NH2
O
4 级MS 专业质谱培训机构
[C3H5N2O]+ 85.0396 85.0388, 9.4ppm
H2 N N C O O
+
NH2
H N
+
质子转移
O
N C O
NH 3
i, [- NH3]
O
N C
H N +
[C7H8N3O2 166.0611
Cl (M+H)+-(H2O) Cl NH2 Cl
rH, i
+ CH CH NH3 m/z 203
专业质谱培训机构
ESI 源内 CID
ESI In-source CID
100
397 609
CH3O
N H
N OCH3 OCH3 OCH3
]+
[C7H5N2O2]+ 149.0346
149.0354, 5.4ppm
O
3 级MS
H N
H N
N C O
+
i
O
N C
N C O
H N
+
O
N C
H N
+
+
O
[C7H5N2O2]
+
[C6H5N2O]+ 121.0396
121.0409, 10,7ppm
149.0346
N C O
H N
+
[- CO]
100
re
- CH3OH
m/z 577 m/z 365
397 609
80
M+ H+ 195 448
re
- CH3OH
60
(M+Na)+ 631
40
115
20
365
577
CH3O
N H CH3OOC
N O + O C H OCH3 OCH3 OCH3
i
+ O C
OCH3 OCH3 OCH3
H3C
O
M+H + m/z 609
3 级MS
H N
H N
+
质子转移
HC
i, [- NH3]
O
HC O O
H2 N + HC O O
O
NH 2
[C6H4NO2]+ 122.0237 122.0230, 5.7ppm
H 2N .. HC + O NH 2
H2 N+
NH 2
[C6H7N2O2 139.0502
]+
HC O O
i
+ H2N O
m/z 149
H N M+H+
+ OH
rH, re + O NH - CH3NHCHO CH3 m/z 193
N m/z 134
专业质谱培训机构
产生 m/z 134 的反应历程
H
H H NH N CH3
OH H O
H
OH O
?
OH O
2级MS
139.0503
166.0611
206.0571
少量杂质:
MH+ 223.0823
3级MS
[C9H11N4O3]+ 223.0826 (1.3ppm)
85.0388 122.0230
139.0510 149.0354
4级MS
4级MS
93.0454 121.0409 专业质谱培训机构
O -
Full MS (FT-ICR)
N H N H N
N
1'
Nicotine-1'-N-oxide
[M+H]+ C10H14N2O1 measured: m/z 179.11801 calculated: m/z 179.11788 Delta 0.13 mmu / 0.7 ppm
CH 3
Cotinine
H H N N
OH O
-
O HN CH3
CH3
H N N Nicotine CH3 MW 162
149.07008
-
OH
3'-Hydroxycotinine 175.08553
C10H12N2O2
H OH H N M+H+
H N + O NH CH3
re + O NH - CH2=CHOH CH3 m/z 193 H OH
O
主成分 Caffeine C8H10N4O2 194.08038
C N C O N
N CH N
杂质 C9H10N4O3 222.07529 (1.3 ppm)
O
O C N C O
O C N C O N N C N H O O
N
H N
NH2
C N C O N
H N
NH2
C
C
(1)
O
O C N C N H N C N O
i
O
N C
+
NH2
NH2
H C H N
NH2
NH2
rH, i
O
+C
O O
[C7H8N3O2]+ 166.0611
C H
rH, i, [-HCN]
..
NH2 N HC + HC O O NH2
HC O O H2 N
+
NH2
[C6H7N2O2]+ 139.0502 139.0510, 5.8ppm
+ NH 3
]+
re
N
O C
.. .. H2N
NH 2
+
N C O O
[M+H]+- 57
O
N C
H2 N +
NH2
O
2 级MS
[C7H8N3O2]+ 166.0611
166.0611
专业质谱培训机构
H2 N N C O O
H
NH2
+
H2 C
+
z O
C NH CH C b
O
c R'
O i NH i CH R C
+
CH C R' O
b
+
O NH CH R C NH H
+
CH C R'
i
+
NH
CH R
NH
CH R
a
O
O NH CH R C NH H
+
H C R'
O C rH , i NH CH R
C NH3
+
c+2
专业质谱培训机构
175.08653
Calculated: 175.0871
H N N Nicotine CH3 W 162
C10H12N2O2 5'-Hydroxycotinine
162.05499
HO NH O CH3 N M+H + m/z 193
- CH3O •
re
- H2O N N CH3 m/z 175
+
i
N
+
NH CH3
HN N CH 3
M+H+ m/z 193
H
质子转移到羰基
OH
+
OH
+
HN N CH3
OH
i
N
m/z 134
专业质谱培训机构
来自某国际机构的考核样品
主成分为:
O N N O Caffeine C8 H10 N4O 2 194.08038 N N
偶电子离子裂解规律
ESI 源内 CID (瘦肉精) ESI In-source CID (clenbuterol)
Cl NH2 Cl H2 CH CH N C(Me)3 OH H M+H+ m/z 277 Cl NH2 Cl H2 CH CH N H C(Me)3 CH2
re - H2O
Cl NH2 H2 CH CH N C(Me)3 m/z 259
尼古丁 (MS/MS)
尼古丁
N N
C10H14N2 162.1 尼古丁
H NH N m/z 163
i
N
HN
re
NH2 CH3
+
N m/z 132
NH N
i
