元素周期律学案 (2)
人教版必修二第一章第二节《元素周期律》(第2课时)教案

【教学设计】必修Ⅱ第一章物质结构元素周期律第二节元素周期律(第2课时)一、教材分析:在本节中,这些知识将更加细化,理论性更强,体系更加完整。
学生已经学习了原子的构成、核外电子排布和元素周期表简介等一些基本的物质结构知识,这些为本节的学习奠定了一定的基础。
通过学习,可以使学生对于所学元素化合物等知识进行综合、归纳。
同时,作为理论指导,学生能更好的把无机化学知识系统化、络化。
本节用第三周期为例,通过典型金属和典型非金属的性质递变,引入元素周期律。
二、教学目标:1、知识与技能:(1)掌握元素的金属性和非金属性随原子序数的增递而呈现周期性变化的规律。
(2)通过实验操作,培养学生实验技能。
2、过程与方法:(1)自主学习,归纳比较元素周期律。
(2)自主探究,通过实验探究,培养学生探究能力。
3、情感、态度与价值观:培养学生辩证唯物主义观点——量变到质变规律三、教学重点难点:重点:元素的金属性和非金属性随原子序数的递增而呈现周期性变化的规律。
难点:探究能力的培养四、学情分析:元素周期律的是高中化学的基础理论内容,但是元素性质的周期性变化可以从资料进行分析而得出的,所以,要注意激发学生的学习主动性,让学生去动手实验获取证据,让学生去分析图表、资料获取信息。
具体来说,对于元素的金属性的周期性变化,可以由学生在分组实验的基础上,观察Na与冷水、Mg与冷水、Mg与沸水、Mg和 Al与同浓度盐酸反应的剧烈程度,根据获得的第一手证据,来推导出结论。
元素的非金属性的周期性变化可以让学生阅读材料、观看实验录像或电脑模拟动画,以获得直观的感性的材料。
五、教学方法:对比、分类、归纳、总结等方法六、课前准备:1.学生的学习准备:预习课本上相关的实验,初步把握实验的原理和方法步骤;完成课前预习学案。
2.教师的教学准备:多媒体课件制作、实物投影仪,课前预习学案,课内探究学案,课后延伸拓展学案。
3.教具准备:两人一组,实验室内教学。
课前打开实验室门窗通风,课前准备好——试管、烧杯、胶头滴管、砂纸、镁带、铝片、试管夹、火柴、酒精灯、酚酞试液、、1m o1/L盐酸,1m o1/LA1C13溶液、3mo1/LNaOH溶液、3mo1/LH2SO4溶液、1m o1/LMgC12溶液。
化学:1.2.3《元素周期律》学案(新人教版必修2).doc
IVA VA非金属性逐▼金属性逐渐金属性逐O非金属性逐渐第二节元素周期律第3课时学案学习目标:知识与技能:1.掌握元素周期表和元素周期律的应用2.了解周期表中金属元素、非金属元素分区。
3.掌握元素化合价与元素在周期表屮位置的关系。
过程与方法:1.归纳、比较。
通过对前面所学知识的归纳比较,掌握“位、构、性”的关系。
2.自主学习。
引导自主探究,分析化合价与元素在周期表中位置的关系。
情感、态度与价值观:培养学生辩证唯物主义观点,培养学生科学创新品质,培养学生理论联系实际的能力学习重点:周期表、周期律的应用学习难点:“位、构、性”的推导。
学习过程:三、元素周期表、元素周期律的应用1、自主学习:(一)元素的金属性、非金属性与元素在周期表中位置的关系看书并认真观察下表,填空并画出金属与非金属的交界线,标出其附近的元素符号。
2、课堂练习:X、Y是兀素周期表中的两种兀素。
下列叙述中能说明X的非金属性比Y强的是()A、X原子的电子层比Y原子的电子层数多B、X的氢化物的沸点比Y的氢化物的沸点低C、X的气态氢化物比Y的气态氢化物稳定D、Y的单质能将X从NaX的溶液中置换出来(二)元素的化合价与元素在周期表中位置的关系3、探究思考:1、标出下列有下划线元素的化合价:NaCI MgCI2 A1CI3 H2SiO3 H3PO4 H2SO4 HC1042、总结最高正化合价与什么有直接关系?得出结论:主族元素最高正化合价= ______________ = ____________ = _________________ 4、探究思考:写出下列化合物中有下划线元素的化合价:Na2CO3与CH4 H2SO4与H2S HCI与HQ04分析最高正化合价与最低负化合价之间的关系,并解释其原因。
得出结论:______________________________________________________________ O5、课堂练习:某元素X的最高价氧化物对应水化物的化学式为HXO4,则其气态氢化物的化学式为:________ ;若其水溶液呈现酸性,且能与AgNOs溶液反应生成白色沉淀,则它在元素周期表中的位置是:__________ 。
高中化学必修2 第二节 元素周期律(第2课时) 学案
D.从硅到氯负价从-4-1
2.已知 X、Y、Z 为三种原子序数相连的元 素,最高价氧化物对应水化物的酸性相对强
弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是 A.气态氢化物的稳定性:HX>H2Y>ZH3 B.非金属活泼性:Y<X<Z
C.原子半径:X>Y>Z 1
D.原子最外电子层上电子数的关系:Y= (X+Z) 2
4.难点:探究能力的培养
二、学习过程
(一)Na 、Mg、Al 和水的反应
Mg
Al
与冷 H2O 反应 与沸 H2O 反应
结论
Na 现象
化学方程 式
Na 与冷水剧烈反应,Mg 只能与沸水反应,Al 与水不反应。
(二)Mg、Al 和盐酸的反应
Mg
Al
现象
反应方程式
结论
Mg、Al 都很容易与稀盐酸反应,放出 H2,但 Mg 比 Al 更剧 烈
(2)最高价氧化物的水化物碱性最强的是
。
(3)最高价氧化物的水化物呈两性的是
。
(4)最高价氧化物的水化物酸性最强的是
。
(5)能形成气态氢化物且最稳定的是
。
8.用原子结构的观点说明元素性质随原子序数的递增而呈周期性变化的原因。
答:
9.X、Y、Z 三种元素的原子具有相同的电子层数,而 Y 的核电荷数比 X 大 2,Z 的
D.X2Y
5.A、B 均为原子序数 1~20 的元素,已知 A 的原子序数为 n, A2 离子比 B2 离子少
8 个电子,则 B 的原子序数为
A.n+4
B. n+6
C.n+8
D.n+10
6.X、Y、Z 是 3 种短周期元素,其中 X、Y 位于同一族,Y、Z 处于同一周期。X 原子
第二节元素周期律第2课时学案.doc
第二节元素周期律第2课时学案知识与技能:1.掌握元素的金属性和非金属性随原子序数的增递而呈现周期性变化的规律。
2.通过实验操作,提高实验技能°过程与方法:1.自主学习,自主归纳比较元素周期律。
2.自主探究,通过实验探究,提局探究能力。
情感、态度与价值观:培养辩证唯物主义观点:理解量变到质变规律。
学习重点元素的金属性和非金属性随原了序数的递增而呈现周期性变化的规律。
学习难点探究能力的培养。
学习过程:一、元素周期律(三)元素周期律1、自主学习:元素的金属性、非金属性强弱判断依据。
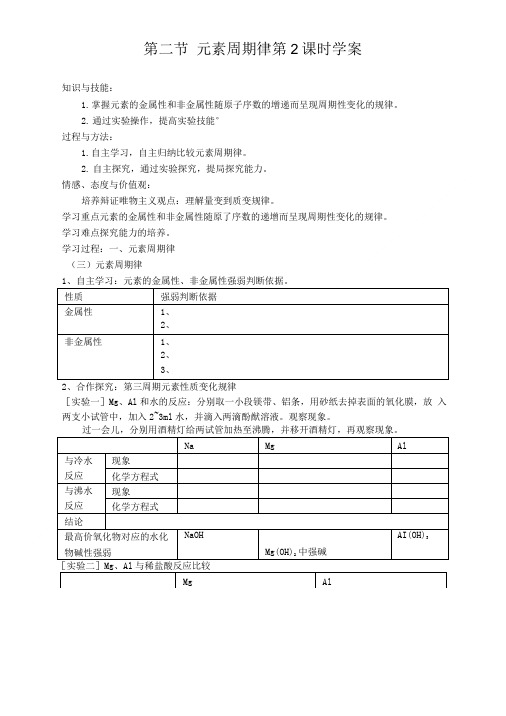
性质强弱判断依据金属性1、2、非金属性1、2、3、2、合作探究:第三周期元素性质变化规律[实验一]Mg、Al和水的反应:分别取一小段镁带、铝条,用砂纸去掉表面的氧化膜,放入两支小试管中,加入2~3ml水,并滴入两滴酚猷溶液。
观察现象。
过一会儿,分别用酒精灯给两试管加热至沸腾,并移开酒精灯,再观察现象。
Na Mg Al与冷水反应现象化学方程式与沸水反应现象化学方程式结论最高价氧化物对应的水化物碱性强弱NaOHMg(OH)2中强碱AI(OH)3[实验二]Mg、Al与稀盐酸反应比较Mg Al现象反应方程式结论[总结]Na、Mg、Al与水反应越来越,对应氧化物水化物的碱性越来越金属性逐渐 c3、自我总结:看资料总结:Si P S CI单质与氢气反应的条件高温磷蒸气与氢气能反应加热光照或点燃时发生爆炸而化口气态氢化物的稳定性最高价氧化物对应的水化物(含氧酸)酸性强弱H2SiO3弱酸H3PO4中强酸H2SO4强酸HCIO4强酸(比H2SO4酸性强)结论[总结]第三周期元素Na Mg Al Si P S Cl,金属性逐渐,非金属性逐渐 O4、自主学习:同周期元素性质递变规律同周期从左到右,金属性逐渐,非金属性逐渐。
根据1—18号元素的原子结构示意图,体会元素性质和原子结构的关系。
决定可归纳出。
5、自主学习:元素周期律(1)定义:0(2 )实质:o6、课堂反馈练习:X、Y、Z三种元索的原了具有相同的电子层数,而Y的核电荷数比X大2, Z的质子数比 Y 多4, 1摩尔X的单质跟足量的酸起反应能置换出1克纨气,这时X转为具有饭原子相同的电子层结构的离子,根据上述条件推测:(1)X Y Z ;(2)X、Y最高价氧化物对应水化物跟的气态氢化物的水溶液反应的离了方程式分别为①,②。
元素周期律第二课时导学案

元素周期律第二课时知识目标:1.掌握元素的金属性和非金属性随原子序数的递增而呈现周期性变化规律2.掌握元素周期表和元素周期律的应用,了解周期表中金属元素、非金属元素分区,掌握元素化合价与元素在周期表中的位置关系教学重点与教学难点:1.元素的金属性和非金属性随原子序数的递增而呈现周期性变化的规律。
2.“位、构、性”的推导知识铺垫:1.随着原子序数的递增,元素原子的呈现周期性变化。
随着原子序数的递增,元素的呈现周期性变化。
随着原子序数的递增,元素的呈现周期性变化。
2.判断元素金属性强弱的依据:(1);(2)。
判断元素非金属性强弱的依据:(1);(2)。
3.钠与水反应的实验现象及方程式:4.Al(OH)3与酸、碱的反应方程式:、自主学习:1.2.相关反应的化学方程式:、、结论:Na、Mg、Al的金属性强弱的顺序是参考资料:/3请大家根据资料以及判断元素非金属性强弱的依据,比较:氢化物稳定性强弱顺序最高价氧化物的水化物的酸性强弱顺序结论:随着原子序数的递增,11~17号的元素的金属性逐渐,非金属性逐渐4.关系?非金属元素的最高正价和最低负价的绝对值之和有什么规律?结论:特殊:氧元素的化合价一般是价,而氟元素正化合价。
元素只有正化合价而无负价。
(2)原子结构与元素在周期表中的位置的关系电子层数= 最外层电子数=5.元素周期表和元素周期律的应用:(1)在元素周期表中:同周期的元素从左至右,元素的金属性,元素的非金属性;同主族的元素从上至下,元素的金属性,非金属性。
在周期表的最右面一纵行是;金属元素与非金属元素之间没有严格的界限,位于金属与非金属分界线附近的元素既能,又能。
参考资料:/(2)指导新元素的发现及预测他们的原子结构和性质。
(3)寻找所需物质在能找到制造半导体材料,如;在能找到作催化剂,耐高温,耐腐蚀的合金材料。
合作交流:请根据学过的碱金属元素(ⅠA),卤族元素(ⅦA)的性质递变规律思考:(1)哪种元素的金属性最强?(不包括放射性元素)位于周期表中什么位置?(2)哪种元素的非金属性最强?位于周期表中什么位置?互动探究:例1:下列说法中肯定错误的是()A.某原子K层上只有一个电子B.某原子M层上电子数为L层上电子数的4倍C.某离子M层上和L层上的电子数均为K层的4倍D.某离子的核电荷数与最外层电子数相等例2:R.W.X.Y.Z为原子序数依次增大的同一短周期元素,下列说法一定正确的是(m.n 均为正整数)()A.若R(OH)m为强碱,则W(OH)m+1也为强碱B.若H n XO m为强酸,则Y是活泼非金属元素C.若Y的最低化合价为-2,则Z的最高正价为+6D.若X的最高正价为+5,则五种元素都是非金属元素例3 超重元素“稳定岛”的假设预言:自然界中可能存在着原子序数为114的元素的稳定同位素208X。
元素周期律导学案第二课时.doc

结论:随着 ________________ 元素原子半径呈现___________________ 。
同一周期元素(0族元素除外),从左到右,元素原子半径逐渐________________3、随着原子序数的递增,元素的主要化合价变化的规律结论:随着 ________________ 元素的主要化合价呈现____________________ o注意:—无正价。
4、请叙述一下比较钠、镁、铝三种金属的金属性强弱的实验设计思路。
5、请叙述一下比较归、磷、硫、氯四种非金属的非金属性强弱的实验设计思路。
III、预习自测1.下列各组元素中,按最高正价递增顺序排列的是A.F、Cl、Br、IB. K、Mg、C、SC. C、N、0、FD. Li、Na、K、Rb2.下列说法正确的是()A.原子序数越大,原子半径一定越大B.电子层数越多的原子半径一定比电子层数少的原子半径大C.元素性质的周期性变化不是元素性质的简单重复D.按C、N、0、F的顺序,元素的最高正价依次升高高一年级化学学科导学案题目:第二节元素周期律第二课时元素周期律【学习目标】1、(1) 了解元素原子核外电子排布、原子半径、主要化合价和元素金属性、非金属性的周期性变化。
(2)认识元素性质的周期性变化是兀素原子核外电子排布的周期性变化的结果,从而理解元素周期律的实质。
2、通过学生观察,分析实验现象,对大量数据、事实进行分析,归纳和总结,培养学生观察和分析问题的能力及逻辑推理能力。
3、了解元素周期律的重要意义,认识事物的变化是由量变引起质变的规律,同时深化对“结构决定性质”以及“在相似中找差别、在差别中找规律”等学科思想的认识。
【重点】1、周期律的含义和实质。
2元素性质与原子结构的关系【难点】元素性质和原子结构的关系c预习案p【使用说明及学法指导】1.先通读教材14〜16页,思考科学探究中的实验,预测实验现象。
2.通过知识准备,回顾已学过的元素及其化合物的知识,复习同主族元素性质的相似性和递变性及其内在原因。
必修第一册化学人教版:元素周期律(第2课时)教案
第四章物质结构元素周期律
4.2 元素周期律(第2课时)
教学设计
一、教学目标
1.知识与技能
(1)了解周期表中金属元素、非金属元素分区。
(2)掌握元素化合价与元素在周期表中的位置关系。
2.过程与方法
(1)自主学习。
自主引导探究,分析化合价与元素在周期表中位置的关系。
(2)归纳、比较。
通过对前面所学知识的归纳比较,掌握“位、构、性”的关系。
3.情感态度与价值观
培养学生辨证唯物主义观点,培养学生科学创造品质以及理论联系实际的能力。
二、教学重难点
1.教学重点:周期表、周期律的应用
2.教学难点:“位、构、性”的推导
三、教学过程
四.板书设计
元素周期律
1、元素的金属性、非金属性与元素在周期表中位置的关系
2、元素的化合价与元素在周期表中位置的关系
(1)主族元素最高正化合价=族序数=最外层电子数=价电子数(2)非金属元素,最高正化合价与最低负化合价绝对值之和等于8。
3、元素周期律、元素周期表的应用。
高中化学优质教案 元素周期律(二) 教学设计[选修]
教案
[讲]同周期元素从左往右,电负性逐渐增大,表明金属性逐渐减弱,非金属性逐渐增强。
同主族元素从上往下,电负性逐渐减小,表明元素的金属性
元素的电负性用于判断一种元素是金属元素还是非金属元素,以及元素的活泼性。
通常,电负性小于2的元素,大部分是金属元素;电负性大于的元素,大部分是非金属元素。
非金属元素的电负性越大,非金属元素越
[科学探究]
在元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”。
查阅资料,比较锂和镁在空气中燃烧的产物,铍和。
1.2元素周期律第2课时:元素周期律学案(人教版必修2)
第2课时元素周期律1.同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物HXO4、H2YO4、H3ZO4的酸性依次减弱,则下列判断正确的是()A.原子半径X最大,Z最小B.非金属性X最强,Z最弱C.气态氢化物中HX最不稳定D.原子序数:Z>Y>X答案 B解析由最高价氧化物对应水化物酸性强弱可知三种元素非金属性强弱顺序为X>Y>Z,则三种元素的原子序数大小关系为X>Y>Z,由同周期元素性质的递变规律可知:原子半径的大小顺序为Z>Y>X,气态氢化物的稳定性为HX>H2Y>ZH3。
2.已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是()A.原子半径:A>B>D>C B.原子序数:d>c>b>aC.离子半径:C>D>B>A D.单质的还原性:A>B>D>C答案 C解析对电子层结构相同的离子,核电荷数越大,半径越小,由题可判断:aA2+=Mg2+,bB+=Na+,cC3-=N3-,dD-=F-,故原子半径:Na>Mg>N>F,原子序数:a>b>d>c,离子半径:N3->F->Na+>Mg2+,还原性:Na>Mg>N>F。
3.下列叙述中,A金属性肯定比B金属性强的是()A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子的电子层数多C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多D.常温时,A能从水中置换出H2,而B不能答案 D解析本题的关键是要弄清金属性强弱的实质是原子失电子的难易程度,原子越容易失电子,其金属性越强,与原子失电子数目无关;其次得失电子的能力主要取决于原子结构,尤其与最外层电子数和电子层数密切相关。
3.3.2 元素符号 元素周期表(2) 学案
课题3 元素第2课时元素符号元素周期表【学习目标】1.理解元素的概念,统一对物质的宏观组成与微观结构的认识。
2.知道元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
3.初步认识元素周期表,知道它是学习和研究化学的工具,能根据原子序数,在元素周期表中找到指定元素和有关该元素的一些其他信息。
【自主学习】阅读教材P59—P60,完成下列各题:1.元素是具有__________________________________________________的总称。
2.在地壳中含量相对较多的元素由高到低依次是___________________________。
3.空气中含量最多的元素是___________,其次是________________而生物体内(包括人体)排在前三位的元1素是______、_______、和_______ 。
4.元素符号由1—2个字母组成。
它们的大小写方式是_____________ 。
5.元素符号都能表示两个意义。
以元素符号Fe 为例⑴(宏观)表示 ________ ⑵(微观)表示 __________。
某些符号还能表示第三个意义(金属元素或稀有气体或固态非金属),表示该元素的单质。
如Fe 还能表示⑶ ______________ 。
6.元素周期表最初由俄国化学家门捷列夫创立,是化学史上最重大的事件之一。
在元素周期表中,横排叫做________ ,竖列叫做_________ 。
原子序数=_________________ = _________________ =_________________元素的分类:__________________、__________________、__________________【共同建构】活动一:问题探究:什么是元素?不同的元素通过什么来区别?1.观察、比较下表中两种碳原子和三种氢原子在结构上有何共同点?几种原子的构成22.你能试着说说什么叫元素吗?(同桌交流)3.阅读课本,进一步理解元素的概念。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013级高一下学期期末复习学案——《物质结构 元素周期律》班级 姓名一、原子结构⎪⎩⎪⎨⎧⎩⎨⎧核外电子中子质子原子核原子X A Z质量数(A) = 质子数(Z) + 中子数(N) 离子电荷数=质子数-核外电子数质子数= = =原子的核外电子数[例1]写出表示含有8个质子、10个中子的原子的化学符号:___________________[例2]已知R 2+离子核外有a 个电子,b 个中子。
表示R 原子符号正确的是( )R D R C R B R A b a 2-a 2b a 2a 2b a 2a b a ++++-+-、、、、二、原子核外电子排布规律核外电子是由里向外,分层排布的,各电子层最多容纳的电子数为 个;最外层电子数不得超过 个(K 层为最外层不超过 个电子),次外层电子数不得超过 个,倒数第三层电子数不得超过 个。
1、核外电子数相同的粒子规律⑴核外电子总数为10个电子的粒子共有15种。
阳离子有 ; 阴离子有 ;分子有 . ⑵核外电子总数为18个电子的粒子共有16种。
阳离子有 ; 阴离子有 ;分子有 .2、几种表示方法:原子结构示意图、电子式(电子式表示形成过程)、结构式、空间构型[例3]下列分子中所有原子都满足最外层8电子结构的是A 、六氟化氙(XeF 6)B 、次氯酸(HClO)C 、氯化硫(S 2Cl 2)D 、三氟化硼(BF 3)[例4]A +、B +、C -、D 、E 五种粒子(分子或离子)它们分别含10个电子,已知它们有如下转化关系:①A + + C -→D + E ②B + + C -→2D 。
据此,回答下列问题:⑴写出所列离子的电子式A +____________、B +____________、C - 。
⑵具有相同空间构型的粒子是 和 (写化学符号),A +离子中的键角为 。
⑶写出B +和E 反应的离子方程式 。
[例5] A 、B 、C 、D 、E 分别代表5种微粒,每种微粒中都含有18个电子。
其中A 和C 都是由单原子形成的阴离子,B 、D 和E 都是分子;又知在水溶液中A 跟B 反应可生成C 和D ;E 具有强氧化性:⑴用化学符号表示上述5种微粒:A ,B ,C ,D ,E ; ⑵在溶液中A 跟B 反应的离子方程式是: 。
三、核素与同位素1、同位素: 相同, 不同的原子互称 。
①同一元素的各种同位素(原子)虽然质量数不同,但 几乎完全一样;②天然存在的元素里,不论是游离态还是化合态,各种同位素所占的 一般是不变的。
2、相对原子质量⑴原子的相对原子质量:以一个12C 原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。
它是相对质量,单位为1⑵元素相对原子质量的计算:元素的相对原子质量是按各种天然同位素原子所占的原子个数百分比求出的平均值。
......%%2211+⨯+⨯=a Ar a Ar Ar其中Ar 1、Ar 2…为 的相对原子质量,a 1%、a 2%…为同位素的 或同位素的原子的物质的量分数但不是 分数。
四、元素周期律的实质及内容:1、元素周期律的内容及实质:⑴元素的性质随着元素 ,这个规律叫元素周期律。
元素性质的周期性变化是元素原子的 的必然结果,这就是元素周期律的实质。
2、元素周期律包括三个方面的内容⑴核外电子排布的周期性变化:原子的最外层电子数由1→8(第一周期1→2) ⑵原子半径的周期性变化:元素的原子半径由大→小(稀有气体例外) ⑶主要化合价的周期性变化:正价+1→+7 负价-4 →-1(F 、O 例外)3、微粒半径大小比较规律⑴同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐 。
⑵同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐 。
⑶电子层结构相同的离子,核电荷数越大,则离子半径 。
⑷同种元素的微粒半径: 离子< < 离子。
4、金属性、非金属性强弱的实验事实⑴金属性强弱的实验事实①元素的单质与 或 反应置换出氢的 或反应的剧烈程度②元素的单质的 (或离子的 )③元素的氧化物对应的水化物即氢氧化物的 强弱⑵非金属性强弱实验事实①与H 2反应生成 的 或反应的剧烈程度或生成的气态氢化物的②元素最高价氧化物对应的水化物 强弱③单质的 (或离子的 )强弱注意:金属性不等同于还原性,同理非金属性不等同于氧化性。
例如I -有较强的还原性而不是金属性;Ag +有氧化性而不是非金属性。
五、元素周期表的实质及内容:1、元素周期表的结构⑴周期:由 决定,7个横行为 。
短周期指 长周期指⑵族:18个纵行,共 个族: 个主族、 个副族、 零族,1个 。
主族有第 纵行,依次为 ;副族有第 纵行,依次为 ;第 纵行为零族;第8、9、10纵行为 族。
2、几个量的关系 周期数= 最外层 = 序数=主族元素的 + =8 (对非金属而言,金属无负化合价)3、同周期、同主族元素的性质递变规律(从上到下,从右向左金属性逐渐增强;从左到右,从下至上非金属性逐渐增强)4、周期表中部分规律总结⑴最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He例外)。
⑵在周期表中,第ⅡA与ⅢA族元素的原子序数差别有以下三种情况:①第1~3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差25。
⑶同族(主族+零族)相邻元素的原子序数差别有以下两种情况:①第ⅠA、ⅡA族上,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅢA~ⅦA族以及零族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
⑷元素周期表中除第Ⅷ族元素以外,原子序数为奇(或偶)数的元素,元素所在族的序数及主要化合价也为奇(或偶)数。
⑸元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般既有金属性,也有非金属性。
⑹对角线规则:沿周期表中金属与非金属分界线方向对角(左上角与右下角)的两主族元素性质相似,这一规律以第二、三周期元素间尤为明显。
如Li与Mg、Be与Al、B与Si性质相似;[例6]已知短周期元素的离子a A2+、b B+、c C3-、d D-都具有相同的电子层结构,则下列叙述正确的是( )A、原子半径A>B>C>DB、原子序数d>c>b>aC、离子半径C>D>B>AD、单质的还原性A>B>D>C[例7]X、Y、Z、W四种主族元素,若:X的阳离子与Y的阴离子具有相同的电子层结构;W 的阳离子氧化性大于等电荷数的X阳离子的氧化性;Z的阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小排列的顺序是( )A、Z>X>Y>WB、W>X>Y>ZC、X>Z>Y>WD、Z>Y>X>W[例8]设X,Y,Z代表三种元素, 已知:⑴X+和Y-两种离子具有相同的电子层结构;⑵Z元素原子核内质子数比Y元素原子核内质子数少9;⑶Y和Z两种元素可以形成4核42个电子的负一价阴离子;据此,请填空⑴Y元素是________X元素是_________⑵由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是__________[例9]致冷剂是一种易被压缩,液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度变冷,从而达到致冷目的。
人们曾采用过乙醚,CH3Cl等作致冷剂,但它们不是有毒,就是易燃。
于是科学家根据元素性质的递变规律,开发新的致冷剂。
据现有知识,有些元素化合物的易燃烧,毒性变化趋势如下:⑴氢化物的易燃性:第二周期> H2O>HF,第三周期SiH4>PH3> >⑵化合物的毒性:PH3>NH3;H2S H2O;CS2CO2;CCl4>CF4(填:<或>)于是科学家们开始把注意力集中在含F、Cl化合物上。
⑶已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围介于其间。
经过较长时间反复试验,一种新的致冷剂CF2Cl2终于诞生了,其他类似的还可以是⑷然而,这种致冷剂造成了当今的某一环境问题是,但求助于周期表中元素及其化合物的变化趋势来开发致冷剂的科学思淮方法是值得借鉴的.①毒性②沸点③易燃性④水溶性⑤颜色a①②③b②④⑤c②③④[例10]在短周期元素中⑴ 最高价氧化物对应的水化物既能与酸反应又能与碱反应均生成盐和水的元素有 ⑵ 最高正价与最低负价代数和等于0的元素有________________________________ ⑶ 最高正价等于等于最低负价绝对值的3倍的元素是__________________________⑷ 最外层电子数等于核外电子总数的一半的元素是____________________________⑸ 最外层电子数等于内层电子总数的一半的元素有____________________________[例11] 元素周期表中,金属和非金属元素的分界线附近能找到的元素是( )A 、研制新型农药元素B 、制半导体材料元素C 、制造催化剂元素D 、制耐高温合金元素[例12]A 、B 、C 、D 为同一周期的4种元素,已知0.2 mol A 与足量酸充分反应后生成2.24 L H 2(标准状况下)。
B 的氧化物既可溶于酸又可溶于强碱溶液。
C 、D 离子的电子层结构与氩原子相同,C 点燃时与氧气反应生成的氧化物可与C 的气态氢化物反应得到C 的单质,D 单质常温下为气态。
⑴A 、B 、C 、D 的元素名称分别为:A ,B ,C ,D 。
⑵画出B 的原子结构示意图 。
⑶C 在周期表中位于第 周期, 族。
⑷写出B 的最高价氧化物与D 的最高价氧化物的水化物反应的离子方程式: ⑸写出C 点燃时与氧气反应生成的氧化物可与C 的气态氢化物反应得化学方程式:[例13]短周期元素X 、Y 、Z 在周期表中的位置关系如图所示,已知X 最外层电子数为2,则下列叙述中正确的是( )A 、Z 一定是活泼的金属元素B 、Y 的最高价氧化物的水化物是一种强酸C 、1molX 的单质跟足量水反应时,发生转移的电子为2molD 、Y 的氢化物稳定性大于Z 的氢化物稳定性六、化学键化学键: 之间 的相互作用,人们把使 相结合或 相结合的作用力通称为化学键,化学反应的过程,本质上就是 的过程,⎪⎩⎪⎨⎧⎩⎨⎧种原子之间非极性(共价)键:同种原子之间极性(共价)键:不同共价键:原子之间间离子键:阴、阳离子之化学键 含共价键的物质不一定是共价化合物,可能是 或 ;(举例)含极性共价键的离子化合物有 ;含非极性键的离子化合物有 ;既有极性键又有非极性键的共价化合物有七、分子间作用力及氢键:影响物质的物理性质如熔沸点等;氢键不是化学键,通常存在于 这三种分子之间,使得这三种物质的熔沸点比同主族其他元素氢化物的熔沸点高;重点物质的电子式:CO 2 NH 4Cl NaOH K 2O 2 CCl 4 OH - H 3O + N 2 Na 3N BF 3 CN - PCl 5 HClO H 2O 2 —OH —COOH —CH 3 —CHO He Ar Br 2 S Mg NaH电子式表示物质的形成过程:H 2O CH 4 Na 2S MgCl 2 CaO CS 2 NH 3结构式的书写:C 2H 6 C 2H 4 C 6H 6 C 2H 5OH CH 3COOH PCl 3 CO 2 H 2O N 2 N 2H 4。
