钠及其化合物一轮复习
高考一轮复习钠及其化合物
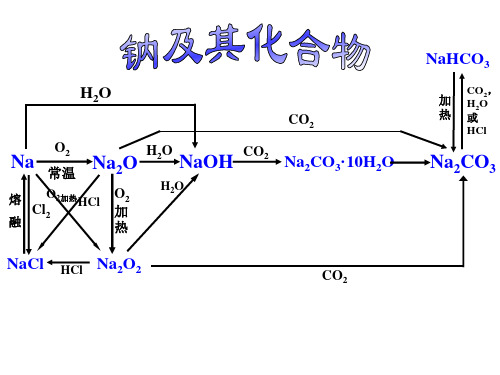
Na2CO3、NaOH
CO2,
H2O 或
HCl
Na2CO3
练习:向含a摩尔NaOH的溶液中,缓慢通入 b摩尔CO2气体,充分反应后,在低温低压下 蒸发溶液,得到不含结晶水的白色固体。 白色固体有四种可能组成,请填写下表:
a/b的取值范围
白色固体组成
1 a/b≤1 2 1< a/b<2 3 a/b=2 4 a/b>2
NaHCO3 Na2CO3、NaHCO3
H2O
CO2
Na
O2 常温
Na2O H2O NaOH CO2
熔 融
O2加热
Cl2
HCl
O2 加
热
H2O
Na2CO3·10H2O
NaCl HCl Na2O2
CO2
NaHCO3
加 热
CO2,
H2O 或
HCl
Na2CO3
一、钠
1、钠的物理性质:
颜色 光泽 状态 密度 硬度
银白色 金属光泽 固态
比水小 比煤油大
四、NaOH
1.俗名: 烧碱、火碱、苛性钠 2.潮解
43..工氢业氧2制化、法钠固氢体溶氧于化水会钠放出N大a量O的H热.
电解
2NaCl + H2O = 2NaOH + H2 ↑ +Cl2 ↑ 5. 碱的通性
与CO2反应的量的关系
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3 nco2:nNaOH=1:2时,产物只有Na2CO3
HCO3-+H+=CO2↑+H2O
与强碱
HCO3-+OH-=CO32-+H2O
钠及其化合物-2024年高考化学一轮复习课件

Na+ +11 2 8 1
(O2﹑CI2﹑H2O﹑H+等) 失去1个e-
Na+ +11 2 8
(1)与非金属单质(如 O2、Cl2)的反应:
常温:4Na+O2===2Na2O
O2:
加热:2Na
△ +O2=====Na2O
2
Cl2: 2N__a_+__C__l_2___高_温______2_N_a__C_l___ 。
2
Байду номын сангаас
3
考点一 钠的性质
必备知识,识记理解
1.钠的物理性质
颜色 密度
___银__白___色,有金属光泽。
ρ(H2O)___>___ρ(Na)___>___ρ(煤油)。
熔点 ___低__于___100 ℃。
硬度 质地__柔__软____,可以用小刀切割。
传导性 可导电、导热。
2.钠的化学性质 从钠原子的结构认识钠的化学性质——还原性:
决定了反应速率的快慢,由三种物质电离H+的能力可知H+浓度的大小顺序 为c>a>b,因而反应速率为c>a>b
2.按要求书写反应的离子方程式(1)将Na投入到Ca(HCO3)2溶液中,反应后 生成正盐溶液: ______2_N_a_+__C__a_2+__+__2_H_C__O_3_2_- _=_C__a_C_O__3↓_+__2_N__a_+_+__C__O_3_2-_+__H_2_↑_________________。 (_2_)_将__N_a_2投_N_入_a_+到__NN_H_H_44+_H+__CH_O_C_3O溶__3液-__=中__2,_N_a有_+_刺+__激C__O性_3_2气_-+_味_N_气_H_3体_↑_+放__H出_2_↑:___________________。
考点13钠及其化合物(核心考点精讲)-备战2025年高考化学一轮复习(全国通用)

考点13 钠及其化合物(核心考点精讲)一、3年真题考点分布二、命题规律及备考策略【命题规律】从近三年高考试题来看,本专题一般与其他专题内容结合起来进行考查,常以一个选项或一个填空的形式考查钠与过氧化钠的性质、碳酸钠与碳酸氢钠的鉴别及有关计算。
【备考策略】1.构建网络,使知识系统化;2.注重与氧化还原反应、电化学、综合实验等融合。
【命题预测】预测2024年高考对本专题的考查特点不变,直接出现大题的可能性不大,但有考查迁移能力的可能性,考查物质的结构与性质(如钠的活泼性、过氧化钠的结构与性质、碳酸氢钠的热不稳定性)的选择题出现概率较大。
可能还会在选择题中考查钠与水的原理,过氧化钠的电子式、与水反应的电子转移等。
1.钠的物理性质银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。
2.从钠原子的原子结构认识钠的化学性质——还原性Na―――――――――→O 2、Cl 2、H 2O 、H +等失去e -Na+(1)与非金属单质(如O 2、Cl 2)的反应O 2{常温:4Na +O 2===2Na 2O ,加热:2Na +O 2=====△Na 2O 2 Cl 2:2Na +Cl 2=====点燃2NaCl (2)与水反应①离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====通电2Na +Cl 2↑。
(2)保存:密封保存,通常保存在石蜡油或煤油中。
4.钠的用途(1)钠钾合金(液态)可用于原子反应堆的导热剂。
(2)用作电光源,制作高压钠灯。
(3)冶炼某些金属金属钠具有强还原性,熔融状态下可以用于制取金属,如4Na +TiCl 4=====熔融4NaCl +Ti 。
(1)钠与水、酸反应的实质都是与H +的反应。
高三化学第一轮复习钠及其化合物人教.pptx

密封、远离易燃物
第18页/共68页
[高考考查层面] 命题点 1 过氧化钠的强氧化性
1.从元素化合价角度分析Na2O2的性质
失去电子,化合价升高
0
O2
表现为还原性
-1
Na2O2
得到电子,化合价降低 -2
表现为氧化性
O
第19页/共68页
2.强氧化性的五个表现
第20页/共68页
[典题示例] 1.在溶液中加入足量的Na2O2后仍能大量共存的离子组是
[考点达标层面]
1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)(2014·山东高考)Na2O2与水反应是水作还原剂的氧化还原
反应。
(× )
(2)(2014·江苏高考)过氧化钠的电子式为Na
O··
··
O··
··
Na。
(× )
(3)(2014·江苏高考)在过氧化钠与水的反应中,每生成0.1 mol
+H2O===2Na++2OH-+O2↑。
(× )
第30页/共68页
2.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一
般在飞船内安装盛有Naຫໍສະໝຸດ O2或K2O2颗粒的装置,它的用途是产
生氧气。下列关于Na2O2的叙述正确的是
()
A.Na2O2中阴、阳离子的个数比为1∶1
_N_a_2_O__+__2_H__C_l_=_=_=__2_N__a_C_l__ 与盐酸反应 _+__H_2_O
主要用途
可制烧碱
保存
密封
过氧化钠(Na2O2)
_2_N__a_2_O_2_+__2_H__2_O__=_=_=__ _4_N_a__O_H__+__O__2↑___ _2_N__a_2_O_2_+__2__C_O__2_=_=_=__ _2_N__a_2_C_O__3_+__O__2__ _2_N__a_2_O_2_+__4__H_C__l=__=_=__ _4_N__a_C__l+__2__H_2_O__+__O__2↑___
2024届高三化学高考备考一轮复习专题:钠及其重要化合物课件

、
g。
(5)无水Na 2 CO 3 可作为基准物质标定盐酸浓度。称量前,若无水Na 2 CO 3
保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结
果
A.偏高
答案:A
(填字母)。
B.偏低
C.不变
1.侯氏制碱法
(1)制备原料
食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气,其反应为C+
B.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
C.Na和O2在加热时反应生成Na2O2,在常温下反应生成Na2O
D.Na2O2能与水反应,生成NaOH,所以Na2O2是碱性氧化物
2.对Na2O2与CO2和H2O(g)混合气体的反应来说,下列说法错误的是(D
)
A.只要参加反应的Na2O2一定,反应生成的氧气就一定
答案:aefbcg
(2)B中使用雾化装置的优点是
。
答案:增大接触面积,使反应更充分
(3)生成NaHCO3的总反应的化学方程式为
。
答案:CO2+NH3+NaCl+H2O
NaHCO3↓+NH4Cl
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量
Na2O2,Na2O2增重0.14 g,则固体NaHCO3的质量为
②向滤液中加入NaCl粉末,存在NaCl
(s)+NH4Cl(aq)
NaCl(aq)+
NH4Cl(s)过程。为使NH4Cl沉淀充分析
出并分离,根据NaCl和NH4Cl的溶解度曲
线,需采用的操作为
高三一轮复习钠及其化合物ppt课件

△ 2NaHCO3
Na2CO3+CO2↑+H2O
七、碱金属元素的原子结构和碱金属的性质的比较
K例外
元元核 素素电 名符荷 称号数
相似性
颜 色 最外 和 层电
状 子数
化学 性质
态
递变性
熔 点
沸 点
密 度
原 子 半 径
电 子
层 数
还 原 性
锂 Li 3 银
单质都是 降 降 增 增 增 增
钠 Na 11 白
一、钠的物理性质
金属钠:色 银白色 密度 小 导电、传热性
态 固体
熔沸点
良好
硬度 软
低
二、钠的化学性质
(一)与非金属反应
1、钠与氧气反应:
失4e-
4Na + O2
2Na2O (白色)
得4e-
失去2e-
2Na + O2 点燃 Na2O2(淡黄色) 得到2e-
2、与其它非金属反应:
在氯气中燃烧: (剧烈、产生白色的烟) 2Na + Cl2 点燃 2NaCl
解析 ①为了滤去黄光;②、③除去铂丝上的杂质; ④本身颜色越微弱的火焰在实验时干扰越小,被检 验物质的火焰颜色越明显;焰色反应除用铂丝外, 还可以用光洁无锈的铁丝、镍丝、铬丝等。 答案 D
从使用情况来看,闭胸式的使用比较 广泛。 敞开式 盾构之 中有挤 压式盾 构、全 部敞开 式盾构 ,但在 近些年 的城市 地下工 程施工 中已很 少使用 ,在此 不再说 明。
碳酸氢钠 四种:Na.C.H.O
俗名
纯碱、苏打
小苏打
晶体颜色 白色粉末
细小的白色晶体
溶解性
易溶
可溶
与酸反应 现象明显
2024届高三化学高考备考一轮复习:钠及其化合物课件
(6)1 mol Na2O与Na2O2的混合物中阴离子数为6.02×1023。( ) (7)Na、Na2O2投入FeCl3溶液中均有红褐色沉淀和气体生成。( ) [答案] (1)× (2)√ (3)× (4)× (5)√ (6)√ (7)√
钠及其氧化物的性质与应用 1.把一小块金属钠放入下列溶液中,说法正确的是( C ) A.放入饱和NaOH溶液中:有氢气放出,恢复至原温度后溶液的 pH增大 B.放入稀CuSO4溶液中:有氢气放出,有紫红色铜析出 C.放入MgCl2溶液中:有氢气放出,有白色沉淀生成 D.放入NH4NO3溶液中:有无色无味气体放出
[答案] (1)NaHCO3+CH3COOH===CH3COONa+CO2↑+H2O (2)小苏打水具有碱性,能与酸性物质反应,减小酸性 (3)若服用 小苏打药品,胃中的酸与小苏打反应生成CO2气体,加重胃溃疡
Na2CO3与NaHCO3的性质及应用 1 . 有 关 NaHCO3 和 Na2CO3 与 盐 酸 的 反 应 , 以 下 叙 述 错 误 的 是 (C )
①与非金属反应O2常 加温 热: :4_N_2_Na_+a_+_O_O_2=_2=_==_=△2_=N_=_=a_2N_Oa_2_O__2 ______ Cl2:2Na+Cl2==△===2NaCl
②与 H2O 反应:_2_N_a_+__2_H__2O__=_=_=_2_N__a_O_H__+__H_2_↑__。
2.纯碱和小苏打是厨房中两种常见的物品,它们都是白色固体, 下列区分这两种物质的方法中正确的是 ( C ) A.分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏 打 B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生 明显变化的是小苏打 C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食 醋,产生气泡快的是小苏打 D.先将两种样品配成溶液,分别加入澄清石灰水,无白色沉淀生 成的是小苏打
2025届高中化学一轮复习练习:钠及其重要化合物(含解析)
钠及其重要化合物一、单选题(共15题)1.一定温度下,向饱和碳酸钠溶液中通入足量的CO 2气体,忽略溶液体积的变化,所得溶液中有关量一定变大的是A .c (H +)B .c (Na +)C .n (H 2O)D .n ()2.下列关于钠及其化合物的说法正确的是A .与都具有强还原性B .和长期露置于空气中最终产物不相同C .将足量的、和分别加入含有酚酞的水中,最终溶液均变为红色D .将少量和分别投入溶液中,均既有沉淀生成又有气体放出3.以NaCl 为原料,可制取Na 、Na 2O 2、NaOH 和Na 2CO 3等。
Na 2CO 3,可用侯氏制碱法制取,主要涉及如下反应:N 2(g)+3H 2(g)2NH 3(g) ΔH=-92.4kJ·mol -1NaCl+NH 3+CO 2+H 2O=NaHCO 3↓+NH 4Cl 2NaHCO 3Na 2CO 3+CO 2↑+H 2O在指定条件下,下列选项所示的物质间转化不能实现的是A .Na(s)Na 2O 2(s)B .Na 2O 2(s)Na 2CO 3(s)C .NaCl(aq)Cl 2(g)D .NaOH(aq)Al(OH)3(s)4.下列过程不涉及氧化还原反应的是A .电解熔融氯化钠制备金属钠B .用氯气制消毒液C .过氧化钠做供氧剂D .用NaHCO 3治疗胃酸过多5.“铷(Rb)原子钟”被誉为卫星的“心脏”。
下列说法正确的是A .金属铷的熔点高于钾B .的中子数为48C .和化学性质不同D .铷元素属于ⅠB 族6.纯碱是重要的化工原料之一。
下列有关Na 2CO 3的说法错误的是A .Na 2CO 3的溶解度比NaHCO 3小B .Na 2CO 3是生产玻璃的原料之一23CO -Na Na +2Na O 22Na O Na 2Na O 22Na O Na 22Na O 4CuSO A A †‡AA Δ2O (g)Δ−−−→2CO (g)−−−→电解−−−−→Al(s)−−−→8537Rb 8537Rb 8737RbC .Na 2CO 3属于离子晶体D .Na 2CO 3的焰色反应呈黄色7.下列关于的叙述不正确的是A .是碱性氧化物B .能与发生反应C .可以作供氧剂D .能与发生反应8.向100mLNaOH 溶液中通入一定量的CO 2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L 的盐酸,产生CO 2的体积与所加盐酸体积之间关系如图所示。
高考化学一轮总复习课件钠及其重要化合物
THANKS
感谢观看
实验现象
溶液由红色逐渐变无色。
实验结论
氢氧化钠与盐酸反应生成氯化 钠和水。
碳酸钠和碳酸氢钠的性质实验
实验目的
探究碳酸钠和碳酸氢钠的性质差异。
实验步骤
分别向盛有碳酸钠和碳酸氢钠溶液的试管中滴加稀盐酸,观察现象; 再分别加热两种固体,观察现象。
实验现象
碳酸钠与稀盐酸反应产生气泡较慢,碳酸氢钠与稀盐酸反应产生气泡 较快;加热碳酸钠无明显变化,加热碳酸氢钠有气体产生。
高考化学一轮总复习课件
钠及其重要化合物
汇报人:XX
20XX-01-12
• 钠元素及其性质 • 钠的重要化合物 • 钠及其化合物的相互转化 • 钠及其化合物的实验探究 • 高考真题解析与备考策略 • 知识拓展与前沿动态
01
钠元素及其性质
钠元素的原子结构和性质
原子结构
钠是元素周期表中第11号元素,位于第三周期第IA族。其原子结构为2-8-1,最 外层只有一个电子,容易失去形成+1价的阳离子。
加强实验技能的训练,熟悉与钠及其 重要化合物相关的实验操作和规范, 提高实验能力。
做题技巧指导
提供做题技巧指导,如选择题答题技 巧、填空题答题规范等,帮助学生提 高答题效率和准确性。
易错点与难点剖析
易错知识点归纳
总结学生在学习钠及其重 要化合物时容易出错的知 识点,进行归纳和分类。
典型错题分析
选取典型的错题进行分析 ,找出错误原因和解题思 路上的误区,帮助学生避 免类似错误。
实验结论
碳酸钠和碳酸氢钠都能与酸反应生成二氧化碳气体,但反应速率不同 ;碳酸氢钠受热易分解生成碳酸钠、水和二氧化碳。
05
高考真题解析与备考策略
2024届高考化学一轮总复习:钠及其重要化合物课件
与 Na2SO4 不反应,不能产生沉淀,不符合题意;③中反应消耗水,溶液温度升高,
Ca(OH)2 的溶解度降低,析出 Ca(OH)2 沉淀;④中 Ca2++HCO-3 +OH-===CaCO3↓
+H2O;⑤中生成的 Cu(OH)2 是蓝色沉淀,不符合题意;⑥中水减少,c(Na+)增大,
1.将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是
()
①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水 ④Ca(HCO3)2溶液
⑤CuSO4溶液 ⑥饱和NaCl溶液
A.①④⑤⑥ B.①③⑤⑥Biblioteka C.②④⑤⑥ D.①③④⑥
解析:2Na+2H2O===2NaOH+H2↑,①中 Mg2++2OH-===Mg(OH)2↓;②中 NaOH
第二单元
金属及其化合物
第4讲 钠及其重要化合物
考点要求
核心素养
1.宏观辨识与微观探析:从微观的角度认识钠的原子结构、
1.了解钠的制备方法,理解其性质,从宏观辨识钠及其化合物的性质和应用,理
掌握其主要性质及应 解“结构决定性质”的内涵。
用。
2.变化观念与平衡思想:通过比较、分析钠及其化合物的
2.了解钠的重要化合 性质和应用,加深对化学变化需要一定的条件,并遵循一
呈淡黄色
(2)与水反应(与滴加酚酞的水反应)。
化学方程式:2Na+2H2O===2NaOH+H2↑。 离子方程式:2Na+2H2O===2Na++2OH-+H2↑。 (3)与乙醇反应。 钠沉入乙醇中,缓慢逸出气体,化学方程式: 2Na+2C2H5OH―→2C2H5ONa+H2↑。
(4)与酸溶液反应。 钠与酸溶液的反应比与水的反应更剧烈,离子方程式:2Na+2H+===2Na++H2↑。 (5)与盐(如CuSO4)溶液反应。 离子方程式:2Na+2H2O===2Na++2OH-+H2↑、Cu2++2OH-===Cu(OH)2↓。 4.保存:钠很容易跟空气中的氧气和水起反应,因此在实验室中,通常将钠保存 在煤油或石蜡油里,由于ρ(Na)>ρ(煤油),钠沉在煤油下面,将钠与氧气和水隔绝。 金属钠不能保存在汽油或四氯化碳中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一轮复习
第三章金属及其化合物
第一讲钠及其化合物
(第1课时)
教学设计
教学目标:
知识与技能:
1、了解钠的性质及其运用。
2、了解钠的重要化合物性质及其运用。
过程与方法:
1、学生自学基本了解钠及其化合物(氧化钠、过氧化钠)的性质。
2、通过思维导图引导学生知道如何复习元素化合物。
3、教师和学生共同通过思维导图学习钠、氧化钠、过氧化钠的性质及
运用
态度与价值观:
1、使学生认识自学是很好且终生的学习的方法。
2 、使学生认识思维导图是很好的学习工具。
教学重点:钠和过氧化钠的性质及其运用教学难点:学生对知识的整理与归纳的能力的培养教学过程:
教师作品展示
练习过渡提问途及制法
1.巩固钠
的相关性
质。
2.指导学
生思维导
图的绘
制。
巩固、检
测钠的相
关性质
引入钠的
氧化物的
复习
整体认知
钠的氧化
物
钠的
制法、
物理
性质、
化学
性质、
用途
及制
法
1.展示教师的钠单质的思维导图
加1
邸胃
加i计|汕
:hfi软
2.与学生作品比较,指出各自的优缺点钠的
相关性质
提问复习氧化氧化
复习、钠的性质钠的
导图总结物理
性质、
结构、
化学
性质
思维导图体现了每个人对知识的理解认知程度,也是个性的充分表现。
用心画好每张图。
愉快的欣赏每张图,学
习是快乐的,生活是美好的。
让我们继续用思维导图寻找
学习的快乐——学习钠的氧化物。
1.常见钠的氧化物有哪些?
2.它们都有钠元素和氧元素,但化学组成不同,性质
会有哪些差异呢?
提问:1.氧化钠的物理性质有哪些?
2.氧化钠是属于离子化合物还是共价化合物?
说出理由。
3.氧化钠是何种类型氧化物?
展示氧化钠导图
提问:1.过氧化钠的物理性质有哪些?
2.过氧化钠是属于离子化合物还是共价化合物?说出理由。
3.过氧化钠为什么可做潜艇或防毒面具中的供氧剂?
展示过氧化钠导图
冬聋一們UQ-t-m軒吨聊+<)j
钠的w化物
钠的代化物
讲述:氧化钠和过氧化钠有相同的地方,也有不同的地方,所以我们最好能采用对比的方式学习,这样牢牢掌握它们的性质。
同时结构决定性质,性质决定用途的化学思想的运用也能帮我们建立各知识点间的关系,加强记忆和理解。
练习巩固钠的
氧化物的
性质钠的氧化物的性质
提问复习过氧复习、化钠的性
导图质
总结过氧化钠的物理性质、结构、化学性质、用途。
讲述 1.加强氧
化钠与过氧
化钠的差异
的比较。
2.
深化结构决
定性质,性
质决定用途
的化学思
想。
氧化
钠和
过氧
化钠
结
构
勾
、
性质、
用途
及之
间的
联系
展示导图:
&卄竄子他合物
Welcome !!! 欢迎您的下载, 资料仅供参考!。
