化学十字交叉法(可编辑修改word版)
高中化学解题方法——十字交叉法

在化学反应速率问题中,十字交叉法可以用来确定反应速率常数与反应物浓度之 间的关系,从而理解反应速率的变化规律。
03
CATALOGUE
十字交叉法的解题步骤
确定问题类型
01
02
03
混合物计算
当题目涉及混合物时,可 以通过十字交叉法计算混 合物的组成和比例。
平均量计算
当需要计算平均量时,如 平均相对分子质量、平均 摩尔质量等,可以使用十 字交叉法。
高中化学解题方法—— 十字交叉法
汇报人:
202X-01-01
CATALOGUE
目 录
• 十字交叉法的原理 • 十字交叉法的应用 • 十字交叉法的解题步骤 • 十字交叉法的注意事项 • 实例解析
01
CATALOGUE
十字交叉法的原理
原理概述
十字交叉法是一种用于解决混合 物计算问题的化学解题方法。
它通过将混合物的两个组分的质 量或体积进行交叉相乘,来找出 两组分在混合物中的质量比或体
积比。
这种方法适用于解决涉及两种组 分混合的问题,如气体混合、溶
液混合等。
原理的数学表达
则A组分在混合物中 的质量分数为:XA = (m1/M)。
两组分的交叉相乘关
系为:m1XA
=
m2XB。
B组分在混合物中的 质量分数为:XB = (m2/M)。
溶液配制与稀释
总结词
适用于溶液配制和稀释的计算,特别是当涉及溶液的平均量和两个不同浓度的 溶液时。
详细描述
在溶液配制和稀释过程中,十字交叉法可以用来计算两个不同浓度的溶液混合 后的平均浓度,或者确定某一浓度的溶液稀释到另一浓度的比例。
化学反应速率
总结词
十字交叉法带答案Microsoft Word 97 - 2003 文档

化学十字交叉法的原理及应用(一)混和气体计算中的十字交叉法【例题1】在常温下,将1体积乙烯(C2H4)和一定量的CH4混和,测得混和气体对氢气的相对密度为12,求CH4所占的体积。
0.5(二)同位素原子百分含量计算的十字叉法【例题2】溴有两种同位素,79Br和81Br,溴的相对原子质量是80,则79Br和81Br同位素的原子个数比?1:1(三)溶液配制计算中的十字交叉法【例题3】某同学欲配制40%的NaOH溶液120克,实验室中现有10%的NaOH溶液和NaOH固体,问此同学应各取上述物质多少克?80,40练习1.在标况下,有30L的O2和CO2混和物,测得混和气体对氢气的相对密度为20,求O2的体积? 10 2. 碳有两种同位素,11C和14C,碳的相对原子质量是12,则11C和14C同位素的原子个数比?2:13.在一定温度下,将0.1mol的N2和CO2混和物3.2克,求N2的体积分数,质量分数。
75% 65.6%4.在标准状况下,11.2L CH4和CO2混合气体的质量为16.4g,该混合气体中含有mol的CH4,mol的CO2。
0.2 0.35.3.6g碳在一定量的氧气中燃烧,反应后生成的气体质量为9.2g。
则在标准状况下,生成物CO和CO2的体积比为()A.3:2 B.4:1 C.5:1 D.7:46、在标准状况下,由CO和CO2组成的混合气体13.44 L,质量为24g,此混合气体中C和O两种原子的物质的量之比是()A、3∶7B、3∶4C、4∶7D、1∶27.混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积比为()A.1:1 B.1:4 C.4:1 D.1:28. 用80%和40%的硫酸相混合配制成50%的硫酸,求两种浓度的硫酸的质量比?1:39.甲烷和乙烯的混合气体,完全燃烧时消耗相同状况下氧气的体积是混合气体的2.4倍,则甲烷和乙烯的体积比为()。
化学解题方法之“十字交叉法”的妙用

化学解题方法之“十字交叉法”的妙用在化学中凡可按a1x1+a2x2=ā(x1+x2)或(a1-ā)/(ā-a2)=x2/x1计算的问题,都可以应用“十字交叉法”计算。
“十字交叉法”是化学计算中广泛使用的解题方法之一,它具有形象,直观的特点。
如何计算呢?首先应先写出混合两组分对应的量a1 、a2 和交叉点的平均值ā,然后按斜线作差取绝对值即得出相应物质的配比关系,其“十字交叉法”为:组分1:a1 ā-a2 x1 x1为组分分数ā—―= —组分2:a2 a1-āx2 x2为组分分数“十字交叉法”适用的范围是:凡是具有均一性、加和性的混合物,都可运用这种方法进行计算,但须注意,计算所得比值是质量比还是物质的量比,下面介绍几种常见“十字交叉法”的计算:一、相对原子质量“十字交叉法”元素的相对原子质量是元素的各天然同位素相对原子质量和所占的含量算出来的平均值,当仅有两种天然同位素时有等式:A1W1+A2W2=āW,用十字交*法易于求解两种同位素的原子个数比,这种方法叫做相对原子质量“十字交叉法”。
例1:已知氯在自然界中有两种稳定的同位素35Cl和37Cl,其相对原子质量为35、37,求自然界中35Cl所占的原子百分数( )A、31.5%B、77.5%C、22.5%D、69.5%解析:若设自然界中35Cl所占的百分数为x1,37Cl占x2,则有35x1+37x2=35.45(x1+x2)所以可以用“十字交叉法”:Cl35: 35 1.55 x135.45 —= —Cl37: 37 0.45 x2所以w(35Cl)=1.55/(1.55+0.45)×100%=77.5%二、相对分子质量“十字交叉法”两种气体混合时,质量守恒。
即n1M1+n2M2=(n1+n2)M,M 为混合气体的平均相对分子质量,所以可用“十字交*法”求解混合气体的体积比或物质的量比,这种方法叫做相对分子质量“十字交叉法”。
例2 :某混合气体由CO2、H2组成,知其密度为O2的0.5倍,则混合气体中CO2与H2的体积比( )A、2:1B、2: 3 C 、1:2 D、3:2解析:体积比即为物质的量之比,设CO2的物质的量为n1,H2的物质的量为n2,则有44n1+2n2=32×0.5(n1+n2),可用“十字交叉法”CO2 : 44 14 n116 —= —H2 : 2 28 n2可求得n1:n2=1:2,所以答案C正确。
化学十字交叉法

化学十字交叉法化学十字交叉法化学十字交叉法是一种常用于有机合成中的化学反应设计方法。
该方法通过将多个反应条件、试剂和合成步骤交叉进行考虑,以达到优化反应的目的。
这种方法能够减少有机合成过程中的试剂使用量,同时降低反应所需的时间和成本,并优化反应结果。
化学十字交叉法的设计思路化学十字交叉法的设计包括四个方面:1. 反应物交叉条件:化学十字交叉法对反应物条件进行组合和匹配,以提高反应的化学收率和位选性。
在该方法中,反应物的组合不是随意选择的,而是依靠化学常识和实验经验,以避免无效或低效的反应。
2. 反应步骤交叉考虑:通过对反应步骤进行交叉考虑,可以找到化学合成中比较快速和有效的方法。
在很多实验条件下,反应步骤是可以交叉考虑的,这有助于优化反应的时间和成本,同时有助于提高合成的产率。
3. 反应温度和反应时间的考虑:化学十字交叉法还需要考虑反应的时间和温度,以使反应更加稳定和适存。
这些参数的设定通常需要依照各种不同的反应条件和情况来进行调整。
4. 推乳利用条件交叉:再比如说选择酰化反应中原料中二苯乙酸的化学常识和实验经验,在特定情况下有利于提高产量,而在其他情况下会导致反应效率的降低。
在此情况下,化学十字交叉法可以帮助实验者准确预测如何选择适当的反应条件,以达到更佳的结果。
化学十字交叉法的优势和应用化学十字交叉法的主要优势在于它可以优化反应条件,提高产量和降低成本。
在物质生产和有机合成方面,这种方法非常有用。
它可以通过优化试剂浓度、反应条件等参数来帮助提高反应速率和产量。
此外,在有机合成方面,该方法也具有重要的应用。
总的来说,化学十字交叉法在化学合成中具有广泛的应用和优势,可以帮助实验者准确地预测反应条件,以达到更优化和更有效的反应。
在不断突破化学合成技术的过程中,化学十字交叉法也将继续发挥着其独特的应用价值。
初中化学十字交叉法
物质的量比 (或气体体 积比)
2
同位素相对原 子质量
元素相对原子质量
同位素原子的 丰度(百分组 成)
同位素原子 个数比(物 质的量比)
3
溶液物质的量 浓度
混合液物质的量浓 度
溶液体积分数
溶液体积比
4
溶质质量分数 (或物质中元 素的质量分数
混合溶液溶质的质 量分数(或混合物 中某元素的质量分 数)
溶质质量分数 (或物质中元 素的质量分数)
十字交叉法:
例1 欲配制20%的氢氧化钠溶液,需要 10%的氢氧化钠溶液和40%的氢氧化钠溶 液的质量比是多少?
解:设需要10%的氢氧化钠溶液和40%的
氢氧化钠溶液的质量分别是x和y。
则:
10% 40%
20%
40-20 = 20% x 20-10 = 10% y
所以 x : y = 2 : 1
记住:都是大数减小数
质量比
5 密度 6
混合密度
体积分数
用于某些综合计算
体积比
14.MgO和CuO组成的混合物中,氧元素的质量分 数为25%,求混合物中MgO和CuO的质量比。
MgO中,O%=40%,CuO中,O%=20%
MgO 40%
5%
25%
CuO 20%
15%
m(Mg)O 5%1 m(Cu)O 15% 3
到, 免费下载中考数学压轴题软件
到, 免费下载中考数学压轴题软件
十字交叉法练习:
1.某氧化铜和氧化铁的混合物中含氧 元素的质量分数为25%,求混合物中氧 化铜和氧化铁的质量比 1 :1 。
氧化铜O%:20% 25% 30%―25%=5%
氧化铁O%:30%
25%―20%=5%
(完整版)化学十字交叉法

“十字交叉”法的妙用化学计算是从数量的角度研究物质的组成、结构、性质变化,涉及到的化学基本概念多,解法灵活多变,且需要跨学科的知识和思维方法,所以该知识点一直是中学化学教与学的难点,但因能较好地训练学生的逻辑思维能力和思维的敏捷性,又能考察学生的双基知识,所以是教学重点,也是各种考试的热点。
如何进行这方面知识的教学,使学生理解和掌握这些知识、发展学力,一直是各位老师研究的热门话题。
本文拟就教学中所得,粗浅地谈一谈“十字交叉法”在化学计算中的应用。
一、适用范围:“十字交叉法”适用于两组分混合物(或多组分混合物,但其中若干种有确定的物质的量比,因而可以看做两组分的混合物),求算混合物中关于组分的某个化学量(微粒数、质量、气体体积等)的比值或百分含量。
例1:实验测得乙烯与氧气的混合气体的密度是氢气的14.5倍。
可知其中乙烯的质量分数为( )A.25.0%B.27.6%C.72.4%D.75.0%解析:要求混合气中乙烯的质量分数可通过十字交叉法先求出乙烯与氧气的物质的量之比(当然也可以求两组分的质量比,但较繁,不可取),再进一步求出质量分数。
这样,乙烯的质量分数是:ω(C 2H 4)=321283283⨯+⨯⨯×100 %=72.4% 答案:C 。
(解毕)二、十字交叉法的解法探讨:1.十字交叉法的依据:对一个二元混合体系,可建立一个特性方程: ax+b(1-x)=c(a 、b 、c 为常数,分别表示A 组分、B 组分和混合体系的某种平均化学量,如:单位为g/mol 的摩尔质量、单位为g/g 的质量分数等) ;x 为组分A 在混合体系中某化学量的百分数(下同)。
如欲求x/(1-x)之比值,可展开上述关系式,并整理得: ax -bx=c -b 解之,得:b ac a x b a b c x --=---=1, 即:ca b c x x --=-1 2.十字交叉法的常见形式:为方便操作和应用,采用模仿数学因式分解中的十字交叉法,记为:3.解法关健和难点所在:c C 2H 4 28 O 2 32 29 3 1组分1 a c -b 混合物 组分2 b a -c C十字交叉法应用于解题快速简捷,一旦教给了学生,学生往往爱用,但是也往往出错。
十字交叉法写化学式
十字交叉法写化学式
利用化合价写化学式
根据化合价写化学式的依据:
化合物中各元素正负化合价的代数和为零
常见的方法:最小公倍数法和十字交叉法
1、最小公倍数法写化学式
最小公倍数法———“一写、二求、三标、四验”
一写:一般把正价元素的符号(或根)写在左边,负价元素的符号(或根)写在右边,并把化合价写在元素符号(或根)的正上方二求:求两种元素(或根)的最小公倍数,然后求出每种元素(或根)的原子个数。
即原子个数=最小公倍数÷∣化合价∣三标:将原子个数写在相应元素符号(或根)的右下角
四验:检验各种元素正负化合价的代数和是否为零,确定化学式的正确性
2、十字交叉法写化学式
十字交叉法———“一排、二标、三交、四约、五查”
一排:元素符号(或根)一般按正价左,负价右顺序排列
二标:标出各元素的化合价,如果有根只需标出根的化合价
三交:将元素化合价(或根)的绝对值交叉写在另一元素符号(或根)的右下角
四约:将各元素(或根)的原子数约成最简整数比
五查:检查正负化合价代数和是否为零,确定化学式的正确性
这种方法也可以简单记忆为“正左负右标价数,十字交叉写个数”
说明:
①、只有确切知道某物质存在才能根据化合价书写化学式
②、一般把正价写在左边,负价写在右边。
但也有例外。
如NH3
③、如果标明根的个数时,应把根加上括号,再把数字写在右下角。
十字交叉法
求H2和C3H8的体积比。
解:lmolC3H8完全燃烧放热为:571.6/2=285.8千焦
lmolC3H8完全燃烧放热为:2220千焦
lmol混合气体完全燃烧放热为:3847/5=769.4千焦
列出十字交叉法如下:
HCl 36.5 5
求出空气与HCl气体的物质的量比是1/2
例5 某Na2SO3已部分氧化成Na2SO4,经测定该混合物中硫的质量分数为25%,求混合物中Na2SO3和Na2SO4的物质的量之比 (整数比)?
解:由平均质量分数25%,列出十字交叉法如下:
Na2SO3 中 S % 25.397 % 2.465 %
H2 2 20.8
求得CO与H2体积比是1/4 即它们体积分数分别是25% ,75%
例12 已知Fe2O3在高炉中发生反应Fe2O3+CO = 2FeO+CO2,反应形成的固体混合物Fe2O3、FeO中,铁和氧元素的质量比用m(Fe)∶m(O)表示。若m(Fe)∶m(O)=21∶8,计算Fe2O3被CO还原的质量分数。
c
b a-c ②
对比①、②两式可以看出:十字交叉关系中(c-b)/(a-c)为组分A和组分B混合时的质量比,推广到二组分混合体系中,当以一定质量的混合体系为基准所得十字交叉关系,其比值为质量比(例如质量分数是以质量为基准);若有c-b比a-c的化学意义由平均值c决定,则比值就表示组分A中c-b和组分B中a-c所表示的量的比值。如c为质量或质量分数,则(c-b)/(a-c)表示组分A和组分B溶液的质量之比;若c为密度,则(c-b)/(a-c)就表示组分A和组分B的溶液体积之比;若c为摩尔质量,则(c-b)/(a-c) 就表示组分A和组分B的物质的量比。此时可用十字交叉法求混合物中各组分的含量.
高中化学二元混合物的十字交叉法解法
高中化学二元混合物的十字交叉法解法速解的前提:1、必须清楚“十字交叉法”运用后的比例比系——“看分母”法则。
即特性数值的分母所表示的物理量之比。
因为对于二元混合物而言,设x 1、x 2是混合物两组分的某化学量,α 1、α 2为两组分的特性数值,ā为混合物的特性数值,若满足方程式α 1x 1+α 2x 2== ā(x 1 + x 2)可知 x 1(α 1- ā) == x 2(ā-α 2)即 x 1/x 2 ==(ā-α 2)/(α 1- ā)。
凡满足上述方程式的化学量的求解都不得可以用特性数值的“十字交叉法”形式来表示:2、必须清楚“十字交叉法”的适用范围现举几例,若按常规方法解二元一次方程,虽好理解,但费时且麻烦,若能正确运用“十字交叉法”,便可方便、迅速、准确地解题。
例1 现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同。
计算混和物中碳酸锂和碳酸钡的物质的量之比。
分析可将碳酸钙的式量理解为碳酸锂和碳酸钡的混和物的平均式量,利用十字交叉法计算可有:所以,碳酸锂和碳酸钡的物质的量之比为97∶26。
例2 天然的和绝大部分人工制造的晶体都存在各种缺陷。
例如在某种NiO晶体中就存在如右图所示的缺陷:1Ni 2+个空缺,另有2个Ni 3+取代,其结果晶体仍呈电中性,但化合物中Ni原子和O原子的比值却发生了变化。
该氧化镍样品组成为Ni 0.97O,试计算该晶体中的Ni 3+和Ni 2+的离子个数比。
分析本题所求的是Ni 3+和Ni 2+的离子个数比,所以我们所选的特性数值的分母必须是Ni 3+和Ni 2+的离子个数。
由此可知:所以,例3 某亚硫酸钠已部分被氧化成硫酸钠,经测定混合物中的质量分数为25%,求该混合物中亚硫酸钠与硫酸钠的物质的量之比。
分析本题目传统解法是解二元一次方程,但需要假设一些数据,比较费时,但如正确运用“十字交叉法”,弄清比例关系,则能很快地解决问题根据前面介绍的“看分母”法则可知计算出的比例是亚硫酸亚铁钠与硫酸钠中所含硫元素的质量比,但因是同种元素,且每个分子中均含1个硫原子,所以硫的质量比即等于其物质的量之比,所以二者物质的量之比为7∶1。
高中化学解题方法 十字交叉法
方法引入
已知N2、O2混合气体的平均摩尔质量为31g/mol,求 混合气体中N2、O2的物质的量之比?
解:设N2的物质的量为x mol,O2的物质的量为y mol。 N2 (x) 28 O2 (y) 32 x 1 y= 3
31
32-31 =1 31-28 =3
1 答:混合气体中N2、O2的物质的量之比为 3 。
方法小结 “十字交叉法”适用于以下几种情况:
通过“平均相对分子质量”求两混合气体的体积比; 通过“混合物燃烧热”求物质的量之比; 利用“质量分数”求个溶液的质量比;
通过“溶液物质的量浓度”求两溶液混合时的体积比等。
典例讲解
1
现有20%和5%的两种盐酸溶液,若要配制15%的盐
酸溶液,两种盐酸溶液的质量比为多少?
n(CO2)∶n(H2) = 75.7∶75.7 = 1∶1
答:物质的量浓度分别为6mol/L和1mol/L的硫酸溶液按 照体积比3∶2混合才能配成4mol/L的溶液。
已知下列热化学方程式:
C(s) +O2(g) = CO2(g) ΔH=-393.2kJ/mol 2H2(g) + O2(g) = 2H2O(g) ΔH=-483.6kJ/mol
学以致用
现有0.2mol的炭粉和氢气组成的悬浮气、固混合物在氧气中完全
解题方法——十字交叉法
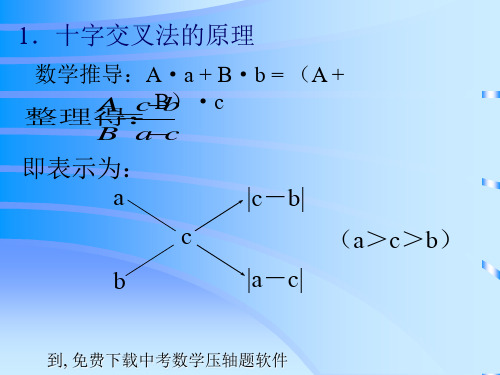
方法概述
十字交叉法是进行二组混合物平均量与组分计算的一 种简便方法。凡可按A1· b1 + A2· b 2 =A · (b1+b2)计算的问 题,均可按十字交叉法计算。 b1 A-A2 整理得: b =
2
A1-A
b 可改成图示: 1 b2
A1 A2
A
A-A2 A1-A
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“十字交叉”法的妙用化学计算是从数量的角度研究物质的组成、结构、性质变化,涉及到的化学基本概念多,解法灵活多变,且需要跨学科的知识和思维方法,所以该知识点一直是中学化学教与学的难点,但因能较好地训练学生的逻辑思维能力和思维的敏捷性,又能考察学生的双基知识,所以是教学重点,也是各种考试的热点。
如何进行这方面知识的教学,使学生理解和掌握这些知识、发展学力,一直是各位老师研究的热门话题。
本文拟就教学中所得,粗浅地谈一谈“十字交叉法”在化学计算中的应用。
一、适用范围:“十字交叉法”适用于两组分混合物(或多组分混合物,但其中若干种有确定的物质的量比,因而可以看做两组分的混合物),求算混合物中关于组分的某个化学量(微粒数、质量、气体体积等)的比值或百分含量。
例1:实验测得乙烯与氧气的混合气体的密度是氢气的14.5 倍。
可知其中乙烯的质量分数为()A.25.0%B.27.6%C.72.4%D.75.0%解析:要求混合气中乙烯的质量分数可通过十字交叉法先求出乙烯与氧气的物质的量之比(当然也可以求两组分的质量比,但较繁,不可取),再进一步求出质量分数。
31 这样,乙烯的质量分数是:3 ⨯ 28即:n(C2H4)n(O2)=3∶1ω(C2H4)= ×100 %=72.4%3 ⨯ 28 + 1⨯ 32答案:C 。
(解毕)二、十字交叉法的解法探讨:1.十字交叉法的依据:对一个二元混合体系,可建立一个特性方程:ax+b(1-x)=c(a、b、c 为常数,分别表示A 组分、B 组分和混合体系的某种平均化学量,如:单位为g/mol 的摩尔质量、单位为g/g 的质量分数等) ;x 为组分A 在混合体系中某化学量的百分数(下同)。
如欲求x/(1-x)之比值,可展开上述关系式,并整理得:ax-bx=c-b 解之,得:x =c -b,1 -x =a -ba -ca -b即:x1 -x =c -ba -c2.十字交叉法的常见形式:为方便操作和应用,采用模仿数学因式分解中的十字交叉法,记为:组分1c-b 混合物组分2 a -cx(组分1) c-b=1-x (组分2) a-c3.解法关健和难点所在:十字交叉法应用于解题快速简捷,一旦教给了学生,学生往往爱用,但是也往往出错。
究其原因,无外乎乱用平均量(即上述a、b、c 不知何物)、交叉相减后其差值之比不知为何量之比。
关于上述a、b、c 这些化学平均量,在这里是指其量纲为(化学量1÷化学量2)的一些比值,如摩尔质量(g/mol)、溶液中溶质的质量分数(溶质质量÷溶液质量)或关于物质组成、变化的其它化学量等等。
设计这些平均量时应优先考虑待求量和题给条件,一般情况下尽可能的将待求量设计为上述化学量2(分数中的分母),至于化学量1则依题给条件选取最容易获得的化学量(分数中的分子),这样上述第1 论点中的a、b、c 应该是分别这样的一些化学平均量(如下图):y(组分1)=组分1的化学量1 y(组分2)=组分2的化学量1x(组分1)组分1的化学量2x(组分2)组分2的化学量2y(混合体系)=混合体系的化学量1x(混合体系)混合体系的化学量2而这些化学平均量a、b、c 交叉相减后所得差值之比,则是组分1和组分2的化学平均量的量纲中化学量2 [如a、b、c 为摩尔质量(g/mol)时,便是物质的量mol]的比值。
例2:把CaCO3和MgCO3组成的混合物充分加热到质量不再减少时,称得残留物的质量是原混合物质量的一半。
则残留物中钙和镁两元素原子的物质的量之比是A.1:4B.1:3C.1:1D.1:2解析:上述问题是计算两组分混合物中某两个化学量之比,可用十字交叉法解题。
解题时先设计混合物的平均化学量c,该题中要求钙和镁两元素原子的物质的量之比(即原子个数比),而平均量中分母(即上述化学量y(组分2))与题给条件相差甚远,故以一摩尔组分质量为分母,一摩尔物质分解后残留物质量为分子而得如下的几个平均量:a=56g÷100g ; b=40g÷84g; c=1/2应用于十字交叉法:组分CaCO3 56/100 1/42 即:m(CaCO3) 1/42混合物=3/50组分MgCO340/84 m(MgCO3)所以,原混合物中两组分CaCO3和MgCO3物质的量之比(即残留物中Ca 和Mg 的物质的量之比为:n(Ca)∶n(Mg)=(1/42)g÷100g/mol∶(3/50) g÷84 g/mol =1∶3答案:B (解毕)注:熟练后或在要表达的计算题中可略去上图,而只以比例式表示,为防止出错,也可在草稿中画上述十字交叉图。
三、十字交叉法的应用与例析:1.两组分混合物中已知组分及混合体系的摩尔质量(或式量),求组分的物质的量之比(或组分气体的体积比、组分物质的微粒数之比):解答这类问题,需设计的平均化学量a、b、c 就直接用摩尔质量(g /mol)。
而用十字交叉法交叉相减后所得差值之比是组分的物质的量之比(或微粒数之比),或依阿伏加德罗定律,也等于(相55同状态下)气态混合体系中组分气体的体积比。
例 3.硼的平均相对原子质量为 10.8,硼在自然界中有种同位素: 10 B 与11 B ,则这两种同位素10 B 、11 5 5 5 5B 在自然界中的原子个数比为A. 1∶2B.1∶4C.1∶6D.1∶8解析:相对原子质量与原子的摩尔质量数值上相等,故元素或原子的相对原子质量可看做十字交叉法中的平均化学量,量纲为 g •mol -1,交叉相减后所得差值之比为两同位素的物质的量(即原子数) 之比。
10 B 11 B 10=1∶4答案:B 解毕) 2. 两种溶液(同溶质)相混合,已知两溶液及混合溶液中溶质的质量分数,求两溶液的质量比: 例 4.将密度为 1.84g •cm -3,质量分数为 98%的浓硫酸与水配制成 30%的稀溶液,应怎么配制?解析:要配制这种硫酸,必须先求出浓硫酸与水的比例。
因为溶液中溶质的质量分数为溶质质量占溶液质量的分数,所以质量分数实际上也是一种平均化学量,可用于十字交叉法求出浓硫酸和水的质量比。
这样,上述平均化学量 a 、b 、c 中的化学量 2 最好就设计为溶液质量,而化学量 1 取最方便的就是溶质质量,即平均化学量 a 、b 、c 就是溶液中溶质的质量分数,应用于十字交叉法(图略),记为:m(浓硫酸)∶m(水)=(30%-0)∶(98%-30%)=15∶34即取 15 份质量的浓硫酸与 34 份质量的水混合得此稀硫酸。
(解毕)3. 两可燃物组成的混合体系,已知其组分及混合物的燃烧热,求组分的物质的量之比或百分含量。
例5.在一定条件下,CO 和 CH 4 燃烧的热化学方程式分别为:2CO(气)+O 2(气)=2CO 2(气)+566KJ ;CH 4(气)+2O 2(气)=CO 2(气)+2H 2O(液)+890KJ现有 CO 和 CH 4 组成的气体混合物 89.6L(标准状态下测定),在上述条件下燃烧,释放的热量为2953KJ ,则 CO 和 CH 4 的体积比为( )A. 1∶3B. 3∶1C.1∶2D.2∶1解析:可燃物的反应热以摩尔反应热来表示时,单位是:KJ/mol ,因此也可以看做是一个平均化学量,两可燃组分及混合物的反应热可当做十字交叉法基本形式中的 a 、b 、c 进行十字交叉,交叉相减后所得差值之比即为两可燃组分的物质的量之 比。
解题时设计并先求算气体混合物的反应热:混合气体的物质的量:n=89.6L ÷22.4L •mol -1=4.00mol∴混合气体的平均反应热: Q (混合物)=2953KJ÷4.00mol=738.3KJ•mol -1双两组分的反应热分别为:Q(CO)=566KJ ÷2mol=283KJ•mo -1;Q(CH 4)=890KJ •mol -1这样,十字交叉法就记为:n(CO)∶n(CH 4)=(890-738.3)∶(738.3-283)≈1∶3答案:B 。
(解毕)4. 其它有关物质组成、变化关系的两组分混合体系,依题意,设计适当的平均化学量,也可用十字交叉法求算两组分的某个化学量的比值或百分含量。
例 6.在一定条件下,将 25 gCO 2 和 CO 的混合气体通过灼热的碳粉,使之充分反应,测知所得气体在标准状态下的体积为 22.4 L ,则在相同状态下原混合气体中 CO 2 和 CO 的体积比为A.1∶4B.1∶3C.1∶2D.2∶1解析:本题所求为两组分混合气体中组分气体的体积之比(按阿伏加德罗定律,即为两组分气 体的物质的量之比),依 高温 CO 2+C===== 2CO,CO 不与C 反应。
又从反应后的气体体积 22.4 L(标态), 是 1 mol 纯净 CO ,总质量为 28 g ,即上述反应中气体质量增加了 28g -25g=3g ,应用差量法可求 得原混合气体的物质的量为:1mol -3 g ÷12 g/mol=0.75mol即原混合气体的摩尔质量是:25g ÷0.75mol=33.3g/mol,将两组分及混合气体的摩尔质量应用于十字交叉法(如下图):CO 2 CO = 1 2 ∴原混合气体中 CO 2 与 CO 的体积比为:n(CO 2)∶n(CO)=1∶2答案:C 。
(解毕) 值得注意的是,有时因题给条件的限制,无法将待求量设计为平均化学量的分母(即化学量 2),此时就应以与已知量有关又容易换算为待求量的其它化学量做为平均量中的化学量 2例 7.KHCO 3 和 CaCO 3 的混合物和等质量的 NaHCO 3 分别与盐酸完全反应时,所消耗的酸的量相等,则混合物中 KHCO 3 的质量分数是A.50%B.68%C.81%D.90%解析:根据 KHCO 3 和 CaCO 3 分别与酸反应的化学方程式: KHCO 3+HCl=KCl+H 2O+CO 2↑CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑ 依题意,上述混合物每消耗 1 摩尔 HCl 需质量 84 g,而组分 KHCO 3 和 CaCO 3 每消耗 1 摩尔 HCl 需质量分别是 100g 和 50g ,这样就可以把反应中消耗的 HCl 设计为上述平均化学量中化学量 2,而与 HCl 反应消耗的固体物质质量设计为化学量 1,应用于十字交叉法并记为 :n(KHCO 3 耗酸) =17∶8 n(CaCO 3 耗酸)又从上述化学方程式可看出,每消耗 1mol 酸需 KHCO 3 1mol,而 CaCO 3 则需 0.5 mol 。
所以混合物中两组分 KHCO 3 和 CaCO 3 物质的量之比是:n(KHCO3)∶n(CaCO3)=17∶(8÷2)=17∶4混合物中KHCO3的质量分数是:×100%=81.0%ω(KHCO3)= 1717+4答案:C。
