[4 2]环加成反应论文:环加成反应 Diels-Alder反应 不对称有机小分子催化 四氢吲哚
Diels-alder反应
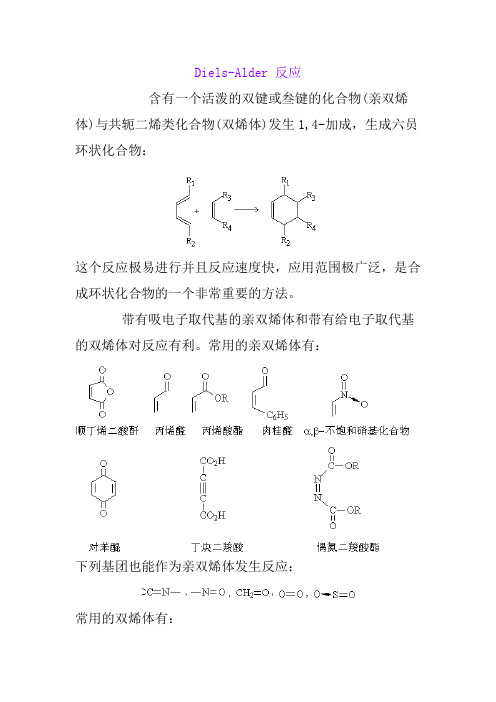
Diels-Alder 反应含有一个活泼的双键或叁键的化合物(亲双烯体)与共轭二烯类化合物(双烯体)发生1,4-加成,生成六员环状化合物:这个反应极易进行并且反应速度快,应用范围极广泛,是合成环状化合物的一个非常重要的方法。
带有吸电子取代基的亲双烯体和带有给电子取代基的双烯体对反应有利。
常用的亲双烯体有:下列基团也能作为亲双烯体发生反应:常用的双烯体有:反应机理这是一个协同反应,反应时,双烯体和亲双烯体彼此靠近,互相作用,形成一个环状过渡态,然后逐渐转化为产物分子:反应是按顺式加成方式进行的,反应物原来的构型关系仍保留在环加成产物中。
例如:正常的Diels-Alder反应主要是由双烯体的HOMO(最高已占轨道)与亲双烯体的LUMO(最低未占轨道)发生作用。
反应过程中,电子从双烯体的HOMO“流入”亲双烯体的LUMO。
也有由双烯体的LUMO与亲双烯体的HOMO作用发生反应的。
反应实例本反应具有很强的区域选择性,当双烯体与亲双烯体上均有取代基时,主要生成两个取代基处于邻位或对位的产物:当双烯体上有给电子取代基、亲双烯体上有不饱和基团如:与烯键(或炔键)共轭时,优先生成内型(endo)加成产物:参考文献[1] O. Diels and K. Alder, Ann., 460, 98 (1928); 470,62 (1929) Ber., 62, 2081, 2087 (1929)[2] J. A. Norton, Chem. Revs., 31, 319 (1942)[3] M. C. Koetzel, Organic Reactions,4, 1 (1948)[4] H. L. Holmes, Organic Reactions,4, 60 (1948)[5] L. W. Butz, Organic Reactions,5,136 (1949)[6] Madronero, Rev. Scienc. Apl. (Madrid) 12, 397 (1958); C.A. 53, 6984 (1959)[7] P. Yates and P. Eaton, J. Amer. Chem. Soc., 82, 4436 (1960)[8] J. G. Martin and R K. Hill, Chem. Rev., 61, 537 (1961)[9] G. I. Fray and R. Robinson, J. Amer. Chem Soc., 83, 249 (1961)[10] L. F. Fieser and M. Fieser, Advanced OrganicChemistry (Reinhold, New York, 1961), pp 206-210 [11] S. B. Needlernan and M. C. C. Kuo, Chem. Rev., 62, 405 (1962)[12] C. Walling and H. J. Schugar, J. Amer. Chem. Soc., 85, 607 (1963)[13] S. Seltzer, J. Am. Chem. Soc.,85, 1360 (1963)[14] W. J. Middleton, J. Org. Chem., 30, 1390(1965)[15] J. B. Lambert, J. D. Roberts, Tetrahedron Letters, 1965, 1457.。
环加成反应简介

环加成反应摘要:环加成反应在有机合成中有非常重要的应用,其基础理论前线轨道理论也是有机化学中非常重要的理论。
本文主要简介环加成反应和前线轨道理论,并对前线轨道在环加成反应中的应用做简要介绍。
关键词:环加成反应前线轨道理论 Diels-Alder反应环加成反应(Cycloaddition Reaction)是两个共轭体系结合成环状分子的一种双分子反应, 它是由两个或多个不饱和化合物(或同一化合物的不同部分)结合生成环状加合物,并伴随有系统总键级数减少的化学反应。
这类反应是合成单环及多环化合物的一种重要方法。
有关环加成反应最早是德国化学家Diels与其学生Alder等在1928年通过环戊二烯与顺丁烯二酸酐发生[4+2]环加成实现的。
常见的环加成反应类型除[4+2]外,还包括[3+2], [2+2+2], [3+2+2], [4+2+2]等。
环加成反应的主要特点是可以将不饱和链状化合物直接转变成环状化合物,包括三元、四元到九元、十元环等,且原子利用率高。
在天然产物的全合成、药物化学等领域有着广泛的应用。
1、前线轨道理论简介前线轨道是由日本理论化学家福井谦一提出的,他指出化合物分子的许多性质主要出最高占据分子轨道相最低未占分子轨道所决定的。
凡是处于前线轨道的电子,可优先配对。
这对选择有机合成反应路线起决定性作用。
鉴于前线轨道理论对于有机化学发展的重要性,他获得了1981年的诺贝尔化学奖。
1.1 前线轨道的几个基本概念分子周围的电子云,根据能量的不同,可以分为不同的能级轨道,根据能量最低原理,电子优先排入能量低的轨道。
前线轨道理论中,将用HOMO表示;未占有电子的能量最低的轨道称之为最低占有轨道,用LUMO表示(如图1-1)。
有的共轭轨道中含有奇数个电子,它的最高已占有轨道只有一个电子,这种单电子占有的轨道称之为单占轨道,用SOMO表示。
在分子中,HOMO轨道对于电子的束缚最为薄弱,LUMO轨道对电子的吸引力最强,因而前线轨道认为,分子加发生化学反应,本质上就是HOMO轨道与LUMO轨道的相互作用,形成新的化学键的过程。
不对称Diels-Alder反应

O O O
Me, H
Single product
O
Hale Waihona Puke 双不对称加成O S O O S BF3.OEt2 Selectivity>130:1 匹配对 O O O S
Diels-Alder反应的规律:
1、区域选择性: 反应产物往往以“假邻对位”产物为主。 即若把六元环比作苯环,那么环上官能团 (假设有两个官能团)之间的相对位置以 邻对位为主!
O OH H 2
O OH H
H NCO2CH2Ph ZnCl2
HNCO2CH2Ph O OH de>98% H
手性双烯体
Ph H OMe OH O O >97% d.e B(OAc)3, 98% OH O O H
H
OR*
EtO2C
N
O O
EtO2C O O C6H6, ref. 3h Me, H
N
R1 R3
R1
R3
+
R4
=
R4 R2 R2
带有吸电子取代基的亲双烯体和带有给电子取代基的 双烯体对反应有利!
常用的亲双烯体有:
O
O
O
O
(Z)
O
OR
(Z)
C6H5
O
顺丁烯二酸酐
丙烯醛
丙烯酸酯
O
肉桂醛
C
O
COOH
OR
N
C
(Z) (Z)
N C OR
C COOH
0
O
对苯醌
丁炔二羧酸
偶氮二羧酸酯
下列基团也能作为亲双烯体发生反应:
Ph
OR' OR' O N O Ph O + CH2Cl2 ,-78℃
两个催化[4+2]环加成反应机理和立体选择性的理论研究
![两个催化[4+2]环加成反应机理和立体选择性的理论研究](https://img.taocdn.com/s3/m/b78839afbdeb19e8b8f67c1cfad6195f312be8d6.png)
两个催化[4+2]环加成反应机理和立体选择性的理论研究两个催化[4+2]环加成反应机理和立体选择性的理论研究不对称合成在近几十年来发展迅速,且在多个方面取得了显著进步。
众多经济节约,反应条件温和,环境友好,产率高,立体选择性好的有机不对称合成反应吸引了科研人员的广泛关注。
本论文运用理论计算的方法对两个不对称催化反应的反应机理进行了详细的分子水平的研究,研究成果对帮助人们从分子水平上理解不对称催化反应的反应机理,以及设计新的合成路径,选择更高效的可再生催化剂等具有非常重要的理论指导价值。
论文的第一章简要描述了氮杂环卡宾(NHC)和胺催化的不对称合成反应的研究进展,第二章介绍了相关的量子理论知识和理论计算方法,第三章和第四章分别详细介绍了用密度泛函理论(DFT)方法对两个有机催化小分子反应机理的理论研究,第五章对全文进行了总结。
以下是关于这两个反应反应机理的简要介绍。
一、NHC催化醛与三氟甲基烯酮[4+2]环加成反应机理与立体选择性的理论研究α,β不饱和酮或醛通过NHC催化的[4+2]不对称合成生成含有连续的多个手性中心的化合物在工业、生物学和化学中均是一个非常有趣,但同时也极具挑战性的课题。
最近,Smith课题组报道了一项非常有意思的研究成果:在温和的实验条件下,以醛和三氟甲基取代的α,β不饱和酮为反应物,通过NHC催化的[4+2]的环加成反应生成含有两个连续的手性碳的三氟甲基吡喃酮。
该反应的最大的突破在于实现了吡喃酮的C(5)位被不同的取代基取代。
在本文中,我们首先运用密度泛函理论(DFT)研究了这个催化反应的反应机理,然后通过对产生立体中心的基元步骤中的两个关键驻点的扭曲能和吉布斯自由能成分的分析探索了对映体和非对映体选择性产生的根本原因。
通过计算我们发现,理论上预测的主要产物的立体异构构型和实验结果完全相符,更为重要的是通过分析我们发现相对吉布斯自由能能垒(?)和相对焓变(?)具有很好的相关性,这表明反应的立体选择性主要源于经过不同构型过渡态的焓变,而非熵变(?),的差异。
Diels-Alder反应(狄尔斯–阿尔德反应)

Diels-Alder反应(狄尔斯–阿尔德反应)Diels-Alder反应,反电⼦要求的Diels-Alder反应和Hetero-Diels–Alder reaction(杂-Diels–Alder反应)都是[4+2]环加成反应,都属于协同反应。
是由共轭双烯与亲双烯体构建环⼰烯⾻架的经典反应。
反应有丰富的⽴体化学呈现,兼有⽴体选择性、⽴体专⼀性和区域选择性等。
该反应是可逆反应,正向成环的反应温度较低,逆向开环反应需要较⾼的温度。
此反应⽤很少能量就可以合成六元环,是制备不饱和六元环的⾮常重要的环化⼿段之⼀,对推动有机化学反应理论的发展起到了重要作⽤。
Danishefsky⼆烯与⼀般的双烯相⽐,有更好的反应性及位置选择性。
因此,是熟为⼈知的有机合成试剂。
1950年的诺贝尔化学奖颁给了德国化学家奥托·迪尔斯(Otto Paul Hermann Diels)和他的学⽣库尔特·阿尔德(Kurt Alder),以表彰他们在1928年发现了著名的“Diels-Alder双烯合成反应”。
反应机理反应机理⼀般认为,在反应时两反应物彼此靠近,相互作⽤, 形成⼀个环状过滤态。
然后逐渐转化为产物分⼦,即旧键的断裂与新键的形成是相互协调地在同⼀步骤中完成的—协同反应,⽆中间体⽣成。
带有给电⼦基团的双烯体和带有吸电⼦基团的亲双烯体进⾏反应。
因为前沿轨道(双烯的HOMO和亲双烯体的LUMO)的能量差越⼩,能够使轨道相互作⽤⽽稳定,从⽽使反应更容易进⾏(电⼦要求型)。
同理,亲双烯体带有给电⼦基,共轭双烯带吸电⼦基的反应也容易进⾏(反电⼦要求型)。
反应是按协同反应顺式加成来进⾏的,优先⽣成endo加成产物(endo规则)。
电⼦要求型的Diels-Alder反应中,⼆次轨道相互作⽤⼤致能解释这⼀规则,但endo/exo选择性也受⽴体影响,根据不同底物,完全选择⽣成exo产物的例⼦也有报道。
除此之外分⼦内的Diels-Alder 反应由于环状结构固定,构型⾃由度较低,也不完全适⽤endo规则。
环加成反应

不同的原子轨道要有效的组成分子轨道,必须满足一定的条件。 这就是能量相近,轨道最大重叠和对称性匹配等三个条件。
在双分子反应中,一个分子的最高占有轨道和另一个分子 的最低空轨道要有效地组成新的分子轨道,假定也和原子轨道 组成分子轨道时类似,也必须满足能量相近,轨道最大重叠和 对称性匹配这三个条件。在这里,对称性匹配这个条件具有特 别重要意义。当两个分子相互接近时,起决定性作用的轨道必 须满足对称性匹配的要求,它们应属于同一对称类型。
在丁二烯和乙烯反应时,无论是丁二烯的HOMO和乙烯的 LUMO,还是乙烯的HOMO和丁二烯的LUMO,能量相差都较 大。因此反应进行得就不会非常顺利,反应条件就需要强烈。
要使反应能顺利进行,需要缩小前线轨道之间的能量差别。丁 二烯的HOMO和乙烯的LUMO能量差值稍小,首先考虑怎样才 能进一步缩小。
OCH3 CHO
OCH3
CHO
要回答这一问题,需要了解1-甲氧基-1,3-丁二烯和丙烯醛这两 个化合物前线轨道的符号,能量和系数:
OMe
CHO
OMe
CHO
HOMO -8.5eV
LUMO 0eV
LUMO 2.5eV
HOMO 10.9eV
图4-6 1-甲氧基-1,3-丁二烯和丙烯醛前线轨道
圆圈表示p轨道在纸平面上的一个瓣,画线的和不画线的代表 相反的符号,而圆圈的大小粗略地正比于轨道系数的大小。
(二)电子反向的Diels-Alder反应
双烯的 LUMO和亲双烯体的HOMO能量差,小于双烯的 HOMO 和亲双烯体的LUMO能量差值,在反应过程中,双烯 的LUMO和亲双烯体的HOMO 起主要作用,叫做电子反向的 Diels-Alder反应。双烯分子的吸电子取代基和亲双烯体中的给 电子取代基使这类反应加快。 (二)中间的Diels-Alder反应 双烯的HOMO和亲双烯体的LUMO能量差,小于双烯的 LUMO和亲双烯体的HOMO能量差值相差不大,在反应过程 中,无论双烯的HOMO和亲双烯体的LUMO,还是双烯的 LUMO和亲双烯体的HOMO都起作用,叫做中间的Diels-Alder 反应。在双烯分子和亲双烯体分子中,给电子取代基和吸电子取代 基都可能加快这类反应。
有机催化的对映选择性Diels–Alder反应

概述本文概述了非对称反应历史上的Diels–Alder反应。
Diels–Alder反应是经济性原子反应最重要的反应之一[1],出自由奥托博士1928年发表的著名论文,而且Diels–Alder反应仍然是目前研究最多、利用最广泛之一的反应[2]。
这项调查延续超过了60年,它提供了各种各样的不饱和体系以二烯烃以及亲二烯体的详细信息以及可能的各种影响因素。
Diels–Alder反应也是最古老的有机转换反应之一,作为手性助剂可获得光学纯化合物的快捷方式[3]。
第一个己烯框架有四个连续立体衰减的过程,这是一个活跃的研究领域。
一个取代环己烯的建设框架其中的拆分方法在近代被恩德斯和同事通过三重串联反应证实了,新方法已经被其他实验工作者进一步应用。
除了lewis酸的催化,通过文献的阅览对其他催化方法也有了大体上的了解。
几种Diels–Alder反应中表明有一个相当大的比率增加水作为溶剂或含有氢键的环境。
Diels–Alder反应合成的多功能性进一步为发现生物催化方法提供运输反应创造了条件。
在不含金属的环境中,以适当的速度在温和条件下与选择性适当的产物反应。
在这种情况下,有机小分子作为有机催化剂是一个好的选择酶,适合有些更具体,更复杂的情况[4]。
有机催化在过去的十年的快速发展,已经取得了伟大的多样化的成果。
在这些过程有重要的醇醛缩合等反应,傅克反应,曼尼希,斯特和亨利的反应[5], 还有Diels–Alder环加成反应。
在已有的催化Diels–Alder 反应中,一个单独的有关专门有机催化方法,还没有出现,比如有关多米诺和脯氨酸在有机催化中反应。
目前更受到关注的是有机催化Diels–Alder环加的发展。
有机合成中Diels-Alder 反应是生成结构复杂的化合物的典型方法之一,合成复杂的大分子是这个世纪化学家热点研究的话题[6],并且是具有挑战的项目。
Diels-Alder 反应能合成我们理想中具有立体选择性的结构复杂多环化合物,在这个方面取得了瞩目的成果。
不对称Diels-Alder反应 共73页PPT资料

Me Me
RO
R Ph
NN
R=H
2
OR R
Ph
• 在D-A反应过程中,阴离子对活性也有一定的 影响。活性顺序大致如下: SbF6>PF6>OTf>BF4。
• 2019年,Kanemasa等报道了一个极为出众的双 噁唑啉配体3,它的多种金属形成的原位催化 剂在环戊二烯与丙烯酰胺的D-A反应中表现
出优异的对映选择性。
O
O
O
N
N
Ph
3
Ph
手性二酚类配合物催化剂
• 通过光学活性联萘酚与各种金属化合物作 用可以得到不同结构的手性金属芳氧基化 合物。
Ph
SiA r3
OR' M OR'
Ph R '= H , S iC l4 M = E t2A lC l, E tA lC l2, T iC l4
O Al Me
O
SiA r3
R Oห้องสมุดไป่ตู้
O NO
Me Ph major
RO O NO
Me Ph minor
O
N
+
t-Bu O
Et2AlCl CH2Cl2
endo:exo=>97:3
O
N t-Bu
O 96%e.e
3.手性不饱和酮
O
OH
H ZnCl2,-20oC
O
OH O H
OH H
endo:exo=15:1 >100
:
1
O OH H
C H
CH2
H
Al H Me3Al
H3C
CC CH3H2
+
Ph
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[4 2]环加成反应论文:有机小分子催化的不对称“4+2”环加成反应构筑四氢吲哚类化合物的研究
【中文摘要】第一章环加成反应在有机合成领域有很广泛的用途,是一类重要的构筑碳-碳键的方法,尤其是在构筑六元环方面表现出
其独特的优势。
自从Diels-Alder反应发现至今,各种类型的环加成反应相继被发现:包括分子内的环加成反应,杂Diels-Alder反应,
高压促进的Diels-Alder反应,Lewis酸催化的Diels-Alder反应,以及近年来有机小分子催化的Diels-Alder反应等。
本文综述了近年来环加成反应的研究进展,特别是有机小分子催化的不对称环加成反应的研究情况。
第二章鉴于有机小分子催化在有机合成中的重要作用,发展了一种简单手性二级胺催化的环加成反应,简洁高效地实现了多取代手性四氢吲哚化合物的合成。
乙烯基吡咯与不饱和醛在三甲基硅基保护的L-脯氨醇催化下以中等产率,较高对映选择性得到了系列多取代手性四氢吲哚,为这类化合物的合成提供了一条新的简洁的途径。
【英文摘要】The [4+2] cycloaddition reaction is a powerful strategy for the formation of carbon-carbon bonds in organic synthesis, which allows facile, stereospecific entry into six-membered ring systems. Many different versions of the Diels-Alder reaction were elaborated, including intramolecular [4+2]cycloadditions, hetero Diels-Alder
reactions, pressure-accelerated Diels-Alder reactions, Lewis acid accelerated Diels-Alder reactions, and organocatalyzed asymmetric Diels-Alder reaction. The recent progress in [4+2] cy...
【关键词】[4 2]环加成反应 Diels-Alder反应不对称有机小分子催化四氢吲哚
【英文关键词】[4 2] cycloaddition Diels-Alder reactions asymmetric organocatalysis tetrahydroindole
【索购全文】联系Q1:138113721 Q2:139938848
【目录】有机小分子催化的不对称“4+2”环加成反应构筑四氢吲哚类化合物的研究摘要5-6Abstract6第一章[4+2]环加成反应研究进展9-39 1.1 引言9 1.2 [4+2]的环加成反应机理研究9-12 1.3 金属催化的[4+2]环加成反
应研究12-21 1.4 小分子催化的[4+2]环加成反应
21-39 1.4.1 金鸡纳碱衍生物催化的[4+2]环加成反应
22-24 1.4.2 Bronsted酸催化的反应[4+2]环加成反应
24-29 1.4.3 二级胺催化的[4+2]环加成反应
29-35 1.4.4 其他有机小分子催化的[4+2]环加成反应
35-39第二章有机小分子催化烯基吡咯与不饱和醛的[4+2]
环加成39-63 2.1 引言39-44 2.2 结果与讨论
44-62 2.2.1 反应条件的优化44-46 2.2.2 反应底物
的拓展46-48 2.2.3 机理的研究48-49 2.2.4 实验部
分49-54 2.2.5 化合物的数据54-62 2.3 小结62-63参考文献63-70在学期间的研究成果70-71致谢71-72附录72-82。
