环境化学第三章资料
合集下载
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化知识交流

之,pE越大,电子浓度越低,体系接受电子的倾向就越强。
(2)氧化还原电位E和pE的关系
Ox +ne→Red
(1)
根据Nernst方程
E=E0-(2.303RT/nF)lg[Red]/[Ox] (2) 当反应达平衡时,定义
E0=(2.303RT/nF) lgK
(3)
从上述化学方程式(1),可写出
K= [Red]/{[Ox][e]n }
如果考虑到羟基配合作用,那么金属氧化物或氢氧化物的 溶解度(MeT)表征为:
MeT = [ Mez+ ] +∑[ Me(OH)nz-n ]
固体的氧化物和氢氧化物具有两性的特征,它们和质子或 羟基离子都发生反应,存在一个pH值,在该值下溶解度为最 小值。在碱性或酸性更强的pH值区域内,溶解度都会变得更 大。
因此,在 H2S 和硫化物均达到饱和的溶液中,溶液重金属离子 的饱和浓度为: [Me2+]=Ksp/[S2-]=Ksp [H+]2/Ksp´ =Ksp [H+]2/(0.1K1K2)
3、碳酸盐
——多相平衡,pH通过控制碳酸根浓度影响沉淀平衡
封闭体系: 只考虑固相和液相,把 H2CO3* 当作不挥发酸类处理。
吸附量随粒度增大而减少,并且当溶质浓度范围固定 时,吸附量随颗粒物浓度增大而减少。
温度变化、几种离子共存(竞争作用)等。
3、沉积物中重金属的释放——属于二次污染问题
诱发释放的主要因素有: (1)盐浓度升高:碱金属和碱土金属阳离子可将被吸附在固体颗
粒上的金属离子交换出来。
(2)氧化还原条件的变化:有机物增多,产生厌氧环境、铁锰氧 化物还原溶解,使结合在其中的金属释放出来。
2、它在中性表面甚至在与吸附离子带相同电荷符号的表面 也能进行吸附作用。
环境化学第三章水

二节 气体在水中的溶解性
水的质量特征:
• 酸度和碱度
第一节 概述
• 盐度和氯度:1千克水中碳酸盐转变为氧化物、溴化物 和碘化物转变为氯化物、有机物完全氧化后所含固体 的总克数。
• 硬度 • 溶氧量:25℃时的饱和浓度
[O2 (aq)] = 2.6×10-3 mol/L = 8.32 mg/L
• 清度和色度
化合物直接与 pH值有关,实际涉及到水解和羟基配合物的平
衡过程,该过程往往复杂多变,这里用强电解质的最简单关 系式表述: Me(OH)n(s) → Men+ + nOH根据溶度积表达式 可导出金属离子浓度 等号两边取负对数: Ksp = [Men+][OH-]n [Men+] = Ksp/[OH-]n = Ksp[H+]n/Kwn -lg[Men+] =-lgKsp-nlg[H+] + nlgKw (3-21)
HS- → H+ + S2则总反应: H2S →2 H+ + S2-
K2= 1.3×10-15
K1,2=K1K2=1.16×10-22
三、溶解沉淀平衡
在饱和水溶液中,H2S浓度总是保持在0.1mol/L,则 [H+]2[S2-] = K1,2×[H2S] = 1.16×10-22×0.1 = 1.16×10-23 由于在水溶液中 H 2 S 的二级电离甚微,故可近似认为 [H+] = [HS-],因此可求得溶液中[S2-]浓度:
三、溶解沉淀平衡
第二节 天然水中的平衡
溶解和沉淀是污染物在水环境中迁移的重要途径,一般金
属化合物在水中迁移能力,直观地可以用溶解度来衡量。
溶解度小者,迁移能力小; 溶解度大者,迁移能力大。 在固—液平衡体系中,需用溶度积来表征溶解度。
03-2环境化学第三章--水环境化学

第5页,共33页。
2、金属水合氧化物:
铝、铁、锰、硅等金属的水合氧化物 天然水中几种重要的容易形成金属水合氧化物的金属:
1)铝:铝水解,主要形态Al3+、Al(OH)2+、Al2(OH)24+、Al(OH)2+、 Al(OH)3和Al(OH)4-,随pH值变化而改变形态浓度比例。
第6页,共33页。
4、吸附等温线
1)吸附等温线和等温式:水体中颗粒物对溶质的吸附
是一个动态平衡过程,在固定的温度条件下,当吸附达
到平衡时,颗粒物表面上的吸附量(G)与溶液中溶质平 衡浓度(c)之间的关系,可用吸附等温线来表达。 ▪水 体 中 常 见 的 吸 附 等 温 线 有 三 类 : Henry 型 、 Freundlich型、Langmuir型,简称为H、F、L型。
第14页,共33页。
解:先计算单位比表面积(ρ为密度)
4r 2
=面积(球)/重量= 4 r 3 =
3
3 0.5 104 2.65
=2.264×104(cm2/g)
其次计算总体积=100m2×0.2m×10%=2m3=2×106cm3 所以总重量=总体积×比重=2×106cm3×2.65g/cm3=5.3×106g 所以总比表面积=5.3×106g×2.264×104(cm2/g)
表3-8 水合氧化物对金属离子的专属吸附与非专属吸附的区别
项
目
非专属吸附
专属吸附
发生吸附的表面净电荷的符号
-
-、0、+
金属离子所起的作用
反离子
配位离子
吸附时所发生的反应
阳离子交换
配位体交换
发生吸附时要求体系的pH值 >零电位点
任意值
2、金属水合氧化物:
铝、铁、锰、硅等金属的水合氧化物 天然水中几种重要的容易形成金属水合氧化物的金属:
1)铝:铝水解,主要形态Al3+、Al(OH)2+、Al2(OH)24+、Al(OH)2+、 Al(OH)3和Al(OH)4-,随pH值变化而改变形态浓度比例。
第6页,共33页。
4、吸附等温线
1)吸附等温线和等温式:水体中颗粒物对溶质的吸附
是一个动态平衡过程,在固定的温度条件下,当吸附达
到平衡时,颗粒物表面上的吸附量(G)与溶液中溶质平 衡浓度(c)之间的关系,可用吸附等温线来表达。 ▪水 体 中 常 见 的 吸 附 等 温 线 有 三 类 : Henry 型 、 Freundlich型、Langmuir型,简称为H、F、L型。
第14页,共33页。
解:先计算单位比表面积(ρ为密度)
4r 2
=面积(球)/重量= 4 r 3 =
3
3 0.5 104 2.65
=2.264×104(cm2/g)
其次计算总体积=100m2×0.2m×10%=2m3=2×106cm3 所以总重量=总体积×比重=2×106cm3×2.65g/cm3=5.3×106g 所以总比表面积=5.3×106g×2.264×104(cm2/g)
表3-8 水合氧化物对金属离子的专属吸附与非专属吸附的区别
项
目
非专属吸附
专属吸附
发生吸附的表面净电荷的符号
-
-、0、+
金属离子所起的作用
反离子
配位离子
吸附时所发生的反应
阳离子交换
配位体交换
发生吸附时要求体系的pH值 >零电位点
任意值
环境化学 2008_第三章 化学污染物的转化行为
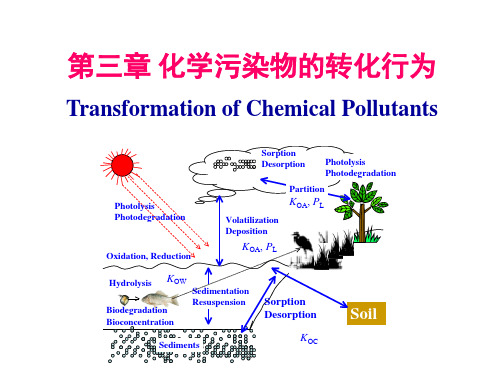
迁移:污染物在环境介质内部或环境介质之间的物理运动 (时间和空间)。不发生化学变化。 物理转化:相变、渗透、凝聚、吸附以及放射性元素蜕变等。 化学转化:光化学氧化、氧化还原和络合水解等作用。 生物化学转化:生物的吸收和代谢作用而发生的变化 。
二、空气中硫氧化物的转化和硫酸烟雾型污染
Transformation of Sulfur Oxides in Air and Pollution of Sulfuric Acid Aerosol 1. 硫的来源 人为来源: 含硫矿物燃料燃烧 煤 (0.5-6%)占60%
n MeT [Me ] [Me(OH)z n ] z 1 n
PbO (s) + 2H PbO (s) + H
+
+
Pb2++H2O Pb(OH)+ Pb(OH)2 Pb(OH)3- +H+
lgKs0=12.7 lgKs1=5.0 lgKs2=-4.4 lgKs3=-15.4
PbO (s) + H2O PbO (s) + 2H2O
四、配合平衡
重要的无机配位体有:OH-、Cl-、CO32-、HCO3-、F-、S2-等。 有机配位体:天然水体中有动植物组织的天然降解产物,如氨 基酸、糖、腐殖酸;生活废水中有洗涤剂、清洁剂、EDTA、 农药和大分子环状化合物等。这些有机物相当一部分具有配合 能力。 (1) 配合物在溶液中的稳定性
对眼睛和呼吸道有强刺激作用。 O3等氧化剂
臭氧浓度 出现时间 毒 性
严重时可导致死亡。
注:本表摘自王晓蓉,1993。
有强氧化破坏作用,严重时可导致死亡。
三、溶解-沉淀
1. 金属类污染物可能发生的迁移和转化过程
二、空气中硫氧化物的转化和硫酸烟雾型污染
Transformation of Sulfur Oxides in Air and Pollution of Sulfuric Acid Aerosol 1. 硫的来源 人为来源: 含硫矿物燃料燃烧 煤 (0.5-6%)占60%
n MeT [Me ] [Me(OH)z n ] z 1 n
PbO (s) + 2H PbO (s) + H
+
+
Pb2++H2O Pb(OH)+ Pb(OH)2 Pb(OH)3- +H+
lgKs0=12.7 lgKs1=5.0 lgKs2=-4.4 lgKs3=-15.4
PbO (s) + H2O PbO (s) + 2H2O
四、配合平衡
重要的无机配位体有:OH-、Cl-、CO32-、HCO3-、F-、S2-等。 有机配位体:天然水体中有动植物组织的天然降解产物,如氨 基酸、糖、腐殖酸;生活废水中有洗涤剂、清洁剂、EDTA、 农药和大分子环状化合物等。这些有机物相当一部分具有配合 能力。 (1) 配合物在溶液中的稳定性
对眼睛和呼吸道有强刺激作用。 O3等氧化剂
臭氧浓度 出现时间 毒 性
严重时可导致死亡。
注:本表摘自王晓蓉,1993。
有强氧化破坏作用,严重时可导致死亡。
三、溶解-沉淀
1. 金属类污染物可能发生的迁移和转化过程
环境化学第三章ppt课件

土壤水0.05% 沼泽水0.03% 大气水0.04%
河水0.006% 生物水0.003%
永冻土底冰0.86% 湖泊淡水0.26%
精选 其他淡水(占世界淡水总储量5%)
精选
6
世界七个水资源总量丰富国家比较
人均径流量(立方米/人)
径流总量(亿立方米)
巴西
俄罗斯
加拿大
美国 印度尼西亚
中国
印度 世界
468700
有机质 海水 <2mg/L 淡水 >2mg/L
精选
22
2、天然水的组成
(1)化学成分 A、溶解态 :盐、有机物和溶解的气体
非溶解态:颗粒物、气泡
水生生物
B、主要离子(八大离子):
K+、Na+、Ca2+、Mg2+、Cl-、SO42-、HCO3-、NO3-, 占天然水总离子的95-99%。
水中的主要离子组成图(P148) 总含盐量: TDS=[Ca2+ + Mg2+ + K+ + Na+ ] + [Cl- + SO42- + HCO3- + NO3-]
精选
27
CO2 的溶解度(P150)
pCO2 =(1.0130-0.03167)×105×3.14×10-4 = 30.8 (Pa) [CO2(aq)] = KH ·pCO2 = 3.34×10-7×30.8 = 1.028×10-5 mol·L-1
CO2在水中离解,则: [H+] = [HCO3-] [H+]2/[CO2] = K1 = 4.45×10-7 [H+] =(1.028×10-5× 4.45×10-7)1/2 = 2.14×10-6 mol·L-1 [HCO3-] =[H+] =(1.028×10-5×4.45×10-7)1/2= 2.14×10-6mol·L-1 pH = 5.67
中国农业大学_807环境化学与环境监测_《环境化学》课件_环境化学第三章

第一节
水环境中的沉淀溶解反应
3、相互结合的离子半径差别愈小,其离子化合物愈牢固, 即难溶解。 溶解度小于0.01克/100克水的物质叫做“难溶物” 地表水和沉积物的孔隙水中主要阴离子Cl-、SO2-4、HCO-3
还原条件下有H2S衍生的HS-与S2-,碳酸盐、氢氧化物、硫 化物难溶。
第一节
水环境中的沉淀溶解反应
一、氧化物和氢氧化物
金属氢氧化物沉淀有多种形态,它们在水环境中的行为差
别很大。氧化物可看成是氢氧化物脱水而成。金属氢氧化 物的沉淀溶解平衡可以用化学反应的通式表述:
Me (OH)n(s) ==== Me n+ + nOH¯ Ksp = [Me n+][OH–]n [Me n+]= Ksp/[OH–]n = Ksp[H+]n / Knw
pc = ( pKsp – npKw ) + npH (3-1)
第一节
水环境中的沉淀溶解反应
1、pc 与pH成直线关系,即在一定的pH的范围内, pH 越高,金属离子的浓度越低;
2、金属离子的价数就是浓度随pH变化的斜率,其中
lg[Men+] 与pH的关系,斜率分别为 -1、-2、-3。 Ag+、Hg+ 的斜率为 1; Ca2+ 、 Mg2+ 、 Fe2+ 、 Mn2+ 、 Zn2+ 、 Pb2+ 、 Cu2+ 、 Hg2+ 、 Ni2+ 、 Cd2+ 、 Co2+ 的斜率为 2; Al3+、Fe3+、Cr3+ 的斜率为 3; 3、当pc = 0时(-lg[Men+] = 0 即 [Men+] = 1 mol/L), 直线在横轴上的pH值为截距 , 用下式计算:
环境化学 第三章空气与废气监测

1) 含硫化合物:SO2、H2S; SO3、硫酸、硫酸盐; 2) 含氮化合物:NO、NO2、NH3; 硝酸、硝酸盐; 3) 碳氧化合物:CO、CO2; 4) 卤素化合物:HF、HCl、Cl2; 5) 碳氢化合物: 6) 其它有机化合物:
粒子状态污染物
粒子状态污染物:即颗粒物,是分散在大
气中的微小固体和液体颗粒,粒径多在0.01100μm之间,是一个复杂的非均匀体系。
对动植物的危害
• 美国蒙塔那洲一铜冶炼厂排出大量SO2、 As2O3,污染周围牧草,草中含砷400PPm, 使在24Km内的羊群大量死亡。
• 臭氧使美国每年森林农作物经济损失超过30 亿美元
• 哥伦比亚的炼铜厂SO2污染,使该厂南部52 英里内30%的树木,南部33英里内60%的树 木死亡或者严重受损。
对材料的损坏
• SO2能腐蚀暴露于空气中的金属制品,使 皮革、纸张、纺织品变脆;
• H2S能使白色铅涂料变成黑色; • 光化学烟雾能使橡胶轮胎龟裂、电镀层加
速腐蚀; • 高浓度的NOx能使尼龙织品分解。
对大气的影响
改变大气的性质和气候的形式
• CO2吸收地面的辐射,颗粒物对阳光的散射 作用能改变地面温度,使温度上升或者下降 (温室效应)
1. 功能区布点法
多用于区域性的常规监测
(1) 先将监测区域划分成工业区、商业区、居 住区、工业和居住混合区、交通密集区、清洁 区等不同功能区
(2) 再根据具体污染情况,按功能区的地形、气 象、人口密度、建筑密度等,在每个功能区 设若干采样点
2. 网格布点法
•适用于有多个污染源,且污染源分布较均匀的地区 •将监测区域划分成若干均匀网状方格,采样点设在两 条直线的交点处或方格中心
家庭炉灶与取暖设备排气 室内空气污染源
粒子状态污染物
粒子状态污染物:即颗粒物,是分散在大
气中的微小固体和液体颗粒,粒径多在0.01100μm之间,是一个复杂的非均匀体系。
对动植物的危害
• 美国蒙塔那洲一铜冶炼厂排出大量SO2、 As2O3,污染周围牧草,草中含砷400PPm, 使在24Km内的羊群大量死亡。
• 臭氧使美国每年森林农作物经济损失超过30 亿美元
• 哥伦比亚的炼铜厂SO2污染,使该厂南部52 英里内30%的树木,南部33英里内60%的树 木死亡或者严重受损。
对材料的损坏
• SO2能腐蚀暴露于空气中的金属制品,使 皮革、纸张、纺织品变脆;
• H2S能使白色铅涂料变成黑色; • 光化学烟雾能使橡胶轮胎龟裂、电镀层加
速腐蚀; • 高浓度的NOx能使尼龙织品分解。
对大气的影响
改变大气的性质和气候的形式
• CO2吸收地面的辐射,颗粒物对阳光的散射 作用能改变地面温度,使温度上升或者下降 (温室效应)
1. 功能区布点法
多用于区域性的常规监测
(1) 先将监测区域划分成工业区、商业区、居 住区、工业和居住混合区、交通密集区、清洁 区等不同功能区
(2) 再根据具体污染情况,按功能区的地形、气 象、人口密度、建筑密度等,在每个功能区 设若干采样点
2. 网格布点法
•适用于有多个污染源,且污染源分布较均匀的地区 •将监测区域划分成若干均匀网状方格,采样点设在两 条直线的交点处或方格中心
家庭炉灶与取暖设备排气 室内空气污染源
03-2环境化学第三章__水环境化学

k 值是 c=1 时的吸附量,它可以大致表示吸附能力
1 的强弱。 n
为斜率,它表示吸附量随浓度增长的强
度。
该等温线不能给出饱和吸附量。
③Langmuir型吸附等温线 G=G0c/(A+c) 1/G=1/G0+(A/G0)(1/c) G0---单位表面上达到饱和 时间的最大吸附量;
G0
G0/2 L型
A
1/G
c
L型
A---常数
1/c
1 1 以 G 对 作图,同样得到一直线。 c
该等温线在一定程度上反映了吸附剂与吸附物的 特性,其形式在许多情况下与实验所用溶质浓度区
段有关。当溶质浓度甚低时,可能在初始区段中呈
现H型,当浓度较高时,曲线可能表现为F型,但统
一起来仍属于L型的不同区段。
④影响吸附作用的因素:
Fe(OH)2+、Fe(OH)2+、Fe2(OH)24+和Fe(OH)3。 3)锰 与铁类似,其丰度虽然不如铁,溶解度比铁高, 也是常见的水合金属氧化物。 4)硅酸的单体H4SiO4,若写成Si(OH)4,则类似于多价金 属,是一种弱酸,过量的硅酸将会生成聚合物,并可生 成胶体以至沉淀物。
重要的水合氧化物主要有:
4、吸附等温线
1)吸附等温线和等温式:水体中颗粒物对溶质的
吸附是一个动态平衡过程,在固定的温度条件下,
当吸附达到平衡时,颗粒物表面上的吸附量 (G)与
溶液中溶质平衡浓度 (c) 之间的关系,可用吸附等 温线来表达。 水体 中常见 的吸附 等温线 有三类 : Henry 型 、 Freundlich型、 Langmuir型,简称为 H、 F、 L型。
① Henry 型吸附等温线为直线,等温式为: G=kc
1 的强弱。 n
为斜率,它表示吸附量随浓度增长的强
度。
该等温线不能给出饱和吸附量。
③Langmuir型吸附等温线 G=G0c/(A+c) 1/G=1/G0+(A/G0)(1/c) G0---单位表面上达到饱和 时间的最大吸附量;
G0
G0/2 L型
A
1/G
c
L型
A---常数
1/c
1 1 以 G 对 作图,同样得到一直线。 c
该等温线在一定程度上反映了吸附剂与吸附物的 特性,其形式在许多情况下与实验所用溶质浓度区
段有关。当溶质浓度甚低时,可能在初始区段中呈
现H型,当浓度较高时,曲线可能表现为F型,但统
一起来仍属于L型的不同区段。
④影响吸附作用的因素:
Fe(OH)2+、Fe(OH)2+、Fe2(OH)24+和Fe(OH)3。 3)锰 与铁类似,其丰度虽然不如铁,溶解度比铁高, 也是常见的水合金属氧化物。 4)硅酸的单体H4SiO4,若写成Si(OH)4,则类似于多价金 属,是一种弱酸,过量的硅酸将会生成聚合物,并可生 成胶体以至沉淀物。
重要的水合氧化物主要有:
4、吸附等温线
1)吸附等温线和等温式:水体中颗粒物对溶质的
吸附是一个动态平衡过程,在固定的温度条件下,
当吸附达到平衡时,颗粒物表面上的吸附量 (G)与
溶液中溶质平衡浓度 (c) 之间的关系,可用吸附等 温线来表达。 水体 中常见 的吸附 等温线 有三类 : Henry 型 、 Freundlich型、 Langmuir型,简称为 H、 F、 L型。
① Henry 型吸附等温线为直线,等温式为: G=kc
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②
lg[Pb (OH)20] = – 4.4
③
lg[Pb (OH)3¯] = – 15.4 + pH ④
第一节 水环境中的沉淀溶解反应
可见除[Pb (OH)20]与pH无关外,其余3种铅形态都与溶液 中H+离子浓度有关,Pb2+、PbOH +、Pb (OH)20和Pb(OH)3---对 数值作为pH值函数特征线的斜率分别为–2、–1、0和 +1,
第三章 水环境化学
第一节 水环境中的沉淀溶解反应
金属离子在水环境中的迁移与否,迁移能力的大小多和这 些离子的化合物在水中的沉淀和溶解反应紧密相关。在金属离 子中,溶解度小者,其在水中的迁移能力小,溶解度大者的迁 移能力大。
第一节 水环境中的沉淀溶解反应
在固—液平衡体系中,一般用溶度积来表征溶解度大小。 尽管在化学理论研究上,溶度积的获得具有严格的条件,将 其用于解释天然水中各种化合物的沉淀溶解性质时存在一定 偏差,但在水环境中各种无机化合物的溶解度或沉淀反应仍 遵守溶度积原则。
在用溶度积讨论无机化合物的沉淀溶解反应平衡,以及 这一反应对金属离子迁移、转化的具体影响时----------?
第一节 水环境中的沉淀溶解反应 要注意的是:
1、金属离子在水中的沉淀溶解过程往往是一些非均相反 应,这些反应进行得缓慢,在动态环境中不易达到平衡。
2、热力学理论中所阐述的物相关系不一定与实际沉淀反 应完全一致。(沉淀可以进一步转化)
第三章 水环境化学
Chapter3. Aquatic Environmental Chemistry
从化学过程和原理方面阐明天然水中的各种化学平衡 问题和无机离子,特别是重金属离子,有机化合物等 在天然水中分布、迁移、转化和归宿规律.
第三章 水环境化学
第一节 水环境中的沉淀溶解反应 第二节 水环境中的配合反应 第三节 水环境中的氧化与还原反应 第四节 水中胶体物质及其吸附作用 第五节 水中有机污染物的迁移转化
溶解度小于0.01克/100克水的物质叫做“难溶物” 地表水和沉积物的孔隙水中主要阴离子Cl-、SO2-4、HCO-3 还原条件下有H2S衍生的HS-与S2-,碳酸盐、氢氧化物、硫 化物难溶。
第一节 水环境中的沉淀溶解反应
一、氧化物和氢氧化物 金属氢氧化物沉淀有多种形态,它们在水环境中的行为差 别很大。氧化物可看成是氢氧化物脱水而成。金属氢氧化 物的沉淀溶解平衡可以用化学反应的通式表述:
MeT=[Mez+]+∑[Me(OH)nz-n]
第一节 水环境中的沉淀溶解反应
铅的各种形态与水体pH的关系以及所对应的浓度
(1) H2O ==== H+ + OH¯
lgKw = -14
(2) PbO(s) + 2H+ ==== Pb2+ + H2O
lg*Ks0 = 12.7
(3) PbO(s) + H+ ==== PbOH +
3、在实际中往往出现化合物的溶解量大于其溶解度的情 况,即存在过饱和现象。
4、固体溶解所产生的离子可能在溶液中进一步反应。 5、用于计算的平衡常数因测定条件不尽相同而存在差别。 (不同文献的平衡常数有差异)
第一节 水环境中的沉淀溶解反应
水对许多物质有很强的溶解能力,是由于它有很高的介电常数, 1、水是强极性分子,对极性大的离子键化合物的溶解能力比极 性小的共价键化合物的溶解能力大。金属离子与SO42-之间为离 子键,在水中的溶解度远大于共价键的金属硫化物。
Me (OH)n(s) ==== Me n+ + nOH¯ Ksp = [Me n+][OH–]n [Me n+]= Ksp/[OH–]n = Ksp[H+]n / Knw
pc = ( pKsp – npKw ) + npH (3-1)
第一节 水环境中的沉淀溶解反应 1、pc 与pH成直线关系,即在一定的pH的范围内, pH 越高,金属离子的浓度越低; 2、金属离子的价数就是浓度随pH变化的斜率,其中 lg[Men+] 与pH的关系,斜率分别为 -1、-2、-3。 Ag+、Hg+ 的斜率为 1; Ca2+、Mg2+、Fe2+、Mn2+、Zn2+、Pb2+、Cu2+、Hg2+、Ni2+、Cd2+、Co2+ 的斜率为 2; Al3+、Fe3+、Cr3+ 的斜率为 3; 3、当pc = 0时(-lg[Men+] = 0 即 [Men+] = 1 mol/L), 直线在横轴上的pH值为截距 , 用下式计算:
lg*Ks1 = 5.0
(4) PbO(s) + H2O ==== Pb (OH)20
lg Ks2 = -4.4
(5) PbO(s) + 2H2O ==== Pb (OH)3¯+ H+ lg*Ks3 = -15.4
lg[Pb2+] = 12.7 – 2pH
①
lg[PbOH +] = 5.0 – pH
pH = 14 – 1/n pKsp
第一节 水环境中的沉淀溶解反应
第一节 水环境中的沉淀溶解反应
1、从图中可看出各金属离子生成氢氧化物沉淀的先后。
2、金属离子的浓度已知,可知道该金属离子开始沉淀时的 pH值。
3、同价金属离子均有相同的斜率,靠右边斜线代表的金属 氢氧化物的溶解度大于靠左边的金属氢氧化物的溶解度。 上边所讨论的并不能充分反映出 的溶解度,应该考虑OH与金属离子可进行配合,金属离子氧化物和氢氧化物的溶 解度:
将有关铅形态浓度的对数对pH 作图,可得Pb的溶解度与 pH的关系, 其中lg[Pb (OH)20]是一条与pH无关的水平线
-
-
第一节 水环境中的沉淀溶解反应
图中阴影所包围的区域为PbO(s)稳定存在的区域, 阴影以外的区域为溶解的铅形态,
[Pb(Ⅱ)T]=[Pb2+]+[ PbOH +]+[ Pb (OH)20]+[ Pb (OH)3¯]
AgF(离子晶格)的溶解度大于 AgCl(共价键) 2、对离子键化合物来说,溶解度随着离子半径的增大和电价 的减少而增加,Na3PO4、 Na2SO4 、 Na2CO3均易溶 ,而 Ca3(PO 4)2 、 CaSO4 、 CaCO3均难溶 。
第一节 水环境中的沉淀溶解反应
3、相互结合的离
