稀土金属有机化学
稀土就是化学元素周期表中镧系元素

稀土就是化学元素周期表中镧系元素——镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu),以及与镧系的15个元素密切相关的两个元素——钪(Sc)和钇(Y)共17种元素,称为稀土元素(Rare Earth)。
简称稀土(RE或R)。
稀土的分类】1)轻稀土(又称铈组):镧、铈、镨、钕、钷、钐、铕、钆。
2)重稀土(又称钇组):铽、镝、钬、铒、铥、镱、镥、钪、钇。
铈组与钇组之别,是因为矿物经分离得到的稀土混合物中,常以铈或钇比例多的而得名。
稀土金属(rare earth metals)又称稀土元素,是元素周期表ⅢB族中钪、钇、镧系17种元素的总称,常用R或RE表示。
它们的名称和化学符号是钪(Sc)、钇(Y)、镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)。
它们的原子序数是21(Sc)、39(Y)、57(La)到71(Lu)。
【名称由来】17种稀土元素名称的由来及用途镧(La) "镧"这个元素是1839年被命名的,当时有个叫"莫桑德"的瑞典人发现铈土中含有其它元素,他借用希腊语中"隐藏"一词把这种元素取名为"镧"。
镧的应用非常广泛,如应用于压电材料、电热材料、热电材料、磁阻材料、发光材料(兰粉)、贮氢材料、光学玻璃、激光材料、各种合金材料等。
她也应用到制备许多有机化工产品的催化剂中,光转换农用薄膜也用到镧,在国外,科学家把镧对作物的作用赋与"超级钙"的美称。
铈(Ce) "铈"这个元素是由德国人克劳普罗斯,瑞典人乌斯伯齐力、希生格尔于1803年发现并命名的,以纪念1801年发现的小行星--谷神星。
稀土元素的反应

3稀土金属与水和酸作用
❖ 稀土金属能分解水,在冷水中作用缓慢,在热 水中作用较快,并迅速地放出氢气;
RE 3H 2O RE (OH)3 3 / 2H 2
❖ 稀土金属能溶解在稀盐酸、硫酸、硝酸中, 生成相应的盐。在氢氟酸和磷酸中不易溶解, 这是由于生成难溶的氟化物和磷酸盐膜所致。
❖ 所有稀土金属在空气中,加热至 180~200℃时,迅速氧化且放出热量。铈 生成CeO2,镨生成Pr6O11(Pr2O3·4PrO2), 铽则生成Tb4O7(Tb2O3·2TbO2),其它稀土 金属则生成RE2O3型氧化物。
(2)稀土金属与氢作用
❖ 稀土金属在室温下能吸收氢,温度升高吸
~ 氢速度加快。当加热至250 300℃时,则 ~ 能激烈吸氢,并生成组成为REHx(X=2 4)
(7)稀土碳酸盐
❖ 往可溶性的稀土盐溶液中加入略微过量的 (NH4)2CO3,即可得到稀土碳酸盐。但随 着原子序数的增加,生成碱式盐的趋势也 增加,碱金属的碳酸盐与稀土可溶性盐作 用只能得到碱式盐,而与碱金属酸式碳酸 盐作用则生成稀土碳酸盐。
❖ 稀土碳酸盐能和大多数酸反应,生成相应 的盐放出CO2。
❖ REC2(s)=RE(g) + 2C(s)
(5)稀土硫酸盐
❖ 稀土氧化物与略微过量的浓硫酸反应、水合 硫酸盐高温脱水或酸式盐的热分解均可制得 无水稀土硫酸盐。无水稀土硫酸盐容易吸水, 溶于水是放热,在20℃时,稀土硫酸盐的溶 解度由铈至铕依次降低,由钇至镥依次升高。
❖ 水合稀土硫酸盐可用通式RE2(SO4)3·nH2O表 示,其中n=3,4,5,6,8,9,但以n=9(La,Ce)和 n=8(Pr至Lu)为最常见。
稀土化学7稀土元素配合物

制备稀土与强碱性含氮配位体配合物,可将 胺类的气体与无机稀土氯化物直接反应,得 到固体的加合物。例如NH3、CH3NH2 与稀土 氯化物作用,得到LnCl3(NH3)n (n=1~8)及 LnCl3(CH3NH2)n (n=1~5)。制备二胺或多胺 的配合物是将无水的稀土盐类与多胺在乙腈
醇、乙腈和乙酸乙酯等,多数情况下可以沉淀出稀土配合
物。也可以用对应的稀土盐类,溶于过量的配位体中,如 二甲基亚砜(DMSO)和二甲基胺(DMF)等,再用减压蒸馏法 将过量的配位体除去。用上述方法可以合成整个稀土系列
的配合物,此时影响配合物的组成的主要因素是稀土的原
子序数,轻稀土与重稀土经常得到不同的配合物组成,而
(4)近年来开展了稀土元素生物化学方面的研究,把稀土离 子作为生物体系中碱土金属结合位置的探针。现已对酶、 氨基酸、冠醚、卟啉类的含氮大环等配合物的溶液化学、 光谱、核磁共振谱和顺磁共振谱等方面进行了研究。
一般化合物的形成是以原子价键理论为基础的。根 据原子价键理论,元素A和元素B化合时,它们相互 之间有一定的“化合量”,它们的原子之间有一定 的数量比。根据各组成元素的原子价可写出相应的 结构式:H2O
配位数 杂化类型 几何构型
2
sp
直线形
3
sp2 平面等边三角形
4
sp3
正四面体形
4
dsp2
正方形
5
dsp3
三角双锥形
6 sp3d2, d2sp3 正八面体形
配位数为2的配Biblioteka 物例:[AgCl2]-, [CuCl2]-
配位数为4的配合物
正四面体形
配
位
稀土金属有机化学

PhSiH3, benzene, rt 96 h, 61%, 2:1ds
SiH2Ph SiH2Ph
SiH2Ph
5% (C5Me4i-Pr)2YCH(TMS)2
n-C6H13
PhSiH3, 50 0C
12 h, 78%, 4:1
PhH2Si
n-C6H13
+ H
n-C6H13
Lanthanide Complexes Catalyzed Hydroamination/Cyclization Reactions of aminoalkynes
R cat. LY-N(TMS)2 NH2
Et
Et
L = N or
N
Et
Et
Pri N
N Pri
nR N n = 1, 2
Livinghouse, T. et al, Adv. Synth. Catal. 2006, 348, 701-704.
Cp*2LnCH(TMS)2 + H2P n
* PH
CH2(TMS)2 PH Cp*2Ln
H2P n Cp*2Ln * PH
Cp*2Ln PH
E =CH(TMS)2
4. Catalytic Hydrosilylation
5% catalyst
n-C8H17
PhH2Si PhSiH3, rt, 1-24h,
75%, 28:1
n-C8H17 +
SiH2Ph n-C8H17
催化剂
Cp*2LuMeTHF Cp*2YbCH(TMS)2 Cp*2YMeTHF Cp*2SmCH(TMS)2 Cp*2NdCH(TMS)2 Cp*2LaCH(TMS)2 Me2SiCp”2YCH(TMS)2 Me2SiCp”2SmCH(TMS)2 Me2SiCp”2NdCH(TMS)2
乙酸铈和硝酸铈

乙酸铈和硝酸铈乙酸铈和硝酸铈是两种常见的铈盐,具有不同的化学性质和用途。
本文将分步骤阐述这两种化合物的性质和用途,以及它们在科学研究和产业应用中的重要性。
1、乙酸铈乙酸铈的化学式为Ce(CH3COO)3,是一种白色晶体,易潮解,不溶于水,溶于乙醇和乙醚。
乙酸铈是一种重要的稀土金属有机盐,具有以下主要用途:(1)作为氧化剂和催化剂。
乙酸铈是一种强氧化剂,常用于有机合成反应中,例如合成烯醇、醛、酮等化合物。
此外,乙酸铈还可以作为催化剂,促进化学反应的进行,提高反应速率和选择性。
(2)用于储存能源。
乙酸铈可以与一些有机物形成复合材料,具有储能性能。
这种材料可以在外界刺激下释放储存的能量,如可将其应用于电池、电容器、动力材料等领域。
(3)用于生物技术。
由于乙酸铈稀土离子的特殊性质,可以与生物体内的蛋白质和核酸发生特殊的作用。
因此乙酸铈常用于生物技术中的分析、诊断和治疗等方面。
2、硝酸铈硝酸铈的化学式为Ce(NO3)3,是一种白色结晶体,易潮解,易溶于水和醇类。
硝酸铈是铈系稀土金属化合物中的重要代表,具有以下主要用途:(1)用于材料科学。
硝酸铈具有优良的光学、电学性能,因此可以用于制备太阳能电池、光电器件等。
此外,硝酸铈也能够改善材料的热稳定性、耐腐蚀性和高温力学性能等方面的特性。
(2)用于电子材料。
硝酸铈可以用于制备电子材料中的瞬变器件、磁存储材料、超导体等,具有良好的性能。
在集成电路领域,硝酸铈也具有重要作用,可用于制备高介质、高温超导体等特殊的电子材料。
(3)用于其他领域。
硝酸铈还可以用于污水处理、催化剂的制备等领域。
在化学分析中,硝酸铈可以用于测定阳离子的含量,其极性高,适用于许多离子的测定。
总之,乙酸铈和硝酸铈作为铈系稀土金属化合物中的重要代表,具有广泛的用途。
它们在材料科学、电子材料、生物技术、化学分析、催化剂等领域中扮演着重要的角色。
在科学研究和产业应用中,它们的重要性不容忽视。
17种稀土元素

17种稀土元素的应用领域稀土的分类1)轻稀土(又称铈组):镧、铈、镨、钕、钷、钐、铕、钆。
2)重稀土(又称钇组):铽、镝、钬、铒、铥、镱、镥、钪、钇。
镧(La)【lán】:镧的应用超级普遍,如应用于压电材料、电热材料、热电材料、磁阻材料、发光材料(兰粉)、贮氢材料、光学玻璃、激光材料、各类合金材料等。
她也应用到制备许多有机化工产品的催化剂中,光转换农用薄膜也用到镧,在国外,科学家把镧对作物的作用赋与"超级钙"的美称。
铈(Ce)【shì】:1,铈作为玻璃添加剂,能吸收紫外线与红外线,现已被大量应用于汽车玻璃。
不仅能防紫外线,还可降低车内温度,从而节约空挪用电。
从1997年起,日本汽车玻璃全加入氧化铈,1996年用于汽车玻璃的氧化铈至少有2000吨,美国约1000多吨。
2,目前正将铈应用到汽车尾气净化催化剂中,可有效避免大量汽车废气排到空气中美国在这方面的消费量占稀土总消费量的三分之一强。
3,硫化铈能够取代铅、镉等对环境和人类有害的金属应用到颜料中,可对塑料着色,也可用于涂料、油墨和纸张等行业。
目前领先的是法国罗纳普朗克公司。
4,Ce:LiSAF激光系统是美国研制出来的固体激光器,通过监测色氨酸浓度可用于探查生物武器,还可用于医学。
铈应用领域超级普遍,几乎所有的稀土应用领域中都含有铈。
如抛光粉、储氢材料、热电材料、铈钨电极、陶瓷电容器、压电陶瓷、铈碳化硅磨料、燃料电池原料、汽油催化剂、某些永磁材料、各类合金钢及有色金属等。
镨(Pr)【pǔ】:1,镨被普遍应用于建筑陶瓷和日用陶瓷中,其与陶瓷釉混合制成色釉,也可单独作釉下颜料,制成的颜料呈淡黄色,色调纯正、淡雅。
2,用于制造永磁体。
选用廉价的镨钕金属代替纯钕金属制造永磁材料,其抗氧性能和机械性能明显提高,可加工成各类形状的磁体。
普遍应用于各类电子器件和马达上。
3,用于石油催化裂化。
以镨钕富集物的形式加入Y型沸石分子筛中制备石油裂化催化剂,可提高催化剂的活性、选择性和稳固性。
稀土论文——化学专用
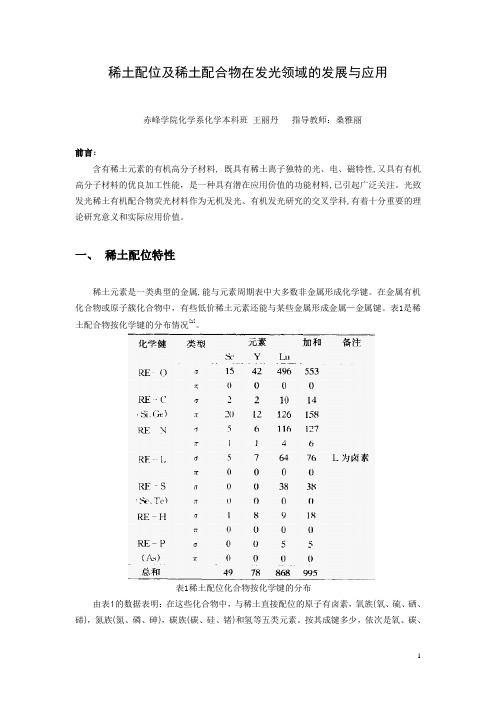
稀土配位及稀土配合物在发光领域的发展与应用赤峰学院化学系化学本科班王丽丹指导教师:桑雅丽前言:含有稀土元素的有机高分子材料, 既具有稀土离子独特的光、电、磁特性,又具有有机高分子材料的优良加工性能,是一种具有潜在应用价值的功能材料,已引起广泛关注。
光致发光稀土有机配合物荧光材料作为无机发光、有机发光研究的交叉学科,有着十分重要的理论研究意义和实际应用价值。
一、稀土配位特性稀土元素是一类典型的金属,能与元素周期表中大多数非金属形成化学键。
在金属有机化合物或原子簇化合物中,有些低价稀土元素还能与某些金属形成金属—金属键。
表1是稀土配合物按化学键的分布情况[1]。
表1稀土配位化合物按化学键的分布由表1的数据表明:在这些化合物中,与稀土直接配位的原子有卤素,氧族(氧、硫、硒、碲),氮族(氮、磷、砷),碳族(碳、硅、锗)和氢等五类元素。
按其成键多少,依次是氧、碳、氮、卤素、硫(硒、碲)、氢和磷(砷)。
配位化合物(包括络合离子)及金属有机化合物中中心离子的配位数是指与它结合的δ配体的配位原子数或π配位所提供的π电子对数。
根据图1可以看出稀土有大而多变的配位数,3d过渡金属的配位数通常是4或6,而稀土元素离子最常见的配位数为8或9,这一数值比较接近6s,6p和5d道数的总和;稀土离子具有较小的配体场稳定化能,而过渡金属的晶体场稳定化能较大,所以稀土元素在形成配合物时键的方向不强,配位数在3 ~12范围内变动[2]。
由图1可以看到其中最常见的配位数为8和9,对稀土化学键及电子结构的研究结果表明:大多数稀土化合物中其化学键的性质属极性共价键,稀土常以6s、6p和5d轨轨道参与成键, 其轨道总数为9,这就是稀土化合物配位数以8和9为主的主要原因。
统计数字表明:具有8和9配位数的配合物约占总数的65%,配位数高于8和9的配合物显著减少,配位数低于8和9的配合物数目也显著减少。
二、稀土配位化学[3]配位化学处于多学科交汇点,稀土配位化学是稀土化学活跃的前沿领域之一。
金属有机

直线型 R2Hg 等边三角形 R3B 四面体 (C2H5)4Pb 平面四方形 [(C2H4)PtCl3]三角双锥 (CH3)5Sb 八面体 M(CO)6,M=Cr,Mo,W
离子型金属有机化合物 M-C是极性键,因为M的电负性小于C。 M包括ⅠA,ⅡA,ⅢA,La系,Ac系。 含离域的多中心键的金属有机化合物 • 缺电子键型(deficient electron compound) 定义:凡电子数少于按电子配对法成键所需 的价电子数的化合物。 • M-C中C原子为π给予体的多中心键的化 合物 • M-C以夹心键形成的π键化合物
1919年,法国H. Hein
CrCl3 + PhMgBr Ph2Cr
当时其成键性质,特点引起广泛讨论,直到1954 年Zeiss阐明其结构是夹心型的-芳烃络合物。 1925年,Fischer-Tropsch反应的发现 Fe Oxide cat H2 + CO 汽油 (合成气) 320-340℃ , 25bar (碳氢混合物) 其机理的研究目前仍然是金属有机化学的一个重 要研究领域,可能是先生成M-C或者M=C。 1936年,该反应在法国得到工业化,南非汽油的 一半量通过该法生产。
• 混合金属(合金)与RX反应
主要是针对高原子序数的金属,M=Tl,Pb,Bi,Hg等。因 为生成的M-C键很弱,RnM的生成焓[△Hf°(RnM)>0] 不能由MXn的生成焓 [△Hf°(MXn)<0]补偿,需加入另 外一种金属促进反应进行。 Na + Hg + 2CH3Br → (CH3)2Hg + 2NaBr
金属有机化学是无机化学和有机化学的交叉学 科,既可以归属于无机化学,也可以归属于有 机化学。 • 无机化学角度:有机金属化合物是一类以有机 烃为配体的配合物或者说含M-C键的配合物, 主要研究其结构,成键规律及性质,稳定性, 配体的解离反应等,目的是用于材料科学方向。 • 有机化学角度:合成及其化学性质,基元反应 特点,配合物中有机配体的形成,新参与的有 机反应及对有机反应的影响规律。目的是希望 用于有机合成,精细化工合成,高分子合成化 学等方面。
