铁三角的转化关系和应用
铁三角的转化

铁三角Fe、Fe2+和Fe3+之间相互转化及检验从Fe、Fe2+和Fe3+的结构可知:Fe只有还原性,Fe3+通常只有氧化性,Fe2+既具有氧化性又具有还原性。
上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化,如下图(常称为铁三角):4Fe2+Fe3+Fe、Cu、I-、S2-、H2S(溶液为绿色)(溶液为棕黄色)1.学习铁及其化合物的性质要注意:(1)抓价态:从铁元素三种价态的相互转化(铁三角关系)去认识铁及其化合物间的氧化—还原反应规律.(2)想属类:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质.2.铁元素的原子在化学反应中,当遇弱氧化剂(如S、H+、Cu2+、I2等)时,铁只能失去最外层的两个电子,而生成+2价铁的化合物,当遇到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成+3价铁的化合物.3.具体反应有:(1)Fe2+→Fe3+①2Fe2++Cl2=2Fe3++2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。
②4Fe2++O2+4H+=4Fe3++2H2O(亚铁盐溶液在空气中容易变质,如绿矾露置于空气中则是:12FeSO4+3O2=4Fe2(SO4)3+2Fe2O3)12Fe2+ + 3O2 + 6H2O =8Fe3+ +4Fe(OH)3 6FeCl2 + 3 Br2 = 4FeCl3 + 2 FeBr3 2 Fe2+ + Br2= 4 Fe3++ 2 Br -6FeBr2 + 3Cl2(少量)= 4 FeCl3+ 2 FeBr32Fe2+ + Br2= 2 Fe3++ 2 Br -2FeBr2 + 3 Cl2(足量)= 2 FeCl3 + 2 Br2 2 Fe2+ + 4 Br- + 3 Cl2 = 2Fe3+ + 6 Cl- + 2 Br2③3Fe2++NO3-+4H+=3Fe3++2H2O+NO↑2FeSO4 + 2 H2SO4(浓) =Fe2(SO4)3 + SO2 ↑+ 2 H2O④5Fe2++MnO4-+8H+=5Fe3++4H2O+Mn2+ Cr2O72- + 6 Fe2++ 14 H+ =2Cr3+ + 6Fe3+ + 7 H2O如在FeCl 2溶液中滴加酸性KMnO 4溶液,溶液由浅绿色变棕黄色,在酸性KMnO 4溶液滴加FeCl 2溶液,溶液由紫红变棕黄。
【全国百强校】河北省定州中学2017届高三化学一轮观摩课教学设计:铁三角的转化及应用

铁三角的转化及应用教学设计
河北定州中学高三化学组马睿
一、考情学情分析
近几年来各地高考对铁的化合物考察非常重视,总体考查上侧重在工艺流程或实验题中,铁的化合物之间的相互转化及应用。
对学生而言,新授课已经结束,学生已经具备了较完备的知识结构,分析问题也更加深刻,讨论也能更加有效的实施。
通过一轮复习,让学生实现对知识掌握系统化。
二、教学目标
1.知识与技能①以二价铁与三价铁与铁的转化为例,理解变价金属元素的氧化还原反应②掌握二价铁三价铁的离子共存问题③掌握铁的化合物在工艺流程中的应用
2.过程与方法①要求学生规范解答过程②提高综合分析问题的能力
3.情感态度与价值观通过分析物质制备的流程过程,使学生关注与化学有关的社会热点问题,认识环境保护和资源合理开发的重要性。
三、教学重难点
铁三角的相互转化及应用。
四、教学方法
讲练结合、归纳总结
五、教学过程
思考,回答两
【思考】哪些离子不与二价铁,三价铁大量共存【总结】不与二价铁,三价铁大量共存的离子【板书】二.二价铁三价铁的离子共存
【投影】补充
六、板书设计
铁三角的转化及应用
一.铁三角的转化
二.二价铁三价铁的离子共存
三.铁三角中的计算
四.铁三角在工艺流程中的应用。
铁三角的化学方程式

铁三角的化学方程式
(原创实用版)
目录
1.铁三角的定义与构成
2.铁三角的化学性质
3.铁三角的化学方程式及其应用
正文
铁三角(Fe3O4)是一种由 FeO、Fe2O3 和 Fe3O4 组成的矿物,通常呈黑色或暗褐色。
它是一种具有磁性的氧化物,具有很高的磁导率。
铁三角广泛应用于磁性材料、磁性传感器、磁性储存器等领域。
铁三角的化学性质主要表现在其氧化还原性上。
在空气中,铁三角可以与氧气反应生成 Fe3O4,反应方程式为:
4FeO + O2 → 2Fe3O4
在高温下,铁三角可以与碳反应生成 Fe2O3 和 CO,反应方程式为:2Fe3O4 + 3C → 6FeO + 3CO
此外,铁三角还可以与其他化合物发生反应,如与盐酸反应生成FeCl2 和 FeCl3,反应方程式为:
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
铁三角的化学方程式及其应用广泛,不仅可以用于研究铁的氧化还原反应,还可以应用于制备磁性材料、磁性传感器、磁性储存器等领域。
例如,在磁性材料制备中,可以通过控制铁三角的组成和结构,调节磁性材料的磁性能。
在磁性传感器和磁性储存器中,铁三角的高磁导率特性可以提高器件的灵敏度和性能。
总之,铁三角作为一种具有磁性的氧化物,具有广泛的应用前景。
铁三角转化及应用

铁三角转化及应用铁三角是一个经济学上的概念,指代三个旨在维护自身利益的角色:政府、企业和工会。
为了实现某些目标,这三方面通常会密切合作。
然而,这种紧密的合作常常会导致利益共享的问题,以及对消费者和其他利益相关者的剥夺。
在这个概念中,政府通常会通过制定政策来监管企业和工会的活动。
企业则会利用政府的支持,为自己谋取更多的利益并保护自己免于竞争。
工会则通过与政府和企业合作,获取更好的工资和福利,并确保劳动者得到公正的待遇。
铁三角可以定义为一个由政府、企业和工会组成的利益集团,他们会通过合作来影响政策制定过程,并谋求自己的利益。
虽然这种合作对于某些方面有利,但对于社会福利和公正有害。
铁三角的存在导致了很多问题。
它们通常不关注消费者的利益,而是旨在实现自己的目标。
政府和企业的合作可以导致政府政策的不公正,而工会则可能会在劳资谈判中获得更高的工资和福利,这最终会导致生产成本的上升。
铁三角的存在也就意味着利益的过度保护,这样可能会导致消费者的需要和利益被忽视。
铁三角还认为政府应该为他们服务,这意味着政府资源的过度使用,并削弱了公共服务和社会基础设施。
然而,铁三角也可以有一些优点。
政府可以通过与企业和工会合作来更好地监管企业的活动,确保企业的行为符合法律规定。
工会也能够确保劳动者得到合理的待遇和福利。
企业则可以更好地了解政策制定过程,以便更好地谋求自己的利益。
铁三角的最大问题在于,他们通常会通过利用彼此之间的势力来谋求自己的利益,以及在政策制定过程中剥夺其他利益相关者的权益。
为了解决这一问题,我们需要寻找其他形式的合作,以更好地实现公共利益和社会公正。
我们可以使用其他的办法来代替铁三角。
例如,政策制定者应该以全社会的利益为先,而非铁三角内部的利益。
政府应该与企业和工会的民间组织进行对话,以更好地理解公民的需要和合法要求。
在劳资谈判中,应着眼于结果的良好表现,而不是颠覆现有的社会协议。
企业也需要公正的机制,来确保消费者得到高质量的产品和服务。
“铁三角”的转化关系及综合应用

Fe2+
Fe Fe2O3
Cu2+
Al
Al2O3、SiO2
• (3)盐溶液的配制与保存
(4)物质的制备
• 含铁物质之间的转化关系图
• 1.判断正误,正确的划“√”,错误的划“×”。
• (1)检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再 滴加KSCN溶液,观察实验现象。( × )
+ -
4Fe(OH)2+O2+2H2O===4Fe(OH)3。 方法三:取出少量被检验的溶液,加入 K3[Fe(CN)6] 溶液,产生蓝色沉淀,证明 有 Fe2+存在。 3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓。
• 2.Fe3+的检验 • 方法一:取出少量被检验的溶液,滴加KSCN溶液,溶液变红色,证明有 Fe3+存在。 • 方法二:取出少量被检验的溶液,加入NaOH溶液,产生红褐色沉淀,证明 有Fe3+存在。 • 方法三:取出少量被检验的溶液,加入苯酚,溶液变紫色,证明有Fe3+存 在。
2++H O +2H+===2Fe3++2H O 2Fe ③__________________________________________________________ ; 2 2 2
3++Fe===3Fe2+ 2Fe ④__________________________________________________________; 3+===Cu2++2Fe2+ Cu + 2Fe ⑤__________________________________________________________。
• (3)除去Mg2+中混有的Fe2+的方法: • 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除 去溶液中的Fe3+。 • (4)除去Cu2+中混有的Fe2+的方法: • 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除 去溶液中的Fe3+。 • Fe3+具有较强的水解能力,pH>3.7时,Fe3+几乎完全水解生成Fe(OH)3沉 淀,在去除Fe3+杂质时,一般可以调节pH值使Fe3+转化成Fe(OH)3沉淀除 去。
“铁三角”的转化及应用 导学案 教师版 含答案
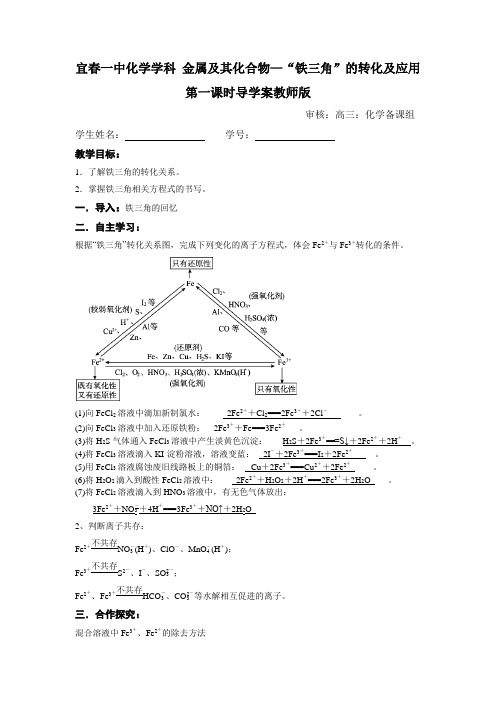
宜春一中化学学科金属及其化合物—“铁三角”的转化及应用第一课时导学案教师版审核:高三:化学备课组学生姓名:学号:教学目标:1.了解铁三角的转化关系。
2.掌握铁三角相关方程式的书写。
一.导入:铁三角的回忆二.自主学习:根据“铁三角”转化关系图,完成下列变化的离子方程式,体会Fe2+与Fe3+转化的条件。
(1)向FeCl2溶液中滴加新制氯水:_____2Fe2++Cl2===2Fe3++2Cl-_______。
(2)向FeCl3溶液中加入还原铁粉:__2Fe3++Fe===3Fe2+___。
(3)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:___ H2S+2Fe3+===S↓+2Fe2++2H+__。
(4)将FeCl3溶液滴入KI-淀粉溶液,溶液变蓝:__2I-+2Fe+===I2+2Fe+_____。
(5)用FeCl3溶液腐蚀废旧线路板上的铜箔:__ Cu+2Fe===Cu+2Fe_____。
(6)将H2O2滴入到酸性FeCl2溶液中:____2Fe2++H2O2+2H+===2Fe3++2H2O____。
(7)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出:____3Fe2++NO-3+4H+===3Fe3++NO↑+2H2O_____2、判断离子共存:Fe2+不共存NO-3(H+)、ClO-、MnO-4(H+);Fe3+不共存S2-、I-、SO2-3;Fe2+、Fe3+不共存HCO-3、CO2-3等水解相互促进的离子。
三.合作探究:混合溶液中Fe3+、Fe2+的除去方法(1)除去Mg 2+中混有的Fe 3+的方法 向混合溶液中加入Mg 、MgO 、MgCO 3、Mg(OH)2中之一,与Fe 3+水解产生的H +反应,促进Fe 3+的水解,将Fe 3+转化为Fe(OH)3沉淀而除去。
(2)除去Cu 2+中混有的Fe 3+的方法 向混合溶液中加入CuO 、CuCO 3、Cu(OH)2、Cu 2(OH)2CO 3中之一,与Fe 3+水解产生的H +反应,促进Fe 3+的水解,将Fe 3+转化为Fe(OH)3沉淀而除去。
《高二化学铁三角》课件

感谢观看
总结词:探究铁三角的性质和应用。
实验步骤
1. 将制备好的铁单质与浓硝酸反应,观察反应现象。
2. 将铁的氧化物与稀硫酸反应,观察反应现象。
实验结果:通过实验观察到铁单质与浓硝酸反应生成了氮气和二氧化氮,而铁的氧化物与稀硫酸反应可以生成相应的盐类和水。这些性质在化学工业和日常生活中有着广泛的应用。
01
04
铁三角的实验探究
总结词:通过实验探究,了解铁三角的制备方法。
实验步骤
1. 准备实验器材和试剂,如试管、烧杯、铁粉、氧化铜、硫酸等。
2. 将铁粉和氧化铜混合后放入试管中,加入适量的稀硫酸,观察反应现象。
3. 加热试管,观察反应速度和产物的变化。
实验结果:通过实验观察到铁粉和氧化铜在稀硫酸的作用下反应生成了铁的氧化物和铜的氧化物,加热后反应速度加快,生成物颜色发生变化。
02
03
04
05
05
铁三角的习题与解析
解析铁三角的概念
解析铁三角的转化
解析铁三角的应用
解析铁三角的实验
01
02
03
04
解释铁三角的定义、组成和性质,说明其在化学反应中的作用。
分析铁三角各物质之间的转化关系,说明转化的条件和原理。
解释铁三角在实际生产和生活中的应用原理,说明其重要性和意义。
分析实验设计的合理性和可行性,给出实验操作步骤和注意事项。
03
铁三角的化学性质
铁是一种过渡金属,具有多种化合价,如+2和+3价。
铁在常温下不易氧化,但在潮湿环境中容易生锈。
铁可以与酸、盐等发生置换反应,生成成铁离子。
亚铁离子在碱性溶液中不稳定,容易生成沉淀。
“铁三角”的转化关系

“铁三角”的转化关系
谢谢观赏!
“铁三角”的转化关系
【二、判断方法】
要确定某一溶液是否饱和,只要看在一定温度下有没 有不能继续溶解的剩余溶质存在,如有,且溶质的质量不 再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶 液。
“铁三角”的转化关系
“铁三角”的转化关系
“铁三角”的转化关系
(1)Fe2+→Fe,在金属活动性顺序表中排在Fe前的金属,如Zn、 Al等,可以将Fe2+还原成Fe。
“铁三角”的转化关系
“铁三角”的转化关系
【二、Fe2+和Fe3+的检验】
(1)Fe2+的检验: 方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶 液立即变红色。 方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为 灰绿色,最后变为红褐色。 (2)Fe3+的检验: 方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血 红色。 方法二:滴加NaOH溶液,出现红褐色沉淀。
Zn+FeSO4=ZnSO4+Fe 注意:K、Ca、Na等活泼金属,由于它们在水溶液中不能存在, 所以不能作为还原剂来完成Fe2+→Fe的转化。 (2)Fe3+→Fe2+需要较强的还原剂。如Fe、Zn、H2S(S2-)、KI(I-)、 Na2SO3(SO32-)等,Cu虽不是强的还原剂,但因Fe3+具有较强 的氧化性,可被Cu还原成Fe2+。 Cu+2FeCl3=CuCl2+2FeCl2 H2S+2FeCl3=2FeCl2+S↓+2HCl 2KI+2FeCl3=FeCl2+I2+2KCl知识点—— “铁三角” 的源自化关系“铁三角”的转化关系
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)Fe3+能使淀粉-KI 溶液变蓝:2_F__e_3+__+__2_I-__=_=_=_2_F_e_2_+_+_ 。I2
2.“铁三角”的应用
(3)除杂方法(括号内为杂质)
①Fe2+(Fe3+):加过量铁粉过滤 ②FeCl3(FeCl2):加氯水或H2O2 ③FeCl2(CuCl2):加过量铁粉过滤 ④Fe(Al)、Fe2O3(Al2O3、SiO2):加过量强碱溶液过滤
铁及其化合物性质的综合考查 [考向分析]铁在生活生产中有广泛用途,是高考的命
解析显/隐
放映结束 感谢各位的批评指导!
谢 谢!
让我们共同进步
相互促进水解反应而不能大量共存。
②Fe2+与 NO3-(H+)、ClO-、MnO- 4 (H+),Fe3+与 S2-、 I-、HS-、SO23-在溶液中因发生氧化还原反应而不能大量
共存。 Fe3+与SCN- 发生络合反应不能大量共存。
2.“铁三角”的应用 (2)Fe2+和Fe3+的鉴别常用方法
(1)观察法:Fe3+的盐溶液呈棕黄色,Fe2+的盐溶液呈浅绿色。 (2)SCN-法:滴入KSCN或其他可溶性硫氰化物溶液,呈 血红色的是Fe3+的盐溶液,不变色的是Fe2+的盐溶液。 (3)碱液法:分别加入碱液(如氨水),生成红褐色沉淀的是 Fe3+的盐溶液,先生成白色絮状沉淀,又迅速转变为灰绿色, 最终变为红褐色的是Fe2+的盐溶液。 (4)KMnO4(或溴水)法:分别加入少量酸性KMnO4溶液 (或溴水),能使之褪色的是Fe2+的盐溶液,不能使之褪色 的是Fe3+的盐溶液。
P35 [例5] 水溶液中能够大量共存的一组离子是( A )
A.PH=1的溶液中:Fe3+、Cl-、Na+、SO42B.H+、Na+、Fe2+、MnO4C、在0.1 mol/L FeCl3溶液中:K+、NH4+、I-、SCND、K+、Fe3+、OH-、SO42-
①Fe3+、Fe2+与 HCO- 3 、AlO2-、CO23-等在溶液中因发生
题热点。常见考查方式有离子共存(有色离子、形成沉淀、水解)、 铁铜实验、化工工艺流程等,主要考查的物质有Fe、Fe2+、Fe3+ 的相互转化,Fe2+的还原性、Fe3+的强氧化性和强水解能力, 并与氧化还原反应的知识联系起来考查。
【真题】(2012·海南化学,14)在FeCl3溶液蚀刻铜箔制造电路板 的工艺中,废液处理和资源回收的过程简述如下:
“铁三角”的转化关系及其应 用
丰顺中学 邹毅芳
1.“铁三角”中的转化关系
实验回顾
操作
现象
反应的离子方程式
FeCl3溶液
加入铁粉、 KSCN溶液
不显红色
2Fe3+ + Fe = 3Fe2+
上层清液加
入氯水,振 荡
ቤተ መጻሕፍቲ ባይዱ
变红色
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
1.“铁三角”中的转化关系
1.Fe2+具有较强的还原性,与氧化剂反应生成Fe3+ (1)Fe2+被氯气氧化:_2_F_e_2_+_+__C_l_2_=_=_=_2_C_l_-_+__2_F_e_3_+_____________。 (2)Fe2+被溴水氧化:_2_F_e_2_+_+__B_r_2_=_=_=_2_B_r_-_+__2_F_e_3_+_____________。 (3)Fe2+被高锰酸钾氧化:5F_e_2_+_+__M_n_O_- 4_+__8_H__+=_=_=__5F_e_3_+_+__M_n_2_+_+__4_H_2。O (4)Fe2+被稀硝酸氧化:3_F_e_2+_+__N__O_- 3_+__4_H__+_=_=_=_3_F_e_3_+_+__N_O_↑ ___+__2_H_2。O (5)Fe2+被浓硝酸氧化:F_e_2+_+__N__O_- 3_+__2_H__+_=_=_=_F_e_3_+_+__N_O__2↑__+__H__2O__。 (6)Fe2+被氧气氧化:_4_F_e_2_+_+__O__2+__4_H__+_=_=_=_4_F__e3_+_+__2_H__2_O_______。
1.“铁三角”中的转化关系
2.Fe3+有较强的氧化性,与还原剂反应生成 Fe2+ (1) Fe3+被 Fe 还原:_2_F_e_3_+_+__F_e_=_=_=__3_F_e_2+________________。 (2) Fe3+被 Cu 还原:2_F__e_3+__+__C_u_=_=_=__2_F_e_2+__+__C_u_2_+________。
(5)SO2 通入 FeCl3 溶液中:__________________________。 _______2_F_e_3+_+__S_O__2_+__2_H_2_O_=_=_=__2_F_e_2+_+__S_O__24_-_+__4_H_+___________
2.“铁三角”的应用 (1)判断离子共存
【例】(2013年东北三校联考) 下列检验试剂选用正确的是( )。
A.用氯水、KSCN溶液检验FeCl3中是否有FeCl2 B.用酸性KMnO4溶液检验FeCl3中是否有FeCl2 C.用NaOH溶液检验MgCl2中是否有FeCl2 D.用硝酸检验某黄色固体是纯铜还是黄铜(铜和锌的合金) 解析:A组中的Fe3+产生的干扰无法消除;B组中酸性 KMnO4溶液还能氧化Cl-;C组中虽然Mg2+也能形成白色沉淀, 但若有Fe2+,则生成的白色沉淀颜色会发生变化,故C项正确;D 组中纯铜和黄铜均能溶解在硝酸中,不能达到目的。 答案:C
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液; Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的 空气。 已知:Ksp[Fe(OH)3]=4.0×10-38 回答下列问题: __(_1_)_F_2e_FC_el_33+蚀__+刻__C铜_u_=箔_=_=反__2应_F_e的_2+_离_+__子C_u_方2_+_程__式__为________; (2)过程Ⅰ加入铁屑的主要作用是__回__收__铜__,分离得到固体的主要 成分是_C__u_和__F_e_,从固体中分离出铜需采用的方法是 _______加__过__量__盐__酸__反__应__后__过__滤_________; (3)过程Ⅱ中发生反应的化学方程式为 __________F__e_C_l_2+__C__a_(O__H_)_2_=_=_=_F_e_(_O_H__)_2↓_+__C__a_C_l_2 __________ ________4_F__e_(O__H_)_2_+__O_2_+__2_H_2_O__=_=_=_4_F_e_(_O_H__)3_________________; (4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为________。(列式 计算) c(Fe3+)= (4.0×10-38)/(109)3 =4.0×10-11(mol·L-1)
