“铁三角”转化及应用
人教版高中化学必修第一册精品课件 第3章 铁 金属材料 微专题5 “铁三角”的相互转化及应用

专题阐释 1.从物质类别和元素价态角度建构铁及其化合物的“价—类”二维图
例1 部分含铁物质的“价—类”二维图关系如图所示。下列推断不合理的 是( D ) A.c既可被氧化,也可被还原 B.a可与f反应生成c C.通过化合反应或复分解反应均能直接得到e D.g→e的转化能由一步反应实现
解析 根据含铁物质的“价—类”二维图关系可知a是Fe,b是FeO,c是亚铁盐,d是
4.某工厂的工业废水中含有大量的Fe2+、Fe3+、Cu2+和少量Na+。工厂计划 从该废水中回收硫酸亚铁和金属铜,设计如下流程。
下列说法正确的是( B ) A.加入过量A,发生的反应均为置换反应 B.固体B为混合物而固体E为纯净物 C.物质D既可以用稀硫酸也可以用稀盐酸 D.滤液C和滤液F组成完全相同
专题精练
1.[2023辽宁辽阳高一期中]向含有一定物质的量的FeCl3和CuCl2的混合溶 液中逐渐加入Fe粉至过量,该溶液的质量随加入铁粉的质量的变化关系图 为( A )
解析 FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,可先后发生反 应:2FeCl3+Fe ══ 3FeCl2、CuCl2+Fe ══ FeCl2+Cu。Fe先与FeCl3溶液反应, 溶液的质量增加,FeCl3反应完全后再与CuCl2溶液反应,由于Fe的相对原子 质量小于Cu的相对原子质量,导致溶液质量减小,当FeCl3和CuCl2全部反应 完全,溶液质量保持不变,故A图像正确。
铁三角转化图及化学方程式

铁三角转化图及化学方程式铁三角转化图是一种反映物质间相互转化关系的图形模型,由三个物质相互转化所组成,它们之间形成一个三角形的结构。
铁三角的诞生有很大的意义,它将化学反应能够用一组化学方程式表示出来,可以经过图表的形式,更直观的体现物质之间的关系。
以水漂白剂的制备为例,水漂白剂的制备可以用铁三角转化图来表示:氢氧化钠(NaOH)、次氯酸钠(NaClO)、氯气(Cl_2)这三种原料,可以通过化学合成反应形成水漂白剂(NaClO_2),并能形成一个铁三角结构。
化学转化方程如下:NaOH + NaClO = NaClO_2 + H_2ONaClO + Cl_2 = NaClO_2铁三角模型要求,物质转换关系互为可逆向变化,也就是说即便是一种物质被消耗掉,也有可能会通过与其他物质反应产生。
举个例子,氯气(Cl_2)在水漂白剂的制备中是“消耗”的,但它其实也可以通过下列反应与NaClO发生作用形成:2NaOH + Cl_2 = NaClO + NaCl + H_2O从铁三角结构可以发现,它通过三种物质之间相互转换,实现化学反应的化学变化过程。
化学变化过程是由它们之间相互联系而产生的,它们之间联系的细节描述就是化学反应的过程以及它们所发生的物理或化学变化的内容。
在实际中,铁三角所反映的学习过程是指从一种物质变化到另一种物质的过程,这种过程中所发生的不同变化的执行情况,从而实现人们的物质转换需求。
铁三角图结构可以清楚的反映物质间相互转化的情况,为学习提供了更直接明了的方式,同时它也能帮助我们更加容易的了解到化学反应过程中物质的变化情况,明确有关反应变化的化学方程式,使得更好的了解到反应所发生的实质。
因此,能够看出铁三角转化图对于临床医学中的护理人员,其实也有很大的帮助。
【全国百强校】河北省定州中学2017届高三化学一轮观摩课教学设计:铁三角的转化及应用

铁三角的转化及应用教学设计
河北定州中学高三化学组马睿
一、考情学情分析
近几年来各地高考对铁的化合物考察非常重视,总体考查上侧重在工艺流程或实验题中,铁的化合物之间的相互转化及应用。
对学生而言,新授课已经结束,学生已经具备了较完备的知识结构,分析问题也更加深刻,讨论也能更加有效的实施。
通过一轮复习,让学生实现对知识掌握系统化。
二、教学目标
1.知识与技能①以二价铁与三价铁与铁的转化为例,理解变价金属元素的氧化还原反应②掌握二价铁三价铁的离子共存问题③掌握铁的化合物在工艺流程中的应用
2.过程与方法①要求学生规范解答过程②提高综合分析问题的能力
3.情感态度与价值观通过分析物质制备的流程过程,使学生关注与化学有关的社会热点问题,认识环境保护和资源合理开发的重要性。
三、教学重难点
铁三角的相互转化及应用。
四、教学方法
讲练结合、归纳总结
五、教学过程
思考,回答两
【思考】哪些离子不与二价铁,三价铁大量共存【总结】不与二价铁,三价铁大量共存的离子【板书】二.二价铁三价铁的离子共存
【投影】补充
六、板书设计
铁三角的转化及应用
一.铁三角的转化
二.二价铁三价铁的离子共存
三.铁三角中的计算
四.铁三角在工艺流程中的应用。
铁三角转化及应用

铁三角转化及应用铁三角是一个经济学上的概念,指代三个旨在维护自身利益的角色:政府、企业和工会。
为了实现某些目标,这三方面通常会密切合作。
然而,这种紧密的合作常常会导致利益共享的问题,以及对消费者和其他利益相关者的剥夺。
在这个概念中,政府通常会通过制定政策来监管企业和工会的活动。
企业则会利用政府的支持,为自己谋取更多的利益并保护自己免于竞争。
工会则通过与政府和企业合作,获取更好的工资和福利,并确保劳动者得到公正的待遇。
铁三角可以定义为一个由政府、企业和工会组成的利益集团,他们会通过合作来影响政策制定过程,并谋求自己的利益。
虽然这种合作对于某些方面有利,但对于社会福利和公正有害。
铁三角的存在导致了很多问题。
它们通常不关注消费者的利益,而是旨在实现自己的目标。
政府和企业的合作可以导致政府政策的不公正,而工会则可能会在劳资谈判中获得更高的工资和福利,这最终会导致生产成本的上升。
铁三角的存在也就意味着利益的过度保护,这样可能会导致消费者的需要和利益被忽视。
铁三角还认为政府应该为他们服务,这意味着政府资源的过度使用,并削弱了公共服务和社会基础设施。
然而,铁三角也可以有一些优点。
政府可以通过与企业和工会合作来更好地监管企业的活动,确保企业的行为符合法律规定。
工会也能够确保劳动者得到合理的待遇和福利。
企业则可以更好地了解政策制定过程,以便更好地谋求自己的利益。
铁三角的最大问题在于,他们通常会通过利用彼此之间的势力来谋求自己的利益,以及在政策制定过程中剥夺其他利益相关者的权益。
为了解决这一问题,我们需要寻找其他形式的合作,以更好地实现公共利益和社会公正。
我们可以使用其他的办法来代替铁三角。
例如,政策制定者应该以全社会的利益为先,而非铁三角内部的利益。
政府应该与企业和工会的民间组织进行对话,以更好地理解公民的需要和合法要求。
在劳资谈判中,应着眼于结果的良好表现,而不是颠覆现有的社会协议。
企业也需要公正的机制,来确保消费者得到高质量的产品和服务。
“铁三角”的转化关系及综合应用

Fe2+
Fe Fe2O3
Cu2+
Al
Al2O3、SiO2
• (3)盐溶液的配制与保存
(4)物质的制备
• 含铁物质之间的转化关系图
• 1.判断正误,正确的划“√”,错误的划“×”。
• (1)检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再 滴加KSCN溶液,观察实验现象。( × )
+ -
4Fe(OH)2+O2+2H2O===4Fe(OH)3。 方法三:取出少量被检验的溶液,加入 K3[Fe(CN)6] 溶液,产生蓝色沉淀,证明 有 Fe2+存在。 3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓。
• 2.Fe3+的检验 • 方法一:取出少量被检验的溶液,滴加KSCN溶液,溶液变红色,证明有 Fe3+存在。 • 方法二:取出少量被检验的溶液,加入NaOH溶液,产生红褐色沉淀,证明 有Fe3+存在。 • 方法三:取出少量被检验的溶液,加入苯酚,溶液变紫色,证明有Fe3+存 在。
2++H O +2H+===2Fe3++2H O 2Fe ③__________________________________________________________ ; 2 2 2
3++Fe===3Fe2+ 2Fe ④__________________________________________________________; 3+===Cu2++2Fe2+ Cu + 2Fe ⑤__________________________________________________________。
• (3)除去Mg2+中混有的Fe2+的方法: • 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除 去溶液中的Fe3+。 • (4)除去Cu2+中混有的Fe2+的方法: • 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除 去溶液中的Fe3+。 • Fe3+具有较强的水解能力,pH>3.7时,Fe3+几乎完全水解生成Fe(OH)3沉 淀,在去除Fe3+杂质时,一般可以调节pH值使Fe3+转化成Fe(OH)3沉淀除 去。
“铁三角”的转化及应用 导学案 教师版 含答案
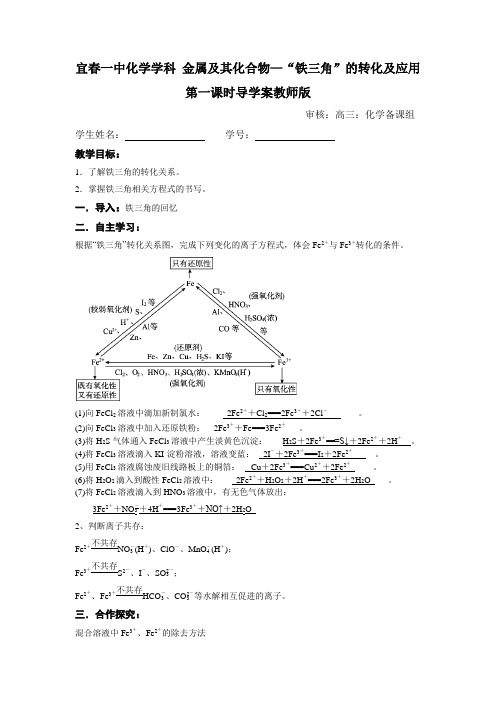
宜春一中化学学科金属及其化合物—“铁三角”的转化及应用第一课时导学案教师版审核:高三:化学备课组学生姓名:学号:教学目标:1.了解铁三角的转化关系。
2.掌握铁三角相关方程式的书写。
一.导入:铁三角的回忆二.自主学习:根据“铁三角”转化关系图,完成下列变化的离子方程式,体会Fe2+与Fe3+转化的条件。
(1)向FeCl2溶液中滴加新制氯水:_____2Fe2++Cl2===2Fe3++2Cl-_______。
(2)向FeCl3溶液中加入还原铁粉:__2Fe3++Fe===3Fe2+___。
(3)将H2S气体通入FeCl3溶液中产生淡黄色沉淀:___ H2S+2Fe3+===S↓+2Fe2++2H+__。
(4)将FeCl3溶液滴入KI-淀粉溶液,溶液变蓝:__2I-+2Fe+===I2+2Fe+_____。
(5)用FeCl3溶液腐蚀废旧线路板上的铜箔:__ Cu+2Fe===Cu+2Fe_____。
(6)将H2O2滴入到酸性FeCl2溶液中:____2Fe2++H2O2+2H+===2Fe3++2H2O____。
(7)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出:____3Fe2++NO-3+4H+===3Fe3++NO↑+2H2O_____2、判断离子共存:Fe2+不共存NO-3(H+)、ClO-、MnO-4(H+);Fe3+不共存S2-、I-、SO2-3;Fe2+、Fe3+不共存HCO-3、CO2-3等水解相互促进的离子。
三.合作探究:混合溶液中Fe3+、Fe2+的除去方法(1)除去Mg 2+中混有的Fe 3+的方法 向混合溶液中加入Mg 、MgO 、MgCO 3、Mg(OH)2中之一,与Fe 3+水解产生的H +反应,促进Fe 3+的水解,将Fe 3+转化为Fe(OH)3沉淀而除去。
(2)除去Cu 2+中混有的Fe 3+的方法 向混合溶液中加入CuO 、CuCO 3、Cu(OH)2、Cu 2(OH)2CO 3中之一,与Fe 3+水解产生的H +反应,促进Fe 3+的水解,将Fe 3+转化为Fe(OH)3沉淀而除去。
铁

“铁三角”一、转化关系1、Fe→Fe2+铁与氧化性比较弱的非金属(如S、I2),非氧化性酸(如盐酸、稀硫酸),不活泼金属的盐溶液(如CuSO4溶液),FeCl3溶液反应,都可实现这种转化。
例如:Fe+CuSO4===Cu+FeSO4;Fe+2FeCl3===3FeCl2;Fe+2H+===Fe2++H2↑2、Fe2+→ Fe比较活泼的金属(如Al、Zn)、CO、H2、C等能从亚铁化合物中置换出来。
例如:FeCl2+Zn===ZnCl2+Fe;FeO+H2△Fe+H2O3、Fe→Fe3+铁与强氧化剂,如Cl2、H2O2、KMnO4(H+)、HNO3、浓H2SO4在一定条件下反应都会实现转化。
例如:2Fe+3Cl2点燃2FeCl34、Fe3+→Fe可通过较强还原剂,如Al、Zn、CO、H2等。
例如:Fe2O3+3CO△2Fe+3CO2;Fe2O3+2Al△2Fe+Al2O3;2FeCl3+3Zn===2Fe+3ZnCl25、Fe→Fe3O4Fe与O2,H2O(g)反应时生成Fe3O4。
如:3Fe+4H2O(g)高温Fe3O4+4H26、Fe3O4→FeFe3O4在高温条件下用还原剂(CO、H2、C、Al)还原出Fe。
7、Fe2+→Fe3+亚铁盐与强氧化剂反应,如Cl2、Br2、HNO3、浓硫酸、KMnO4(H+)、H2O2等。
例如:2FeCl2+Cl2===2FeCl3。
8、Fe3+→Fe2+铁盐溶液与比较强的还原剂反应,如Fe、Cu、碘化物、硫化物等。
例如:2Fe3++S2-===2Fe2++S;2Fe3++Cu===2Fe2++Cu2+;2Fe3++Fe===3Fe2+;2Fe3++2I-===2Fe2++I2特别提醒:做题的时候尤其要注意铁的变价二、重要应用1、除杂主要离子杂质离子除杂方法Fe2+Fe3+加过量铁粉后过滤FeCl3FeCl2加氯水或H2O2FeCl2CuCl2加过量铁粉后过滤2、判断离子共存Fe2+ 不共存→NO3-(H+)、ClO-、MnO4-(H+)Fe3+ 不共存→S2-、I-、SO32-Fe2+ 、Fe3+ 不共存→CO32-、HCO3-等相互促进水解的离子(双水解)3、盐溶液的配制与保存4、Fe(OH)2的制备实验探究Fe(OH)2具有很强的还原性,极易被O2氧化,实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态的关键是怎样降低反应体系中O2的存在量和操作过程中O2的引入。
“铁三角”的转化关系

“铁三角”的转化关系
谢谢观赏!
“铁三角”的转化关系
【二、判断方法】
要确定某一溶液是否饱和,只要看在一定温度下有没 有不能继续溶解的剩余溶质存在,如有,且溶质的质量不 再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶 液。
“铁三角”的转化关系
“铁三角”的转化关系
“铁三角”的转化关系
(1)Fe2+→Fe,在金属活动性顺序表中排在Fe前的金属,如Zn、 Al等,可以将Fe2+还原成Fe。
“铁三角”的转化关系
“铁三角”的转化关系
【二、Fe2+和Fe3+的检验】
(1)Fe2+的检验: 方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶 液立即变红色。 方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为 灰绿色,最后变为红褐色。 (2)Fe3+的检验: 方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血 红色。 方法二:滴加NaOH溶液,出现红褐色沉淀。
Zn+FeSO4=ZnSO4+Fe 注意:K、Ca、Na等活泼金属,由于它们在水溶液中不能存在, 所以不能作为还原剂来完成Fe2+→Fe的转化。 (2)Fe3+→Fe2+需要较强的还原剂。如Fe、Zn、H2S(S2-)、KI(I-)、 Na2SO3(SO32-)等,Cu虽不是强的还原剂,但因Fe3+具有较强 的氧化性,可被Cu还原成Fe2+。 Cu+2FeCl3=CuCl2+2FeCl2 H2S+2FeCl3=2FeCl2+S↓+2HCl 2KI+2FeCl3=FeCl2+I2+2KCl知识点—— “铁三角” 的源自化关系“铁三角”的转化关系
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“铁三角”转化及应用
一、铁三角
书写下列反应的方程式,是离子反应的写离子方程式。
(1)Fe 和CuSO 4溶液
Fe +Cu 2+===Cu +Fe 2+
; (2)Zn 和FeSO 4溶液反应
Zn +Fe 2+===Fe +Zn 2+;
(3)CO 和Fe 2O 3高温下反应
3CO +Fe 2O 3=====高温2Fe +3CO 2;
(4)Al 和Fe 2O 3高温下反应
2Al +Fe 2O 3=====高温Al 2O 3+2Fe ;
(5)FeCl 2溶液和Cl 2反应
2Fe 2++Cl 2===2Fe 3++2Cl -;
(6)FeCl 2溶液和H 2O 2反应
2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O ;
(7)FeCl 2溶液和O 2反应
4Fe 2++O 2+4H +===4Fe 3++2H 2O ;
(8)FeCl3溶液和Cu反应
2Fe3++Cu===2Fe2++Cu2+;
(9)FeCl3溶液和H2S反应
2Fe3++H2S===S↓+2Fe2++2H+;
(10)FeCl3溶液和KI反应
2Fe3++2I-===2Fe2++I2;
(11)FeCl2和稀HNO3反应
3Fe2++4H++NO-3===3Fe3++NO↑+2H2O。
1.怎样保存含Fe2+、Fe3+的溶液?
提示:(1)含Fe2+的溶液:加入少量铁粉(或铁钉、铁屑),防止Fe2+被氧化;加入少量相应的酸,防止Fe2+水解[Fe(NO3)2例外]。
(2)含Fe3+的溶液:加入少量相应的酸,防止Fe3+水解。
2.怎样用FeCl3溶液制备无水FeCl3?
提示:在HCl气流中加热浓缩FeCl3溶液。
3.如何除去酸性MgCl2溶液中的Fe2+?
提示:先加H2O2把Fe2+氧化为Fe3+,然后加入MgO[或Mg(OH)2或MgCO3]调节溶液的pH,使Fe3+完全水解生成Fe(OH)3沉淀,然后过滤除去。
4.向FeSO4溶液中加入Na2O2固体,有什么现象?试写出反应的离子方程式。
提示:有气泡产生,有红褐色沉淀生成。
4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+8Na++O2↑。
5.如何除去括号中的杂质
(1)Fe2+(Fe3+):;
(2)FeCl3(FeCl2):;
(3)FeCl2(CuCl2):;
(4)Fe(Al):;
(5)Fe2O3(Al2O3、SiO2):。
提示:(1)加过量铁粉,过滤 (2)加氯水或H 2O 2 (3)加过量铁粉,过滤 (4)加过量强碱溶液,过滤 (5)加过量强碱溶液,过滤
二、Fe 2+、Fe 3+的检验
1.Fe 2+的检验
方法一:取出少量被检验的溶液,滴加KSCN 溶液,无现象,再滴加氯水,若变成红色溶液,说明有Fe 2+存在(鉴别时不能先滴加氯水)。
2Fe 2++Cl 2===2Fe 3++2Cl -,
Fe 3++3SCN -Fe(SCN)3(红色)。
方法二:取出少量被检验的溶液,加入NaOH 溶液,产生白色絮状沉淀,白色絮状沉淀迅速变成灰绿色,最终变为红褐色,证明有Fe 2+存在。
Fe 2++2OH -===Fe(OH)2↓,
4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
2.Fe 3+的检验
方法一:取出少量被检验的溶液,滴加KSCN 溶液,溶液变红色,证明有Fe 3+存在。
方法二:取出少量被检验的溶液,加入NaOH 溶液,产生红褐色沉淀,证明有Fe 3+存在。
3.含Fe 2+、Fe 3+的混合溶液中Fe 3+、Fe 2+的检验
(1)Fe 3+的检验: 混合溶液――→滴加KSCN 溶液溶液变红色,说明含有Fe 3+ 混合溶液试纸变蓝色,说明含有Fe 3+
(2)Fe 2+的检验:
混合溶液――→滴加酸性KMnO 4KMnO 4溶液紫红色褪去,说明含有Fe 2+
混合溶液――→滴加溴水溴水褪色,说明含有Fe 2+
4.离子检验的答题模板
取少许滤(溶)液,滴入少量×××溶液(试剂),若×××(现象),说明含有×××。
说明:解答此类题目要注意4个得分点:取样→选择试剂→描述现象→得出结论。
(1)取样:要取“少许”试样。
(2)选择试剂:选择合理的试剂,确保有明显的现象发生。
(3)描述现象:规范准确描述实验现象。
(4)得出结论:根据现象得出结论。
三、Fe 2+、Fe 3+相互转化中的两个重要关系
1.Fe 2+与强氧化剂(O 2、Cl 2、Br 2、H 2O 2、Na 2O 2、KMnO 4、浓硫酸、HNO 3、NO 2、K 2Cr 2O 7等)反应时,被氧化为Fe 3+。
如
2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O 、6Fe 2++Cr 2O 2-7+14H +===2Cr
3++6Fe 3++7H 2O 。
2.Fe 3+与Fe 、Cu 、S 2-(H 2S)、I -(HI)等还原剂反应时生成Fe 2+。
如2Fe 3++H 2S===2Fe 2++S ↓+2H +、2Fe 3++Fe===3Fe 2+、2Fe 3++Cu===2Fe 2++Cu 2+(三价铁盐腐蚀印刷电路板)。
注意:氧化性:Ag +>Fe 3+>Cu 2+>Fe 2+,还原性:S 2->I ->Fe 2+>Br ->Cl -。
四、Fe 2+、Fe 3+性质的常见考查形式总结
1.+2价为铁元素的中间价态,Fe 2+既有氧化性,又有还原性,但以还原性为主,常见的考查形式:
(1)酸性条件下,MnO -4、ClO -、NO -3等氧化性离子与Fe
2+不能大量共存。
(2)Fe(OH)2的制备。
(3)亚铁盐在空气中易变质及其溶液的保存(加入铁粉)。
2.(1)通常情况下,+3价为铁元素的最高价态,Fe3+具有较强的氧化性,常见的考查形式:①I-、S2-、SO2-3等还原性离子与Fe3+不能大量共存;②Fe3+与Fe、Cu、H2S等发生反应。
(2)Fe3+等易水解,常涉及以下几种考查形式:
①Fe3+与HCO-3、AlO-2等易水解离子的共存问题;②FeCl3、Fe2(SO4)3溶液蒸干产物的判定;③MgCl2溶液中Fe2+、Fe3+的除杂[H2O2或Cl2氧化,MgO、Mg(OH)2调pH,使Fe3+水解生成Fe(OH)3沉淀]。
练习
(2015·高考海南卷)工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。
现用如图所示的装置模拟上述过程进行实验。
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为,装置B中加入的试剂是。
(2)制取无水氯化亚铁的实验中,装置A用来制取。
尾气的成分是。
若仍用D装置进行尾气处理,存在的问题是、。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是。
欲制得纯净的FeCl2,在实验操作中应先,再。
解析:(1)制取无水氯化铁的实验中,A装置为氯气的制备装置,发生的反
应为二氧化锰和浓盐酸共热生成二氯化锰、氯气和水,反应的化学方程式为MnO 2+4HCl(浓)=====△
MnCl 2+Cl 2↑+2H 2O ,装置B 的作用是除去氯气中的水蒸气,B 中加入的试剂是浓硫酸。
(2)根据题给信息知制取无水氯化亚铁的实验中,装置A 用来制取HCl ;尾气的成分是HCl 和H 2;若仍用D 装置进行尾气处理,氯化氢气体极易溶于水,氢气不反应,则存在的问题是发生倒吸、可燃性气体H 2不能被吸收。
(3)检验FeCl 3常用的试剂是KSCN 溶液;欲制得纯净的FeCl 2,应防止装置中氧气的干扰,在实验操作中应先点燃A 处的酒精灯,利用产生的氯化氢气体排出装置中的空气,再点燃C 处的酒精灯。
答案:(1)MnO 2+4HCl(浓)=====△
MnCl 2+Cl 2↑+2H 2O 浓硫酸
(2)HCl HCl 和H 2 发生倒吸 可燃性气体H 2不能被吸收
(3)KSCN 溶液 点燃A 处的酒精灯 点燃C 处的酒精灯。
