“铁三角”的转化关系及综合应用
铁三角转化图及化学方程式

铁三角转化图及化学方程式铁三角转化图是一种反映物质间相互转化关系的图形模型,由三个物质相互转化所组成,它们之间形成一个三角形的结构。
铁三角的诞生有很大的意义,它将化学反应能够用一组化学方程式表示出来,可以经过图表的形式,更直观的体现物质之间的关系。
以水漂白剂的制备为例,水漂白剂的制备可以用铁三角转化图来表示:氢氧化钠(NaOH)、次氯酸钠(NaClO)、氯气(Cl_2)这三种原料,可以通过化学合成反应形成水漂白剂(NaClO_2),并能形成一个铁三角结构。
化学转化方程如下:NaOH + NaClO = NaClO_2 + H_2ONaClO + Cl_2 = NaClO_2铁三角模型要求,物质转换关系互为可逆向变化,也就是说即便是一种物质被消耗掉,也有可能会通过与其他物质反应产生。
举个例子,氯气(Cl_2)在水漂白剂的制备中是“消耗”的,但它其实也可以通过下列反应与NaClO发生作用形成:2NaOH + Cl_2 = NaClO + NaCl + H_2O从铁三角结构可以发现,它通过三种物质之间相互转换,实现化学反应的化学变化过程。
化学变化过程是由它们之间相互联系而产生的,它们之间联系的细节描述就是化学反应的过程以及它们所发生的物理或化学变化的内容。
在实际中,铁三角所反映的学习过程是指从一种物质变化到另一种物质的过程,这种过程中所发生的不同变化的执行情况,从而实现人们的物质转换需求。
铁三角图结构可以清楚的反映物质间相互转化的情况,为学习提供了更直接明了的方式,同时它也能帮助我们更加容易的了解到化学反应过程中物质的变化情况,明确有关反应变化的化学方程式,使得更好的了解到反应所发生的实质。
因此,能够看出铁三角转化图对于临床医学中的护理人员,其实也有很大的帮助。
铁三角转化及应用

铁三角转化及应用铁三角是一个经济学上的概念,指代三个旨在维护自身利益的角色:政府、企业和工会。
为了实现某些目标,这三方面通常会密切合作。
然而,这种紧密的合作常常会导致利益共享的问题,以及对消费者和其他利益相关者的剥夺。
在这个概念中,政府通常会通过制定政策来监管企业和工会的活动。
企业则会利用政府的支持,为自己谋取更多的利益并保护自己免于竞争。
工会则通过与政府和企业合作,获取更好的工资和福利,并确保劳动者得到公正的待遇。
铁三角可以定义为一个由政府、企业和工会组成的利益集团,他们会通过合作来影响政策制定过程,并谋求自己的利益。
虽然这种合作对于某些方面有利,但对于社会福利和公正有害。
铁三角的存在导致了很多问题。
它们通常不关注消费者的利益,而是旨在实现自己的目标。
政府和企业的合作可以导致政府政策的不公正,而工会则可能会在劳资谈判中获得更高的工资和福利,这最终会导致生产成本的上升。
铁三角的存在也就意味着利益的过度保护,这样可能会导致消费者的需要和利益被忽视。
铁三角还认为政府应该为他们服务,这意味着政府资源的过度使用,并削弱了公共服务和社会基础设施。
然而,铁三角也可以有一些优点。
政府可以通过与企业和工会合作来更好地监管企业的活动,确保企业的行为符合法律规定。
工会也能够确保劳动者得到合理的待遇和福利。
企业则可以更好地了解政策制定过程,以便更好地谋求自己的利益。
铁三角的最大问题在于,他们通常会通过利用彼此之间的势力来谋求自己的利益,以及在政策制定过程中剥夺其他利益相关者的权益。
为了解决这一问题,我们需要寻找其他形式的合作,以更好地实现公共利益和社会公正。
我们可以使用其他的办法来代替铁三角。
例如,政策制定者应该以全社会的利益为先,而非铁三角内部的利益。
政府应该与企业和工会的民间组织进行对话,以更好地理解公民的需要和合法要求。
在劳资谈判中,应着眼于结果的良好表现,而不是颠覆现有的社会协议。
企业也需要公正的机制,来确保消费者得到高质量的产品和服务。
2019版高考化学大一轮复习第10讲铁及其重要化合物考点2“铁三角”的转化关系及综合应用考题集萃实战演练

第三章第10讲考点二1.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可使用的试剂是( B)A.NaOH B.KMnO4C.KSCN解析检验含有Fe3+的溶液中是否含有Fe2+时需利用Fe2+的特有性质,同时要考虑Fe3+对Fe2+的干扰。
A项,加入NaOH溶液会生成红褐色氢氧化铁沉淀,对是否有白色沉淀产生的观察有干扰,错误;B项,Fe2+具有还原性,若溶液中含有Fe2+,加入少量高锰酸钾溶液后,溶液褪色,正确;C项,KSCN是利用溶液变血红色来检验Fe3+的试剂,错误;D项,苯酚是利用溶液变紫色来检验Fe3+的试剂,错误。
2.下列有关Fe2(SO4)3溶液的叙述正确的是( D)A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I24+Ba2++3OH-===Fe(OH)3↓+BaSO4↓C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO2-D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe3.(2016·全国卷甲)某班同学用如下实验探究Fe2+、Fe3+的性质。
回答下列问题:(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。
在FeCl2溶液中需加入少量铁屑,其目的是__防止Fe2+被氧化__。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。
FeCl2溶液与氯水反应的离子方程式为__2Fe2++Cl2===2Fe3++2Cl-__。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__隔绝空气(排除氧气对实验的影响)__。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1mol·L-1 FeCl3溶液混合。
“铁三角”的转化关系

“铁三角”的转化关系
谢谢观赏!
“铁三角”的转化关系
【二、判断方法】
要确定某一溶液是否饱和,只要看在一定温度下有没 有不能继续溶解的剩余溶质存在,如有,且溶质的质量不 再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶 液。
“铁三角”的转化关系
“铁三角”的转化关系
“铁三角”的转化关系
(1)Fe2+→Fe,在金属活动性顺序表中排在Fe前的金属,如Zn、 Al等,可以将Fe2+还原成Fe。
“铁三角”的转化关系
“铁三角”的转化关系
【二、Fe2+和Fe3+的检验】
(1)Fe2+的检验: 方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶 液立即变红色。 方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为 灰绿色,最后变为红褐色。 (2)Fe3+的检验: 方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血 红色。 方法二:滴加NaOH溶液,出现红褐色沉淀。
Zn+FeSO4=ZnSO4+Fe 注意:K、Ca、Na等活泼金属,由于它们在水溶液中不能存在, 所以不能作为还原剂来完成Fe2+→Fe的转化。 (2)Fe3+→Fe2+需要较强的还原剂。如Fe、Zn、H2S(S2-)、KI(I-)、 Na2SO3(SO32-)等,Cu虽不是强的还原剂,但因Fe3+具有较强 的氧化性,可被Cu还原成Fe2+。 Cu+2FeCl3=CuCl2+2FeCl2 H2S+2FeCl3=2FeCl2+S↓+2HCl 2KI+2FeCl3=FeCl2+I2+2KCl知识点—— “铁三角” 的源自化关系“铁三角”的转化关系
“铁三角”转化及应用
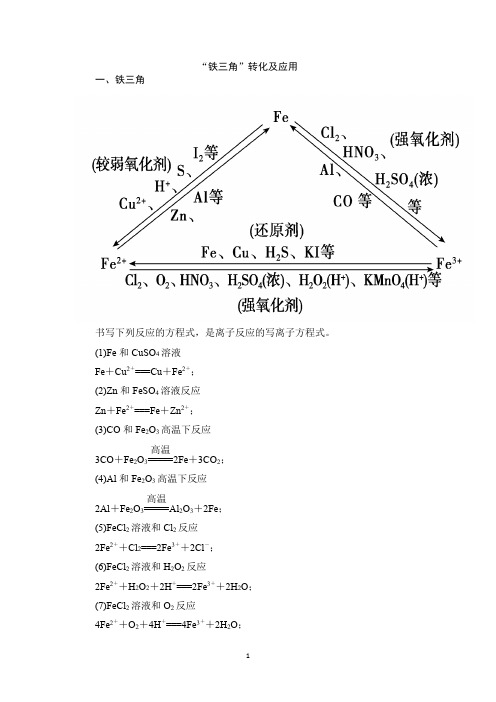
“铁三角”转化及应用一、铁三角书写下列反应的方程式,是离子反应的写离子方程式。
(1)Fe 和CuSO 4溶液Fe +Cu 2+===Cu +Fe 2+; (2)Zn 和FeSO 4溶液反应Zn +Fe 2+===Fe +Zn 2+;(3)CO 和Fe 2O 3高温下反应3CO +Fe 2O 3=====高温2Fe +3CO 2;(4)Al 和Fe 2O 3高温下反应2Al +Fe 2O 3=====高温Al 2O 3+2Fe ;(5)FeCl 2溶液和Cl 2反应2Fe 2++Cl 2===2Fe 3++2Cl -;(6)FeCl 2溶液和H 2O 2反应2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O ;(7)FeCl 2溶液和O 2反应4Fe 2++O 2+4H +===4Fe 3++2H 2O ;(8)FeCl3溶液和Cu反应2Fe3++Cu===2Fe2++Cu2+;(9)FeCl3溶液和H2S反应2Fe3++H2S===S↓+2Fe2++2H+;(10)FeCl3溶液和KI反应2Fe3++2I-===2Fe2++I2;(11)FeCl2和稀HNO3反应3Fe2++4H++NO-3===3Fe3++NO↑+2H2O。
1.怎样保存含Fe2+、Fe3+的溶液?提示:(1)含Fe2+的溶液:加入少量铁粉(或铁钉、铁屑),防止Fe2+被氧化;加入少量相应的酸,防止Fe2+水解[Fe(NO3)2例外]。
(2)含Fe3+的溶液:加入少量相应的酸,防止Fe3+水解。
2.怎样用FeCl3溶液制备无水FeCl3?提示:在HCl气流中加热浓缩FeCl3溶液。
3.如何除去酸性MgCl2溶液中的Fe2+?提示:先加H2O2把Fe2+氧化为Fe3+,然后加入MgO[或Mg(OH)2或MgCO3]调节溶液的pH,使Fe3+完全水解生成Fe(OH)3沉淀,然后过滤除去。
4.向FeSO4溶液中加入Na2O2固体,有什么现象?试写出反应的离子方程式。
专题:铁三角的转化及应用

专题(4)铁三角的转化核心知识点一:一、“铁三角”1. Fe、Fe2+和Fe3+之间相互转化从Fe、Fe2+和Fe3+的结构可知:Fe只有还原性,Fe3+通常只有氧化性,Fe2+既具有氧化性又具有还原性。
上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化,如下图(常称为铁三角):(1)Fe→Fe2+或Fe3+①与弱氧化剂反应生成Fe2+与S、Fe3+、Cu2+、H+等弱氧化剂反应生成+2价的铁,例如:Fe+2Fe3+=3 Fe2+Fe+ Cu2+= Cu+ Fe2+Fe+2 H+= Fe2++ H2↑②与强氧化剂反应生成Fe3+与Cl2、Br2、HNO3(浓、稀)等强氧化剂反应生成+3价的铁,例如:2Fe+3Cl22FeCl3Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O(2)Fe2+→Fe3+或Fe①与氧化剂反应生成Fe3+与Cl2、HNO3(浓、稀)等强氧化剂反应生成+3价的铁,例如:2Fe2++Cl2=2Fe3++2Cl-②与还原剂反应生成Fe与C、Al、Zn、CO、S2-等还原剂反应生成铁单质,例如:Fe2++ Zn= Zn2+ + Fe(3)Fe3+→Fe或Fe2+①与还原剂反应生成Fe与C、Al、CO等还原剂反应生成铁单质,例如:Fe2O3+3CO2Fe+3CO2②与还原剂反应生成Fe2+与Fe、Cu、I-、S2-等还原剂反应生成Fe2+,例如:2Fe3++ Cu= 2Fe2+ + Cu2+注意:Fe3+、Fe2+、Fe的相互转化,可以应用于试剂的保存、配制和除杂,如配制硫酸亚铁溶液时加入少量的铁粉以防止Fe2+被氧化。
2. “铁三角”的应用:(1)判断离子共存:Fe2+与(H+)、ClO−、(H+),Fe3+与S2−、I−、HS−、在溶液中因发生氧化还原反应而不能大量共存。
(2)除杂方法(括号内为杂质):Fe2+(Fe3+):加过量铁粉,过滤;FeCl3(FeCl2):加氯水或H2O2;FeCl2(CuCl2):加过量铁粉,过滤;Fe(Al)、Fe2O3(Al2O3、SiO2):加过量强碱溶液,过滤;(3)盐溶液的保存:亚铁盐溶液——加入少量铁屑以防止Fe2+被氧化。
铁及其化合物转化关系的应用(解析版)

第三章铁金属材料第一节铁及其化合物3.1.4铁及其化合物转化关系的应用板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养1.掌握铁及其化合物的转化关系及应用。
2.理解化工流程及实验室中实现铁及其化合物的转化原理和条件分析。
重点:铁及其化合物相互转化。
难点:铁及其化合物相互转化的实质。
一、铁及其化合物之间的转化——“铁三角”从Fe 、Fe 2+和Fe 3+的结构可知:Fe 只有还原性,Fe 3+通常只有氧化性,Fe 2+既具有氧化性又具有还原性。
上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态铁的相互转化,我们把这个相互转化设计成三角形,常称为铁三角。
1.Fe 3+的形成由于Fe 3+的氧化性较强,要想生成Fe 3+,需要强氧化剂,通常有:Cl 2、Br 2、HNO 3、浓H 2SO 4、KMnO 4(H +)。
与Cl 2反应:2Fe 2++Cl 2===2Fe 3++2Cl −、2Fe+3Cl 22FeCl 3;与KMnO 4反应:5Fe 2++MnO 4-+8H +===5Fe 3++Mn 2++4H 2O 。
2.0Fe 的形成单质Fe 的还原性较强,要想生成单质Fe ,得需强还原剂,通常有:Al 、Zn 、CO 、H 2。
Fe 2++Zn===Fe+Zn 2+;FeO+Al(CO 、H 2)−−−→高温Fe+Al 2O 3(CO 2、H 2O);Fe 2O 3+Al(CO 、H 2)−−−→高温Fe+Al 2O 3(CO 2、H 2O)。
3.Fe 2+的形成Fe 2+的氧化性、还原性都不强,所以,从Fe→Fe 2+,弱氧化剂即可,通常有:S 、H +、Cu 2+、Fe 3+;从Fe 3+→Fe 2+,能被Fe 3+氧化的还原剂有:Fe 、Cu 、I −、S 2−、HS −、SO 2、SO 32-。
铁三角 化学转换

铁三角化学转换铁三角在化学中是指铁、氧和碳这三种元素之间的相互转化关系。
铁是一种常见的金属元素,具有良好的导电、导热和机械性能,广泛应用于工业和建筑领域。
氧是地球上最常见的元素之一,化学符号为O,是生命活动必不可少的气体。
碳是一种非金属元素,广泛存在于自然界中,其化学符号为C。
铁的化学转换与氧和碳密切相关。
铁与氧发生化学反应生成氧化铁,这是一种常见的反应。
氧化铁有多种不同的形式,例如FeO、Fe2O3等。
其中,Fe2O3是一种重要的氧化铁,也是红色矿石的主要成分。
氧化铁具有良好的抗腐蚀性能,被广泛应用于涂料、颜料、陶瓷等领域。
另一方面,铁与碳也有密切的关系。
碳可以与铁形成多种不同的化合物,其中最重要的是碳化铁。
碳化铁是一种硬而脆的物质,具有良好的耐磨性和高温稳定性,被广泛用作刀具和机械零件的材料。
此外,碳还可以与铁形成一种重要的合金——钢。
钢是一种具有高强度、高韧性和良好可塑性的合金材料,被广泛应用于建筑、汽车、航空航天等领域。
除了与氧和碳的化学反应外,铁还可以发生其他化学转化。
例如,铁可以与硫反应生成硫化铁,这是一种黑色的物质,广泛存在于自然界中。
硫化铁在矿石中具有重要的地质意义,也被用于制备某些化学品。
在生物体内,铁也发挥着重要的作用。
人体中的血红蛋白和肌红蛋白含有铁离子,能够与氧结合运输氧气到身体各个组织。
铁还参与体内某些酶的催化作用,对维持生命活动至关重要。
铁、氧和碳之间的化学转换是化学领域中一个重要的研究方向。
通过研究铁的化学性质和其与氧、碳等元素的相互作用,可以深入了解铁的性质和应用,为工业生产和科学研究提供有价值的参考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Fe2+
Fe Fe2O3
Cu2+
Al
Al2O3、SiO2
• (3)盐溶液的配制与保存
(4)物质的制备
• 含铁物质之间的转化关系图
• 1.判断正误,正确的划“√”,错误的划“×”。
• (1)检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再 滴加KSCN溶液,观察实验现象。( × )
+ -
4Fe(OH)2+O2+2H2O===4Fe(OH)3。 方法三:取出少量被检验的溶液,加入 K3[Fe(CN)6] 溶液,产生蓝色沉淀,证明 有 Fe2+存在。 3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓。
• 2.Fe3+的检验 • 方法一:取出少量被检验的溶液,滴加KSCN溶液,溶液变红色,证明有 Fe3+存在。 • 方法二:取出少量被检验的溶液,加入NaOH溶液,产生红褐色沉淀,证明 有Fe3+存在。 • 方法三:取出少量被检验的溶液,加入苯酚,溶液变紫色,证明有Fe3+存 在。
2++H O +2H+===2Fe3++2H O 2Fe ③__________________________________________________________ ; 2 2 2
3++Fe===3Fe2+ 2Fe ④__________________________________________________________; 3+===Cu2++2Fe2+ Cu + 2Fe ⑤__________________________________________________________。
• (3)除去Mg2+中混有的Fe2+的方法: • 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除 去溶液中的Fe3+。 • (4)除去Cu2+中混有的Fe2+的方法: • 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除 去溶液中的Fe3+。 • Fe3+具有较强的水解能力,pH>3.7时,Fe3+几乎完全水解生成Fe(OH)3沉 淀,在去除Fe3+杂质时,一般可以调节pH值使Fe3+转化成Fe(OH)3沉淀除 去。
+
2Fe2++Cl2===2Fe3++2Cl- ①__________________________________________________________ ;
+ - 2+ 3+ 3Fe + 4H + NO ===3Fe +2H2O+NO↑ 3 ②__________________________________________________________ ;
Fe2+、Fe3+的检验方法
1.Fe2+的检验 方法一:取出少量被检验的溶液,滴加 KSCN 溶液,无现象,再滴加氯水,若 变成红色溶液,说明有 Fe2+存在(鉴别时不能先滴加氯水)。 2Fe2++Cl2===2Fe3++2Cl-, Fe3++3SCN- Fe(SCN)3(红色)。
方法二:取出少量被检验的溶液,加入 NaOH 溶液,产生白色絮状沉淀,白色 絮状沉淀迅速变成灰绿色,最终变为红褐色,证明有 Fe2+存在。 Fe2 +2OH ===Fe(OH)2↓,
第 三 章 金属及其化合物
第10讲 铁及其重要化合物
栏目导航
板 块 一
板
块
二
板
块
三
板
块
四
考点二
“铁三角”的转化关系及综合应用
• 1.“铁三角”的转化关系
用离子方程式实现 Fe2 与 Fe3 的相互转化
+ +
FeΒιβλιοθήκη 2+ ①Cl2、②NO3 H 、③H2O2H
- + +
④Fe、⑤Cu
Fe3
• (2)检验Fe(NO3)2晶体是否氧化变质的方法是将Fe(NO3)2样品溶于稀H2SO4后,滴加 KSCN溶液,观察溶液是否变红。( ) × • (3)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中 一定含有Fe2+。( √ )
• 2.下列除杂的操作不正确的是(
) C
• A.MgCl2溶液中混有少量FeCl3:加入足量镁充分反应后过滤 • B.FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤
2.“铁三角”的重要应用 (1)判断离子共存
+ - - + Fe ――→NO- (H ) 、 ClO 、 MnO (H ); 3 4 - Fe3+――→S2-、I-、SO2 3 ;
2+ 不共存
不共存
Fe 、Fe ――→HCO3 、CO2 3 等水解相互促进的离子。
- -
2+
3+ 不共存
• (2)除杂 主要物质 Fe2+ FeCl3 杂质 Fe3+ FeCl2 除杂方法 加过量铁粉后过滤 ____________________________________ 加氯水或H2O2 ____________________________________ 加过量铁粉后过滤 ____________________________________ 加过量强碱(如NaOH)溶液后过滤 ____________________________________ 加过量强碱(如NaOH)溶液后过滤 ____________________________________
• C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤
• D.CuCl2溶液中混有少量FeCl2:先加入H2O2将Fe2+氧化成Fe3+,再加入CuO充分 反应后过滤 • 解析 除去CuCl2溶液中少量的FeCl3应加入CuO或CuCO3等,C项错误。
• 混合溶液中Fe3+、Fe2+的除去方法 • (1)除去Mg2+中混有的Fe3+的方法: • 向混合溶液中加入Mg、MgO、MgCO3、Mg(OH)2中之一,与Fe3+水解产生的H+ 反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。 • (2)除去Cu2+中混有的Fe3+的方法: • 向混合溶液中加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3中之一,与Fe3+水解产 生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
