肿瘤内科在研临床试验一览表(截止201509)
肺癌内科治疗临床研究十年回顾和现状

肺癌内科治疗临床研究十年回顾和现状
陈薪如;周彩存
【期刊名称】《实用肿瘤杂志》
【年(卷),期】2024(39)3
【摘要】肺癌作为全球死亡率最高的恶性肿瘤,严重威胁人类健康。
近10年来,随着精准医学时代的到来,肺癌治疗格局已发生翻天覆地的变化。
多项围术期免疫或靶向治疗相关的临床研究的公布让更多早期非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者有望实现肿瘤“治愈”。
此外,免疫治疗及靶向治疗也让更多晚期NSCLC患者有望实现“慢病化”。
多种新型药物的研发,如抗体-药物偶联物(antibody-drug conjugate,ADC)、免疫双抗及肿瘤疫苗等百花齐放,进一步提高了抗肿瘤治疗疗效。
本文将对近10年肺癌内科治疗领域的重要研究进行回顾,并根据目前治疗现状探讨未来发展方向。
【总页数】10页(P209-218)
【作者】陈薪如;周彩存
【作者单位】同济大学附属上海市肺科医院肿瘤科;同济大学附属东方医院肿瘤科【正文语种】中文
【中图分类】R73
【相关文献】
1.关于非小细胞肺癌内科治疗的几个问题——再谈"中国肺癌临床指引"
2.近十年有关肺癌治疗Meta分析的回顾
3.回顾2009年:肺癌内科治疗进展
4.小细胞肺癌内
科治疗的回顾与展望5.临床药师参与心血管内科临床治疗实践的回顾性研究及思路探讨
因版权原因,仅展示原文概要,查看原文内容请购买。
中文版NCCN指南(2015_v 2版)

T4:不论肿瘤大小,直接侵犯胸壁和/或皮肤(溃疡或 皮肤结节) N2:同侧腋窝淋巴结转移,临床表现为固定或相互融 合;或缺乏同侧腋窝淋巴结转移的临床证据,但临床 上发现有同侧内乳淋巴结转移 pN2:4~9个腋窝淋巴结转移;或临床上发现内乳淋巴 结转移,但腋窝淋巴结无转移,转移病灶>2.0 mm pN2b:临床上发现内乳淋巴结转移,但腋窝淋巴结无 转移 任何T N3:同侧锁骨下淋巴结转移伴或不伴腋窝淋巴结转移; 或临床上发现同侧内乳淋巴结转移伴腋窝淋巴结转移; 或同侧锁骨上淋巴结转移伴或不伴腋窝或内乳淋巴结 转移 N3a:同侧锁骨下淋巴结转移 N3b:同侧内乳淋巴结及腋窝淋巴结转移 N3c:同侧锁骨上淋巴结转移 pN3:≥10个腋窝淋巴结转移
原发肿瘤≤0.5 cm或 原发肿瘤微浸润 pT1, pT2,或 pT3; pN0或pN1mi(腋窝 淋巴结转移灶≤2 mm)
pN0 PN1mi
组织学类型: 导管癌 小叶癌 混合型癌 化生性癌
BINV-5
仅供内部学习使用
浸润性乳腺癌
激素受体阳性、HER-2阴性的乳腺癌患者的全身辅助治疗
原发肿瘤≤0.5 cm 或原发肿瘤微浸润 pT1, pT2,或 pT3; pN0 或 pN1mi(腋窝 淋巴结转移灶≤2 mm) 组织学类 型: 导管癌 小叶癌 混合型癌 化生性癌 pN0 PN1mi 考虑辅助内分泌治疗(2B类) 辅助内分泌治疗(2B类) ±辅助化疗(2B类)
• • •
专家普遍认为,大于10 mm的切缘属阴性(但此切缘宽度也许过大,而且可能影响美观) 小于1 mm的切缘被认为不足够 对于范围在1~10 mm之间的切缘,一般切缘越宽,局部复发率越低。但是对于位于乳腺纤维-腺分界部 位(如靠近胸壁或皮肤)的肿瘤,手术边缘不足1mm并不一定要进行再次手术,但可以对肿块切除部 DCIS-1 位进行较大剂量推量照射(2B类)。 仅供内部学习使用
肿瘤学最新进展
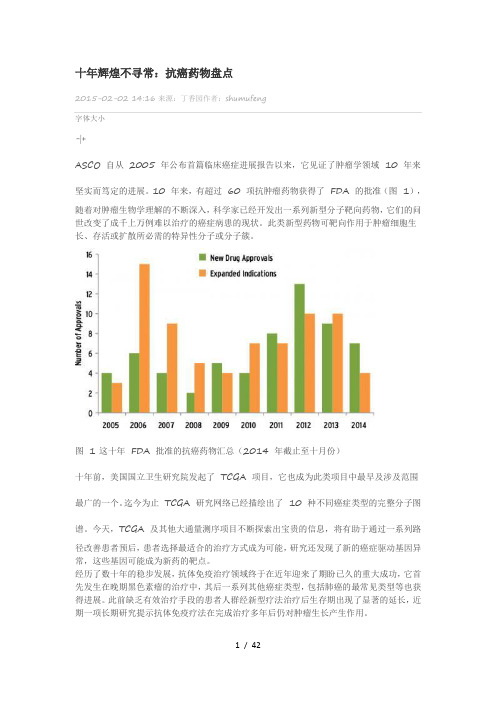
十年辉煌不寻常:抗癌药物盘点2015-02-02 14:16来源:丁香园作者:shumufeng字体大小-|+ASCO 自从2005 年公布首篇临床癌症进展报告以来,它见证了肿瘤学领域10 年来坚实而笃定的进展。
10 年来,有超过60 项抗肿瘤药物获得了FDA 的批准(图1),随着对肿瘤生物学理解的不断深入,科学家已经开发出一系列新型分子靶向药物,它们的问世改变了成千上万例难以治疗的癌症病患的现状。
此类新型药物可靶向作用于肿瘤细胞生长、存活或扩散所必需的特异性分子或分子簇。
图 1 这十年FDA 批准的抗癌药物汇总(2014 年截止至十月份)十年前,美国国立卫生研究院发起了TCGA 项目,它也成为此类项目中最早及涉及范围最广的一个。
迄今为止TCGA 研究网络已经描绘出了10 种不同癌症类型的完整分子图谱。
今天,TCGA 及其他大通量测序项目不断探索出宝贵的信息,将有助于通过一系列路径改善患者预后,患者选择最适合的治疗方式成为可能,研究还发现了新的癌症驱动基因异常,这些基因可能成为新药的靶点。
经历了数十年的稳步发展,抗体免疫治疗领域终于在近年迎来了期盼已久的重大成功,它首先发生在晚期黑色素瘤的治疗中,其后一系列其他癌症类型,包括肺癌的最常见类型等也获得进展。
此前缺乏有效治疗手段的患者人群经新型疗法治疗后生存期出现了显著的延长,近期一项长期研究提示抗体免疫疗法在完成治疗多年后仍对肿瘤生长产生作用。
另一种免疫疗法致力于重组自身的免疫细胞以攻击肿瘤细胞,它对于特定的血液肿瘤以及一系列实体肿瘤同样表现出色。
过去的十年间首款癌症疫苗也得以问世(宫颈癌Gardasil 疫苗)。
探索其他类型癌症疫苗的试验也正在进行中。
最后,大规模的筛查研究带来了新的重要证据,表明对于一些常见癌症如肺癌、乳腺癌以及前列腺癌可推进筛查实践。
靶向治疗迅速发展最近的十年间,我们看到由FDA 批准的新型靶向治疗药物有了稳步且迅猛的增加,远远超过新型化疗药物的研发速度(图2)。
基于CDASH标准的肿瘤临床试验病例报告表设计

◇临床药理学◇中国临床药理学与治疗学中国药理学会主办!"#$ %&'()*,+,,"%''- &.'%/0012))3334565104578&'&&9:;<&=>=?2=(& =(=&'&& '# &.收稿 &'&& '= %%修回国家自然科学基金(@%==#..$)陈建芳,女,硕士研究生,研究方向:生物统计。
A 8BC;2#%.=%'&#.D kk4578娄冬华,通信作者,男,硕士,副教授,硕导,研究方向:医学统计理论、方法与应用。
A 8BC;2;7:K7HI/:BD F7/:4578基于!QO,X 标准的肿瘤临床试验病例报告表设计陈建芳,娄冬华南京医科大学公共卫生学院,南京&%%%((,江苏摘要 目的:探讨基于临床数据获取协调标准(5;CHC5B;KB0B B5k:CFC0C7H F0BHKBSKF /BS87HCEB0C7HL!QO,X )的肿瘤临床试验病例报告表(5BFJ SJ17S0T7S8L !*[)的设计意义、方法及内容。
方法:对照!QO,X `&4&,分析肿瘤临床试验数据特点,设计符合肿瘤临床试验实际需求的标准化!*[。
结果:将!QO,X 标准应用到肿瘤临床试验!*[的设计中,规范肿瘤临床试验数据采集,以使肿瘤临床试验!*[设计相对标准化,提升数据质量。
结论:执行基于!QO,X 标准的肿瘤!*[设计,能够促进肿瘤临床研究数据交换、共享,有利于提升肿瘤临床研究结果可靠性。
关键词 临床数据获取协调标准;肿瘤临床试验;病例报告表中图分类号:*-(-文献标志码:O文章编号:%''- &.'%>&'&&?'= '=(& '(K7C :%'4%&'-&)64CFFH4%''- &.'%4&'&&4'=4''(临床试验为新药研究开发中的重要且必经环节,其通过向患者或健康志愿者给予相关药物干预,以揭示或证实药物的药理作用,确定其治疗有效性及安全性[%]。
我院2015年第四季度抗肿瘤药应用情况的调查分析

世界最新医学信息文摘 2016年 第16卷 第77期191·调研分析·我院2015年第四季度抗肿瘤药应用情况的调查分析张伟霞(国防大学 防务学院门诊部,北京 102249)摘要:目的调查我院2015年第四季度抗肿瘤药使用情况,了解临床抗肿瘤药用药特点。
方法对我院2015年第四季度抗肿瘤药使用种类、销售金额等进行统计、分析。
结果我院抗肿瘤药物中销售金额前三位的分别是抑制蛋白质合成与功能的抗肿瘤药(42.98%)、抗肿瘤辅助药(31.18%)和影响DNA结构与功能的抗肿瘤药(12.94%);销售金额前五名的品种是多西他赛(23.89%)、香菇多糖(16.19%)、斑蝥酸钠维生素B6(9.98%)、奥沙利铂(9.98%)和紫杉醇(7.95%)。
结论我院抗肿瘤药的用药现状符合当前国内该类药品消耗总趋势,使用情况基本合理。
关键词:抗肿瘤药物;销售金额;调查分析中图分类号:R73-31 文献标识码:B DOI:10.3969/j.issn.1671-3141.2016.77.1600 引言恶性肿瘤作为全球较大的公共卫生问题之一,极大地危害人类的健康,并将成为新世纪人类的第一杀手。
据WHO世界癌症研究中心全球监测数据显示:2008年全球癌症新发病例1300万,死亡760万[1];据初步预计,2020年全球恶性肿瘤新发病病人将达2000万。
死亡病例将达到1200万。
如不采取有效措施,照此趋势发展,到2030年全球将有2600万新增癌症病例,死亡例数将跃至1700万。
从世界范围来看,发展中国家面临着更大的疾病负担,我国作为一个发展中大国,恶性肿瘤面临的形势也愈发严峻。
化疗、外科手术与放射治疗是肿瘤治疗的三大重要组成部分[2]。
为了了解抗肿瘤药的使用情况,更好地发挥抗肿瘤药的临床疗效,现对我院2015年第四季度抗肿瘤药的使用情况进行分析,为临床合理用药提供参考。
1 资料与方法1.1 一般资料。
从信息系统中收集2015年第四季度抗肿瘤药的品种、剂型、规格、使用数量、销售金额等信息,所有数据均采用Excel 2003软件进行处理。
关于肿瘤药物的临床试验,看看这篇就够了!

关于肿瘤药物的临床试验,看看这篇就够了!肿瘤治疗是一场攻坚战,不应该放弃任何机会。
对于不少患者来说,参加新药临床试验是一个可能获益的方式。
国内外几乎所有的专家,对于标准治疗失败,或者没有标准治疗的患者,都会积极推荐参加临床试验。
【良医汇-肿瘤资讯】已建立临床试验推荐中心,目前已有18个肿瘤相关药物临床试验,覆盖肺癌、肝癌、乳腺癌、胃腺癌、食管鳞癌、鼻咽癌、头颈部鳞癌,黑色素瘤、骨髓瘤、前列腺癌、白血病、淋巴瘤及神经内分泌肿瘤等13个瘤种。
各位医生朋友,如果您身边有合适参与临床试验的患者,请随时推荐给我们!成功参与以下任意一项研究,跟该研究相关药物、研究相关的检查及研究访视均免费。
【3个肺癌项目临床试验】•二线系统性化疗后疾病进展或者毒性不能耐受的晚期非鳞非小细胞肺癌患者招募1. 试验简介呋喹替尼治疗晚期非鳞状细胞非小细胞肺癌患者的随机、双盲、安慰剂对照、多中心III期临床研究 (FALUCA)2. 面向患者我们非常感谢您转介经组织学或细胞学确认的,二线系统性化疗后疾病进展或者毒性不能耐受的晚期非鳞状细胞 NSCLC 患者3. 主要入选标准1. 经组织和/或细胞学确诊的局部晚期和/或转移性 IIIB/IV 期非鳞状细胞 NSCLC 患者;2. 既往二线系统性化疗后疾病进展或毒性不能耐受(不包括 TKI 治疗);注:a.一线化疗须是含铂两药方案; b.每个系统性化疗方案需完成至少一个周期的治疗;同药维持治疗认为是同一个方案; c.允许前期进行辅助/新辅助化疗。
如果辅助/新辅助化疗期间或者完成后一年内出现复发或转移,则认为辅助/新辅助化疗是针对进展期疾病的一线系统性化疗失败;3. EGFR 基因检测结果为阴性;或检测结果阳性且已经接受过相关靶向药物治疗后耐药或不能耐受的患者;4. ALK 基因检测结果为阴性;或检测结果阳性且已经接受过相关靶向药物治疗后耐药或不能耐受的患者;或组织标本不足以进行 ALK 基因检测的患者;5. 年龄在18-75岁(含18岁和75岁);6. 明确有可测量病灶(根据RECIST1.1);7. 体力状况计分(ECOG评分)0-1;注:以上为部分主要标准,最终入组标准由项目医生掌握。
肿瘤医院药物临床试验机构药物临床试验立项表
肿瘤医院药物临床试验机构药物临床试验立项表一、研究目的与背景1.1 研究目的本次药物临床试验的目的是探索一种新型抗肿瘤药物的临床疗效和安全性,为肿瘤患者提供更有效、安全的治疗选择,改善其生存质量。
1.2 研究背景肿瘤是当今世界的重大健康问题之一,其发病率和死亡率逐年增加。
目前,虽然已经有一些抗肿瘤药物用于治疗,但是仍然存在疗效不佳、耐药性强、副作用大等问题。
因此,迫切需要发现和开发新型的抗肿瘤药物,提高肿瘤患者的治疗效果。
二、研究内容和方法2.1 研究内容本次药物临床试验的研究内容为评估一种新型抗肿瘤药物在肿瘤患者中的疗效和安全性。
研究将招募一定数量的肿瘤患者,并随机分成两组,一组接受新药物治疗,另一组接受安慰剂治疗作为对照。
2.2 研究方法本次药物临床试验采用单盲、随机对照、多中心研究的设计。
具体研究方法如下:•招募标准:选择符合研究要求的肿瘤患者作为研究对象。
•随机分组:将符合入选标准的患者随机分成实验组和对照组。
•给药方案:实验组患者接受新药物治疗,对照组患者接受安慰剂治疗。
•疗效评估:观察和记录患者的治疗效果,包括肿瘤缩小程度、生存期延长等指标。
•安全性评估:观察和记录患者的药物相关副作用和不良反应情况。
三、研究计划3.1 试验周期本次药物临床试验预计的总周期为12个月,包括患者招募、治疗、随访、数据收集、数据分析等阶段。
3.2 试验流程本次药物临床试验的具体流程如下:1.患者招募:通过医院内部和外部宣传渠道招募符合入选标准的肿瘤患者。
2.入组评估:对招募的患者进行详细评估,确定其是否符合研究要求。
3.随机分组:将符合入选标准的患者随机分成实验组和对照组。
4.治疗干预:实验组患者接受新药物治疗,对照组患者接受安慰剂治疗。
5.随访观察:定期对患者进行随访,观察记录其治疗效果和安全性情况。
6.数据收集:收集患者的相关数据,包括肿瘤缩小程度、生存期延长等指标。
7.数据分析:对收集到的数据进行统计学分析,评估药物的疗效和安全性。
2015中国MM指南更新
影响MM的预后因素
肿瘤特性
• 核型异常 • 倍体 • 17p- (p53缺失) • t(14;16) • t(14;20) • t(4;14) • 传统细胞遗传学13号染色 体缺失 • 1号染色体异常 • t(11;14) • t(6;14) • LDH • 浆细胞增殖指数 • 浆细胞白血病 • GEP高危
• 联合应用ISS 和荧光原位 杂交(FISH)结 果对患者进 行分层
小结
对于血液系统发病率上升到第二位的恶性肿瘤——多发性骨
髓瘤,诊断标准、预后分期的不断更新是患者更好进行个体
化治疗的前提.
相对于传统的预后ISS评估体系,R-ISS体系更好的提高了 MM患者预后评估,风险指数更高。该系统更具有临床预测 性及治疗指导价值。
修改的ISS分期(R-ISS)
IST-CAR-506 EMN 01 RV-MM-EMN-441
ISS stage, CA by FISH (CD138+) serum LDH
4,445 patients with NDMM
11 international, multicenter clinical trials, from 2005 to 2012
检测项目
有条件的建议做CT、MRI、PET-CT
中华内科杂志. 2015; 54(12): 1066-50.
诊断标准的前移
Not CRAB but now SLiM CRAB
•S (60% 浆细胞增多) •Li (轻链 I/U >100) •M (MRI 1处或多处局灶性损害) •C (血钙升高) •R (肾功能不全) •A (贫血) •B (骨病)
肺部肿瘤的诊疗实践与答案-2024年华医网继续教育
肺部肿瘤的诊疗实践与答案2024年华医网继续教育目录一、肺癌的筛查与管理 (1)二、 2022EO肺癌靶向治疗研究新进展 (3)三、 PD-L1制剂在小细胞肺癌治疗中的应用 (5)四、免疫治疗中irAE的管理 (7)五、 2021小细胞肺癌诊疗指南解读 (9)六、非小细胞肺癌的术后治疗 (10)七、 I-IIIB期非小细胞肺癌完全切除术后辅助治疗指南解读 (12)八、免疫检查点抑制剂治疗相关副反应及处理策略 (17)九、关于亚肺叶切除的思考 (18)十、肺癌脑转移诊治专家共识解读 (20)十一、 EGFR突变阳性晚期NSCLC的一线治疗 (22)十二、 EGFR突变阳性晚期NSCLC全程管理 (24)十三、肿瘤患者营养治疗的知信行 (25)十四、以临床价值为导向的抗肿瘤药物临床合理使用管理实践 (27)十五、肺小结节的精准定位 (29)十六、肺段(亚段)切除的经验分享 (31)十七、肺癌的精准诊疗与分子诊断策略 (33)十八、 GGO诊疗的现状与挑战 (35)一、肺癌的筛查与管理1.肺癌的禁忌食物不包括()A.脂肪食物B.辛辣食物C.腌制食物D.高蛋白食物E.饮酒和咖啡参考答案:D2.()是目前肺癌诊断、分期、疗效评价及治疗后随诊中最重要和最常用的影像检查方法A.胸部X线片B.PET-CTC.MRID.胸部CTE.超声检查参考答案:D3.下述哪项不是肺癌放疗的副作用()A.放射性肺纤维化B.脱发C.支气管胸膜瘘D.骨髓抑制E.局部皮肤反应参考答案:C4.2015年中国恶性肿瘤流行病学研究显示,()位居全国恶性肿瘤发病首位A.肺癌B.胃癌C.肝癌D.食道癌E.结直肠癌参考答案:A5.肺癌的临床表现不包括()A.咳嗽B.胸痛C.咳血D.呼吸困难E.发热参考答案:B二、2022EO肺癌靶向治疗研究新进展1.奥希替尼用于EGFR突变、未接受过RT、初治CNS转移患者BMRR达()A.59.8%B.77%C.74%D.27%E.76.9%参考答案:E2.下列不属于靶向治疗的是()A.早期+局晚B.晚期一线治疗C.早期三线治疗D.晚期二线E.后线治疗参考答案:C3.特泊替尼联合奥希替尼的ORR为()A.54.5%B.27%C.59.8%D.77%E.74%参考答案:A4.下列描述错误的是()A.FLOURISH 是目前在中国EGFR敏感突变NSCLC患者中开展的规模的前瞻性真实世界研究B.奥希替尼即使是在脑转移以及合并症等疾病负担较重的患者人群中C.奥希替尼未表现出与FLAURA 临床试验类似的临床疗效与安全性D.目前研究仍在随访中,后续更?中国患者?群的数据分析值得持续关注E.奥希替尼表现出与FLAURA 临床试验类似的临床疗效与安全性参考答案:C5.希替尼暴露总持续时间的中位数为()A.35.5个月B.25.8个月C.15.8个月D.35.8个月E.45.8个月参考答案:D三、PD-L1制剂在小细胞肺癌治疗中的应用1.与小细胞肺癌相关的是()A.PSAB.CA19-9C.NSED.CYFRA21-1E.CA15-3参考答案:C2.PD-L1抑制剂联合化疗是ES-SCLC目前有且的一线免疫治疗方案()A.正确B.错误参考答案:A3.对放疗最敏感的肺癌是()A.鳞癌B.小细胞癌C.腺癌D.大细胞癌E.细支气管肺泡癌参考答案:B4.关于小细胞肺癌,叙述错误的是()A.易复发和转移B.单一治疗效果好C.肿瘤倍增时间短D.对放射治疗和化学治疗敏感E.早期易出现转移参考答案:B5.截止目前小细胞肺癌相关的临床试验数据来看,PD-L1抑制剂用于SCLC具有更大的治疗获益,相较PD-1抑制剂更具优势()A.正确B.错误参考答案:A四、免疫治疗中irAE的管理1.斑疹/丘疹区域>()全身BSA,应暂停ICIs治疗,使用的糖皮质激素外用A.10%B.15%C.20%D.25%E.30%参考答案:E2.在ICIs治疗期间,每()周复查ECG、心肌酶谱等A.1-2B.2-4C.4-6D.6-8E.8-10参考答案:B3.除()外,ICIs相关肝脏毒性与自身免疫性肝炎均不同A.女性显著性B.抗平滑肌抗体C.肝小叶炎症D.浆细胞增多E.CD20+ 和CD 4+参考答案:C4.PD-1/PD-L1抑制剂单药治疗时,irAEs不可逆的是()A.皮肤皮疹或瘙痒B.结肠炎C.肝脏毒性D.内分泌病变E.肺炎参考答案:D5.irAEs的常见毒性不包括()A.皮肤B.胃肠C.心血管D.内分泌器官E.肝脏参考答案:C五、2021小细胞肺癌诊疗指南解读1.对于不具有神经内分泌形态学特征的肿瘤,不推荐进行神经内分泌标记物染色()A.正确B.错误参考答案:A2.属于Ⅱ级推荐的免疫治疗前基线检查是()A.静息或活动时血氧饱和度常规胸部影像学检查B.24小时动态ECG检查C.特定肿瘤类型的基因突变状态D.心肌酶E.尿常规参考答案:C3.肿瘤细胞被免疫细胞识别的关键是()A.肿瘤表达黏附分子B.C.D.B.肿瘤分泌细胞因子C.肿瘤表达MHCI分子D.肿瘤表达MHCII分子参考答案:C4.()CSCO小细胞肺癌诊疗指南首次编写并出版A.2010年B.2012年C.2014年D.2016年E.2018年参考答案:D5.根据免疫相关毒性分级管理总体原则,G1的处理措施是()A.无需住院,局部使用糖皮质激素B.住院治疗,停止ICIs治疗C.无需住院,不推荐糖皮质激素治疗,可继续ICIs治疗D.无需住院,不推荐糖皮质激素治疗,但停止ICIs治疗E.住院治疗,静脉使用甲基泼尼松龙参考答案:C六、非小细胞肺癌的术后治疗1.完全切除后的NSCLC患者5年生存率差异大,ⅠB-ⅢA期患者的生存率在(),有待进一步提高A.90%B.36%-53%之间C.36%-68%之间D.77%-92%之间E.33%参考答案:C2.推荐对高危人群进行肺癌筛查的检查是()A.低剂量螺旋CTB.胸片C.超声D.磁共振E.生化指标检查参考答案:A3.下述器官中最容易发生小细胞肺癌转移的是()A.脑B.骨骼C.肝脏D.胰腺E.肾上腺参考答案:C以下关于肺癌患者肿瘤的随访内容,不正确的是()A.NSCLC患者肿瘤完全切除术后有必要进行密切随访B.建议对于NSCLC患者肿瘤完全切除术后,推荐的随访频次为术后前5年每6个月随访1次,术后5年以上每年随访1次,并根据术后恢复情况,酌情决定首次随访时间C.对于出现新发症状或症状加重的患者推荐立即随访D.PET-CT有明显优势,推荐随访以PET-CT为主E.随访期间应鼓励患者戒烟参考答案:D4.下列哪种肿瘤的发病率()A.肝癌B.胃癌C.乳腺癌D.肺癌参考答案:D七、I-IIIB期非小细胞肺癌完全切除术后辅助治疗指南解读1.以下关于根治性切除术的描述,不正确的是()A.需符合肿瘤完全切除的标准B.尽管NSCLC患者接受了肿瘤完全切除术,所有术后患者仍都存在肿瘤复发转移的危险C.危险度随分期的增加而减少D.支气管、动脉、静脉、支气管周围组织和肿瘤附近的组织切缘均阴性E.系统性淋巴结清扫及采样后结外组织无侵犯参考答案:C2.亚裔人群肺腺癌EGFR基因突变阳性率约为50%,一半推荐仲检查范围涵盖不包括()A.17B.18C.19D.20E.21参考答案:A3.以下关于肺癌患者肿瘤的随访内容,不正确的是()A.NSCLC患者肿瘤完全切除术后有必要进行密切随访B.建议对于NSCLC患者肿瘤完全切除术后,推荐的随访频次为术后前5年每6个月随访1次,术后5年以上每年随访1次,并根据术后恢复情况,酌情决定首次随访时间C.对于出现新发症状或症状加重的患者推荐立即随访D.PET-CT有明显优势,推荐随访以PET-CT为主E.随访期间应鼓励患者戒烟参考答案:D4.以下描述不正确的是()A.NSCLC需进一步明确亚型B.术后标本应出现非小细胞肺癌-非特指型(NSCLC-NOS)的诊断C.对于原位腺癌、微浸润性腺癌、贴壁为主型腺癌、腺鳞癌、肉瘤样癌、大细胞癌,以及神经内分泌癌中的典型类癌、不典型类癌等类型,需要充分观察术后病理形态改变方可诊断D.肿瘤中含有多种病理类型(包括腺鳞癌、复合型小细胞癌、复合型大细胞神经内分泌癌等)还应评估病理类型所占比例E.对于腺癌术后病理标本应给出腺癌亚型及比例(以5%含量递增比例),微乳头型腺癌及实体型腺癌未达5%也应列出参考答案:B5.以下关于辅助化疗的治疗时机及推荐疗程的描述,不正确的是()A.待患者术后体能状况基本恢复正常,可开始辅助化疗B.辅助化疗一般在术后4-6周开始C.辅助化疗建议最晚不超过手术后2个月D.术后辅助化疗常规推荐4周期E.更多化疗周期不会增加患者获益,反而可能增加不良反应1.EGFRm+ NSCLC辅助/新辅助治疗进展2.奥希替尼用于新辅助治疗研究的描述中错误的是()A.NEOS中期分析表明,新辅助奥希替尼可以作为可切除的 II-IIIB 期 EGFR突变肺腺癌有效且可行的治疗策略B.真实世界多中心回顾性研究表明,在可切除的 IA-IIIB期 EGFR突变NSCLC患者中使用奥希替尼进行新辅助治疗具有良好的耐受性,并且可以带来良好的病理响应C.真实世界多中心回顾性研究表明,奥希替尼新辅助治疗具有良好的耐受性,不会导致手术意外延迟D.真实世界多中心回顾性研究表明,奥希替尼新辅助治疗具有良好的耐受性,但会增加手术并发症E.新辅助奥希替尼对比/二代EGFR-TKI为EGFRm NSCLC带来更高的ORR及R0切除率数值,可能带来更好的疗效参考答案:D3.ADAURA研究中,奥希替尼降低()疾病复发风险A.80%B.70%C.60%D.50%E.40%4.()研究改写中国肺癌指南,将晚期靶向治疗引入手术患者治疗中A.BR19B.RADIANTC.MSKCCD.SELECTE.ADJUVANT/EVAN参考答案:E5.下面对基于液体活检的无细胞DNA(cfDNA)分析描述错误的是()A.为疾病诊断的临床实践提供了一种非侵入性方法B.cfDNA片段组学特征已用于肺癌的检测C.目前对肺癌的检测灵敏度已非常高D.Ⅰ期肺癌的检测灵敏度可能低于40%E.用于肺癌的早期诊断可以提高生存率并使患者受益参考答案:C6.FDA及参与Orbis计划的多国监管机构(HC、C和HAS)一致认为奥希替尼辅助治疗可以为()EGFRmNSCLC带来显著的临床获益A.IA-IIB期B.IB-IIIA期C.IIA-IVA期D.IIB-IIIB期E.IIB-IIIC期参考答案:B八、免疫检查点抑制剂治疗相关副反应及处理策略1.当皮疹覆盖<10%体表面积(BSA)时,应采取的措施是()A.局部激素类软膏(弱效),隔日一次;如有瘙痒,口服抗组胺类药物B.皮肤科会诊或皮肤活检C.局部激素类软膏(中效)或激素类软膏(),每日两次D.暂停免疫治疗E.静滴甲基强的松龙1-2 mg/kg参考答案:A2.是否完成学习()A.是B.否参考答案:A3.免疫相关不良反应发生的器官中,比较罕见的是()A.皮肤B.胃肠道C.肺D.心血管E.肝脏参考答案:D4.治疗中发生不良事件,需要考虑的可能性是()A.疾病进展B.偶然事件C.irAEsD.以上都是参考答案:D5.一项关于Pembrolizumab的研究显示,最早出现的毒性反应是()A.皮肤反应B.甲状腺功能减退C.肝脏毒性D.肺炎E.肠炎参考答案:C九、关于亚肺叶切除的思考1.楔形切除时,肿瘤细胞可能会有残留,因此楔形切除只适用于非侵袭性肺癌()A.对B.错参考答案:A以下说法有误的是()A.对于仅行楔形切除者,R0切除且评估淋巴结数>5个者OS优势明显B.STAS-患者局部复发率更高,总体生存更差C.肿瘤细胞可以沿着血管、淋巴管、支气管或相邻肺泡腔扩散D.切缘不足、淋巴结评估不充分均会显著影响预后参考答案:B2.个对比肺叶和亚肺叶切除的RCT研究的时间为()A.1997年B.1995年C.1996年D.1994年E.1993年参考答案:B3.根据NCCN指南,不属于Sublobectomy指征的一项是()A.肺功能储备差或合并疾病多而不能耐受肺叶切除者B.直径≤2cm周围型结节C.GGO≥50%D.倍增时间≥200天E.病理为AIS参考答案:D4.肿瘤较小时,很少扩散到段间静脉之外,因此肺段切除甚至可以应用于部分侵袭性肺癌()A.对B.错参考答案:A十、肺癌脑转移诊治专家共识解读1.肺癌脑转移辅助检查中的检查是()A.影像学检查方法B.分子病理检测C.血清肿瘤标志物D.腰椎穿刺E.脑脊液检查参考答案:A2.分子靶向治疗中,属于ALK抑制剂的是()A.吉非替尼B.厄洛替尼C.克唑替尼D.埃克替尼E.奥希替尼参考答案:C3.肺癌是我国最常见的恶性肿瘤,在整个疾病病程中约()%的患者会发生脑转移,并且驱动基因阳性的肺癌患者脑转移发生率更高A.35B.40C.45D.50E.55参考答案:D4.脑转移的分级预后指标中的纳入4个预后因素,不包括()A.KPSB.年龄C.性别D.脑转移数目E.有无颅外转移参考答案:C5.SCLC不手术的情况是()A.位于脑干、丘脑、基底节的脑转移瘤B.转移瘤和/或水肿体积大C.颅内压失代偿D.肿瘤卒中E.危及生命者参考答案:A十一、EGFR突变阳性晚期NSCLC的一线治疗1.EGFR非经典突变哪类药物()A.免疫治疗B.化疗C.一代EGFR抑制剂D.二代EGFR抑制剂E.抗血管生成治疗参考答案:D2.EGFR-TKI+VEGFR治疗模式,被证实有PFS获益的研究是()A.JO 25567B.NEJ 026C.RELAYD.CTONG 1509(中国)E.以上都是参考答案:E3.非小细胞肺癌中靶向药物最多的靶点是()A.KRASB.EGFRC.ALKD.ROS1E.RET参考答案:B4.相比单药治疗,联合治疗的EGFR突变血浆清除率更高更快()A.正确B.错误参考答案:A5.EGFR突变率在哪种病理类型中()A.大细胞癌B.腺癌C.鳞癌D.小细胞癌参考答案:B十二、EGFR突变阳性晚期NSCLC全程管理1.肿瘤的一线治疗是指()A.手术前进行的化疗B.手术后进行的化疗C.病人已经接受过治疗无效以后再进行的治疗D.晚期无法手术或术后复发、转移的肿瘤患者使用的个全身治疗方案参考答案:D以下哪个指标被认为是评估肿瘤临床获益的金标准()A.PFSB.ORRC.DCRD.OS参考答案:D2.EGFR突变率在哪种病理类型中()A.大细胞癌B.腺癌C.鳞癌D.小细胞癌参考答案:B3.Responserate是指()A.反应时间B.生存率C.缓解率D.有效率参考答案:C4.特殊情况下抗肿瘤药物使用采纳的循证医学证据,依次是其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、临床诊疗指南,学协会发布的诊疗规范、临床诊疗指南和临床路径等()A.正确B.错误参考答案:A十三、肿瘤患者营养治疗的知信行1.2017年发表的法国研究结果:()%的患者不规范使用肠外营养(不符合指南标准)A.65B.70C.75D.80参考答案:A2.2020年发表的意大利肿瘤学会(AIOM)的全国调研:()肿瘤科医护人员依从指南进行营养筛查和评估A.1/3B.1/4C.1/5D.1/6参考答案:A3.化疗开始至结束,全程给予ONS,按计划化疗完成率()A.70%B.80%C.90%D.100%E.50%参考答案:D4.2021年最新发表的ESPEN《肿瘤患者临床营养实用指南》推荐:肿瘤患者的营养治疗,()A.肠内营养B.ONSC.肠外营养D.营养咨询参考答案:B5.2021年最新发表的ESPEN《肿瘤患者临床营养实用指南》推荐:放疗患者的营养治疗,()A.ONS/ENB.肠内营养C.肠外营养D.营养咨询参考答案:A十四、以临床价值为导向的抗肿瘤药物临床合理使用管理实践1.下列哪项不属于我院抗肿瘤药物管理工作组的权责()A.制定本机构抗肿瘤药物管理制度并组织实施B.审议本机构抗肿瘤药物分级管理目录C.负责抗肿瘤药物的采购、供应、集中调配及合理用药指导D.组织对患者合理使用抗肿瘤药物的宣传教育参考答案:C2.具有抗肿瘤药物处方权的临床医师职称要求为()A.住院医师B.职业医师C.助理医师D.初级及中级以上职称医师参考答案:D3.抗肿瘤药物临床应用实行分级管理,根据安全性、可行性、经济学等因素,将抗肿瘤药物分为限制使用级和()A.普通使用级B.一般使用级C.特殊使用级D.临床试验级参考答案:A4.处方前置审核对于医生的作用是什么()A.限制医生自由开药B.提醒医生注意药品的剂量和使用方法C.让医生了解、掌握用药的规范和标准D.增加医生的工作量参考答案:C一位46岁女性患者患有胃低分化腺癌IV期,曾经接受过替雷利珠单抗和恩沃利单抗等多轮治疗,近期评价为PD。
2015ASCO 临床肿瘤学进展年度报告——治疗篇
2015 年1 月,ASCO 在Journal of Clinical Oncology 发表了《2015 年临床肿瘤学进展:ASCO 抗癌进展年度报告》。
而有关肿瘤治疗部分,更是报告中的精华所在。
在过去的一年中,常见及罕见肿瘤的治疗都出现了突破性的进展,直接使患者的生存延长,生活质量提高。
这些进展包括靶向治疗以及近期令人振奋的免疫治疗——直到近年来我们才看到免疫治疗所获得的一些成就。
除此之外,联合不同方式治疗的策略表现出在大规模多中心研究中的强大效果;化疗药联合标准方案内分泌治疗使得进展期前列腺癌的患者大大地延长了生存期,以及将放疗加入标准方案化疗之后,可以将胶质瘤等脑部肿瘤的患者生存期延长 5 年以上。
多学科综合治疗可延长脑部肿瘤及前列腺癌患者生存多学科联合治疗——是指一种联合多种药物或者不同形式治疗的策略——目前已经证实这种治疗对于多种恶性肿瘤可以起到显著的效果。
然而,由于每项单独的治疗都会增加副反应,平衡各种治疗的风险及获益需要在临床试验中进行细致的评估。
研究者近期汇报了两种不同肿瘤(脑部肿瘤及前列腺癌)的联合治疗取得了巨大的成果。
化疗联合放疗可以延长低级别胶质瘤患者 5 年的总生存时间过去的30 年内,放疗已经成为低级别胶质瘤的一线治疗方式。
胶质瘤是指从胶质细胞起源的一种脑部支持细胞肿瘤。
胶质瘤会根据肿瘤细胞与正常细胞的相似程度进行分级。
低级别(2 级)胶质瘤生长比较缓慢,它占所有脑部肿瘤的3%。
近期,一项联邦赞助的研究中,纳入了250 例有低级别胶质瘤的患者,结果表示放疗联合化疗可以将患者的总生存时间提高5.5 年,相比于单纯放疗而言。
平均来说,单独接受放疗的患者总生存时间为7.8 年,而接受放化疗联合PCV(甲基苄肼、洛莫司汀和长春新碱)方案化疗的患者的生存时间为13.3 年。
联合治疗也使得疾病进展发生的时间推迟了10 年,而单纯应用放疗仅仅只能推迟4 年。
直到这项研究以前,对于低级别胶质瘤进行化疗仍然是存在争议的,因为化疗对于哪些患者在哪些时间点能够发挥作用目前还缺乏强有力的证据支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
III
中国早期浸润性乳腺癌患者接受阿诺新®辅助治疗后的前瞻性非干预性研究
辉瑞制药有限公司
复旦大学附属肿瘤医院
邵志敏
非干预性
注射用盐酸莎巴比星联合顺铂治疗小细胞肺癌(广泛期)安全性、耐受性及药代动力学I期临床研究
合肥合源医药公司
蚌埠医学院第一附属医院
吴穷
I
注射用盐酸莎巴比星联合顺铂治疗小细胞肺癌(广泛期)安全性、耐受性及药代动力学I期临床研究
徐兵河
III
甲磺酸阿帕替尼治疗晚期EGFR野生型、非鳞、非小细胞肺癌随机、双盲、安慰剂平行对照、多中心III期临床试验
江苏恒瑞医药股份有限公司
同济大学附属上海肺科医院
周彩存
中山大学附属肿瘤医院张力
III
尼妥珠单抗(泰欣生)联合吉西他滨对比安慰剂联合吉西他滨治疗K-RAS野生型局部晚期或转移性胰腺癌的前瞻性、随机对照、双盲、多中心的注册临床研究
北京双鹭药业股份有限公司
中国医学科学院肿瘤医院
石远凯
III
苹果酸法米替尼治疗胃肠间质瘤的开放、单臂、多中心II期临床试验
江苏恒瑞医药股份有限公司
中国人民解放军第八一医院
秦叔逵
II
甲磺酸阿帕替尼片二线治疗晚期肝细胞癌III期临床试验
江苏恒瑞医药股份有限公司/
上海恒瑞医药有限公司
中国人民解放军第八一医院
百泰生物药业有限公司
中国人民解放军第八一医院秦叔逵
上海复旦大学附属肿瘤医院李进
III
在晚期肝癌患者中对LY2157299、LY2157299-索拉非尼联合以及索拉非尼治疗进行比较的一项随机II期研究
礼来公司
全球多中心II期临床研究,
亚洲区无组长单位
II
项目名称
申办单位
牵头单位及主要研究者
研究分期
治疗晚期肝细胞癌(K-001)的随机、双盲、阳性药平行对照、多中心临床研究
北京华世天富生物医药科技有限公司
中国人民解放军第八一医院
秦叔逵
IIb
聚乙二醇重组人粒细胞集落刺激因子注射液用于预防化疗后中心粒细胞减少的有效性和安全性多中心、随机、开放、平行对照III期临床试验
Astrazeneca AB
阿斯利康
中国人民解放军第八一医院
秦叔逵Βιβλιοθήκη III一项比较Palbociclib(口服CDK4/6抑制剂)联合来曲唑和安慰剂联合来曲唑治疗既往未经治疗的亚洲女性绝经后ER(+),HER2(-)晚期乳腺癌的多中心、随机、双盲、3期研究
辉瑞制药有限公司(Pfizer)
中国医学科学院肿瘤医院
合肥合源医药公司
中国医学科学院肿瘤医院
石远凯
I
比较盐酸安罗替尼胶囊联合最佳支持治疗与安慰剂联合最佳支持治疗在标准治疗后进展的转移性结直肠癌患者中的随机双盲、安慰剂对照多中心临床试验
正大天晴药业集团股份有限公司
中国医学科学院肿瘤医院
王金万
III
Olaparib(AZD2281)联合紫杉醇与安慰剂联合紫杉醇在一线治疗后疾病进展的亚洲晚期胃癌(包括胃食管接合处)的III期临床试验
