氮的氧化物》课件讲解
合集下载
氮的氧化物(PPT)4-4
例2:在标况下,把一个50mL量筒装满水 倒置于水槽中,先通入10mLNO,然后 通入20mLO2,问最后剩余气体为多少? 解: 4NO+3O2+2H2O=====4HNO3 4mL 3mL 10mL x
X=7.5mL 现有氧气20mL,所以O2过量, 应根据NO的体积算,剩余氧气有12.5mL.
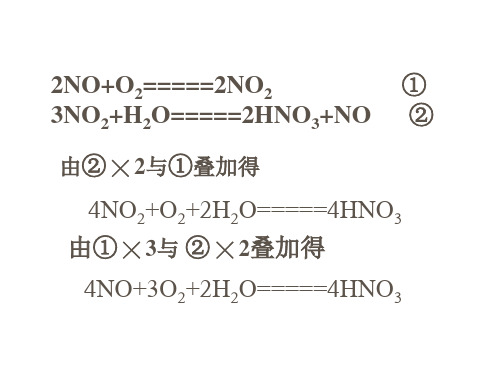
2NO+O2=====2NO2
①
3NO2+H2O=====2HNO3+NO ②
由② ╳ 2与①叠加得
4NO2+O2+2H2O=====4HNO3 由① ╳ 3与 ② ╳ 2叠加得
4NO+3O2+2H2O=====4HNO3
腊人常在奥林匹亚(a)举行体育竞技,年的国际体育大会决定把世界性的综合运动会叫做奥林匹克运动会。第一届于年在希腊雅典举行,以后每四年一次, 在会员国的某个城市举行。简称奥运会。 【奥秘】名深奥的尚未被认识的秘密:探索宇宙的~。 【奥妙】形(道理、内容)深奥微妙:~无穷|其中的道理 非常~。 【奥义】〈书〉名深;天天美剧 美剧下载 https:// 美剧天堂 最新美剧 ;奥的义理:探求五经~。 【奥援】〈书〉名官场 中暗中撑腰的力量;有力的靠山(多含贬义)。 【奥运村】名奥林匹克运动会主办城市为参赛的各国代表团提供的有各种生活设施的住处。 【奥运会】名奥 林匹克运动会的简称。 【奥旨】名深奥的含义:深得其中~。 【骜】(驁)〈书〉①骏马。②同“傲”。 【慠】〈书〉同“傲”。 【隩】〈书〉同 “奥”?。 【墺】①〈书〉可以居住的地方。②〈方〉山间平地:深山野~。 【澳】①海边弯曲可以停船的地方(多用于地名):三都~(在福建)。②() 名指:港~同胞。③()名姓。 【澳】名①指澳洲(现称大洋洲):~毛(澳洲出产的羊毛)。②指澳大利亚。 【澳抗】名澳大利亚抗原的简称,人体血清 中一种异常蛋白质,与病度性乙型肝炎的发病有密切关系。现称乙型肝炎表面抗原。 【币】名地区通行的货币,以圆为单位。 【懊】烦恼;悔恨:~恨|~ 恼。 【懊恨】动悔恨。 【懊悔】动做错了事或说错了话,心里自恨不该这样:~不已。 【懊??】〈书〉动烦恼;懊悔。 【懊恼】形心里别扭;烦恼。 【懊 丧】形因事情不如意而情绪低落,精神不振:神情~。 【鏊】[鏊子](?)名烙饼的器具,用铁做成,平面圆形,中心稍凸。 【八】①数七加一后所得的 数目。参看页〖数字〗。②()名姓。 【八拜之交】ī拜把子的关系。 【八宝菜】名由核桃仁、莴笋、杏仁、黄瓜、花生米等混合在一起的酱菜。 【八宝饭】 名糯米加果料儿、莲子、桂圆等蒸制的甜食。 【八宝粥】名糯米加莲子、桂圆、红枣、果料儿、花生米等煮成的粥。 【八辈子】?名好几辈子,形容很深的 程度或很长的时间:倒了~霉|这都是~前的事儿了。 【八成】①数量词。十分之八:~新|任务完成了~啦。②(~儿)副多半;大概:看样子~儿他不 来了。 【八斗才】名宋无名氏《释常谈》:“谢灵运尝曰:‘天下才有一石,曹子建独占八斗,我得一斗,天下共分一斗。’”后来用“八斗才”比喻很高 的才能。 【八方】名指东、西、南、北、东南、东北、西南、西北,泛指周围各地:四面~|一方有难,~支援。 【八分书】名汉字的一种字体,即汉隶。 【八竿子打不
氮的氧化物_1中小学PPT教学课件

德、日法西斯专政 建立的途径有什么不 同?
P.30 问题讨论 参考答案
在德国,以希特勒为头子的法西斯组织纳 粹党,通过蛊惑人心的宣传,骗取了各阶层的广 泛支持,从而成为国会第一大党。希特勒被授 权组阁,出任德国总理,建立起法西斯专政。在 日本,为摆脱严重的经济危机和政治危机,以军 部为主力的法西斯好战势力迅速抬头。通过 对外发动战争,使军部势力更加强大。1936年 二二六兵变之后,军部控制了新上台的内阁,建 立起军部法西斯专政
CCuu+(4NHON3)O23+(2浓NO)2=↑+2H2O
排水法
向上排气法
用碱液吸收
1. NO中有少量的NO2除去方法为( D ) A.通过盛有浓H2SO4的洗气瓶 B.通过盛有无水CaCl2的干燥管 C.先通过盛有浓H2SO4的洗气瓶,然后再通过盛有水的洗气瓶 D.先通过盛有水的洗气瓶,然后再通过盛有浓H2SO4的洗气瓶
1.知识与技能 了解NO、NO2的物理性质、掌握 氮氧化物之间的转化 了解氮氧化物对空气的污染及防治措施
2.过程与方法 培养学生观察实验、思考问题、交流研讨的能力,训练科学 的学习方法。
3.情感价值观 培养学生对化学现象与化学本质的辩证认识以及热爱科学, 提倡环境保护的思想。
第四章 第三节 氮的氧化物及大气的污染
请概括德国法西斯政权的内外政策。
对内 恐怖 独裁
制造“国会纵火案”,取缔其他政党 疯狂迫害犹太人 严密控制文化思想和文化教育
对外 扩军 备战
实行国民经济军事化 1935年撕毁《凡尔赛和约》实行普遍 义务兵役制 1936年开进莱茵非军事区
“国会纵火案”是怎么一回事?
庭
上 揭
季
露米
事特
《氮的氧化物》高一必修一PPT课件(第4.3.2课时)

y>4∶3
O2过量并剩余 恰好完全反应 NO过量并剩余
高一化学精品课程(人教版)
PART FOUR
实训与提升
Please enter the table of contents text herePlease enter the table of contents text here
一、典例分析
一、氮气
1.氮气 (1)物理性质
颜色 _无__色___
气味 _无__味___
溶解性 __难____溶于水
密度 与空气接近
(2)化学性质 ①通常状况下较稳定,与其他物质不反应。 ②高温或放电时能与O2反应生成NO,化学方程式为
____________________________。
二、一氧化氮和二氧化氮
毒性
_有__毒__ _
_有__毒__ _
二、一氧化氮和二氧化氮
(3)化学性质 ①常温下,NO不稳定,易与O2化合生成NO2,化学方程式 为___2_N__O_+__O_2_=_2_N_O__2__; ②NO2溶于水时与水发生反应,化学方程式为 _3_N_O__2+__H_2_O__=_2_H_N_O__3+__N_O__。
高一化学精品课程(人教版)
第四章 非金属及其化合物
第三节 硫和氮的氧化物
第2课时 氮的氧化物
高一化学精品课程(人教版)
01 学习的目标 01 氮和氮的氧化物 01 氮的氧化物溶于水的计算 01 实训与提升
高一化学精品课程(人教版)
PART ONE
学习的目标
Please enter the table of contents text herePlease enter the table of contents text here
《氮气和氮的氧化物》精品课件

+4
+5 N价态
NO
化合价 +5 +4 +2
0 -3
H2
NH3
O2
N2
NO2
O2
NO
氢化物
单质
氧化物
HNO3 Cu(NO3)2
酸
盐 物质类别
3 一氧化氮与二氧化氮
3.2 化学性质
1
NO
还原性 2NO+O2=2NO2
放热反应 常温上反应速率极快!
归纳与整理
氧 极快 化 三 较快
NO与O2 Fe(OH)2与O2 Fe2+与O2
2.如何除去NO中NO2 ? 混合气通过水洗
思考﹒ 讨论
设计实验,要求尽可能多的使集气瓶内的NO气体被水吸收。
不断通氧气
不断通氧气
2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
……
6NO+3O2=6NO2 6NO2+2H2O=4HNO3+2NO
4NO+3O2+2H2O=4HNO3
思考﹒ 讨论
2
氧化性
6NO2+8NH3 催化剂 7N2+12H2O
汽车尾气(含烃类、CO、NO和NO2等)是城市主要污 染源之一,治理的办法之一是在汽车排气管装上催化转化 器,使NO或NO2与CO反应生成可参与大气生态循环的无 毒气体,请写出NO2与CO转化的化学方程式。
4CO+2NO2 催化剂 4CO2+N2
3 一氧化氮与二氧化氮
3.2 化学性质
1
NO2
氧化性与还原性
3NO2+H2O=2HNO3+NO
2
氧化性
6NO2+8NH3 催化剂 7N2+12H2O
3
还原性
Na2O2+2NO2=2NaNO3
氮的氧化物和硝酸中小学PPT教学课件

②金属与HNO3反应不产生H2。 ③比较HNO3与Na2CO3和Na2SO3的反应。(前者为复 分解反应,后者为氧化还原反应。) (2)不稳定性:浓硝酸显黄色,是因为 HNO3分
解产生的NO2溶解在硝酸中 ,说明浓硝酸具有 不稳定 性,化学方程式为 4HNO3 4NO2↑+O2↑+2H2O 。
(3)强氧化性
答案 (1)二者有着本质区别。酸的挥发性是一 种物理性质,指的是酸以分子状态离开溶液逸出。 一般低沸点酸挥发性强。而不稳定性指化学性质, 指的是酸分子分解生成新的物质。
(2)酸性指酸中H+表现出的性质;氧化性有时 是H+表现出的性质,有时指酸根离子表现出的,即 其中心原子被还原,此时不生成H2。 (3)浓、稀硝酸均具有酸的通性,所以都可以 使紫色石蕊试液变红,但二者又都具有氧化性,
①与金属的反应
a.除Pt、Au外,大部分金属均能与HNO3反应。
b.Cu与浓、稀HNO3发生反应的化学方程式分别为:
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O ,
3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+4H2O 。
c.Fe、Al遇冷的浓HNO3或浓H2SO4能发生 钝化 ,
(4)与有机物的反应 ①硝化反应(如与苯反应); ②酯化反应(如与纤维素反应); ③颜色反应(如与蛋白质反应)。
要点精讲
要点一 氮的氧化物与O2、H2O混合的计算方法 1.加合式法
(1)NO2和O2混合气体溶于水的计算
由4NO2+O2+2H2O
4HNO3可知,当体积比:
V(NO2):V(O2)
<4∶1 =4∶1 >4∶1
解产生的NO2溶解在硝酸中 ,说明浓硝酸具有 不稳定 性,化学方程式为 4HNO3 4NO2↑+O2↑+2H2O 。
(3)强氧化性
答案 (1)二者有着本质区别。酸的挥发性是一 种物理性质,指的是酸以分子状态离开溶液逸出。 一般低沸点酸挥发性强。而不稳定性指化学性质, 指的是酸分子分解生成新的物质。
(2)酸性指酸中H+表现出的性质;氧化性有时 是H+表现出的性质,有时指酸根离子表现出的,即 其中心原子被还原,此时不生成H2。 (3)浓、稀硝酸均具有酸的通性,所以都可以 使紫色石蕊试液变红,但二者又都具有氧化性,
①与金属的反应
a.除Pt、Au外,大部分金属均能与HNO3反应。
b.Cu与浓、稀HNO3发生反应的化学方程式分别为:
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O ,
3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+4H2O 。
c.Fe、Al遇冷的浓HNO3或浓H2SO4能发生 钝化 ,
(4)与有机物的反应 ①硝化反应(如与苯反应); ②酯化反应(如与纤维素反应); ③颜色反应(如与蛋白质反应)。
要点精讲
要点一 氮的氧化物与O2、H2O混合的计算方法 1.加合式法
(1)NO2和O2混合气体溶于水的计算
由4NO2+O2+2H2O
4HNO3可知,当体积比:
V(NO2):V(O2)
<4∶1 =4∶1 >4∶1
《氮及其氧化物》课件

吸入氮氧化物可能引发心 血管系统的各种问题,如 高血压、心脏病等。
免疫系统损伤
长期接触氮氧化物可能降 低人体的免疫力,使人更 容易受到病毒和细菌的侵 害。
氮氧化物的防治措施
改善能源结构
推广使用清洁能源,减少燃煤和燃油 的使用,从而减少氮氧化物的排放。
尾气处理
对汽车尾气进行催化还原处理,将氮 氧化物转化为无害的氮气和水蒸气。
反应机理
氮氧化物的化学反应通常涉及电子转移和配位键的形成, 这些反应机理对于理解氮氧化物的化学性质至关重要。
氮氧化物的生成与转化
燃烧生成
在高温燃烧条件下,氮气和氧气 反应可生成一氧化氮(NO)和二氧
化氮(NO₂)。
工业制备
工业上常用硝酸与金属反应制备 氮氧化物,如铜与浓硝酸反应生
成硝酸铜、二氧化氮和水。
。
氮气在高温或放电条件下,可以 与某些元素发生反应,生成氮化
物或氮氧化物。
氮气的化学性质
01
氮气与金属反应,通常生成氮化 物。例如:镁与氮气反应,生成 氮化镁。
02
氮气与非金属反应,通常生成氮 氧化物。例如:氢气与氮气反应 ,生成氨气。
氮气的应用
氮气是一种重要的工业气体, 用于合成氨、制硝酸、制尿素 等化工生产中。
《氮及其氧化物》 ppt课件
目录
• 氮气的性质 • 氮氧化物的性质 • 氮氧化物的危害与防治 • 氮氧化物在工业上的应用 • 氮氧化物的前沿研究进展
01
氮气的性质
氮气的物理性质
氮气是一种无色、无味、无臭的 气体,在标准状况下,氮气的密
度为1.25g/L,接近空气。
氮气是一种惰性气体,化学性质 稳定,不易与其他物质发生反应
氮氧化物还用作高温防护涂层,防止金属在高温下氧化和腐蚀。
免疫系统损伤
长期接触氮氧化物可能降 低人体的免疫力,使人更 容易受到病毒和细菌的侵 害。
氮氧化物的防治措施
改善能源结构
推广使用清洁能源,减少燃煤和燃油 的使用,从而减少氮氧化物的排放。
尾气处理
对汽车尾气进行催化还原处理,将氮 氧化物转化为无害的氮气和水蒸气。
反应机理
氮氧化物的化学反应通常涉及电子转移和配位键的形成, 这些反应机理对于理解氮氧化物的化学性质至关重要。
氮氧化物的生成与转化
燃烧生成
在高温燃烧条件下,氮气和氧气 反应可生成一氧化氮(NO)和二氧
化氮(NO₂)。
工业制备
工业上常用硝酸与金属反应制备 氮氧化物,如铜与浓硝酸反应生
成硝酸铜、二氧化氮和水。
。
氮气在高温或放电条件下,可以 与某些元素发生反应,生成氮化
物或氮氧化物。
氮气的化学性质
01
氮气与金属反应,通常生成氮化 物。例如:镁与氮气反应,生成 氮化镁。
02
氮气与非金属反应,通常生成氮 氧化物。例如:氢气与氮气反应 ,生成氨气。
氮气的应用
氮气是一种重要的工业气体, 用于合成氨、制硝酸、制尿素 等化工生产中。
《氮及其氧化物》 ppt课件
目录
• 氮气的性质 • 氮氧化物的性质 • 氮氧化物的危害与防治 • 氮氧化物在工业上的应用 • 氮氧化物的前沿研究进展
01
氮气的性质
氮气的物理性质
氮气是一种无色、无味、无臭的 气体,在标准状况下,氮气的密
度为1.25g/L,接近空气。
氮气是一种惰性气体,化学性质 稳定,不易与其他物质发生反应
氮氧化物还用作高温防护涂层,防止金属在高温下氧化和腐蚀。
氮的氧化物中小学PPT教学课件

近代自然科学家
前期
后 期
艾萨克·牛顿
Isaac Newton 1642.12.25~1727.3.31 英格兰物理、数学、天文学家
查尔斯·罗伯特·达尔文
Charles Robert Darwin 1809.2.12~1882.4.19 英国博物学家 进化论奠基人
阿尔伯特·爱因斯坦
Albert Einstein 1879.3.14~1955.4.18 德裔美国 现代物理学奠基人
SO2 和 Cl2 漂白作用的比较 [例2]已知盐酸加到品红溶液中,使品红溶液的红色加深。 试推测:
(1)向品红溶液中通过量的 SO2 的现象为_______________; 加热后的现象为___________________________。
(2)向品红溶液中通入过量的 Cl2 的现象为______________。 (3)向品红溶液中通入物质的量比为 1∶1 且足量的 SO2 和 Cl2 后现象为__________________________________________。
①酸性氧化物的性质 a.与水反应生成亚硫酸:_S_O__2+__H__2_O______H_2_S_O__3 _;
b.与碱(NaOH)反应:_S_O__2+__2_N__a_O_H_____N__a_2S_O__3+__H__2_O__; c.与碱性氧化物(CaO)反应:_S_O__2+__C__a_O____△____C_a_S_O__3 _。
科学的殉道士
1514年5月,波兰哥白尼经过40年天文观测,写成《天体运行论》,创立“日心说”,开启 了近代自然科学之门。1533年,哥白尼在罗马做了一系列讲演,未遭到教皇反对。1543年5月24 日该书出版。伽利略用自制的世界上第一个天文望远镜,证实并支持哥白尼的“日心说”,后入 狱“放弃了”日心说。布鲁诺也在1592年5月23日被捕,终因坚持于1600年2月17日在罗马百花
氮气及氮的氧化物课件
• [例1] 工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3, 工艺流程如下:
• 已知:Na2CO3+NO+NO2===2NaNO2+CO2。
• (1)中和液所含溶质除NaNO2及少量Na2CO3外,还有____________(填化学式)。
• (2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是 _________________。蒸发Ⅰ产生的蒸气中含有少量NaNO2等有毒物质,不能直 接排放,将其冷凝后用于流程中的____________(填操作名称)最合理。
• ②NO与NO2按物质的量之比1:1被足量的NaOH溶液完全吸收后只得到一种钠盐, 该钠盐的化学式是______N_a_N__O_2_。
解析 (1)V(NO)+V(NO2)=3.0 L,23V(NO)+43V(NO2)=3.5 L,则 V(NO)=0.75 L, V(NO2)=2.25 L,V(NO)∶V(NO2)=1∶3。(2)②NO 中氮的化合价为+2,NO2 中氮 的化合价为+4,利用电子守恒,二者按 1∶1 混合时与 NaOH 反应生成盐的化合价 必然为+3 价,即为 NaNO2。
• (4)标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA。 ( ×)
• (5)常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA。(
)√ ×
• (6)溴蒸气和NO2都为红棕色气体,用湿润的淀粉-KI试纸可以鉴别。( )
• 2.下列说法正确的是 ( )B • A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 • B.NO可用于某些疾病的治疗 • C.常温下,N2既能与O2反应又能与H2反应 • D.汽车尾气的主要污染成分包括NO、CO和N2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节 硫和氮的氧化物
(一)氮气 1、物理性质:
无色无味气体,不溶于水,密度比 空气稍小。 2、化学性质:不活泼
放电或高温 N2 + O2 ===== 2NO
高温、高压
N2+3H2 催化剂 2NH3
(二) NO和NO2 氮元素有六种氧化物:
N2O NO N2O3 NO2 N2O4 N2O5
二、二氧化氮和一氧化氮
• 2 、NO 和NO2是否为酸性氧化物? HNO3 的酸酐是什么?
• 酸酐:某酸脱去一分子的水,所剩下的部分称为 该酸的酸酐。
H2SO4→
H2SO3→
HNO3→
HNO2→
你知道吗?
在新疆与青海交界处有一山谷,人称“魔 鬼谷”。经常电闪雷鸣,狂风暴雨,把人畜 击毙,然而谷内却是牧草茂盛,四季常青。 这是为什么?
乐 山 大 佛 遭 受 酸 雨
平 静 的 湖 水 却 缺 少 了
O2
色红;棕水色位又继消续失上升,2NO2
(3) 继续通入氧 水逐渐充满试管 3NO2+H2O=
气
4 NO2 + 2H2O + O2 =
4HN2HON3O3+NO
三、二氧化硫和二氧化氮对大气的污染
1、二氧化硫和二氧化氮是主要的大气污染物。
2、污染物的来源:
(1)SO2主要来自于化石燃料(如煤与石油) 的燃烧、含硫金属的冶炼以及制造硫酸、磷肥 等产生的废气。
• 1、在放电或高温下:
放电或高温
N2 + O2 === 2 NO (无色) 一氧化氮
• 2、在常温下: 2 NO + O2 = 2 NO2 (红棕色) 二氧化氮
物理 性质
化学 性质
N的化合价 颜色状态 气味 溶解性 密度 毒性 与O2反应 与H2O反应 生成来源
NO
NO2
深入学习
• 1、实验室如何收集NO 和NO2 ?
科学探究
• 现给你一试管二氧化氮,其他药品和仪器自选。
1、请你设计实验,要求尽可能多地NO2被水吸收。
实验步骤
现象
解释(反应式)
(1)
(2)
(3)
实验步骤
现象
解释(反应式)
(1) 将充满NO2 红棕色逐渐消失, 3NO2+H2O=
的试管倒立 在水槽
试管水位上升到2/3 处
2HNO3+NO
(2) 往试管通入 无色气体变成红棕 2NO+O2=
• 科学视野:信使分子——NO
想一想: • (1)1998年的诺贝尔生理学和医学奖的主要研究成果是
什么? ------发现NO在人体的血管系统内具有传送信号的功能
• (2) NO一向被视为大气污染物,却在生命过程中有如此 重要的功能,这是否能给人们一些什么启示呢?
------世上没有绝对的有害物质
二、二氧化氮和一氧化氮
(2)NO2主要来自于汽车尾气。
三、SO2、NO2对大气的污染:
酸雨的形成:
雨水. 霜. 雹. 露 等
CO2 SO2 NOx
燃烧
石油 煤 金属矿物、对人体的直接危害,首先是它的刺激性,其次是它会 形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部, 引起肺水肿等疾病而使人致死; 2、引起河流、湖泊的水体酸化,严重影响水生动物生长 3、破坏土壤、植被、森林; 4、腐蚀金属、油漆、皮革、纺织品及建筑材料等; 5、渗入地下,可引起地下水酸化,酸化后的地下水中铝、 铜、锌、镉等对人体有害金属元素的含量会偏高。
(一)氮气 1、物理性质:
无色无味气体,不溶于水,密度比 空气稍小。 2、化学性质:不活泼
放电或高温 N2 + O2 ===== 2NO
高温、高压
N2+3H2 催化剂 2NH3
(二) NO和NO2 氮元素有六种氧化物:
N2O NO N2O3 NO2 N2O4 N2O5
二、二氧化氮和一氧化氮
• 2 、NO 和NO2是否为酸性氧化物? HNO3 的酸酐是什么?
• 酸酐:某酸脱去一分子的水,所剩下的部分称为 该酸的酸酐。
H2SO4→
H2SO3→
HNO3→
HNO2→
你知道吗?
在新疆与青海交界处有一山谷,人称“魔 鬼谷”。经常电闪雷鸣,狂风暴雨,把人畜 击毙,然而谷内却是牧草茂盛,四季常青。 这是为什么?
乐 山 大 佛 遭 受 酸 雨
平 静 的 湖 水 却 缺 少 了
O2
色红;棕水色位又继消续失上升,2NO2
(3) 继续通入氧 水逐渐充满试管 3NO2+H2O=
气
4 NO2 + 2H2O + O2 =
4HN2HON3O3+NO
三、二氧化硫和二氧化氮对大气的污染
1、二氧化硫和二氧化氮是主要的大气污染物。
2、污染物的来源:
(1)SO2主要来自于化石燃料(如煤与石油) 的燃烧、含硫金属的冶炼以及制造硫酸、磷肥 等产生的废气。
• 1、在放电或高温下:
放电或高温
N2 + O2 === 2 NO (无色) 一氧化氮
• 2、在常温下: 2 NO + O2 = 2 NO2 (红棕色) 二氧化氮
物理 性质
化学 性质
N的化合价 颜色状态 气味 溶解性 密度 毒性 与O2反应 与H2O反应 生成来源
NO
NO2
深入学习
• 1、实验室如何收集NO 和NO2 ?
科学探究
• 现给你一试管二氧化氮,其他药品和仪器自选。
1、请你设计实验,要求尽可能多地NO2被水吸收。
实验步骤
现象
解释(反应式)
(1)
(2)
(3)
实验步骤
现象
解释(反应式)
(1) 将充满NO2 红棕色逐渐消失, 3NO2+H2O=
的试管倒立 在水槽
试管水位上升到2/3 处
2HNO3+NO
(2) 往试管通入 无色气体变成红棕 2NO+O2=
• 科学视野:信使分子——NO
想一想: • (1)1998年的诺贝尔生理学和医学奖的主要研究成果是
什么? ------发现NO在人体的血管系统内具有传送信号的功能
• (2) NO一向被视为大气污染物,却在生命过程中有如此 重要的功能,这是否能给人们一些什么启示呢?
------世上没有绝对的有害物质
二、二氧化氮和一氧化氮
(2)NO2主要来自于汽车尾气。
三、SO2、NO2对大气的污染:
酸雨的形成:
雨水. 霜. 雹. 露 等
CO2 SO2 NOx
燃烧
石油 煤 金属矿物、对人体的直接危害,首先是它的刺激性,其次是它会 形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部, 引起肺水肿等疾病而使人致死; 2、引起河流、湖泊的水体酸化,严重影响水生动物生长 3、破坏土壤、植被、森林; 4、腐蚀金属、油漆、皮革、纺织品及建筑材料等; 5、渗入地下,可引起地下水酸化,酸化后的地下水中铝、 铜、锌、镉等对人体有害金属元素的含量会偏高。
