“洗气瓶”的7种用法
《洗气瓶的使用》课件

02
洗气瓶的使用方法
准备阶段
检查洗气瓶是否完好
安装辅助工具
在使用洗气瓶之前,首先要确保洗气 瓶没有损坏,特别是瓶口和瓶身连接 处应无裂缝。
将导管和橡皮管等辅助工具正确安装 在洗气瓶上,确保密封良好。
准备所需工具和材料
根据实验需求,准备必要的导管、橡 皮管、橡皮塞等辅助工具,以及要洗 涤的气体。
使用阶段
洗气瓶在化学实验中还可以用于收集 特定气体,如利用排液法将气体通入 洗气瓶中,通过控制条件收集气体。
通过控制气体流速,洗气瓶能够实现 气体与吸收液的充分接触,提高气体 处理效果。
洗气瓶在化学实验中还可以用于气体 压力的测量,通过测量气体通过洗气 瓶的压力差,可以计算气体的流速和 流量。
在工业生产中的应用
控制气体流量
在通入气体时,应控制气体流量,不宜过快或过慢,以保证实验 结果的准确性。
观察并记录实验现象
在使用洗气瓶的过程中,应注意观察实验现象,如气体的颜色、状 态等变化,并做好记录。
保持安全操作
在实验过程中,应遵守安全操作规程,避免因操作不当引发安全事 故。
结束阶段
01
02
03
清洗洗气瓶
实验结束后,应及时清洗 洗气瓶,以备下次使用。 清洗时应特别注意瓶内和 瓶外都要清洗干净。
在其他领域的应用
01
洗气瓶在其他领域如环 保、医疗、食品加工等 领域也有广泛应用。
02
在环保领域,洗气瓶可 用于气体除尘和有害气 体处理,减少空气污染 。
03
在医疗领域,洗气瓶可 用于呼吸治疗和麻醉气 体的净化处理。
04
在食品加工领域,洗气 瓶可用于气体除臭和脱 氧,提高食品的保鲜度 和品质。
孟氏洗气瓶原理

孟氏洗气瓶原理洗气瓶是一种实验室常用的装置,主要用于吸收和去除实验中产生的有害气体和气体混合物,以保证实验环境的安全和可靠性。
孟氏洗气瓶是其中一种常见的洗气瓶,其原理和使用方法在实验室中得到广泛应用。
本文将详细介绍孟氏洗气瓶的原理和使用方法,以帮助读者更好地理解和使用这一实验装置。
一、孟氏洗气瓶的原理孟氏洗气瓶是一种通过水的溶解和吸收作用去除有害气体和气体混合物的装置。
其主要原理是利用水的溶解和吸收作用,将进入洗气瓶的气体分子分解为离子和分子,并与水分子发生化学反应,从而达到去除有害气体和气体混合物的目的。
孟氏洗气瓶由两个部分组成:上部为气体进口,下部为气体出口。
在洗气瓶中,气体进口处与水面相接触,气体在进入洗气瓶后首先与水发生接触,然后通过水的溶解和吸收作用,将有害气体和气体混合物分解为离子和分子,最终达到去除有害气体和气体混合物的目的。
在洗气瓶中,水溶解气体的速度受多种因素的影响,如水温、气体浓度、气体流速等。
二、孟氏洗气瓶的使用方法1、准备工作在使用孟氏洗气瓶前,需要进行一些准备工作。
首先,需要将洗气瓶清洗干净,并将洗气瓶中的水灌满。
其次,需要根据实验需要选择合适的气体进口和气体出口,并将其连接好。
最后,需要调节气体流速和水温,以达到最佳的气体去除效果。
2、操作步骤在使用孟氏洗气瓶时,需要按照以下步骤进行操作:(1)将洗气瓶连接好,调节好气体流速和水温。
(2)开启气体进口和气体出口,使气体从进口进入洗气瓶,然后从出口排出。
(3)在实验过程中,需要不断观察洗气瓶中的水位和气体流速,并根据需要调节水温和气体流速,以保证实验的正常进行。
(4)实验结束后,需要关闭气体进口和气体出口,并将洗气瓶中的水排空,以便下次使用。
三、注意事项在使用孟氏洗气瓶时,需要注意以下事项:1、在使用前,需要将洗气瓶清洗干净,并将洗气瓶中的水灌满,以保证实验的可靠性。
2、在使用过程中,需要不断观察洗气瓶中的水位和气体流速,并根据需要调节水温和气体流速,以保证实验的正常进行。
多功能瓶的使用

氧气瓶的氧气是通过一根管子给病人输氧的,但氧气是 无色无味的,怎样才对输氧的情况一目了然呢?比如氧 气流量的大小?是否管道堵塞?是否氧气瓶的氧气用完? 旁边的小瓶字,就是起这个作用的,小瓶子里有半瓶纯 水,瓶塞上有一进一出两个管子,氧气从氧气瓶出来, 先进入小瓶子的进气管,而进气管插入的深度是在水面 以下,进来的氧气在小瓶子的水里会冒出很多泡泡,再 在小瓶子的上部,通过出气管,输给病人。这样,氧气 的输送情况,就很容易从小瓶子里的水泡泡的有无或者 大小来了解了,很直观!
小结
水蒸气结和气体杂质的检验与除杂
1.检验原则:先验水蒸气,后验其它. 2.除杂原则:先除其它,最后除水蒸气.
二、集气瓶 1、向上排空气取气瓶
长短进短长出
使用条件:
收集的气体的密度大于空气密 度(组成气体的分子的相对分 子质量大于29),并且气体不 与空气中的成分反应。
常见实例: O2、CO2、Cl2、NO2
二、集气瓶 2、向下排空气取气瓶
长短进短长出
使用条件:收集的气体的密 度小于空气密度,并且气体 不与空气中的成分反应。
常见实例: H2、NH3
二、集气瓶
3、排水集气瓶 规则:上进下出
使用条件: ① 气体不溶或难溶于水; ② 气体不与水反应; ③ 对于部分气体来说,密度与 空气密度接近,无法用排空气 法收集。
常见实例: O2、H2、NO、CO
二、集气瓶
4、排水量气瓶 规则:上进下出
使用条件: ① 气体不溶或难溶于水; ② 气体不与水反应;
如果忽略导管内的水,量筒内 水的体积就是进入集气瓶中气 体的体积。
谢谢!
该气体具有的性质
;
❖ (2)用高锰酸钾制取一瓶纯净的氧气的装置组合是
洗气瓶的多种用途
气体短进长出
可用于收集密度 比空气小的气体, 可利 用注入不能相溶的液体排出气体,取用。
取气
液体长进, 气体短出
如利用注入 水排出O2或
H2
三、洗气(除杂质)、干燥
洗气瓶内装有吸收杂质的液体,混和 气通过时杂质(或水蒸气)被吸收。
洗气、干燥
气体长进短出 (“穿肠过”)
气泡快慢看 流速,湿润 气体
用途 排水集气法
向上排空气法
向下排空气法 取气 洗气、干燥 验气 量气 吸收法尾气处理 燃烧法尾气处理
气(液)体流向 气体 短进长出
实例
图例
可用于收集不易溶于 水的气体,如O2或H2
气体长进短出
气体短进长出
液体长进,气体短出
气体长进短出 (“穿肠过”) 气体长进短出(“穿 肠过”) 液体短进长出
如用NaOH溶液 除去CO中混有的 CO2,用浓H2SO4 除去CO中混有的 水蒸气
四、 验气(检验或证明某气体)
洗气瓶内装有验某气所需试剂,检验 时必须要有现象来证明。
验气
气体长进短出 (“穿肠过”)
瓶内装AgNO3溶液, 检验H2中是否混有 HCl,观察有无白 色沉淀生成。内装 Ca(OH)2溶液,检 验CO中是否混有 CO2,观察有无白 色沉淀生成。
吸收法尾气 处理
气体长进短 出
如用NaOH溶 液吸收SO2气 体
燃烧法尾气 处理
气体长进短 出,出气端 改为尖端, 点燃
如处理CO气 体
七、观察气体的流速,并 湿润气体
在医院给病人输氧气时,瓶中盛放大约 半瓶蒸馏水。可观察输出氧气的速度,也 可观察是否有氧气输出,也湿润了氧气。
观察气体流 速
气体长进短 出
“洗气瓶”的7种用法课件
收集气体
防倒吸
五、测量气体体积装置
气体
六、缓冲压强装置
七、液封装置
小结
1.气体收集 2.气体净化 3.气体反应 4.防倒吸 5.测量气体体积 6.缓冲压强
7.液封
人有了知识,就会具备各种分析能力, 明辨是非的能力。 所以我们要勤恳读书,广泛阅读, 古人说“书中自有黄金屋。 ”通过阅读科技书籍,我们能丰富知识, 培养逻辑思维能力; 通过阅读文学作品,我们能提高文学鉴赏水平, 培养文学情趣; 通过阅读报刊,我们能增长见识,扩大自己的知识面。 有许多书籍还能培养我们的道德情操, 给我们巨大的精神力量, 鼓舞我们前进。
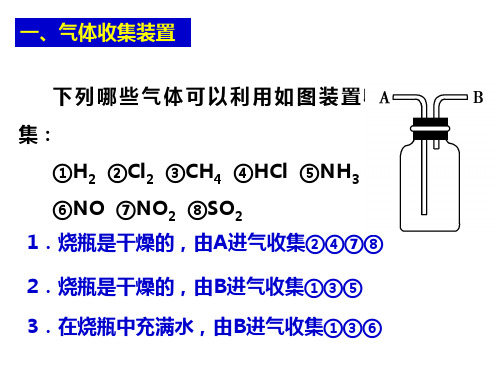
一、气体收集装置 下列哪①H2 ②Cl2 ③CH4 ④HCl ⑤NH3
⑥NO ⑦NO2 ⑧SO2
1.烧瓶是干燥的,由A进气收集②④⑦⑧ 2.烧瓶是干燥的,由B进气收集①③⑤
3.在烧瓶中充满水,由B进气收集①③⑥
二、气体净化装置
三、气体反应装置
四、防倒吸装置
浓氨水
碱石灰
常见物质制法 洗气瓶的一瓶八用

一、中学阶段常见12种气体的工业制法和实验室制法归纳1.氢气(1)工业制法:①水煤气法:(高温条件下还原水蒸气)单质+化合物化合物+单质:C+H2O(g)CO+H2;化合物+化合物化合物+单质:CO+ H2O(g) CO2+H2②氯碱工业的副产物:(电解饱和食盐水)溶液A+B+C :2NaCl+2H2O2NaOH +H2↑+ Cl2↑,(2)实验室制法:①中等以上活泼金属与非氧化性强酸的置换反应:单质+化合物化合物+单质:Zn+H 2SO4=ZnSO4+H2↑②个别金属与强碱溶液的置换反应:单质+化合物化合物+单质:2Al+2NaOH+2H 2O=2NaAlO2+3H2↑,2.乙烯(1)工业制法:石油裂解制乙烯:高碳烷烃低碳烷烃+低碳烯烃:C4H10C2H6+C2H4;C8H18C6H14+C2H4(2)实验室制法:乙醇的消去反应:CH3CH2OH CH2=CH2↑+H2O3.乙炔(1)工业制法:煤干馏得到焦炭,煅烧石灰石得到生石灰,在高温电弧炉中生石灰和焦炭反应生成电石和一氧化碳,电石和饱和食盐水反应生成熟石灰和乙炔。
3C+CaO CaC 2+CO↑;CaC2+2H2O Ca(OH)2+C2H2↑(2)实验室制法:电石水解法:CaC 2+2H2O Ca(OH)2+C2H2↑4.一氧化碳(1)工业制法:①水煤气法:(高温条件下还原水蒸气)单质+化合物化合物+单质:C+H2O(g)CO+H2;②焦炭还原二氧化硅(工业制备粗硅的副产物):2C+SiO2Si+2CO↑③工业制备电石的副产物:3C+CaO CaC2+CO↑;(2)实验室制法:①草酸分解法:H2C2O4 CO↑+CO2↑+H2O ;混合气体通过碱石灰得到一氧化碳。
②甲酸分解法:HCOOH CO↑+H2O5.二氧化碳(1)工业制法:①高温分解,煅烧大理石:CaCO3CaO+CO2↑②玻璃工业副产物:SiO2+Na2CO3Na2SiO3+CO2↑,SiO2+CaCO3CaSiO3+CO2↑③联碱工业小苏打制纯碱的副产物:2NaHCO3Na2CO3+H2O+CO2↑(2)实验室制法:复分解反应:碳酸钙与盐酸的反应:CaCO3+2HCl=CaCl2+H2O+CO2↑6.氨气(1)工业制法化合反应:合成氨工业N2+3H2 2NH3(2)实验室制法①氯化铵和消石灰混合受热制备氨气:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O②浓氨水滴入到生石灰(烧碱或碱石灰)表面快速产生氨气。
细说'洗气瓶'
细说“洗气瓶”的功用这种装置是我们最常见的,经常出现在各类综合试题中,在不同的试题中此装置的作用各不相同。
现总结出来供大家参考:1、收集气体(1)排空气法:收集密度比空气大的气从长管进气,收集密度比空气小的从短管进气,如果收集那些有毒有害的气体时,还要连一个相应尾气处理装置,防止造成空气的污染。
(2)排水法:对于难溶于水的气体收集,先要在瓶中装满水,然后从短管进气,把水排出来,如果用一量筒接液,还可以间接测量出生成气体的体积。
如果在水面的上方用一些植物油液封的话,此装置就可以收集我们常见的气体了,还可以量取出体积。
例1 :某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为马H2C2O4.2H2O)可以制取CO,方程式可写成H2C2O4.2H2O△CO↑+CO2↑+3H2O,该课题小组的同学设计了如图所示的装置并进行了实验。
请回答:(1)为证明分解产物中有水,装置A中的物质应该是 ____________;(2)装置B的作用是____________;(3)实验中采用“压水法”收集CO(装置C);从CO的物理性质考虑,是因为____________;(4)通常情况下CO2能用来灭火,与此相关的化学性质是____________。
解析:(1)无水硫酸铜(2)吸收二氧化碳(3)一氧化碳难溶于水且密度比空气略小(4)二氧化碳不支持燃烧,本身也不能燃烧。
2、储气瓶作为储气瓶可以暂时储存少量的气体,只要通过长管的一端,加入与所存气不相溶的液体,就可以把气体全顺利的挤压出来,通过控制液体的流量可以得到实验所需的平稳的气流。
3、洗气瓶作为洗气瓶,事先瓶中装入一些化学试剂,对不同的实验目的不同,作用也不同,但都要长管进气,短管出气,这样才能达到“洗气”目的。
(1)、检验气体。
例如:在检验二氧化碳气体,二氧化硫气体分别通入澄清石灰水、和品红溶液等。
(2)、吸收气体。
例如: CO(CO2),CO2(H2O),SO2(H2O),CO2(HCl)等除去这些气体中的杂质气体。
孟氏洗气瓶原理
孟氏洗气瓶原理孟氏洗气瓶是一种常用于实验室的装置,它的主要作用是用于吸取气体或溶液中的气体,并将其中的杂质去除,从而得到纯净的气体。
孟氏洗气瓶的原理是利用液体的密度差异,将气体通过液体的过滤,达到去除杂质的目的。
下面我们将详细介绍孟氏洗气瓶的原理、使用方法以及注意事项。
一、孟氏洗气瓶的原理孟氏洗气瓶的原理是利用液体的密度差异,将气体通过液体的过滤,达到去除杂质的目的。
它由上、中、下三部分组成,上部为气体入口,中部为液体滤层,下部为出口,通常用玻璃制成。
当气体进入孟氏洗气瓶时,首先进入的是液体滤层,液体滤层中的液体可以过滤掉气体中的杂质,而气体则通过液体滤层向下流动,最终从出口排出。
由于不同液体的密度不同,因此可以根据需要选择不同的液体作为滤层,从而达到去除不同杂质的目的。
二、孟氏洗气瓶的使用方法1. 清洗:在使用孟氏洗气瓶之前,应该先进行清洗。
将孟氏洗气瓶中的液体倒掉,加入适量的清水,摇晃几次,然后倒掉清水。
2. 加液:在清洗后,将需要的液体加入孟氏洗气瓶中,液体的高度应该略高于液体滤层的高度。
3. 连接:将需要过滤的气体连接到孟氏洗气瓶的入口处。
4. 吸取:打开气体源,使气体进入孟氏洗气瓶中。
5. 排气:当气体通过液体滤层时,会被过滤掉一部分杂质,因此需要排出其中的杂质。
排气的方法是将孟氏洗气瓶倾斜,使气体从出口处排出,同时液体滤层中的液体不要倒出。
6. 关闭:当需要停止吸取气体时,应该关闭气体源,然后将孟氏洗气瓶倾斜,使液体滤层中的液体不会倒出。
三、注意事项1. 液体滤层的选择:不同的液体可以过滤掉不同的杂质,因此在选择液体滤层时应该根据需要选择不同的液体。
例如,如果需要过滤氯气,可以选择浓盐酸作为液体滤层。
2. 液体滤层的高度:液体滤层的高度应该略高于液体表面,以确保气体可以通过液体滤层。
3. 清洗:在使用前和使用后都应该进行清洗,以确保孟氏洗气瓶的清洁和卫生。
4. 操作:在操作时应该注意安全,避免瓶子倾斜或翻倒,以免液体滤层中的液体溅出。
多功能瓶的说明
如何使用多功能瓶
一、洗气(图①)
多功能瓶作为洗气瓶来使用时,气体要从长导管进入,从短导管中出去。
可用来检验气体、干燥气体、吸收或除去气体中的杂质。
●检验气体:如检验二氧化碳,瓶内的试剂是澄清的石灰水。
●干燥气体:如干燥混有水蒸气的O2,瓶内的试剂是浓硫酸(浓硫酸不能干燥NH3)。
●吸收气体或除去气体中的杂质:
A、对于吸收SO2、CO2,可以用NaOH溶液吸收(Ca(OH)2微溶于水,一般不用石灰水)
B、对于除去CO2中的杂质HCl气体,可以用NaHCO3溶液来除去(不用NaOH溶液)。
二、往上排出空气法(图②)
用于收集密度比空气大(即相对分子质量大于29),且不与空气中的成分反应的气体。
长管进,短管出。
比如收集O2、CO2、Cl2、NO2
三、往下排出空气法(图③)
用于收集密度比空气小(即相对分子质量小于29),且不与空气中的成分反应的气体(但CO的密度很接近空气,所以收集CO只能用排水集气法)。
短管进,长管出。
比如收集H2、NH3
四、排水集气法(图④)
用于收集难溶于水,且不与水反应的气体。
短管进,长管出。
比如收集O2、H2、CO、NO
五、排水量气瓶
用于测量集气瓶中所收集到的气体的体积(难溶于水,且不与水反应的气体)。
短管进,长管出。
量筒内水的体积就是集气瓶中气体的体积。
洗气瓶的应用
洗气瓶的应用简介江苏省兴化市安丰初级中学钟支安一种由试剂瓶和带导管的双孔橡皮塞配成的装置(如下图),在初中化学中一般叫做洗气瓶。
在许多的化学实验中都使用到这种装置,现就其常见的用途概括如下。
一、用于实验室制备气体时的收集装置对不溶于水且不与水发生反应的气体,可用排水法收集气体。
先将瓶中装满水,再按“短进长出”的要求进气即可(即从右边导管进气,从左边导管排水)。
对不与空气中物质反应且无毒的气体,可用排空气法收集。
其进气方式按:密度比空气大的气体下口进(即从左管进气);密度比空气小的气体上口进(即从右管进气)的要求进气即可。
二、用于测量气体的体积将瓶中装满水,从B进气,再把从左管排出的水通入到量筒中。
通过测量排出的水的体积,可知道收集到的气体的体积。
三、用于检验气体物质在洗气瓶中放半瓶液体试剂,再按“长进短出”要求进气即可用于检验气体物质。
如:1、盛放澄清石灰水可用于检验气体CO2。
2、盛放Ag NO3溶液可用于检验气体HCl。
3、盛放无色酚酞试液可用于检验NH3。
4、盛放KMnO4溶液可用于检验气体SO2。
四、用于除去气体中的杂质在洗气瓶中放入合适的液体试剂,按“长进短出”要求进气即可用于除去某些气体中的杂质。
注意所选用的试剂只可与杂质反应,或能吸收杂质气体,但不要与原气体发生反应。
如:1、盛放浓硫酸可用于除去氧气、氢气等气体中的水蒸气。
2、盛放NaOH溶液可用于除去CO2、HCl、SO2等酸性气体。
3、盛放水可用于除去空气中的烟尘,或用于观察气体输出速度等。
下面,就其在具体问题中的应用例析如下:例1、水煤气的主要成分是CO和H2,还含有少量的CO2和水蒸汽,利用下图的装置设计实验证明水煤气中含有的CO和H2,则装置的连接顺序为_________________。
(填序号,各洗气瓶图的下方括号中是所用的试剂)(硫酸铜)(氢氧化钠)(氢氧化钙)(氧化铜)(浓硫酸)A B C D E分析:CO和H2无法直接用某种试剂进行检验,应首先通过灼热的CuO将其转变为CO2和H2O,然后用澄清石灰水和无水硫酸铜进行检验。
