新兽用生物制品临床试验审批
卫生部新药(新生物制品)审批工作程序-

卫生部新药(新生物制品)审批工作程序正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 卫生部新药(新生物制品)审批工作程序(1986年9月19日)一、卫生部药品审评委员会办公室(以下简称药审办)在收到卫生厅(局)或生物制品申请单位报部的申请表和有关资料后根据《新药审批办法》、《新生物制品审批办法》开始审核,一般需在30天内完成以下工作:1.如申报资料不全或某些资料不符合要求,药审办可向卫生厅(局)或生物制品申报单位提出意见并要求补报资料。
2.如申报资料不符合规定,药审办除提出意见外,可将资料退初审单位(生物制品退申报单位)。
3.经药审办审核符合规定的申报资料,分别寄送审评委员会有关委员进行审评,同时送药典会1份。
以上所需资料份数由药审办通过卫生厅(局)或生物制品申报单位索取。
二、在药品审评委员会委员审阅新药或新生物制品申报资料期间,药审办应为药品审评委员会的审评做好各项准备工作,对申报资料进行药学和医学的技术审查。
审查中根据需要可与以下单位联系。
1.对申报资料中的某些项目或实验数据需进行复核的,由药审办与检定所商定并由检定所负责完成。
样品的复核工作一般在收验后45天内完成,复核结果送药审办。
2.对申报资料中的某些临床研究或人体观察数据需进行核实的,药审办可向有关临床基地或人体观察单位了解情况,必要时可由临床基地或人体观察单位负责核对实验数据,复核结果送药审办。
3.对新药、新生物制品的名称及质量标准,征求药典会的意见,药典会应配合审查,提出意见。
三、对新药申请临床研究或新生物制品申请人体观察,一般采取请审评委员审阅申报资料提出书面意见的方式进行审评,必要时可召开审评会议。
兽药临床试验研究质量管理规范检查标准(兽用生物制品)(征求意(精)

附件 3机构名称:检查时间:兽药临床试验研究质量管理规范检查标准(兽用生物制品(征求意见稿兽药临床试验机构检查标准(兽用生物制品使用说明:1.本标准根据《兽药临床试验质量管理规范》(以下简称兽药 GCP 制定。
2.兽药临床试验机构检查标准共涉及条款 187条, A 表、 B 表 2部分。
A 表为基本表涉及条款 58条,关键条款(条款号前加“ *” 14条,一般条款 44条; B 表为项目评定标准表涉及条款 129条,关键条款 28条,一般条款 101条。
3.在组织兽药 GCP 验收检查时,须确定相应的检查范围和内容,按照申请项目进行打分。
例如:申请 3个试验项目,需使用 A 表 1份, B 表按照 3个项目分别评定,共3份。
4. 评定方式:评定结果分为“ N ”、“ Y ˉ”和“ Y ” 3档。
凡某项目得分在 75分以上的,判定为符合要求,评定结果标为“ Y ”; 凡某项目得分在 50-75分之间的,判定为基本符合要求,评定结果标为“ Y ˉ”;凡某项目得分在 50分以下的,判定为不符合要求,评定结果标为“ N ”。
对于不涉及的项目, 标为“ -” 。
5. 结果统计 :一般条款中 , 1个“ N ” 折合成 3个“ Y ˉ” , 关键条款的“ N ” 不折合为“ Y ˉ” , 结果按下表统计。
6.A 表评定意见为不符合要求的,不再对申请项目进行评定。
7.结果评定A 表基本表B 表项目评定标准表1A 表 --基本表2 3B 表 --**项目评定标准表4 56789A 表打分表(兽用生物制品10条款序号评定结果 18 19 20 21 22 23 24 25 26 53 54 55 评定原因条款序号评定结果 44 45 46 47 48 49 50 51 52 56 57 58 评定原因 Y 的数量: Y-的数量: N 的数量:检查组成员签名:填写评定意见 **机构具备承担兽药临床试验的基本条件。
兽用生物制品注册申报应注意的事项及建议_王忠田
兽用生物制品注册申报应注意的事项及建议王忠田(中国兽医药品监察所,北京100081)[收稿日期]2014-06-16[文献标识码]A [文章编号]1002-1280(2014)07-0053-05[中图分类号]S851.66[摘要]依据《兽药管理条例》、《兽药注册办法》等法规,结合多年来的评审工作经历,围绕临床试验和生物制品注册申报两个方面,详细总结了国内兽用生物制品注册申报中应注意的有关事项,包括注册法律法规、申报程序和技术要求;同时提出了对兽用生物制品注册需高度重视、认真规范书写材料、多学习文献和保证真实几方面建议,以期为我国兽用生物制品的注册申报提供参考。
[关键词]兽用生物制品;国内注册;注意事项;建议作者简介:王忠田,博士,副研究员,从事兽用生物制品评审与监察。
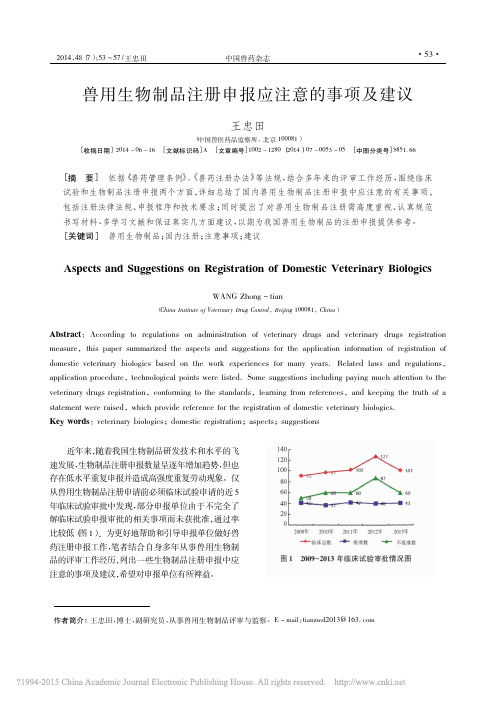
E -mail :tianzwsl2013@163.comAspects and Suggestions on Registration of Domestic Veterinary BiologicsWANG Zhong -tian(China Institute of Veterinary Drug Control ,Beijing 100081,China )Abstract :According to regulations on administration of veterinary drugs and veterinary drugs registration measure ,this paper summarized the aspects and suggestions for the application information of registration of domestic veterinary biologics based on the work experiences for many years.Related laws and regulations ,application procedure ,technological points were listed.Some suggestions including paying much attention to the veterinary drugs registration ,conforming to the standards ,learning from references ,and keeping the truth of a statement were raised ,which provide reference for the registration of domestic veterinary biologics.Key words :veterinary biologics ;domestic registration ;aspects ;suggestions近年来,随着我国生物制品研发技术和水平的飞速发展,生物制品注册申报数量呈逐年增加趋势,但也存在低水平重复申报并造成高强度重复劳动现象。
新生物制品审批办法-

新生物制品审批办法正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 新生物制品审批办法(一九八五年七月一日卫生部发布)第一章总则第一条根据《中华人民共和国药品管理法》第二十一条、第二十二条规定,特制订本办法。
第二条新生物制品系指我国未生产过的制品和未经批准生产的制品。
已批准生产的制品,凡有重大的生产工艺改革或改换用于制备活疫苗、活菌苗的毒种或菌种亦属本办法管理范围。
第三条凡在国内进行新生物制品研究、生产、检定、经营、使用、监督管理的单位和个人都必须遵守本办法。
第二章新生物制品的分类和命名第四条新生物制品按生物制品管理要求分以下几类:第一类:减毒的活菌苗、活疫苗。
第二类;死菌苗、死疫苗、类毒素、抗毒素、抗血清、特异性免疫球蛋白、噬菌体及用于人体内的诊断用品。
第三类:人血液制品及由人和动物血液或组织等加工制成的免疫制品。
第四类:体外试验用的属于血清学和免疫学的诊断用品。
第五条新生物制品应按生物制品统一名称规程有关规定命名。
第三章新生物制品的研究第六条新生物制品研究的内容,包括选种、生产方法和工艺路线、质量标准、人体观察或临床试验。
应对菌毒种的抗原性、免疫原性、毒性、基因的稳定性、生产工艺和生产条件(小量及中间试制),制品的安全性、有效性、稳定性、保存条件以及有关生物学、理化学、免疫学、检定方法和质量标准进行研究,按第四章的要求从小量到大量进行人体观察或临床试验,提出制造及检定规程和使用说明书草案。
第七条研制一、二、三类制品,应将其研究计划报卫生部,并抄送所在省、自治区、直辖市卫生厅(局)及卫生部药品生物制品检定所。
第四章新生物制品的人体观察第八条研制单位申报人体观察前,必须完成该新制品的中间试制,用于人体观察的制品必须是中间试制的产品。
研制新兽药使用一类病原微生物审批规范

附件1农业部行政审批服务保障标准体系(第二批)目录1. 研制新兽药使用一类病原微生物审批规范2. 新兽用生物制品临床试验审批规范3. 新兽药注册规范4. 进口兽药注册(兽药注册)规范5. 进口兽药再注册(兽药再注册)规范6. 兽药变更注册规范7. 兽医微生物菌(毒、虫)种进出口和使用审批规范8. 兽药进口(通关单)审批规范9. 兽药(兽用生物制品)进口审批规范10.兽药生产许可证核发规范11.兽药产品批准文号核发及标签、说明书审批规范12.从事高致病性或疑似高致病性病原微生物实验活动审批规范13.跨省、自治区、直辖市运输或运往国外高致病性病原微生物菌(毒)种或者样本审批规范14.高致病性病原微生物实验活动资格认定规范NY/XZSP BZ 209.1-2014 研制新兽药使用一类病原微生物审批规范1 适用范围本标准规定了农业部负责的研制新兽药使用一类病原微生物审批的审批依据、审批程序、审查内容、办理时限、结果公开等内容。
本标准适用于研制新兽药使用一类病原微生物审批项目。
2 审批依据2.1 《中华人民共和国行政许可法》。
2.2 《兽药管理条例》。
2.3《病原微生物实验室生物安全管理条例》。
2.4《新兽药研制管理办法》。
2.5《动物病原微生物菌(毒)种保藏管理办法》。
2.6《高致病性动物病原微生物实验室生物安全管理审批办法》。
3 审批程序、审查内容和办理时限3.1农业部行政审批办公大厅兽医窗口受理。
3.1.1审查内容a) 申请内容是否属于受理范畴;b)申请材料是否齐全、有效;c)申请表填写是否准确、完整。
3.1.2 办理程序3.1.2.1 农业部行政审批办公大厅兽医窗口对申请材料进行受理审查,并做出是否受理决定。
3.1.2.2 审查合格的,向申请人出具受理通知书,同时将申请材料和办理通知书送农业部兽医局;审查不合格的,向申请人出具不予受理通知书,并详细说明理由。
3.1.3 办理时限2个工作日。
3.2 农业部兽医局审查报签及批件制作。
新生物制品审批办法

2
变的生物技术产品以及需试产期考核的改变给药途径的产品核发试生产文号。 第十八条 国药试字新生物制品试生产期二年。试生产期满3个月前,生产单位填写申请表(附
件十四),提交规定的有关申报资料(附件二),报国家药品监督管理局审批;审批期间,其试生产 批准文号仍然有效。如有特殊情况,确需延长试生产期者,经批准可延长试生产期。批准转正式生 产的产品,发给新的批准文号为“国药准字S××××××××”, 逾期未提出转正式生产申请或试产期满未批准转正式生产的产品原批准文号取消。
附件:
一、新生物制品临床研究申请表 二、新生物制品申报资料项目
(一)治疗用新生物制品申报资料项目 (二)预防用新生物制品申报资料项目 (三)体外诊断用品申报资料项目 三、人用重组DNA制品质量控制要点 四、人用鼠源性单克隆抗体质量控制要点 五、传代细胞系生产生物制品规程
3
六、预防用新生物制品临床研究的技术要求 七、预防用新生物制品临床研究程序 八、人的体细胞治疗申报临床试验指导原则 九、人基因治疗申报临床试验指导原则 十、放射免疫分析药盒申报资料项目及要求 十一、用于检测病原体的体外核酸扩增(PCR)诊断试剂盒的申报、审评暂行办法 十二、体外生物诊断试剂报批批量最低要求 十三、新生物制品证书生产申请表 十四、新生物制品转正式生产申请表 十五、新生物制品试行规程转正申请表 十六、新生物制品试行规程转正的具体要求
2.已在我国批准进口注册的生物制品。 3.改变剂型或给药途径的生物制品。 第五类:增加适应症的生物制品。
第三章 新生物制品研制的要求
第八条 新生物制品研制内容,包括生产用菌毒种、细胞株、生物组织、生产工艺和产品质量 标准、检定方法、保存条件、稳定性以及与制品安全性、有效性有关的免疫学、药理学、毒理学、 药代动力学等临床前的研究工作和临床研究。并根据研究结果提出制造检定规程和产品使用说明书 (草案)。
446号令农业部行政审批综合办公办事指南.
附件 :农业部行政审批综合办公办事指南 (兽药行政许可部分1. 研制新兽药使用一类病原微生物审批2. 兽用新生物制品临床试验审批3. 兽药生产许可证审批4. 兽药产品批准文号核发5. 新兽药注册6. 进口兽药注册(兽药注册7. 进口兽药再注册(兽药再注册8. 兽药变更注册9. 兽药进口许可证审批10. 兽药安全性评价单位资格认定11. 兽药广告审查12. 兽医微生物菌(毒、虫种认定项目名称:研制新兽药使用一类病原微生物审批项目类型:前审后批审批内容:研制单位基本情况及生物安全防范基本条件法律依据:1. 《兽药管理条例》2. 《病原微生物实验室生物安全管理条例》3. 《兽医微生物菌种保藏管理试行办法》 ([80]农业 [牧 ]字第 181号办事条件:1. 《研制新兽药使用一类病原微生物申请表》一式两份2. 申请报告 (内容包括申请单位基本情况及生物安全防范基本条件3. 农业部核发的《高致病性动物病原微生物实验室资格证书》 (复印件办理程序:1. 材料受理。
农业部行政审批综合办公室受理省级兽医行政管理部门递交的《研制新兽药使用一类病原微生物申请表》及其相关材料,并进行初审。
2. 项目审查。
农业部兽医局根据国家有关规定对申请材料进行审查。
3. 办理批件。
农业部兽医局根据审查意见提出审批方案,报经部长审批后办理批件。
承诺时限:20个工作日收费标准:不收费项目名称:兽用新生物制品临床试验审批项目类型:前审后批审批内容:1. 研制单位基本情况及生物安全防范基本条件2. 下一步研制方案法律依据:1. 《兽药管理条例》2. 《病原微生物实验室生物安全管理条例》3. 《兽医微生物菌种保藏管理试行办法》 ([80]农业 [牧 ]字第 181号办事条件:1. 《兽用新生物制品临床试验申请表》一式两份 2. 申请报告 (内容包括研制单位基本情况及生物安全防范基本条件; 菌 [毒、虫]种名称、来源和特性 3. 中试产品生产工艺、质量标准(草案、中间试制研究总结报告及检验报告4. 临床试验方案5. 实验室阶段安全性评价报告及其他临床前研究资料6. 中间试制单位《兽药 GMP 证书》和《兽药生产许可证》 (均为复印件7. 使用一类病原微生物的, 应提交国务院兽医行政管理部门的批准文件(复印件办理程序:1. 材料受理。
新生物制品审批办法补充规定
新生物制品审批办法补充规定【发布部门】卫生部(已撤销)【公布日期】1988.11.15【实施日期】1988.11.15【时效性】现行有效【效力级别】部门规章新生物制品审批办法补充规定(1988年11月15日卫生部)根据《药品管理法》和《新生物制品审批办法》实施的经验,现作如下补充规定:第一条新生物制品与新药品难以区分者按以下办法处理。
原则上按其用途,用作免疫预防者属生物制品;用作临床治疗者属药品;但该产品的生产工艺,质量控制标准及其检测方法接近生物制品者,虽属治疗用品仍按新生物制品审批程序申报,申报时需参考《新药审批办法》中有关技术要求。
在申请临床研究时所报资料除符合《新生物制品审批办法》要求外,尚需根据不同制品增加必要的新药申请临床研究的资料,并需在卫生部指定的临床基地或卫生部认可的单位进行临床研究,完成临床研究后需同时请西药分委员会的有关临床专家审评。
第二条关于基因工程产品:在未成立基因工程专门委员会之前,属于预防用疫苗、菌苗类基因工程制品,归生物制品分委员会审评;属于临床治疗用的激素、抗生素等类基因工程药品归西药审评分委员会审评。
根据审评技术需要邀请有关专家参予审评,划分不明确的制品可参考补充规定第一条。
第三条同一生物制品,不同单位申请审评或生产时,按以下不同情况办理:新生物制品审批办法十五条二十条药品管理法第四条对《新生物制品审批办法》中有些规定不明确部分,作如下解释:新生物制品审批办法二条新生物制品审批办法十五二十条(1)具备《药品管理法》第二章所规定的条件;(2)新生物制品证书付本及技术转让的合同书;(3)接受技术转让后扩大试生产的技术总结及连续生产的三批中间试制产品制检记录和样品,经检定所检定或认可。
新生物制品审批办法十一条(1)进行人体观察的特殊申请报告(包括研究的进展,申请目的,进行人体观察依据,国内外情况);(2)新生物制品的菌毒种或小试制品的抗原性、免疫原性、毒性、安全性、有效性,初步制备方法和初步稳定性等实验室资料及动物实验研究数据;(3)准备进行人体观察的该制品全部原始制造及检定记录;(4)拟进行人体观察的实施方案;(5)填写新生物制品人体观察申请表。
新生物制品审批办法
新生物制品审批办法第一章总则第一条根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施办法》的规定,为加强新生物制品研制和审批的管理,特制定本办法。
第二条生物制品是应用普通的或以基因工程、细胞工程、蛋白质工程、发酵工程等生物技术获得的微生物、细胞及各种动物和人源的组织和液体等生物材料制备,用于人类疾病预防、治疗和诊断的药品。
第三条新生物制品系指我国未批准上市的生物制品;已批准上市的生物制品,当改换制备疫苗和生物技术产品的菌毒种、细胞株及其他重大生产工艺改革对制品的安全性、有效性可能有显著影响时按新生物制品审批。
第四条新生物制品审批实行国家一级审批制度。
第五条凡在中华人民共和国境内进行新生物制品研究、生产、经营、使用、检定、审批、监督管理的单位和个人,都必须遵守本办法。
第二章新生物制品命名及分类第六条新生物制品的命名应遵照《中国生物制品规程》和药品命名原则的有关规定命名。
第七条新生物制品分为五类:第一类:国内外尚未批准上市的生物制品。
第二类:国外已批准上市,尚未列入药典或规程,我国也未进口的生物制品。
第三类:1.疗效以生物制品为主的新复方制剂。
2.工艺重大改革后的生物制品。
第四类:1.国外药典或规程已收载的生物制品。
2.已在我国批准进口注册的生物制品。
3.改变剂型或给药途径的生物制品。
第五类:增加适应症的生物制品。
第三章新生物制品研制的要求第八条新生物制品研制内容,包括生产用菌毒种、细胞株、生物组织、生产工艺和产品质量标准、检定方法、保存条件、稳定性以及与制品安全性、有效性有关的免疫学、药理学、毒理学、药代动力学等临床前的研究工作和临床研究。
,并根据研究结果提出制造检定规程和产品使用说明书(草案)。
第九条新生物制品研制和生产要分别符合我国《药品非临床研究质量管理规范》(GLP)、《药品生产质量管理规范》(GMP)的有关规定。
第十条新生物制品研制过程一般分为以下几个阶段,各阶段的要求如下。
新兽药注册评审程序及兽用生物制品生产与检验用菌(毒、虫)种研究资料技术要求
10只
取适宜组织接种
5 取适宜组织接种
5只分离鉴定
三、 生产与检验用菌(毒、虫)种的研究资料
毒力返强试验一般要求 试验设计: 试验动物品种、日龄、数量、接种时间、途径、接 种量、传代方法、观察内容和时间、微生物分离鉴定方法、传代 后毒力返强程度的评价标准 试验动物: SPF级或健康易感动物,试验动物日龄应对被检微 生物最易感,动物数量2∼5头(只),在正式试验前应测定菌毒 种对动物的敏感性 传代方法: 适宜的时间采集含菌(毒、虫)量最高的组织、分 泌物或排泄物,对于容易水平传播的可以利用接触传播的方式进 行传代
三、 生产与检验用菌(毒、虫)种的研究资料
生产用菌(毒、虫)种种子批
2 基础种子批鉴定项目 毒力返强试验: 评估疫苗基础种子经靶动物连续传代后的毒力 或遗传稳定性,以确保疫苗接种动物后不会导致毒力增强。 主要针对活苗,包括人工制弱、自然弱毒
毒力返强试验
基础种毒 最低代次 接种易感动物 1 取适宜组织接种 2 取适宜组织接种 3 取适宜组织接种 4 5只分离鉴定 5只分离鉴定 5只分离鉴定 观察21天。与第1 代临床症状、病理 变化、基因型鉴定、 遗传稳定性 5只分离鉴定 5只分离鉴定
三、 生产与检验用菌(毒、虫)种的研究资料
动物病原微生物分类名录 一类动物病原微生物: 口蹄疫病毒、高致病性禽流感病毒、 猪水泡病病毒、非洲猪瘟病毒、非洲马温病毒、牛瘟病毒、 小反刍兽疫病毒、牛传染性胸膜肺炎丝状支原体、牛海绵状 脑病病原、痒病病原 二类动物病原微生物:猪瘟病毒、鸡新城疫病毒、狂犬病 病毒、绵羊痘/山羊痘病毒、蓝舌病病毒、兔病毒性出血症病 毒、炭疽芽孢杆菌、布氏杆菌
猪圆环病毒2型
猪细小病毒
单苗,灭活
单苗,灭活
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
XXXXXX
联系人
XXX
联系电话
136XXXXXXXX
试制批数
5批
批号
XXXXX、XXXXX、XXXXX、XXXXX、XXXXX
每批数量
100瓶/批
4.临床试验实施地点、时间
临床试验承担单位:
养殖场1:
地址1:
养殖场2:
地址2:
5.申报单位与拟实施临床试验单位协议书原件(可Biblioteka 附)见申报资料XX-XX页
2.本表1~5栏由申请单位填写。
3.本表签章复印件无效。
1.新兽药名称
XXX病灭活疫苗
2.申请单位
名称
XXXX生物技术有限公司
地址
XXX省XXX市XXX路XX号
邮编
XXXXXX
联系人
XXX
联系电话
136XXXXXXXX
3.中间试制单位
名称
XXXXXX生物技术有限公司
地址
XXX省XXX市XXX路XX号
6.备注
无
流水号:
新兽用生物制品临床试验申请表
(示范文本)
申请单位(盖章):XXXX生物技术有限公司
兽 药 名 称:XXX病灭活疫苗
申 请 日 期:XXXX年XX月XX日
中华人民共和国农业农村部制
填表说明
1.本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。一份表格仅限于一种制品,不同制品需另行填写。字迹不清、项目填写不全者,不予受理。
