各种化学试剂标准溶液的配制
(完整版)试验室常用溶液及试剂配制试验室常用溶液试剂的配制表一普通酸
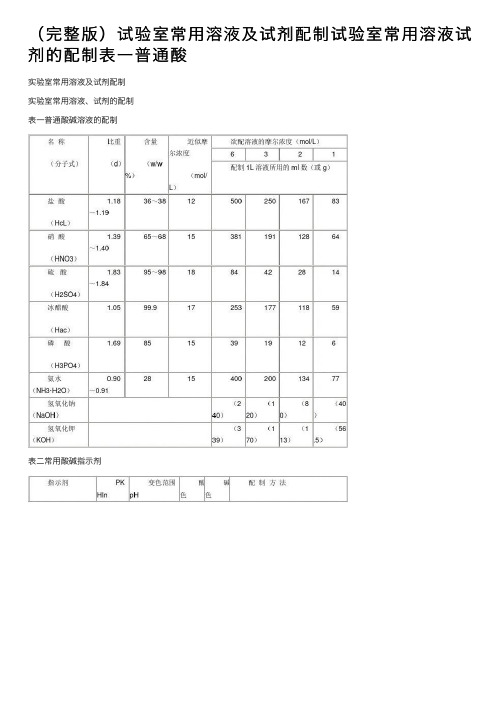
(完整版)试验室常⽤溶液及试剂配制试验室常⽤溶液试剂的配制表⼀普通酸实验室常⽤溶液及试剂配制实验室常⽤溶液、试剂的配制表⼀普通酸碱溶液的配制表⼆常⽤酸碱指⽰剂表三混合酸碱指⽰剂表四容量分析基准物质的⼲燥表五缓冲溶液的配制1、氯化钾-盐酸缓冲溶液2、邻苯⼆甲酸氢钾-氢氧化钾缓冲溶液3、邻苯⼆甲酸氢钾-氢氧化钾缓冲溶液4、⼄酸-⼄酸钠缓冲溶液5、磷酸⼆氢钾-氢氧化钠缓冲溶液6、硼砂-氢氧化钠缓冲溶液7、氨⽔-氯化铵缓冲溶液8、常⽤缓冲溶液的配制实验室常⽤试验⽅法2九、柠檬酸(C6H8O7·H2O)称取试样1.5g(精确到0.0002g)于三⾓瓶内,加⼊⽔50ml溶解,加酚酞指⽰剂3滴,⽤1mol/L 氢氧化钠标准溶液滴定⾄粉红⾊为终点,同时做空⽩试验。
计算:X%(⼀⽔)= (V1-V0)×C×0.06404 m×(1-0.08566)×100X%(⽆⽔)= (V1-V0)×C×0.06404 m×100V1-----消耗氢氧化钠标准溶液的体积,ml;V0-----空⽩所消耗氢氧化钠标准溶液的体积,ml;C------氢氧化钠标准溶液浓度,mol/L;m---样品质量。
⼗、钙含量测定(磷酸氢钙CaHPO4、磷酸⼆氢钙Ca(H2PO4)2·H2O、钙粉等)称取2g(精确到0.0002g)样品,⽤10ml盐酸(1+1)溶解,转移⾄100ml容量瓶中定溶,⽤移液管吸取10ml于250ml锥形瓶中,加50ml⽔,5ml蔗糖溶液(25g/L),2ml三⼄酸胺(1+1),1ml⼄⼆胺(1+1),1滴孔雀绿指⽰液(1g/L),滴加氢氧化钾溶液(200g/L)⾄⽆⾊,再过量10ml,加0.1g盐酸羟胺(每加⼀种试剂都要摇匀),加钙黄绿素少许,在⿊⾊背景下⽤0.05mol/L的EDTA标准溶液滴定⾄绿⾊荧光消失呈现紫红⾊为滴定终点。
化学试剂配制方法

电厂化学试剂配制1、硬度:一种测定硬度大于0.5me/L的水样;二种测定硬度在1-0.5ue/L的水样。
⑴、氨-氯化铵缓冲溶液:称取20g氯化铵溶于500高纯水中,加150ml浓氨水,用高纯水稀释至1000ml混匀;取50ml按第二方法测定其硬度,根据测定结果往其余950ml缓冲溶液加所需EDTA溶液抵消其硬度。
⑵、(高硬度)氨-氯化铵缓冲溶液:称取67.5克氯化铵,加570ml浓氨水,加1gEDTA用高纯水稀释至1000ml混匀;⑶、硼砂缓冲溶液:称取40g硼砂溶于80ml高纯水中,加入10g氢氧化钠,溶解后用高纯水稀释至1000ml,按上述方法抵消硬度。
⑷、0.5﹪铬黑T指示剂(乙醇溶液):称取0.5g铬黑T 与4.5g盐酸羟胺在研钵中磨匀,混合后溶于100ml95﹪乙醇中,转入棕色瓶中。
使用期限不超过1个月。
⑸、酸性铬蓝K指示剂(乙醇溶液):称取0.5g酸性铬蓝K与4.5盐酸羟胺混合,加10ml氨-氯化铵缓冲溶液(硼砂也可)和40ml高纯水,溶解后用95﹪乙醇稀释至100ml. 使用期限不超过1个月。
2、磷酸盐:⑴、磷酸盐储备液(1ml=1mgPO4),称取在105℃干燥过的优级纯磷酸二氢钾1.433g溶于少量除盐水中,并稀释至1000ml。
⑵、磷酸工作溶液:(1ml=0.1mgPO4),取上述储备液10ml稀释至100ml⑶、钼酸铵-偏钒酸铵-硫酸显色液(酸性钼酸铵):(A)称取50g钼酸铵和2.5g偏钒酸铵,溶于400ml除盐水中;(B)取195ml浓硫酸,在不断搅拌下徐徐加入到250ml除盐水中,并冷却至室温。
将(B)配置的溶液倒入(A)配置的溶液中,用除盐水稀释至1000ml。
3、二氧化硅:⑴、酸性钼酸铵溶液:A.称取50g钼酸铵溶于500ml高纯水中;B.取42ml浓硫酸,在不断搅拌下加入到300ml高纯水中,并冷却至室温。
C.将A加入到B中,然后用高纯水稀释至1000ml。
⑵、10﹪酒石酸溶液(质量/体积)⑶、1、2、4酸还原剂:A.称取1.5g1、2、4酸和无水亚硫酸钠溶于200ml高纯水中B. 称取90g 亚硫酸氢钠,溶于600ml高纯水中。
水质分析常用化学试剂配制方法

水质分析常用化学试剂配制方法1. 重铬酸钾标准溶液【C(1/6K2Cr2O7)=0.2500mol/L】:称取预先在120℃烘干2h的重铬酸钾12.258g溶解于纯水中,并定容到1000mL。
2. 试亚铁灵指示溶液:称取1.485g邻菲啰啉,0.695g硫酸亚铁溶解于纯水中,并稀释到100mL,储存于棕色瓶中。
3. 硫酸亚铁铵标准溶液(约为0.05mol/L):称取19.75g硫酸亚铁铵溶解于纯水中,边搅拌边加入20mL浓硫酸,冷却后定容到1000mL。
(不用时应于冰箱中保存,防止标定后的浓度变化)。
或称取39.5g 硫酸亚铁铵溶解于纯水中,边搅拌边加入40mL浓硫酸,冷却后定容到2000mL。
4. 1%硫酸-硫酸银溶液:在500mL浓硫酸(比重1.84)中加入5g硫酸银。
5. 1mol/L的盐酸溶液:用11体积的纯水稀释1体积的浓盐酸(密度1.19g/mL)即可。
取83mL的浓盐酸稀释到1000mL。
详细方法:在500mL的烧杯中加入约400mL蒸馏水,徐徐加入83mL(50+20+10+3)浓盐酸,用玻璃棒搅拌均匀后,转入1000mL容量瓶中,用蒸馏水冲洗烧杯至少三次,冲洗水转入容量瓶中,定容至1000mL即可。
6. 1mol/L的氢氧化钠溶液:将40g氢氧化钠溶于500mL水中,冷至室温,稀释至1000ml,盛放在聚乙烯瓶中。
7. 10%(m/V)抗坏血酸溶液:按上述方法溶解10g抗坏血酸于蒸馏水中,并稀释至100mL。
该溶液贮存在棕色玻璃细口瓶内,在4℃冰箱内保存,可稳定几周。
如颜色变黄,则重新配制。
8. (1+1)硫酸:取500mL烧杯一只,用量筒量取150mL蒸馏水加入到烧杯中,然后用量筒量取150mL 浓硫酸,多余的可以用玻璃棒蘸出至水槽中。
用玻璃棒将150mL浓硫酸缓缓加入到150mL蒸馏水中,加完后,用玻璃棒缓慢搅拌使之混合均匀,冷却至室温待用。
9. 1+9盐酸:在9份体积的蒸馏水中,徐徐加入浓盐酸(d=1.198g/mL)1份。
草酸钠标准溶液的配制

草酸钠标准溶液的配制
草酸钠标准溶液是化学实验室常用的一种溶液,用于酸碱滴定分析和标定。
正确的配制草酸钠标准溶液对于实验结果的准确性至关重要。
下面将介绍草酸钠标准溶液的配制方法及注意事项。
首先,准备所需试剂和设备:
草酸钠固体。
蒸馏水。
电子天平。
烧杯。
磁力搅拌器。
称量瓶。
pH计。
其次,按照以下步骤进行草酸钠标准溶液的配制:
1. 使用电子天平称量出所需的草酸钠固体,精确到0.01克。
2. 将称量好的草酸钠固体放入烧杯中。
3. 加入适量的蒸馏水,溶解草酸钠固体,使用磁力搅拌器进行搅拌,直至草酸钠充分溶解。
4. 将溶解好的草酸钠溶液转移至称量瓶中,并用蒸馏水稀释至刻度线。
5. 用pH计检测草酸钠标准溶液的pH值,确保其在理想范围内。
在配制草酸钠标准溶液时,需要注意以下几点:
草酸钠固体的称量要准确,避免因误差导致标准溶液浓度不准确。
溶解草酸钠固体时,应充分搅拌,确保溶解彻底。
稀释草酸钠溶液时,应使用准确的称量瓶,并注意控制稀释的比例。
配制完成后,应使用pH计检测草酸钠标准溶液的pH值,确保其符合实验要求。
总之,正确的草酸钠标准溶液配制方法及注意事项对于化学实验的准确性和可靠性至关重要。
在配制过程中,需要严格控制每个步骤,确保草酸钠标准溶液的浓度和pH值符合实验要求。
希望以上内容能够帮助您正确配制草酸钠标准溶液,提高实验的准确性和可靠性。
各种化学试剂标准溶液的配制

常用试剂的配制一、标准溶液的配制1、硫酸H2SO4溶液的配制:1000mL浓度c1/2H2SO4=L,即cH2SO4=L的硫酸溶液的配制:取3mL左右的浓硫酸缓缓注入1000mL水中,冷却,摇匀;新配制的硫酸需要标定,其标定方法如下:称取于270-300 ℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色;同时做空白试验取50mL水,加10滴溴甲酚绿-甲基红指示液,同样用硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色;计算公式为:式中:m:无水碳酸钠的质量,g;V1:滴定时所用的硫酸的体积,mL;V2:空白滴定时所用的硫酸的体积,mL;M:无水硫酸钠的相对分子质量,g/mol,M1/2Na2CO3=;测定氨氮时,氨氮含量的计算:氨氮:氨氮含量,mg/L;V1:滴定水样时所用的硫酸的体积,mL;V2:空白滴定时所用的硫酸的体积,mL;M:硫酸溶液的浓度,mol/L;V:水样的体积, mL;2、重铬酸钾K2Cr2O7溶液的配制1000mL浓度c1/6K2Cr2O7=L,即cK2Cr2O7= mol/L的重铬酸钾溶液的配制:称取于120 ℃下干燥2h的重铬酸钾溶于水中,并移入容量瓶中,定容至1000mL,摇匀,备用;3、硫酸亚铁铵标准溶液的配制:1000mL mol/L硫酸亚铁铵标准溶液的配制:称取39.5g硫酸亚铁铵溶于水中,边搅拌边缓慢加入20mL浓硫酸,冷却后移入1000 mL容量瓶中,加水稀释至刻度线,摇匀;临用前,需用重铬酸钾标准溶液进行标定;标定方法如下:准确吸取 mL重铬酸钾标准溶液于锥形瓶中,加入100 mL水,缓慢加入30 mL浓硫酸,混匀;冷却后,加入3滴试亚铁灵指示剂,用硫酸亚铁铵溶液进行滴定,溶液的颜色由黄色经蓝绿色编为红褐色即为终点;硫酸亚铁铵浓度的计算公式如下:c:硫酸亚铁铵的浓度,mol/L;V:硫酸亚铁铵滴定时用的量,mL;在测定COD时,COD的计算公式为:式中:COD:COD的含量,mg/L;c:硫酸亚铁铵的浓度,mol/L;V:滴定空白时硫酸亚铁铵标准溶液的用量,mL;:滴定水样时硫酸亚铁铵标准溶液的用量,mL;V1V:水样的体积, mL;二、指示剂的配制1、试亚铁灵指示剂称取邻菲罗啉,硫酸亚铁溶于水中,热水浴中加热使之溶解,稀释至100mL,保存于棕色试剂瓶中;2、甲基红-亚甲基蓝混合指示剂称取0.1g亚甲基蓝,溶于95%乙醇,用95%乙醇稀释至100mL;然后称取0.1g甲基红,溶于95%乙醇,用95%乙醇稀释至100mL;分别取50mL亚甲基蓝和100mL甲基红溶液混匀即可;3、溴甲酚绿-甲基红指示剂称取0.1g溴甲酚绿,溶于95%乙醇,用95%乙醇稀释至100mL;称取0.2g甲基红,溶于95%乙醇,用95%乙醇稀释至100mL;分别取30mL溴甲酚绿,10mL甲基红溶液,混匀即可;。
化学试剂标准滴定溶液的制备

化学试剂标准滴定溶液的制备GB/601-2016目录1、范围 (3)2、规范性引用文件 (3)3、一般规定 (3)4、标准滴定溶液的配制与标定 (5)4.1氢氧化钠标准滴定溶液 (6)4.2盐酸标准滴定溶液 (7)4.3硫酸标准滴定溶液 (8)4.4碳酸钠标准滴定溶液 (9)4.5重铬酸钾标准滴定溶液[c(1/6K2C r2O7 ) =0.1 mol/L ] (9)4.6硫代硫酸钠标准滴定溶液[c (Na2S2O3) =0.1 mol/L] (9)4.7溴标准滴定溶液[c(1/2Br2)=0.1mol/L ] (10)4.8溴酸钾标准滴定溶液[c(1/6KBrO3)=0.1mol/L ] (11)4.9碘标准滴定溶液[c(1/2I2)=0.1mol/L] (12)4.10碘酸钾标准滴定溶液 (12)4.11草酸(或草酸钠)标准滴定溶液[ c(1/2H2C2O4)=0.1 mol/L或c(1/2Na2c2o4=0.1mol/L ] (13)4.12高锰酸钾标准滴定溶液[c(1/5KMnO4)=0.1mol/L ] (14)4.13硫酸铁(II)铵标准滴定溶液 (15)4.14硫酸铈(或硫酸铈铵)标准滴定溶液{ c〔Ce(SO4)2〕=0.1mol/L或c [2(NH4)2SO4·Ce(SO4)2 ]=0.1mol/L }………………………..16.4.15乙二胺四乙酸二钠标准滴定溶液 (17)4.16氧化锌标准滴定溶液 (17)4.17氧化镁(或硫酸镁)标准滴定溶液[c(MgCl2)=0.1mol/L或c(MgSO4)=0.1mol/L] (17)4.18硝酸铅标准滴定溶液{c[Pb(NO3)2]=0.05mol/L} (18)4.19氧化钠标准滴定溶液[c(NaCl)=0.1mol/L] (19)4.20硫氰酸钠(或硫氰酸钾、硫氰酸铵)标准滴定溶液[c(NaSCN)=0.1mol/L,c(KSCN)=0.1mol/L,c(NH4SCN)=0.1mol/L] (19)4.21硝酸银标准滴定溶液[c(AgNO3)=0.1 mol/L] (20)4.22硝酸汞标准滴定溶液 (22)4.23亚硝酸钠标准滴定溶液 (23)4.24高氯酸标准滴定溶液[c(HClO4)=0.1mol/L ] (23)4.25氢氧化钾—乙醇标准滴定溶液[c( KOH )=0.1 mol/L ] (24)4.26盐酸—乙醇标准滴定溶液[c(HCL)=0.5mol/L] (24)4.27硫酸铁(III)铵标准滴定溶液{c [NH4Fe(SO4)2 ]=0.1mol/L } (24)附录A(规范性附录)不同温度下标准滴定溶液体积的补正值 (25)附录B(规范性附录)滴定管容量测定方法 (27)附录C(资料性附录)部分标准滴定溶液的比较法 (28)附录D(资料性附录)标准滴定溶液浓度的扩展不确定度评定 (31)附录E(资料性附录)含汞废液的处理方法 (36)附录F(资料性附录)玻璃量器容量的扩展不确定度评定 (37)1、范围本标准规定了化学试剂标准滴定溶液的配制和标定方法。
化学试剂配制-常用标准溶液的配制

常用标准溶液的配制1、常用标准滴定溶液的制备氢氧化钠标准溶液的配制(1)配制浓度为c(NaOH)=1mol/L、c(NaOH)=0.5mol/L、c(NaOH)=0.1mol/L的氢氧化钠标准滴定溶液:称取100g氢氧化钠,溶于100mL水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮,用塑料管虹吸下述规定体积的上层清液,注入1000mL无二氧化碳的水中,摇匀。
c(NaOH)(mol/L)氢氧化钠饱和溶液(mL)1 520.5 260.1 5(2)标定:称取下述规定量的于105~110℃烘至恒重的基准邻苯二甲酸氢钾,称准至0.0001g,溶于下述规定体积的无二氧化碳的水中,加2滴酚酞指示剂,用配制好的氢氧化钠溶液滴定至溶液呈粉红色,同时做空白实验。
c(NaOH) 邻苯二甲酸氢钾无二氧化碳的水1 6 800.5 3 800.1 0.6 50(3)计算:氢氧化钠标准溶液的浓度按下式计算:c(NaOH)=m/(V1-V0)×0.2042式中:c(NaOH)--氢氧化钠标准溶液之物质的量浓度m--邻苯二甲酸氢钾的质量V1--氢氧化钠溶液的用量V0--空白试验氢氧化钠溶液的用量0.2042--与1.00mL氢氧化钠标准溶液相当的以克表示的邻苯二甲酸氢钾的质量。
(4)比较法:量取30.00~35.00mL下述规定浓度的盐酸标准溶液,加50mL无二氧化碳的水及2滴酚酞指示剂,用配制好的氢氧化钠溶液滴定,近终点时加热至80℃,继续滴定至溶液呈粉红色。
c(NaOH) c(HCL)1 10.5 0.50.1 0.1氢氧化钠标准溶液的浓度按下式计算:c(NaOH)=V1c1/V式中:V1--盐酸标准溶液的用量c1--盐酸浓度V--氢氧化钠溶液的用量。
HCL标准溶液的配制(1)配制浓度为c(HCL)=1、0.5、0.1mol/L的盐酸标准滴定溶液:量取下述规定体积的盐酸,注入1000mL水中,摇匀。
c(HCL)/(mol/L)盐酸/mL1 900.5 450.1 9(2)标定:称取下述规定量的于270~300℃灼烧至恒重的基准无水碳酸钠,称准至0.0001g,溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示剂,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。
国标化学试剂标准溶液的配制

国标化学试剂标准溶液的配制国标化学试剂标准溶液的配制是化学实验中非常重要的一项工作。
通过配制标准溶液,可以确保实验结果的准确性和可重复性。
下面将介绍一下国标化学试剂标准溶液的配制方法。
首先,我们需要准备好所需的试剂和仪器设备。
通常情况下,配制标准溶液需要使用精确称量的试剂和精密的容量瓶、移液管等仪器设备。
在开始配制之前,我们需要确保试剂和仪器设备的干净和无污染。
其次,我们需要确定所需配制的标准溶液的浓度和体积。
根据实验需求,我们可以选择不同浓度和体积的标准溶液进行配制。
在确定浓度和体积之后,我们就可以开始具体的配制过程了。
第三步是精确称量试剂。
根据所需配制标准溶液的浓度和体积,我们需要精确称取相应的试剂。
在称取试剂时,应该注意使用干净的称量纸,并且避免直接用手触摸试剂,以免造成污染。
第四步是将试剂溶解于适量的溶剂中。
在将试剂溶解于溶剂中时,应该充分搅拌以保证试剂充分溶解。
同时,需要注意控制溶剂的温度,以免影响试剂的溶解度。
第五步是将溶液转移至容量瓶中。
在转移溶液时,应该使用精密的移液管,并且注意避免溶液的飞溅和挥发。
转移时应该尽量避免空气进入容量瓶内,以免影响标准溶液的浓度。
第六步是用溶剂补足至刻度线。
在转移完溶液后,我们需要用适量的溶剂补足至容量瓶刻度线。
补足溶剂时应该小心操作,避免过量或不足。
最后一步是充分混合溶液。
在补足完溶剂后,我们需要充分混合溶液,以确保标准溶液的均匀性。
混合时可以轻轻摇晃容量瓶或使用磁力搅拌器等设备。
完成上述步骤后,我们就成功配制出了国标化学试剂标准溶液。
在实验中使用标准溶液时,我们需要注意保持实验环境的洁净和无尘,并且避免与其他试剂发生反应。
总之,国标化学试剂标准溶液的配制是一项需要严格操作和精确控制的工作。
通过正确配制标准溶液,我们可以获得准确可靠的实验结果,并且为后续实验工作奠定基础。
希望以上内容对大家有所帮助!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各种化学试剂标准溶液的
配制
Final revision by standardization team on December 10, 2020.
常用试剂的配制一、标准溶液的配制
1、硫酸(H
2SO
4
)溶液的配制:
1000mL浓度c(1/2H
2SO
4
)=L,即c(H
2
SO
4
)=L的硫酸溶液的配制:
取3mL左右的浓硫酸缓缓注入1000mL水中,冷却,摇匀。
新配制的硫酸需要标定,其标定方法如下:
称取于270-300 ℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验(取50mL水,加10滴溴甲酚绿-甲基红指示液,同样用硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色)。
计算公式为:
式中:
m:无水碳酸钠的质量,g;
V
1
:滴定时所用的硫酸的体积,mL;
V
2
:空白滴定时所用的硫酸的体积,mL;
M:无水硫酸钠的相对分子质量,g/mol,[M(1/2Na
2CO
3
)=)]。
测定氨氮时,氨氮含量的计算:
式中:
氨氮:氨氮含量,mg/L;
V
1
:滴定水样时所用的硫酸的体积,mL;
V
2
:空白滴定时所用的硫酸的体积,mL;
M:硫酸溶液的浓度,mol/L;
V:水样的体积, mL。
2、重铬酸钾(K
2Cr
2
O
7
)溶液的配制
1000mL浓度c(1/6K
2Cr
2
O
7
)=L,即c(K
2
Cr
2
O
7
)= mol/L的重铬酸钾溶液的配制:
称取于120 ℃下干燥2h的重铬酸钾溶于水中,并移入容量瓶中,定容至1000mL,摇匀,备用。
3、硫酸亚铁铵标准溶液的配制:
1000mL mol/L硫酸亚铁铵标准溶液的配制:称取39.5g硫酸亚铁铵溶于水中,边搅拌边缓慢加入20mL浓硫酸,冷却后移入1000 mL容量瓶中,加水稀释至刻度线,摇匀。
临用前,需用重铬酸钾标准溶液进行标定。
标定方法如下:
准确吸取 mL重铬酸钾标准溶液于锥形瓶中,加入100 mL水,缓慢加入30 mL浓硫酸,混匀。
冷却后,加入3滴试亚铁灵指示剂,用硫酸亚铁铵溶液进行滴定,溶液的颜色由黄色经蓝绿色编为红褐色即为终点。
硫酸亚铁铵浓度的计算公式如下:
式中:
c:硫酸亚铁铵的浓度,mol/L;
V:硫酸亚铁铵滴定时用的量,mL。
在测定COD时,COD的计算公式为:
式中:
COD:COD的含量,mg/L;
c:硫酸亚铁铵的浓度,mol/L;
:滴定空白时硫酸亚铁铵标准溶液的用量,mL;
V
:滴定水样时硫酸亚铁铵标准溶液的用量,mL;
V
1
V:水样的体积, mL。
二、指示剂的配制
1、试亚铁灵指示剂
称取邻菲罗啉,硫酸亚铁溶于水中,热水浴中加热使之溶解,稀释至100mL,保存于棕色试剂瓶中。
2、甲基红-亚甲基蓝混合指示剂
称取0.1g亚甲基蓝,溶于95%乙醇,用95%乙醇稀释至100mL;然后称取0.1g甲基红,溶于95%乙醇,用95%乙醇稀释至100mL;分别取50mL亚甲基蓝和100mL甲基红溶液混匀即可。
3、溴甲酚绿-甲基红指示剂
称取0.1g溴甲酚绿,溶于95%乙醇,用95%乙醇稀释至100mL;称取0.2g甲基红,溶于95%乙醇,用95%乙醇稀释至100mL;分别取30mL溴甲酚绿,10mL甲基红溶液,混匀即可。
