高二化学 3.2.1 乙醛的结构和性质
《乙醛》 讲义

《乙醛》讲义一、乙醛的基本信息乙醛,化学式为 C₂H₄O,结构简式为 CH₃CHO,是一种醛类有机化合物。
它在常温常压下是一种无色、易挥发、具有刺激性气味的液体。
乙醛能与水、乙醇、乙醚等多种有机溶剂混溶。
二、乙醛的物理性质1、外观与气味乙醛为无色透明液体,具有强烈的刺激性气味。
这股气味类似于水果熟透或者发酵的味道。
2、沸点和熔点乙醛的沸点约为 208℃,熔点约为-1235℃。
由于其沸点较低,所以在常温下容易挥发。
3、密度相对密度为 07834(水= 1),这意味着它比水的密度小。
4、溶解性乙醛能与水、乙醇、乙醚等有机溶剂以任意比例互溶。
三、乙醛的化学性质1、加成反应乙醛分子中的碳氧双键可以发生加成反应。
例如,在催化剂的作用下,乙醛可以与氢气发生加成反应,生成乙醇。
CH₃CHO + H₂ → CH₃CH₂OH2、氧化反应(1)乙醛可以被氧气氧化为乙酸。
2CH₃CHO + O₂ → 2CH₃COOH(2)乙醛也能被一些弱氧化剂氧化,比如银氨溶液和新制的氢氧化铜悬浊液。
与银氨溶液反应,会产生银镜现象,化学方程式为:CH₃CHO + 2Ag(NH₃)₂OH → CH₃COONH₄+2Ag↓ + 3NH₃+ H₂O与新制的氢氧化铜悬浊液反应,会产生砖红色沉淀,化学方程式为:CH₃CHO + 2Cu(OH)₂+NaOH → CH₃COONa + Cu₂O↓ +3H₂O3、缩合反应乙醛在一定条件下可以发生自身缩合反应,生成β羟基丁醛。
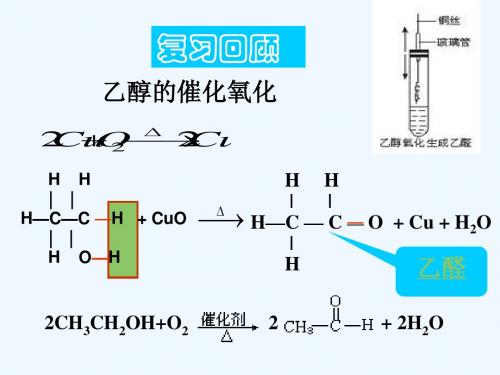
2CH₃CHO → CH₃CH(OH)CH₂CHO四、乙醛的制备方法1、乙醇氧化法乙醇在催化剂(如铜或银)的作用下,加热可以被氧化为乙醛。
这是工业上制备乙醛的常用方法之一。
2CH₃CH₂OH + O₂ → 2CH₃CHO + 2H₂O2、乙烯氧化法乙烯在催化剂(如钯盐)和氧气的作用下,可以被氧化为乙醛。
CH₂=CH₂+ 1/2 O₂ → CH₃CHO五、乙醛的用途1、化工原料乙醛是合成乙酸、乙酸酐、季戊四醇、丁醇、三氯乙醛等多种有机化工产品的重要原料。
乙醛的结构与化学性质

乙醛的结构与化学性质乙醛(化学式:CH3CHO)是一种有机化合物,也被称为乙酰醛。
它是最简单的醛之一,由一个甲基基团和一个氢氧基团以羰基(碳氧双键)连接而成。
乙醛是一种无色有刺激性气味的液体,在自然界中可以由一些水果、咖啡和面包中发现。
乙醛的分子式为C2H4O,相对分子质量为44.05 g/mol。
它可以溶于水,与许多有机化合物发生反应,如醇、胺、酸和芳香化合物。
乙醛是一种极性分子,由于氧原子的电负性较高,使氧原子部分带负电荷,而碳原子部分带正电荷。
这导致乙醛具有一些独特的化学性质。
首先,乙醛是一种容易挥发的液体,具有强烈的刺激性气味。
这也是为什么我们能够在一些水果和其他食物中闻到它的原因。
其次,乙醛是一种弱酸,可以与一些强碱(如氢氧化钠)反应,生成对应的乙酸盐。
这种反应通常被称为酸碱中和反应。
另外,乙醛与一些氧化剂反应,可以发生氧化反应,生成乙酸。
这种反应常常被用于鉴定醛类化合物的存在。
乙醛还可以发生加成反应,与一些亲电试剂反应生成加成产物。
例如,乙醛可以和氢氰酸反应生成氰羟甲酸。
此外,乙醛还可以通过还原反应转化为乙醇。
在还原反应中,氢气和催化剂(如铂催化剂)可以加到乙醛的碳氧双键上,使其还原为醇。
这种还原反应在工业上经常用于生产乙醇。
乙醛还有一些其他的化学性质,例如可以通过羟甲基化反应生成甲醇,可以通过烷基化反应生成烷基醇,还可以通过选择性氧化反应生成乙酸,等等。
总之,乙醛是一种重要的有机化合物,具有独特的结构和化学性质。
它在工业上广泛应用于生产醇、酸、酯等有机化合物。
此外,乙醛在生物体内也扮演着重要的角色,参与许多生物化学反应。
对乙醛的研究不仅有助于深入理解有机化学的基本原理,还对工业和生物科学具有重要的应用价值。
北京市高二化学3.2.1乙醛的结构和性质教学设计

c.使酸性高锰酸钾溶液
4.消去反应
回顾、思考、讨论、代表回答
通过对已学乙醇知识的回顾,培养学生温故旧知的习惯和学习新知的兴趣,激发学生求知欲。
导入新课
【思考】
醛基是常见的有机官能团之一,不同的官能团有不同的性质,如乙醇就具有醇羟基特有的性质,那么醛基有什么特殊性质呢?
聆听
通过介绍,引入主题,使学生了解本节的学习目标。
思考,按照老师引导的思路进行阅读,小组内讨论,代表回答。
通过阅读,培养学生的自主学习能力和团队合作精神。
拓展延伸
一、醛基的检验及性质
1.醛基的性质
醛基可被氧化剂氧化为羧基,也可被H2还原为醇烃基,因此既有还原性,也具有氧化性,可用图示表示如下:
2.醛基的检验
(1)能和银氨溶液发生银镜反应
实验中注意事项:
(3)催化氧化
乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式为:___________________
(4)燃烧:反应方程式:____________________
2.加成反应
乙醛蒸气和H2的混合气体通过热的镍催化剂,发生加成反应的化学方程式为:_______________________________________
2.还原反应
堂内容进行知识的提升。
通过对醛基的结构及性质、氧化或还原反应原理的拓展,把零散的认识升华到系统认识。
例题分析
1.下列说法中,正确的是(C)
A.乙醛分子中的所有原子都在同一平面上
B.凡是能发生银镜反应的有机物都是醛
C.醛类既能被氧化为羧酸,又能被还原为醇
习题巩固
1.下列有机物在反应中被还原的是(C)
A.乙醛发生银镜反应B.乙醇转化成乙醛
高中化学选修5人教版:3.2醛

一、乙醛的物理性质
乙醛是无色、有刺激性气味的液体, 密度比水小,易挥发,易燃烧,能跟水、 乙醇、氯仿等互溶。
二、乙醛的分子结构
HO
分子式: C2H4O
结构式: H C C H
H
结构简式: CH3CHO
O
官能团 醛基: CHO 或
CH
注意: 醛基的写法,不• 要颠倒顺序
2.推测乙醛的1H-NMR谱图?
现象:溶液中出现蓝色沉淀
Cu2+ + 2OH- = Cu(OH)2↓
b、乙醛的氧化:在上述蓝色浊液中加0.5ml乙醛溶液, 加热至沸腾。
现象:产生砖红色沉淀
CH3CHO+2Cu(OH)2 △ CH3COOH+Cu2O↓+2H2O
还原剂
氧化剂
醛分子中的醛基,可被银氨溶液和碱性的新制Cu(OH)2浊 液氧化成羧酸,该羧酸与碱反应形成羧酸盐。
CH3CHO + 2Cu(OH)2 + NaOH △ CH3COONa +
•
Cu2O↓+ 3H2O
(3)与氧气的反应:
△
2CH3CHO + 5O2 点燃 4CO2 + 4H2O
银氨溶液和氢氧化铜是比较弱的氧化剂,它 们都能与乙醛发生反应,那么乙醛应该是一 种 较强 的 还原剂。 除了上面我们已经学习过的,乙醛还能和哪 些常见的物质发生氧化反应 酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水 等。
其中有几种吸收峰,峰面积之比是多少?
HH H C C=O
•
H
乙醛的化学性质
1、与H2加成 根据加成反应原理写出CH3CHO和H2加 成的方程式。 CH3CHO + H2 Ni CH3CH2OH 从氧化还原反应的角度来判断上面的反 应属于什么类型 ?
乙醛的化学式和结构式-概述说明以及解释

乙醛的化学式和结构式-概述说明以及解释1.引言1.1 概述乙醛是一种重要的有机化合物,它在化工、医药、食品等领域都有着广泛的应用。
乙醛具有独特的化学性质和结构特征,其化学式为CH3CHO,结构式为CH3-CHO。
乙醛在化学反应中扮演着重要角色,其重要性不可忽视。
本文将深入探讨乙醛的定义、性质、化学式和结构式,以及乙醛在化学领域的应用和未来发展方向。
通过对乙醛的全面了解,可以更好地认识和利用这种重要的有机化合物。
文章结构部分的内容应包括对整篇文章的组织和安排进行说明。
在这篇关于乙醛的化学式和结构式的文章中,我们将按照以下结构展开讨论:1. 引言部分:1.1 概述:简要介绍乙醛的基本信息和重要性。
1.2 文章结构:介绍本文的组织结构和讨论内容。
1.3 目的:明确本文撰写的目的和意义。
2. 正文部分:2.1 乙醛的定义和性质:详细介绍乙醛的定义、性质和特点。
2.2 乙醛的化学式:分析乙醛的化学式及其组成元素。
2.3 乙醛的结构式:探讨乙醛的分子结构和构造特点。
3. 结论部分:3.1 总结乙醛的重要性:概括乙醛在化学领域的重要作用。
3.2 乙醛在化学领域的应用:列举乙醛在实际应用中的具体场景和用途。
3.3 展望乙醛的未来发展:展望乙醛在未来的应用前景和发展趋势。
通过以上结构安排,我们将全面深入地探讨乙醛的化学式和结构式,展示其重要性和潜在应用价值,为读者提供详尽的信息和知识内容。
1.3 目的本文的目的在于深入探讨乙醛这一化合物的化学式和结构式,并分析其定义、性质以及在化学领域的应用。
通过对乙醛的研究,我们可以更加全面地了解这一化合物的特点和重要性,为化学领域的研究提供更为深入的参考和理解。
同时,通过展望乙醛的未来发展,可以为相关研究的方向和发展趋势提供一定的参考和借鉴,促进乙醛在化学领域的更广泛应用和推广。
通过本文的研究,旨在为读者提供关于乙醛的详尽信息,增强对该化合物的理解和认识。
2.正文2.1 乙醛的定义和性质乙醛,化学式为CH3CHO,又称乙醛醛,是一种有机化合物,属于醛类化合物。
新人教版高中化学选修五3.2《醛》优秀教案(重点资料).doc

第二节醛【教学目标】1.使学生掌握乙醛的结构式,主要性质和用途2.使学生掌握醛基和醛类的概念【教学重点】乙醛的性质和用途【教学过程】一、乙醛1.乙醛的分子组成与结构乙醛的分子式是OHC42,结构式是,简写为CHOCH3。
注意对乙醛的结构简式,醛基要写为—CHO而不能写成—COH。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为C 8.20。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应和氧化反应,都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
注:此处可借助flash 帮助学生理解乙醛的加成反应(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中 的氧气氧化成乙酸:注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为:O H CO O CHO CH 22234452+−−→−+点燃乙醛不仅能被2O 氧化,还能被弱氧化剂氧化。
【实验3-5】在洁净的试管里加入1 mL 2%的3AgNO 溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
再滴入3滴乙醛,振荡后把试管放在热水中温热。
化学:3.2《乙醛》课件(新人教版选修5)
20.8℃,易挥发
推测: 醛基的性质
想 一 想 ?
O C H
结构分析
O CH3 C H
O
发生在
O C
醛基
H
C
O
H 上的反应,断碳氧双键之一
发 生 在
C H
上的反应 ,受C=O的影响,断碳氢键
三、乙醛的化学性质
1.加成反应
O CH 3 C H +H2
O
Ni
△
H H
CH3 C
H 注意:C=O和C=C双键不同,通常情况下,乙醛不 能和HX、X2、H2O发生加成反应。 OH O
3. 由以上两点得出反应规律:
乙 醇
氧 化
还 原
乙 醛
氧 化
乙 酸
4. 醛基的检验方法: (1)与新制的银氨溶液反应有光亮的银镜生成 (2)与新制的氢氧化铜共热煮沸有砖红色沉淀生成
思考
乙醛能被氧气、弱氧化剂银氨溶液、 氢氧化铜氧化,能否被强氧化剂溴水、 酸性高锰酸钾溶液氧化? 溴水、酸性高锰酸钾都能使乙醛氧化 (5)与酸性高锰酸钾反应 乙醛能使高锰酸钾溶液溴水褪色
银氨溶液的配制
在洁净的试管里加入 1 mL 2%的AgNO3溶液,一边振荡试 管,一边逐渐滴入2%的稀氨水,直到最初产生的
沉淀恰好溶解为止,这时得到的溶液通常叫做银氨溶液。
生成 沉淀 NH3· H2 O NH4+ + OH-
AgNO3 + NH3· H2O = AgOH↓+ NH4NO3 Ag+ + NH3· H2O = AgOH↓+ NH4+ AgOH + 2NH3· H2O = Ag(NH3) 2OH + 2H2O
高二化学乙醛、醛类知识精讲

高二化学乙醛、醛类【本讲主要内容】乙醛、醛类乙醛的结构、物理性质、化学性质、制法和用途;醛类的结构、通性和检验方法;对照醛的内容简要了解其同分异构体酮的知识。
【知识掌握】 【知识点精析】 一. 乙醛1. 分子式结构式结构简式官能团 C 2H 4OC H HHCHOH 3C C H O或CH 3CHO醛基2. 物理性质 乙醛是无色、具有刺激性气味的液体,密度比水小,沸点很低(20.8℃,比乙醇低得多),易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
3. 化学性质 (1)加成反应NiOH CH 3-C+H 2CH 3CH 2OH注:① 该反应实质为加氢还原反应。
有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应,而加氧去氢的反应称为氧化反应。
如乙醇的催化氧化。
② 醛基与H 2的加成是在分子中引入—OH 的一种方法。
但工业上并不用此法合成乙醇。
③ C =O 键和C =C 键不同,只能与H 2加成,但不能与溴水加成。
(2)氧化反应① 剧烈氧化——燃烧2CH 3CHO+5O 2点燃4CO 2+4H 2O② 催化氧化2CH 3CHO+O 2催化剂2CH 3COOH③ 被弱氧化剂氧化 a. 银镜反应 Ag ++NH 3·H 2O =AgOH ↓+NH 4+AgOH+2NH 3·H 2O =[23)(NH Ag ]++OH -+2H 2O CH 3CHO+223)(NH Ag ]++2OH-水浴2Ag ↓+CH 3COO -+NH 4++3NH 3+H 2O这个反应叫银镜反应。
银镜反应常被用于检验醛基的存在。
也常用于测定有机物中醛基的数目。
b. 与新制2)(OH Cu 悬浊液反应CuSO 4+2NaOH =2)(OH Cu ↓+Na 2SO 4 22)(OH Cu +CH 3CHOCu 2O ↓+CH 3COOH+2H 2O乙醛与新制2)(OH Cu 悬浊液的反应也可用于检验醛基的存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 醛(第一课时)
学习重点 乙醛的结构特点和主要化学性质。
学习难点 1.乙醛与银氨溶液、新制Cu(OH)2反应的化学方程
式的正确书写。 2.醛基的检验。
一、乙醛的物理性质及其结构
1.乙醛的物理性质
乙醛无是色________、具刺有激__性______气味的液 体,密度比小水________,沸点低(20.8°C),易挥 发,易燃烧,能水跟、__乙__醇__、___氯__仿_____等互溶。
因而完全燃烧等物质的量的乙醇和乙醛,乙醇消耗O2的质 量比乙醛的多。故正确答案为C。
一、醛基的检验及性质
1.醛基的性质 醛基可被氧化剂氧化为羧基,也可被H2还原
为醇烃基,因此既有还原性,也具有氧化性,可用 图示表示如下:
一、醛基的检验及性质 2.醛基的检验 (1)能和银氨溶液发生银镜反应 实验中注意事项: ①试管内壁(玻璃)要光滑洁净; ②银氨溶液要现用现配; ③银氨溶液的制备、乙醛的用量要符合实验说明中的规定; ④混合溶液的温度不能太高,受热要均匀,以温水浴加热 为宜; ⑤在加热过程中,试管不能振荡。
点击观看乙醛的银镜反应
二、乙醛的化学性质
先出现白色沉 淀后变澄清
光亮的银镜
AgNO3+NH3·H2O=AgOH↓+NH4NO3 AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
CH3CHO+2Ag(NH3)2OH 2Ag↓+CH3COONH4+3NH3+H2O
二、乙醛的化学性质 (2)与新制Cu(OH)2的反应
第五章 烃的含氧衍生物
§3-2-1 乙醛的结构和性质
乙醇有哪些主要化学性质?
1.与Na反应 2.取代反应 3.氧化反应 a.燃烧 b.催化氧化 c. 使酸性高锰酸钾溶液 4.消去反应
醛基是常见的有机官能 团之一,不同的官能团有不 同的性质,如乙醇就具有醇 羟基特有的性质,那么醛基
有什么特殊性质呢?
一、乙醛的物理性质及其结构
2.乙醛的分子结构 分子式:_____C_2H_4_O________ 结构式:________________ 电子式:________________
结构简式:______________ 官能团的结构简式:________
二、乙醛的化学性质
1.氧化反应 (1)银镜反应 【实验操作】
【例题三 】
(1)顺利完成银镜反应的实验,必须使用洁净的试管,已用过
的试管,要先在NaOH(aq)中煮沸,以洗去油污,然后再用蒸馏水
洗涤。(2)配制银氨溶液,有两点要求:①沉淀(AgOH和Ag2O的混合 物)必须完全消失,否则影响实验效果;②氨水不可过量,否则产
发生加成反应的化学方程式为: ______________________________________________
【例题一】
下列说法中,正确的是( ) A.乙醛分子中的所有原子都在同一平面上 B.凡是能发生银镜反应的有机物都是醛 C.醛类既能被氧化为羧酸,又能被还原为醇 D.完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量 相等
D.消去反
应
答案
AC
乙醛与氢气发生加成反应,在有机反应中,加 【解氢或去氧是还原反应;加氧或去氢是氧化反应,所 析】以所有加氢反应物可以称为还原反应。
【例题三 】
实验室做乙醛和银氨溶液反应的实验时: (1)为产生光亮的银镜,试管应先用____________溶液煮沸, 倒掉煮沸液后再用清水将试管冲洗干净,最后用蒸馏水洗净。 (2)配制银氨溶液时向盛有______溶液的试管中逐滴滴加 ______________溶液,边滴边振荡,直到___________为止。 有关反应的离子方程式为:①_______________;② ____________。 (3)应用_______加热,产生银镜的离子反应方程式为_______。
存在时被氧气氧化。
2CH2=CH2+O2 2CH3CH2OH+O2 2CH3CHO+O2
2CH3CHO 2CH3CHO+2H2O
2CH3COOH
③有机物被某些非O2的氧化剂氧化 a.能被酸性KMnO4氧化的:烯、炔、二烯、油脂(含 C=C)、苯的同系物、酚、醛、葡萄糖等。
b.能被银氨溶液或新制备的Cu(OH)2悬浊液氧化的: 醛类、甲酸及甲酸酯、葡萄糖、麦芽糖。
点击观看乙醛与新制氢氧化铜的反应
实验操作
二、乙醛的化学性质 (2)与新制CCuSO4=Cu(OH)2↓+Na2SO4
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
二、乙醛的化学性质
点击视频观看乙醛催
(3)催化氧化
化氧化键的断裂动画
一、醛基的检验及性质
(2)与新制Cu(OH)2反应产生红色沉淀 实验中注意事项: ①Cu(OH)2要新制; ②制备Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶 液,应保持碱过量; ③反应条件必须是加热煮沸。
二、氧化反应和还原反应
1.氧化反应
(1) 含义:有机物去H或加O的反应。
(2)类型:①在空气或氧气中燃烧。②在催化剂
RCHO+2[Ag(NH3)2]OH
RCOONH4+2Ag↓+
3NH3+H2O
RCHO+2Cu(OH)2 RCOOH+Cu2O↓+2H2O
2.还原反应 (1)含义:有机物加H或去O的反应。 (2)典型反应
【例题二 】
乙醛与氢气在一定条件下反应生成乙醇,
此反应属于( )
A.还原反应
B.氧化反应
C.加成反应
乙醛在有催化剂并加热的条件下,能被氧气
氧化为乙酸,反应的化学方程式为: _______________2_C__H_3CHO+O2 2CH3COOH
(4)燃烧:反应2方CH程3C式H:O_+__5_O_2______4_C_O__2_+__4_H_2O
二、乙醛的化学性质
2.加成反应 乙醛蒸气和H2的混合气体通过热的镍催化剂,
【例题一】
答案
C
乙醛的结构式为
,其中—CH3的四个原子不可能
在同一平面上;分子中含有醛基的有机物都能发生银镜反应,
而含有醛基的物质除了醛外,还有甲酸及其盐、甲酸酯、葡
【萄糖、麦芽糖等,这些物质并不是醛类物质;—CHO在一 解 析定条件下既可被氧化为—COOH,也可被还原为—CH2OH; 】
由于乙醛与乙醇含有相同的C、O原子数,不同的H原子数,
