第九章-醛酮醌
合集下载
有机化学 第9章 醛、酮、醌

对于脂肪醛、酮来说,α-H的活泼性表现在可以H+的 形式解离,并转移到羰基的氧上,形成所谓烯醇式异构体。
O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
有机物醛、酮、醌

OH R-C-OR' H
OR' R-C-OR' H
¥¥¥¥ ° ¨¥¥¥ ¨¥
¥¥¥ ¨¥¥ ¨¥
缩醛具有双醚结构,对碱和氧化剂稳定,但遇酸迅速水解 为原来的醛和醇 O OR' + H O/H R-C-H + 2R'OH R-CH-OR' 2
¥¥ ¥¥¥¥¥¥¥¥ ¨
所以,制备缩醛时必须用干燥的HCl气体,体系中不能含水。
O O CH3C-CH2-CCH3 2,4- 戊二酮 戊二酮
三、 醛和酮的物理性质
物态:CH2O为气体;C2-C12醛、酮为液体;C13以上醛、 酮为固体。
沸点:与分子量相近的醇、醚、烃相比, 醇>醛、酮>醚>烃。 原因:a. 醇分子间可形成氢键,而其它不能形成氢键; b. 醛、酮的偶极矩大于醚、烃的偶极矩:
一些醛和酮的物理常数
四、 醛和酮的化学性质 (1) 羰基的亲核加成
(甲) 加氢氰酸 (乙) 加格氏试剂 (丙) 加亚硫酸氢钠 (丁) 加醇 (戊)加氨的衍生物
(2) α-氢原子的反应
(甲) 卤化反应 (乙) 缩合反应
(3) 氧化反应 (4) 还原反应 (5) Cannizzaro反应(岐 化反应)
H2/Ni
NaBH4
RCH=CHCHO
-CH=CHCHO
¥¥¥
RCH2CH2CH2OH
-CH=CHCH2OH
¥¥¥
(B)
C=O
[H]
CH 2 (Clemmensen还原法,酸性介质)
[H]: Zn-Hg/HCl
5、 岐化反应
没有-活泼氢的醛在强碱作用下,发生分子间的氧化还原而 生成相应醇和相应酸的反应。
+
09有机化学第四版课件编(第9章_醛酮醌)课件

含3个α-H的醛、酮在碱性条件下卤代时, 3个α-H全被 卤素取代。生成的三卤代醛、酮,在碱性溶液中分解成 CHX3和羧酸盐。称为卤仿反应。
用次碘酸钠(I2+NaOH)作试剂,产生具有特殊气味的黄 色结晶的碘仿,称为碘仿反应(iodoform reaction)。
O CH3C -R
I2/NaOH
O I3CC-R
C=N Y
CO +
H2N OH H2N NH2
H2N NH
NO2
H2N NH
NO2
O
H2N NHCNH2
C N OH
肟
C N NH2
腙
C N NH
苯腙
NO2 2,4-二硝
C N NH
NO2 基苯腙
O
C N NHCNH2
缩氨脲
羰基化合物与羟氨、2,4-二硝基苯肼及氨基脲的加成缩 合产物,都是结晶,具有固定熔点,可用来鉴别醛、酮。 加成缩合产物,在稀酸作用下能水解为原来的醛和酮,可 用这些反应分离、提纯醛、酮。
第九章 醛 酮 醌
Ⅰ 醛(aldehydes)和酮(ketones)
第一节 醛和酮的化学性质
4、还原反应
RCH H
Oδ 1、亲核加成反应 Cδ+ H 3、氧化反应
R
2、α-H的反应
1、羰基上的亲核加成反应(nucleophilic addition)
(1)与 HCN 加成反应 反应是可逆的
δC+=δO- +
砖红色
注意 Fehling试剂不氧化芳醛 Benedict试剂不氧化甲醛
酮类一般不易被氧化。在强氧化剂条件下,被氧化成 碎片,无实际意义。
O RCH2-a C-b CH2R' [O]
有机化学课件第五版汪小兰第9章醛、酮、醌

第九章
醛、酮、醌
• 醛、酮、醌的结构、分类和命名
• 醛、酮、醌的物理性质
• 醛、酮、醌的化学性质
9-1 醛和酮的结构、分类及命名
一、结构 • 醛、酮:分子中含有羰基,故称为羰基化合物。
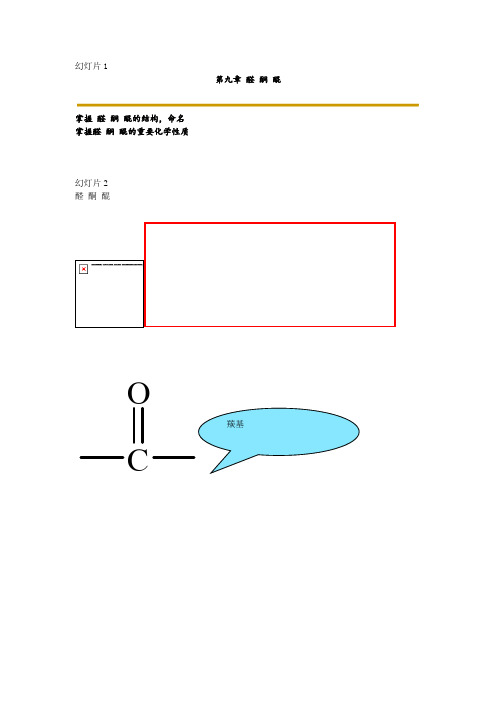
• 官能团: 羰基
C O
O R C H 醛
O C H 醛基
O R C R1
O C 酮基
酮
• C、O:sp2 杂化;
3-戊酮
O CH3CH2C CH CH3
5 4 3 2 1
CH2=CHCHO 丙烯醛
CH3
2-甲基-3-戊酮
O CH3C CH CH CH3
1 2 3 4 5
5 4 3 2 1 CH3CH CHCHCH3
OH
3-戊烯-2-醇
3-戊烯-2-酮
CHO
苯甲醛 苯乙醛
CH2CHO
COCH 3
苯乙酮
O CH2C CH3
CH
CH
CH R
CH3
4 CH
3 CH
H 2 C 1 O
H
+ RMgX 1,4-加
H CH C OH
成 CH 3
CH R
CH
C
OMgX
H+, H2O
CH3
CH R
CH3CHCH2CHO R
CH3CH=CH-CHO
1,2加成
+
CH3CH2MgX
CH3CH=CH-C
OH
CH2CH3
1,4加成
CH3CH
• 酮较难与一元醇反应,与1 ,2-或1,3-二员醇比较容易 进行,产物为环状缩酮。
O
O
O
+ HOCH2CH2OH
醛、酮、醌
• 醛、酮、醌的结构、分类和命名
• 醛、酮、醌的物理性质
• 醛、酮、醌的化学性质
9-1 醛和酮的结构、分类及命名
一、结构 • 醛、酮:分子中含有羰基,故称为羰基化合物。
• 官能团: 羰基
C O
O R C H 醛
O C H 醛基
O R C R1
O C 酮基
酮
• C、O:sp2 杂化;
3-戊酮
O CH3CH2C CH CH3
5 4 3 2 1
CH2=CHCHO 丙烯醛
CH3
2-甲基-3-戊酮
O CH3C CH CH CH3
1 2 3 4 5
5 4 3 2 1 CH3CH CHCHCH3
OH
3-戊烯-2-醇
3-戊烯-2-酮
CHO
苯甲醛 苯乙醛
CH2CHO
COCH 3
苯乙酮
O CH2C CH3
CH
CH
CH R
CH3
4 CH
3 CH
H 2 C 1 O
H
+ RMgX 1,4-加
H CH C OH
成 CH 3
CH R
CH
C
OMgX
H+, H2O
CH3
CH R
CH3CHCH2CHO R
CH3CH=CH-CHO
1,2加成
+
CH3CH2MgX
CH3CH=CH-C
OH
CH2CH3
1,4加成
CH3CH
• 酮较难与一元醇反应,与1 ,2-或1,3-二员醇比较容易 进行,产物为环状缩酮。
O
O
O
+ HOCH2CH2OH
汪版有机第九章醛酮醌

CH3CHCH2CHO OH
Δ
CH3CH CHCHO + H2O
除乙醛的羟醛缩合得到直链化合物外,其他醛的羟醛 缩合产物都是带有支链的。
产物特点:羟基在β-碳上,支链在α-碳上。 使用两种带有α-氢的不同的醛进行羟醛缩合,则产物 较复杂,至少有四种,不适于在合成上应用。
用一种无α-氢的醛和另一种有α-氢的醛,进行交叉羟醛 缩合,则有合成价值。
CH3CHCH2CHO OH
CH3CH CHCHO + H2O
羟醛缩和反应的历程,同时体现了羰基化合物的两大特 性:α-氢的酸性,和羰基的亲核加成。
-
CH3CHO + OH CH3 C O
-
[CH2CHO
-
CH2
CH] + H2O
O-
H + CH2CHO
CH3CHCH2CHO
O-
H2O
CH3CHCH2CHO OH
制备少一个碳的羧酸盐
这一反应称为卤仿反应。
若使用的卤素是碘,就称为碘仿反应。 碘仿是不溶于水的黄色固体,有特殊气味,因此常用 碘仿反应来检验乙醛或甲基酮的存在。 羟基在2-位上的醇,可被次卤酸钠氧化成甲基酮结构, 也能起碘仿反应。
I2 + 2NaOH
NaIO + NaI + H2O
OH
NaIO
1)给电子性基团增多 2)空间位阻增大
R > H
R C=O > 甲基酮 C=O R'
反应活性降低
α-羟基腈分子中的氰基可以水解为羧基,也可以还原为 氨基,进而转化为许多有用的化合物。
H2O,H+
CHCN OH
CHCOOH OH
第9章 醛酮醌
幻灯片47
说明:
Ⅰ用途:鉴别醛类 制不饱和酸
Ⅱ只氧化醛基,不影响双键。
幻灯片48
练习:
步骤:
羟醛缩合,加热脱水,本尼迪特试剂作用.
幻灯片49
5.还原反应 (适应 醛酮)
1)羰基还原为羟基
Ⅰ催化氢化
幻灯片50
幻灯片51
Ⅱ金属氢化物NaBH4 (硼氢化钠)
优点:选择性强,只还原醛、酮、酰卤中的羰基,不还原其它基团。
异丁醛
丙烯醛
幻灯片6
B.酮酮的命名与醚相似,按照羰基所连烃基来命名。
二甲(基)酮
苯乙酮
幻灯片7
系统命名法
选主链:含羰基和重键,Ar–取代基
编 号:近羰基端,指明羰基位置和数目
3-甲基丁醛
βα
β-甲基丁醛
3-苯基-2-丙烯醛
幻灯片8
4-苯基-2-丁酮
4-羰基戊醛
或:4-ቤተ መጻሕፍቲ ባይዱ酮醛
幻灯片9
练习
Z-13-二十碳烯-10-酮
幻灯片52
幻灯片53
2)羰基还原为亚甲基的反应
Ⅰ沃尔夫—凯惜纳—黄鸣龙反应
幻灯片54
练习:
步骤: 酰基化, 黄鸣龙反应.
幻灯片55
Ⅱ克莱门森还原法Zn—Hg / HCl
对碱敏感时可用克莱门森还原法(锌汞齐)
幻灯片56
幻灯片57
6.歧化反应——坎尼扎罗(Cannizzaro)反应
条件: 无α-H 的醛
反应活性
亲核试剂一定,不同类型醛酮反应活性大小
结论:醛>酮,R小的> R大的
幻灯片20
④分析
相同点:都有双键,都能加成.
不同点:
亲核加成
说明:
Ⅰ用途:鉴别醛类 制不饱和酸
Ⅱ只氧化醛基,不影响双键。
幻灯片48
练习:
步骤:
羟醛缩合,加热脱水,本尼迪特试剂作用.
幻灯片49
5.还原反应 (适应 醛酮)
1)羰基还原为羟基
Ⅰ催化氢化
幻灯片50
幻灯片51
Ⅱ金属氢化物NaBH4 (硼氢化钠)
优点:选择性强,只还原醛、酮、酰卤中的羰基,不还原其它基团。
异丁醛
丙烯醛
幻灯片6
B.酮酮的命名与醚相似,按照羰基所连烃基来命名。
二甲(基)酮
苯乙酮
幻灯片7
系统命名法
选主链:含羰基和重键,Ar–取代基
编 号:近羰基端,指明羰基位置和数目
3-甲基丁醛
βα
β-甲基丁醛
3-苯基-2-丙烯醛
幻灯片8
4-苯基-2-丁酮
4-羰基戊醛
或:4-ቤተ መጻሕፍቲ ባይዱ酮醛
幻灯片9
练习
Z-13-二十碳烯-10-酮
幻灯片52
幻灯片53
2)羰基还原为亚甲基的反应
Ⅰ沃尔夫—凯惜纳—黄鸣龙反应
幻灯片54
练习:
步骤: 酰基化, 黄鸣龙反应.
幻灯片55
Ⅱ克莱门森还原法Zn—Hg / HCl
对碱敏感时可用克莱门森还原法(锌汞齐)
幻灯片56
幻灯片57
6.歧化反应——坎尼扎罗(Cannizzaro)反应
条件: 无α-H 的醛
反应活性
亲核试剂一定,不同类型醛酮反应活性大小
结论:醛>酮,R小的> R大的
幻灯片20
④分析
相同点:都有双键,都能加成.
不同点:
亲核加成
醛

*2 反应机理
CH3 CH3
-
C=O
CN
可逆
CH3 CH3
CN CN H2O CH3 C C OH O- 不可逆 CH3
*3 反应条件
反应必须在弱碱性条件下进行。 反应必须在弱碱性条件下进行。
(3)醛、酮与炔化钠的加成 )
R-C≡C-Na+ + ≡ NaNH2 (-NH3) R-C≡CH ≡
C=O
乙醛( 乙醛(89%) ) 环己酮( 环己酮(~35%) )
O
O
丙酮( 丙酮(56.2%) ) 3-戊酮(2%) 戊酮( ) 戊酮
O
丁酮( 丁酮(36.4%) ) 苯乙酮( ) 苯乙酮(1%)
O
>
>
>
反应体系须维持弱酸性 强酸性和强碱性可使加成产物分解
*4 应 用
提纯醛、甲基酮、环酮。 提纯醛、甲基酮、 制备α 羟晴 制备α-羟晴
*1 反应式
亲核加成
CH3CH=O + NH3
HO H CH3CH-NH
-H2O -H2O
CH3CH=NH
HO H 亲核加成 CH3CH=O + RNH2 CH3CH-NR
亚胺
CH3CH=NR
H OH -H2O 亲核加成 CH CH-NR CH3CH=O + R2NH 2 2
亚胺 西佛碱
CH2=CHNR2
O O
*2 反应机理
碱 催 化
C=O ROC OOR
ROH OH C + OR H -H2O C + OR
ROH C
OH OR
-H+
C=O
H
+
有机化学ppt-醛酮醌

a.α-C上含有三个活泼氢的醛,酮与碘的氢氧化钠溶液作用, 生成碘仿(黄色沉淀,有特殊气味)和羧酸钠,称碘仿反应。
b.常用此反应鉴别乙醛和甲基酮以及有( 醇。
)结构的
(2)羟醛缩合反应
O
H
OH
稀OH-
CH3 C H + CH2 CHO
CH3 CH CH2 CHO
乙醛
乙醛
β- 羟基丁醛
是增长碳链的一种方法。
O
O
O
O
O
O
1,4-苯醌 (对苯醌)
1,2-苯醌 (邻苯醌)
O
1,4-萘醌 (α-萘醌)
1,2-萘醌 (β-萘醌)
二、重要的醌及性质 (一) α-萘醌和维生素K
许多天然的植物色素含有α-萘醌的结 构,如维生素K类,它们存在于绿叶蔬菜 中,具有促进凝血作用,故在医学上常用 作止血剂,亦可用于预防长期口服广谱抗 生素药物引起的K族维生素缺乏症。
3-甲基丁醛 β -甲基丁醛
O CH3CHCCH2CH3
CH3 2-甲基-3-戊酮
CH3CH=CHCHO
2-丁烯醛
(CH3)2CHCH2COCH3 4-甲基-2-戊酮
CH3COCH2COCH2CH3 2,4-己二酮
O
CH3CH=CHCCH2CH3
4-己烯-3-酮
OHCCH2CHO 丙二醛
三、醛酮的物理性质
目录
Contents
第一节 醛和酮 第二节 醌
第二节 醌
一、醌的结构和命名 醌是一类具有环状共轭体系的环己二烯二酮类化合物
O
O
O
O 对位
邻位
一、醌的结构和命名
命名:以相应的芳烃衍生物来命名,苯醌、萘醌、蒽醌等,两
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(干)HCl
OH CH3CH2CH2CH OCH2CH3
OCH2CH3 OCH2CH3
丁醛缩二乙醇
或:1,1-二乙氧基丁烷
缩酮
CH3 CH3 C O + 2CH3CH2OH H+ CH3 CH3 C OCH2CH3 OCH2CH3 + H2O
(不断除水)
缩醛对碱、氧化剂很稳定,但在酸性条件下水解:
9.3 醛、酮的制法
1、醇的氧化和脱氢
氧化:
伯醇醛
仲醇酮
控 制 条 件
不饱和醇不饱和醛酮:
特殊氧化剂:丙酮—异丙醇铝(或叔丁醇铝)
三氧化铬—吡啶
脱氢:
2、烃的氧化
烯烃氧化:
工 业 制 法
芳环侧链氧化:
CH2CH3 MnO2 H2SO4 , H2O
COCH3
控制反应条件
3、炔烃水合 乙炔 乙醛 其它炔 酮
δ
2、α-H的反应
主要反应类型:
1、加成反应 —— 羰基的亲核加成反应 (1)与氰化氢加成 (2)与亚硫酸氢鈉加成 (3)与醇加成 (4)与格氏试剂加成 (5)与氨的衍生物反应
2、-氢原子的反应 (1) -氢原子的活泼性(酸性) —— 酮–烯醇互变异构 (2)羟醛缩合反应 (3)卤代反应和卤仿反应 3、 氧化和还原 (1)氧化反应 (2)还原反应 (3)Cannizzaro反应
A> C >B
(1)与氢氰酸的加成
(剧毒)
(-氰醇)
碱对反应有促进作用,酸对反应有抑制作用
反应历程:
决定反应速度
应用:——增加一个碳的反应
C O + HCN
C
OH CN
H2O H+orOH-
C
OH COOH
制备-羟基酸
有机玻璃的单体
—CN作为亲核试剂,负电荷在碳原子上,与之相似的 是炔基负离子也可与醛、酮发生亲核加成.用于制备炔 醇,且反应不可逆:
R-C-OH
醇
甲醛+RMgX 伯醇
醛+RMgX 仲醇
酮+RMgX 叔醇
增 链 反 应
同一种醇可用不同的格氏试剂与不同的羰基 化合物作用生成:
(4)与氨的衍生物反应 氨的衍生物: 氨 HNH2 伯胺 RNH2 羟胺 NH2OH 肼 NH2NH2 2,4-二硝基苯肼
产物 亚胺 希夫碱 肟 腙 2,4-二硝基苯腙
亲核加成反应历程:
决定反应速度
sp2
sp3
比较——亲电加成反应
决定反应速度
X–
影响亲核加成反应因素:
电子因素:凡是增加羰基碳原子的正性有利于亲核加成
空间因素:空间障碍大不利于亲核加成
故:醛比酮易于反应
反应易难顺序:
试比较下列化合物发生亲核加成反应的活性大小:
O2N A CHO CH3 B CHO C CHO
含氢的酮发生类似反应较困难
交叉羟醛缩合:
原 含 氢 的 醛 基 保 留
无需加热
(3)卤代反应和卤仿反应
卤代反应:
醛酮分子中的氢易被卤素取代,生成卤代醛酮
一卤代醛酮氢更活泼,更易被卤代:
卤仿反应:
(X2+NaOH)
卤仿
生成三卤甲烷的反应。
卤仿反应——含有CH3CO-的醛酮与卤素的碱溶液作用,
二羰基化合物,烯醇式含量较多:
共轭效应
(2)羟醛缩合反应
稀碱作用下:
增 链 反 应 实 质 上 也 是 亲 核 加 成醛缩合反应可用于合成多种化合物:
羟基醛、 ,不饱和醛、 二醇、 ,不饱和醇、醇 等等
羟基醛
二醇
,不饱和醛
,不饱和醇
9.2 醛、酮的物理性质
1. 状态
甲醛:气体; C2~C12:液体;>C12:固体
(甲醛41%水溶液——福尔马林)
2. 沸点
CH3CH2CH2CH3 CH3CH2CHO CH3COCH3 CH3CH2CH2OH bpoC -0.5 49 56 97
沸点:醇 >
醛酮 > 烃
静电引力
氢键
C数 , 沸点差距
应用: 用于保护羰基 例:合成 CH2=CH-CHO
CH2=CH-CHO + 2CH3CH2OH
KMnO4 冷 CH2 CH CH OH OH OC2H5 OC2H5
H+
CH2 OH
CHCHO OH
CH2=CH CH
H+ H2O
OC2H5 OC2H5
CH2 OH
CHCHO OH
(4)与格氏试剂加成
O R-C-C-CHH
pka:
受羰基-I,-C影响
19~20
40~50
烯醇负离子
氢原子活泼的原因:
(A) 受羰基-I,-C影响, 氢有离去倾向 (B) p-共轭使烯醇式负离子稳定
酮
烯醇负离子
烯醇
酮 – 烯醇互变异构
互变异构体——能够互相转变而同时存在的异构体。
大多数简单的醛酮,平衡物中以酮式为主:
3.溶解度
低级醛酮在水中溶解度较大 ——羰基的氧可以作为氢键的受体 C数 溶解度 醛酮都溶于有机溶剂 4.红外光谱 特征峰: 羰基C=O: 1680~1750cm-1伸缩振动(强) 醛基C–H: 2720cm-1伸缩振动(尖)
5. 核磁共振谱 醛基质子的化学位移在9~10范围; 与羰基相连的烷基,其-C上质子的化学位移在 2.0~2.7之间
9.5.2. 醌的制备
苯醌:
萘醌
蒽醌
9.5.3. 醌的化学性质
碳碳双键的性质 羰基的性质 共轭双键的性质
(1)加卤素(碳碳双键的性质)
双烯合成-----Diles-Alder反应
(2)共轭加成(共轭双键的性质)
(3)羰基加成
互变异构体
(4)还原反应
(醌氢醌)
对苯醌合对苯二酚
191
9.5.4. 醌的应用
歧化反应——同一分子相互作用发生两种性质 不同方向相反的反应。
交叉歧化反应: 两种不含氢原子的醛在浓碱存在下发生歧化反应
一般其中一种是甲醛,而且甲醛总是氧化成酸。
9.4.4 ,-不饱和醛、酮
,-不饱和醛、酮分子中碳碳双键和羰基 构成-共轭体系,这两个官能团的相互影响 不仅使各自的化学性质有不同程度的改变,而 且还表现出某些特性。
RCOCH3 + 3NaOX CHX3 + RCOONa + 2NaOH
卤仿
含有CH3CHOH基团的化合物也可发生卤仿反应:
卤仿
卤仿反应的用途:
(1)结构鉴定:
碘仿反应——黄色固体、特殊气味
结构: (2)制备羧酸: 比原化合物少一个碳原子——减链反应
9.4.3 氧化和还原 1. 氧化反应
醛与酮在氧化反应上有很大差别——醛易被氧化
金属氢化物:硼氢化钠(NaBH4) 氢化铝锂(LiAlH4)
特点:选择性高
NaBH4:只还原羰基 LiAlH4:还原不对称不饱和键
(3)碳基的彻底还原
试剂:锌汞齐 + 盐酸
结果:还原到烃
Clemmensen还原
3. Cannizzaro反应(歧化反应或康尼查罗反应)
Cannizzaro反应——不含氢原子的醛在浓碱 存在下发生歧化反应,一分子醛还原成醇,另一 分子醛氧化成羧酸。
增链反应
(2)与亚硫酸氢鈉加成
鉴别
反应历程:
饱和(40%)
白色结晶
适用范围:醛、脂肪族甲基酮、少于八个碳的环酮
可逆性:
分离
间接法制备-羟基腈:
(3)与醇加成
不稳定 (无水)
稳 定 (无水)
反应历程:酸催化:
质子化
半缩醛
缩醛
举例:
CH3CH2CH2CHO + CH3CH2OH CH3CH2OH H+ CH3CH2CH2CH
9.4.1 羰基的加成反应 ——亲核加成反应
碳氧双键与碳碳双键的比较: >C=C<
相同处 不同处
>C=O
都是含一个键一个键,易加成
电子云偏向O,有极性 碳正离子活性大 易与缺电子的 亲电试剂作用 易与富电子的 亲核试剂作用
亲电加成
亲核加成
亲核加成反应——由亲核试剂进攻而引起的加成反应
1. 亲电加成
1
-C,-I效应 反应活性下降
重排
反应产物相同
例:
2 亲核加成
由于共扼体系的存在,C=C的+C效应使,-不饱和 醛、酮中羰基的碳原子缺电子性有所下降,而-碳原子 却显出缺电子性。
1
1,4-
1,2-
1,4-
1,4-
9.5 醌
9.5.1 醌的结构和命名 醌是一类特殊的,-不饱和环状共轭二酮。 醌没有芳香性。 按相应的芳烃名称命名:
氨基脲
缩胺脲
反应历程:
加成-脱水反应
加成
脱水
以上产物为结晶固体,可用于定性定量分析——羰基试剂 产物在稀酸下可水解成原醛酮——分离、提纯
不稳定
取代亚胺(希夫碱) 不稳定
芳醛
(希夫碱)
稳定
有机合成上用于制备仲胺,如:
9.4.2 -氢原子的反应
(1)氢原子的活泼性(酸性)
——酮-烯醇互变异构
止 血 剂
本章作业
P176
9.1a,d,f,m,o,r;
9.3c,d,h,k,o; 9.4;9.5a,d,e,f,g; 9.8a,b,c,d; 9.10;9.12;9.17
4、傅氏酰基化反应 ——是制备芳酮的常用方法
制备醛: (盖特曼-科赫反应)
9.4 醛、酮的化学性质
羰基缺电子碳有较高的反应活性;羰基的吸电子作 用的影响(-I,-C),使与其相连的-C上的氢被活化。所 以醛酮的化学性质主要是碳基的反应和-C上氢的反应 . 发生反应的主要部位: 4、还原反应
OH CH3CH2CH2CH OCH2CH3
OCH2CH3 OCH2CH3
丁醛缩二乙醇
或:1,1-二乙氧基丁烷
缩酮
CH3 CH3 C O + 2CH3CH2OH H+ CH3 CH3 C OCH2CH3 OCH2CH3 + H2O
(不断除水)
缩醛对碱、氧化剂很稳定,但在酸性条件下水解:
9.3 醛、酮的制法
1、醇的氧化和脱氢
氧化:
伯醇醛
仲醇酮
控 制 条 件
不饱和醇不饱和醛酮:
特殊氧化剂:丙酮—异丙醇铝(或叔丁醇铝)
三氧化铬—吡啶
脱氢:
2、烃的氧化
烯烃氧化:
工 业 制 法
芳环侧链氧化:
CH2CH3 MnO2 H2SO4 , H2O
COCH3
控制反应条件
3、炔烃水合 乙炔 乙醛 其它炔 酮
δ
2、α-H的反应
主要反应类型:
1、加成反应 —— 羰基的亲核加成反应 (1)与氰化氢加成 (2)与亚硫酸氢鈉加成 (3)与醇加成 (4)与格氏试剂加成 (5)与氨的衍生物反应
2、-氢原子的反应 (1) -氢原子的活泼性(酸性) —— 酮–烯醇互变异构 (2)羟醛缩合反应 (3)卤代反应和卤仿反应 3、 氧化和还原 (1)氧化反应 (2)还原反应 (3)Cannizzaro反应
A> C >B
(1)与氢氰酸的加成
(剧毒)
(-氰醇)
碱对反应有促进作用,酸对反应有抑制作用
反应历程:
决定反应速度
应用:——增加一个碳的反应
C O + HCN
C
OH CN
H2O H+orOH-
C
OH COOH
制备-羟基酸
有机玻璃的单体
—CN作为亲核试剂,负电荷在碳原子上,与之相似的 是炔基负离子也可与醛、酮发生亲核加成.用于制备炔 醇,且反应不可逆:
R-C-OH
醇
甲醛+RMgX 伯醇
醛+RMgX 仲醇
酮+RMgX 叔醇
增 链 反 应
同一种醇可用不同的格氏试剂与不同的羰基 化合物作用生成:
(4)与氨的衍生物反应 氨的衍生物: 氨 HNH2 伯胺 RNH2 羟胺 NH2OH 肼 NH2NH2 2,4-二硝基苯肼
产物 亚胺 希夫碱 肟 腙 2,4-二硝基苯腙
亲核加成反应历程:
决定反应速度
sp2
sp3
比较——亲电加成反应
决定反应速度
X–
影响亲核加成反应因素:
电子因素:凡是增加羰基碳原子的正性有利于亲核加成
空间因素:空间障碍大不利于亲核加成
故:醛比酮易于反应
反应易难顺序:
试比较下列化合物发生亲核加成反应的活性大小:
O2N A CHO CH3 B CHO C CHO
含氢的酮发生类似反应较困难
交叉羟醛缩合:
原 含 氢 的 醛 基 保 留
无需加热
(3)卤代反应和卤仿反应
卤代反应:
醛酮分子中的氢易被卤素取代,生成卤代醛酮
一卤代醛酮氢更活泼,更易被卤代:
卤仿反应:
(X2+NaOH)
卤仿
生成三卤甲烷的反应。
卤仿反应——含有CH3CO-的醛酮与卤素的碱溶液作用,
二羰基化合物,烯醇式含量较多:
共轭效应
(2)羟醛缩合反应
稀碱作用下:
增 链 反 应 实 质 上 也 是 亲 核 加 成醛缩合反应可用于合成多种化合物:
羟基醛、 ,不饱和醛、 二醇、 ,不饱和醇、醇 等等
羟基醛
二醇
,不饱和醛
,不饱和醇
9.2 醛、酮的物理性质
1. 状态
甲醛:气体; C2~C12:液体;>C12:固体
(甲醛41%水溶液——福尔马林)
2. 沸点
CH3CH2CH2CH3 CH3CH2CHO CH3COCH3 CH3CH2CH2OH bpoC -0.5 49 56 97
沸点:醇 >
醛酮 > 烃
静电引力
氢键
C数 , 沸点差距
应用: 用于保护羰基 例:合成 CH2=CH-CHO
CH2=CH-CHO + 2CH3CH2OH
KMnO4 冷 CH2 CH CH OH OH OC2H5 OC2H5
H+
CH2 OH
CHCHO OH
CH2=CH CH
H+ H2O
OC2H5 OC2H5
CH2 OH
CHCHO OH
(4)与格氏试剂加成
O R-C-C-CHH
pka:
受羰基-I,-C影响
19~20
40~50
烯醇负离子
氢原子活泼的原因:
(A) 受羰基-I,-C影响, 氢有离去倾向 (B) p-共轭使烯醇式负离子稳定
酮
烯醇负离子
烯醇
酮 – 烯醇互变异构
互变异构体——能够互相转变而同时存在的异构体。
大多数简单的醛酮,平衡物中以酮式为主:
3.溶解度
低级醛酮在水中溶解度较大 ——羰基的氧可以作为氢键的受体 C数 溶解度 醛酮都溶于有机溶剂 4.红外光谱 特征峰: 羰基C=O: 1680~1750cm-1伸缩振动(强) 醛基C–H: 2720cm-1伸缩振动(尖)
5. 核磁共振谱 醛基质子的化学位移在9~10范围; 与羰基相连的烷基,其-C上质子的化学位移在 2.0~2.7之间
9.5.2. 醌的制备
苯醌:
萘醌
蒽醌
9.5.3. 醌的化学性质
碳碳双键的性质 羰基的性质 共轭双键的性质
(1)加卤素(碳碳双键的性质)
双烯合成-----Diles-Alder反应
(2)共轭加成(共轭双键的性质)
(3)羰基加成
互变异构体
(4)还原反应
(醌氢醌)
对苯醌合对苯二酚
191
9.5.4. 醌的应用
歧化反应——同一分子相互作用发生两种性质 不同方向相反的反应。
交叉歧化反应: 两种不含氢原子的醛在浓碱存在下发生歧化反应
一般其中一种是甲醛,而且甲醛总是氧化成酸。
9.4.4 ,-不饱和醛、酮
,-不饱和醛、酮分子中碳碳双键和羰基 构成-共轭体系,这两个官能团的相互影响 不仅使各自的化学性质有不同程度的改变,而 且还表现出某些特性。
RCOCH3 + 3NaOX CHX3 + RCOONa + 2NaOH
卤仿
含有CH3CHOH基团的化合物也可发生卤仿反应:
卤仿
卤仿反应的用途:
(1)结构鉴定:
碘仿反应——黄色固体、特殊气味
结构: (2)制备羧酸: 比原化合物少一个碳原子——减链反应
9.4.3 氧化和还原 1. 氧化反应
醛与酮在氧化反应上有很大差别——醛易被氧化
金属氢化物:硼氢化钠(NaBH4) 氢化铝锂(LiAlH4)
特点:选择性高
NaBH4:只还原羰基 LiAlH4:还原不对称不饱和键
(3)碳基的彻底还原
试剂:锌汞齐 + 盐酸
结果:还原到烃
Clemmensen还原
3. Cannizzaro反应(歧化反应或康尼查罗反应)
Cannizzaro反应——不含氢原子的醛在浓碱 存在下发生歧化反应,一分子醛还原成醇,另一 分子醛氧化成羧酸。
增链反应
(2)与亚硫酸氢鈉加成
鉴别
反应历程:
饱和(40%)
白色结晶
适用范围:醛、脂肪族甲基酮、少于八个碳的环酮
可逆性:
分离
间接法制备-羟基腈:
(3)与醇加成
不稳定 (无水)
稳 定 (无水)
反应历程:酸催化:
质子化
半缩醛
缩醛
举例:
CH3CH2CH2CHO + CH3CH2OH CH3CH2OH H+ CH3CH2CH2CH
9.4.1 羰基的加成反应 ——亲核加成反应
碳氧双键与碳碳双键的比较: >C=C<
相同处 不同处
>C=O
都是含一个键一个键,易加成
电子云偏向O,有极性 碳正离子活性大 易与缺电子的 亲电试剂作用 易与富电子的 亲核试剂作用
亲电加成
亲核加成
亲核加成反应——由亲核试剂进攻而引起的加成反应
1. 亲电加成
1
-C,-I效应 反应活性下降
重排
反应产物相同
例:
2 亲核加成
由于共扼体系的存在,C=C的+C效应使,-不饱和 醛、酮中羰基的碳原子缺电子性有所下降,而-碳原子 却显出缺电子性。
1
1,4-
1,2-
1,4-
1,4-
9.5 醌
9.5.1 醌的结构和命名 醌是一类特殊的,-不饱和环状共轭二酮。 醌没有芳香性。 按相应的芳烃名称命名:
氨基脲
缩胺脲
反应历程:
加成-脱水反应
加成
脱水
以上产物为结晶固体,可用于定性定量分析——羰基试剂 产物在稀酸下可水解成原醛酮——分离、提纯
不稳定
取代亚胺(希夫碱) 不稳定
芳醛
(希夫碱)
稳定
有机合成上用于制备仲胺,如:
9.4.2 -氢原子的反应
(1)氢原子的活泼性(酸性)
——酮-烯醇互变异构
止 血 剂
本章作业
P176
9.1a,d,f,m,o,r;
9.3c,d,h,k,o; 9.4;9.5a,d,e,f,g; 9.8a,b,c,d; 9.10;9.12;9.17
4、傅氏酰基化反应 ——是制备芳酮的常用方法
制备醛: (盖特曼-科赫反应)
9.4 醛、酮的化学性质
羰基缺电子碳有较高的反应活性;羰基的吸电子作 用的影响(-I,-C),使与其相连的-C上的氢被活化。所 以醛酮的化学性质主要是碳基的反应和-C上氢的反应 . 发生反应的主要部位: 4、还原反应
