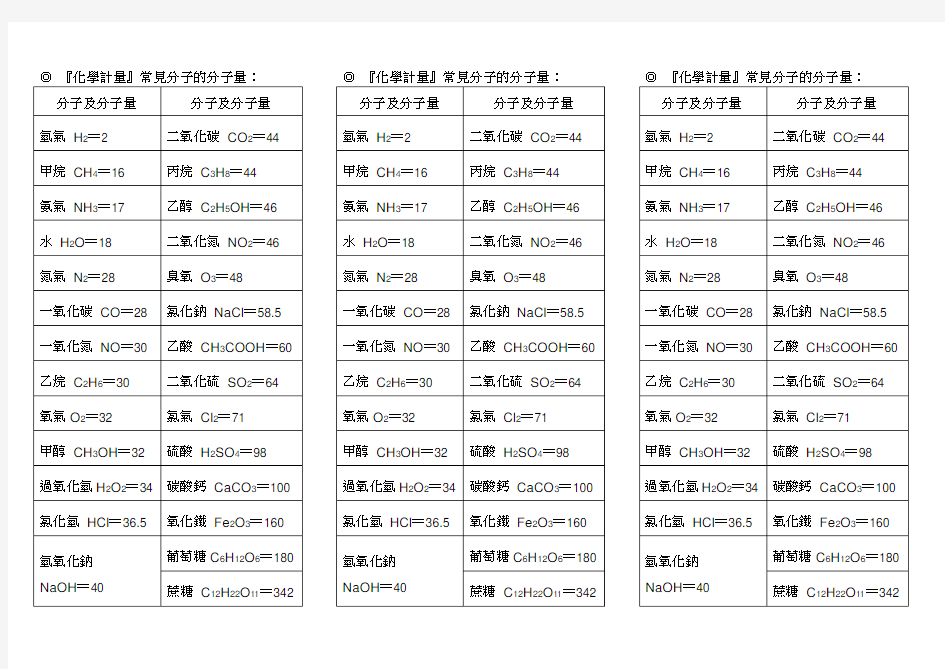
常见分子分子量
有机物分子式计算(成品)
有机物分子式的确定 一、有机物组成元素的判断——燃烧法 有机物完全燃烧后,各元素对应产物为:C→CO2,H→H2O,Cl→HCl。某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素 欲判定该有机物中是否含氧元素 二、实验式(最简式)和分子式的区别与联系 (1)最简式:表示化合物分子所含各元素的原子数目最简单整数比的式子。 不能确切表明分子中的个各原子的个数。 注意: ①最简式是一种表示物质组成的化学用语; ②无机物的最简式一般就是化学式; ③有机物的元素组成简单,种类繁多,具有同一最简式的物质往往不止一种; ④最简式相同的物质,所含各元素的质量分数是相同的,若相对分子质量不 同,其分子式就不同。例如,苯(C6H6)和乙炔(C2H2)的最简式相同,均为CH,故它们所含C、H元素的质量分数是相同的。 (2)分子式:表示化合物分子所含元素的原子种类及数目的式子。 注意: ①分子式是表示物质组成的化学用语; ②无机物的分子式一般就是化学式; ③由于有机物中存在同分异构现象,故分子式相同的有机物,其代表的物质 可能有多种; ④分子式=(最简式)n。,。 三、有机物相对分子质量的计算方法 1、标准状况下,M=22.4ρ(单位:克/升) 2、相对密度法:M=2D (D是氢气密度的倍数) M=29D (D是空气密度的倍数) 四、确定分子式的方法——关键是计算M (1)、实验式法: 由各元素的质量分数→求出实验式→相对分子质量→求分子式。 例1:某有机物含碳40%,氢6.67%,氧53.3%,如果0.2mol该有机物质量为6g,求它的分子式。 (2)、物质的量关系法——比值法 求:1摩尔有机物中各元素的物质的量之比,就是分子式下标的比。 例2:某混合气体由两种气态烃组成。取2.24升该混合气体完全燃烧后得到4.48升二氧化碳(在标况下)和3.6克水,则这两种气体可能是 A、CH4、C3H8 B、CH4、C3H4 C、C2H4、C3H4 D、C2H2、C2H6 E、C2H4、C2H6 例3:由两种气态烃组成的混合气体30ml,与过量氧气完全燃烧后,生成CO2 60ml,水蒸气45ml(相同条件下测得)。求原混合气的成分及体积比。 (3)、化学方程式法——利用化学方程式求分子式。(已知物质的类别) (4)、燃烧通式法——利用通式和相对分子质量求分子式。
有机物分子式的确定-规律总结
有机物分子式的确定 一.有机物组成元素的判断 某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。 欲判定该有机物中是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将碳、氢元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧;否则,原有机物的组成含氧。 二、有机物分子式的确定 1、根据最简式和分子量确定分子式 例1:某有机物中含碳40%、氢6.7%、氧53.3%,且其分子量为90,求其分子式。 例2:某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59g/L,写出该烃的分子式。 注意:(1)某些特殊组成的最简式,在不知化合物相对分子质量时,也可根据组成特点确定其分子式。例如最简式为CH3的在机物,其分子式可表示为(CH3)n,仅当n=2时,氢原子已达饱和,故其分子式为C2H6。同理,最简式为CH3O的有机物,当n=2时,其分子式为C2H6O2 (2)部分有机物的最简式中,氢原子已达饱和,则该有机物的最简式即为分子式。例如最简式为CH4、CH3Cl、C2H6O、C4H10O3等有机物,其最简式即为分子式。 2、根据各元素原子个数确定分子式 例1:吗啡分子含C:71.58% H:6.67% N :4.91% , 其余为氧,其分子量不超过300。试确定其分子式。 例2:实验测得某烃A中含碳85.7%,含氢14.3%。在标准状况下11.2L此化合物气体的质量为14g。求此烃的分子式。 3、根据通式确定分子式 烷烃CnH2n+2 烯烃或环烷烃CnH2n 炔烃或二烯烃CnH2n-2 苯及同系物CnH2n-6 用CnH2n-x(-2≤x≤6)和相对分子量可快速确定烃或分子式
化学有机物经典计算题
化学有机物经典计算题
————————————————————————————————作者:————————————————————————————————日期:
? 超大大中小 ? 有机物的知识很散,我现在在复习,平时就应该把这方面的知识归纳总结! 有关有机物燃烧的题型分类解析 一、一定物质的量有机物燃烧耗氧量的计算 有机物燃烧的试题时,其根本依据是有机物燃烧的通式: ①烃:C x H y +(x+y/4)O 2 →xCO 2 +y/2H 2 O?②烃的衍生物:C x H y O z +(x+y /4-z/2)O 2→xCO 2 +y/2H 2 O 若题中明确给出了烃或烃的衍生物的类别,上面的燃烧通式还可进一步简 化,?如烷烃的燃烧:C n H 2n+2 +(3n+1)/2 O 2 →nCO 2 +(n+1)H 2 O 【题型1】①1mol烃C x H y 完全燃烧时的耗氧量为(x+y/4)mol,即每摩碳 原子消耗1molO 2,每4摩氢原子消耗1molO 2 。?②计算1mol烃的含氧衍生 物完全燃烧的耗氧量时,可先将其中的氧原子折算为水,再将剩余C、H原子按烃 的计算方法计算,如C 2H 5 OH可看作C 2 H 4 ·H 2 O,因此其耗氧量与等物质的量的 C 2H 4 耗氧量相同。根据情况,也可将氧原子折算为CO 2 ,如HCOOH可看作 H 2·CO 2 ,故耗氧量与等物质的量的H 2 相同(折算成的H 2 O和CO 2 不消耗氧)?据 此,上面的燃烧通式也能迅速推写出来,而不必死记硬背。 例⒈充分燃烧等物质的量的下列有机物,相同条件下需要相同体积氧气的是()(A)乙烯、乙醛(B)乙酸乙酯、丙烷 (C)乙炔、苯 (D)环丙烷、丙醇 【变式练习】有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数) ( )?A、8n B、14nC、18n D、44n 【题型2】在总物质的量一定的情况下,以任意比例混合的有机物完全燃烧后有关量的讨论,解答这种题目的关键是:总物质的量一定的混合物,不论以何比 例混合,只要分子中具有相同的碳(或氢)原子,完全燃烧后产生的CO 2(或H 2 O) 的量也一定。若耗氧量一定,则要求各组分在物质的量相同时,耗氧量也相同,这应是常识性知识。
有机物分子式的相关计算
有机物分子式的相关计算 班级:姓名:号数:评价: 方法一:最简式法 1.某有机物组成中含碳54.5%%, 含氢9.1%,其余为氧又知其蒸汽在标况下的密度为3.94g/L,试求其分子式。 方法二:直接求法 1.某有机物组成中含碳54.5%%, 含氢9.1%,其余为氧又知其蒸汽在标况下的密度为3.94g/L,试求其分子式。 小结:确定有机化合物的分子式的方法: [方法一]由物质中各原子(元素)的质量分数→各原子的个数比(实验式)→由相对分子质量和实验式→有机物分子式 [方法二]1 mol物质中各原子(元素)的质量除以原子的摩尔质量→ 1 mol物质中的各种原子的物质的量→知道一个分子中各种原子的个数→有机物分子式 2.燃烧某有机物A 1.50g,生成1.12L(标况)CO2和0.05mol H2O。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。 方法三:燃烧通式法 3.某有机物蒸汽对H2的相对密度为30,1.2g该有机物完全燃烧生成CO2(标况 下)1.344L,H2O1.44g,求该有机物的分子式。 4.某气态烃10 mL与50 mL氧气在一定条件下作用,刚好消耗尽反应物,生成水蒸气40mL,一氧化碳和二氧化碳各20 mL(各气体体积均在同温、同压下测定) ,该烃的分子式为() A.C3H8 B.C4H6 C.C3H6 D.C4H8 5. 将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重 14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为() A.C4H10 B.C2H6O C.C3H8O D.C2H4O2 方法四:讨论分析法 6.两种气态烃组成的混合气体0.1 mol,完全燃烧得0.16 mol CO2和3.6 g水,下列说法正确的是()
气态有机物的相对分子质量大于29时参考资料
气态有机物的相对分子质量大于29时,密度比空气大;液态有机物密度比水小的有烃(烷、烯、炔、芳香烃)、低级酯、一氯代烃、乙醇、乙醛等;密度比水大的有硝基苯、溴苯、四氯化碳、氯仿、溴代烃、乙二醇、丙三醇等。烷、烯、炔等烃类同系物相对密度随着分子内碳原子数的增加的而增大;一氯代烷的相对密度随着碳原子数的增加而减小。 1、检验时利用装置自身的仪器,在没有特殊需要的情况下,往往是不可以随意添加其它仪器来检验装置气密性的。 2、在检验装置的气密性时操作往往是使装置中的气体体积发生变化,但变化的程度要小,大幅度的变化是不能看出装置是否漏气的。 以上两点中以第2点最为重要,是我们容易忽视的一个方面。 一、空气热胀冷缩法 这是教材上介绍的常用的一种方法,操作简便行,但有四个缺点:①如果仪器玻璃较厚、装置较大,或者手掌温度与空气温度相差不大时,都不会产生气泡,更不能形成水柱;②每检查一次用时间偏长;③导气管的尾端被水浸湿,不适宜做避免水参与的实验(如制氨气、制氯化氢等);④若装置内已经装入了试剂就不能再行检查。 二、注水法 适用于检查启普发生器或类似于启普发生器的装置。首先关闭排气导管,从顶部漏斗口注水,当漏斗下端被水封闭后再注水,水面不下降,表明装置气密性好;如果水面下降,表明装置气密性差。此法有两个缺点:①装置内部被水浸湿;②如果已装入了固体试剂则不能再行检查。 为了消除上述两种方法中的缺点,现设计了以下三种气密性检查方法。 三、外接导管浸水法 在装置的尾端导气管上外接一段橡皮管和20~30cm长的玻璃导管,导管浸入试管内的水中,水进入导管一段高度后不再进入,内外液面高度差较大,把试管上下移动几次,仍然如此,表明装置气密性好;如果水进入导管很多,液面高度差很小,表明装置气密性差。四、滴定管压气法 取一支25mL滴定管,下端与橡皮管连接,橡皮管变曲成U形与装置的尾端导管连接,滴定管内装满水。打开滴定管开关,水面下降一段距离后就停止不动,表明装置气密性好;如果水面一直下降不停,表明装置气密性差。 使用此法要注意:滴定管里水面不能超过装置尾端导管30cm高度,否则,压强太大,空气有可压缩性,水有可能流入装置里。 五、滴定管抽气法 取装水的一支25mL滴定管,其上端通过单孔橡皮塞和橡皮管与装置尾端导管连接。打开滴定管的开关,如果水面下降一段后就停止不动,表明装置气密性好;如果水面一直下降,表明装置气密性差。 装置气密性检验的常用方法 河南宏力学校高中部胡乔木
有机物分子式确定的计算方法
有机物分子式确定的计算方法 有机物分子式的确定,即是确定有机物分子里所含元素的种类及各原子的数目。有机物分子式的确定是有机物学习中,最为重要的知识点之一。关于确定有机物分子式的计算题目,也是有机物计算题目当中的重要考题之一。那么,如何确定有机物的分子式呢?总体来讲,先得确定有机物的组成元素,然后再确定各原子的数目从而确定有机物的分子式。下面笔者重点介绍一下在确定有机物分子式的计算当中的一些具体计算方法。 1、确定元素的组成 一般来说,有机物完全燃烧后,各元素对应的产物为c→co2,h→h2o。若有机物完全燃烧后的产物只有co2和h2o,则其组成的元素可能为c、h或c、h、o。欲判断该有机物是否含有氧元素,首先应求出产物中co2中的碳元素质量及h2o中的氢元素的质量,然后将这两种元素的质量相加,再和原有机物的质量进行比较,若相等,则原有机物中不含氧元素,若不相等则原有机物中必定含有氧元素。 2、确定分子式 在确定有机物的组成元素之后,接下来根据题目条件来最终确定这几种元素构成的物质的分子式。在确定分子式进行计算的时候,通常可以采用以下几种计算方法。 方法一、实验式法(即最简式法) 根据有机物的分子式为最简式的整数倍,利用其相对分子质量及求得
的最简式便可 确定其分子式。如烃的最简式求法为: 例1:某含c、h、o三元素的有机物,其c、h、o的质量比为6:1:8,该有机物蒸汽的密度是相同条件下的h2密度的30倍,求该有机物的分子式。 【解析】该有机物中的原子个数比为 故其实验式为ch2o,设其分子式为(ch2o)n,根据题意得: 。 则该有机物的分子式为c2h4o2。 方法二、单位物质的量法 根据题目中的已知条件,确定有机物的元素组成后,直接求出1mol该有机物中各元素原子的物质的量,即可推算出分子式。若给出一定条件下该有机物气体的密度(或相对密度)及各元素的质量分数,则求解分子式的基本途径为:密度(或相对密度)→m→1mol有机物气体中各元素原子的物质的量→分子式。 例2:6.2g某有机物a完全燃烧后,生成8.8gco2和5.4gh2o,并测得该有机物的蒸汽与h2的相对密度是31,求该有机物的分子式。 【解析】分别根据c、h的质量守恒求得a中的c、h质量分别为
有机化合物分子式的确定知识讲解
有机化合物分子式的 确定
高中化学有机化合物分子式的确定 编稿老师佘平平一校林卉二校黄楠审核王慧姝 【考点精讲】 1. 元素分析 ①碳、氢元素质量分数的测定 一般来说,有机物完全燃烧后,各元素的对应产物为:C―→CO2,H―→H2O,将样品置于氧气流中燃烧,燃烧后生成的水和二氧化碳分别用吸水剂和碱液吸收,称重后即可分别计算出样品中碳、氢元素的质量分数。 ②氧元素质量分数的确定。 ③依据碳氢氧的质量分数可求出该物的实验式。 2. 相对分子质量的测定 (1)质谱法 ①原理 样品分子分子离子和碎片离子到达检测器的时间因 质量不同而先后有别质谱图 ②质荷比:分子离子与碎片离子的相对质量与其电荷的比值。最大的数据即为有机物的相对分子质量。 由质谱图判断该有机物的相对分子质量为92。 (2)其他确定相对分子质量的方法: ①M=m/n ②根据有机蒸气的相对密度D,M1=DM2 ③标况下有机蒸气的密度为ρg/L,M=22.4L/mol·ρg/L 3. 确定有机物分子式的一般方法
(1)实验式法: ①根据有机物各元素的质量分数求出分子组成中各元素的原子个数比(最简式)。 ②求出有机物的摩尔质量(相对分子质量)。 (2)直接法: ①求出有机物的摩尔质量(相对分子质量)。 ②根据有机物各元素的质量分数直接求出1mol有机物中各元素原子的物质的量。 【典例精析】 例题1已知某有机物A的实验式为C2H4O,其质谱图如图所示: (1)该有机物的相对分子质量是。 (2)该有机物的分子式为。 思路导航:(1)质谱图最右方的E峰是分子离子产生的,所以其相对分子质量为88。(2)有机物表现的性质及相关结论―→官能团―→确定结构式。如能使溴的四氯化碳溶液褪色的有机物分子中可能含有CC,不能使溴的四氯化碳溶液褪色却能使酸性高锰酸钾溶液褪色的可能是苯的同系物等。实验式是C2H4O,可推出其分子式为C4H8O2。 答案:(1)88(2)C4H8O2 例题2 某有机物A 3.0 g,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式。 思路导航: (1)求有机物A中各元素的质量: m(C)=3.36 L 22.4 L·mol-1 ×12 g·mol-1=1.8 g。 m(H)=3.6 g 18 g·mol-1 ×2×1 g·mol-1=0.4 g。 因m(C)+m(H)=2.2 g<3.0 g,则有机物A中含有O元素,其质量为m(O)=3.0 g-2.2 g=0.8 g。 (2)求有机物A的实验式:
有机物分子式计算专题
有机物分子式确定的方法简述 有机物分子式是推导有机物结构的关键,快速准确的推导出分子式能使同学们在有机分析题中事半功倍,以下是我就一些简单、常见的有机物分子式确定的方法作一个简单的归纳:确定有机物分子式需要两个条件: 1、确定分子组成 2、确定分子中各元素对应的原子的个数 一、确定分子组成 确定分子组成最常见的方法就是燃烧法,而燃烧法核心原理就是质量守恒,有机物大多有C、 H、O构成,判断C、H很简单,而有机物中是否含O则需要以下方法确定. 利用测定燃烧产物得到: m(CO2)→n(C)→m(C) m(H2O)→n(H)→m(H) m(C)+ m(H)是否等于有机物中质量,如相等就证明有机物只含C H,反之则必定有O。 二、确定分子中各元素对应的原子的个数 1、实验式法(最简式法):分子式为实验式的整数倍,利用已知条件找到各个原子的个数比值 确定出实验式再结合分子相对分子质量推导出分子式 提示:对相对分子质量的基本求法: 1、列式计算下列有机物的相对分子质量; ①标准状况下某烃A气体密度为0.717g/L; ②某有机物B的蒸气密度是相同条件下氢气的14倍; ③标准状况下测得0.56g某烃C气体的体积为448mL; 【例题分析】 例1、常温下某气态烃A的密度为相同条件下氢气密度的15倍,该烃中C的质量分数为80%,则该烃的实验式为,分子式为。 2、直接法:直接计算出1mol气体中各元素原子的物质的量,即可推出分子式。 【例题分析】 例2、某烃A 0.1 mol,完全燃烧只生成标况下的CO2 4.48L和水5.4g
例3、0.1L某气态烃完全燃烧,在相同条件下测得生成0.1LCO2和0.2L水蒸气,该烃的分子式是() A. CH4 B. C2H4 C. C2H2 D. C3H6 3、通式法:根据有机物原子的组成通式来确定有机物分子式 烷烃C n H2n+2烯烃C n H2n炔烃C n H2n-2苯的同系物C n H2n-6烃C x H y 饱和一元醇C n H2n+2O 饱和一元醛C n H2n O饱和一元酸C n H2n O2 【例题分析】 例4、m g某饱和一元醇A,在氧气中完全燃烧,生成水14.4g,生成CO213.44L(标况下)试确定该有机物的分子式 例5、某烷烃7.2g进行氯代反应完全转化为一氯化物时,放出的气体通入500mL0.2mol/L的烧碱溶液中,恰好完全反应,此烃不能使溴水或酸性高锰酸钾溶液褪色,试求该烃的分子式。 4、平均值法:对于有机混合物,通常假设一个混合物的平均分子式(C x H y或C x H y O z),通 过已知条件推断出平均分子式,在利用平均分子式中碳氢个数来讨论混合物的组成可能。 【例题分析】 例6、由两种气态烃组成的混合烃20mL,跟过量O2完全燃烧。同温同压条件下当燃烧产物通过浓H2SO4后体积减少了30mL,然后通过碱石灰又减少40mL。这种混合气的组成可能有几种? 5、方程式法:利用燃烧的化学方程式进行计算推断 适用于已知条件是反应前后气体体积的变化、气体压强的变化或气体密度的变化的题型。 规律:气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,则原混合烃中的氢原子平均数大于4;若体积缩小,则原混合烃中氢原子平均数小于4,必有C2H2。(温度在100℃以上)
有机化学————有机物分子式的确定
有机化学————有机物分子式的确定 一.有机物组成元素的判断 某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。 欲判定该有机物中是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将碳、氢元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧;否则,原有机物的组成含氧。 二、有机物分子式的确定 1、根据最简式和分子量确定分子式 例1:某有机物中含碳40%、氢6.7%、氧53.3%,且其分子量为90,求其分子式。 例2:某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59g/L,写出该烃的分子式。 注意:(1)某些特殊组成的最简式,在不知化合物相对分子质量时,也可根据组成特点确定其分子式。例如最简式为CH3的在机物,其分子式可表示为(CH3)n,仅当n=2时,氢原子已达饱和,故其分子式为C2H6。同理,最简式为CH3O的有机物,当n=2时,其分子式为C2H6O2 (2)部分有机物的最简式中,氢原子已达饱和,则该有机物的最简式即为分子式。例如最简式为CH4、CH3Cl、C2H6O、C4H10O3等有机物,其最简式即为分子式。 2、根据各元素原子个数确定分子式 例1:吗啡分子含C:71.58% H:6.67% N :4.91% , 其余为氧,其分子量不超过300。试确定其分子式。 例2:实验测得某烃A中含碳85.7%,含氢14.3%。在标准状况下11.2L此化合物气体的质量为14g。求此烃的分子式。 3、根据通式确定分子式 烷烃CnH2n+2 烯烃或环烷烃CnH2n 炔烃或二烯烃CnH2n-2 苯及同系物CnH2n-6 用CnH2n-x(-2≤x≤6)和相对分子量可快速确定烃或分子式
化合物分子量
硝酸镍Ni(NO3)2 183 六水硝酸镍Ni(NO3)2·6H2O 291 氯化镍NiCl2 130 六水氯化镍:NiCl2·6H20 238 六水硫酸镍 263 六次甲基四胺 140 尿素 CO(NH2)2 60 草酸 C2H2O4 90 二水草酸C2H2O4·2H2O 126 柠檬酸 C6H8O7 192 二水氯化亚锡 SnCl2·2H2O 226 草酸锡 207 二氧化锡 SnO2 151 氧化亚锡 SnO 135 锡酸钠 NaSnO3 213 三水锡酸钠 Na2SnO3·3H2O 267 醋酸亚锡;乙酸亚:Tin(II) acetate C4H6O4Sn 237 CTAB 十六烷基三甲基溴化铵C16H33(CH3)3NBr 或C19H42NBr 364 氯化钡:BaCl2 208 葡萄糖 C6H12O6 180 柠檬酸钠二水合物 C6H5Na3O7.2H2O 294 浓氨水含氨28%~29%,密度0.9g/cm3 35 β-环糊精 1135 草酸锡 SnC2O4 207 五水四氯化锡 351 高锰酸钾KMnO4 158 二氧化锰 MnO2 87 乙酸锰醋酸锰Mn(CH3COO)2.4H2O 245 三乙醇胺 (HOCH2CH2)3N 149 对苯二胺C6H4(NH2)2 108 对苯二酚C6H6O2 110 硫酸锰 MnSO4.1H2O 醋酸锂 Li(CH3COO).2H2O 102 磷酸二氢铵 NH4H2PO4 115
一水氯化锂 LiCl.H2O 92.5 一水氢氧化锂 LiOH.H2O 74 硝酸锂 LiNO3 101 五水硫酸铜 CuSO4.5H2O 250 亚铁氰化钾 K4Fe(CN)6.3H2O 422 铁氰化钾 K3Fe(CN)6 329 碘化钾 KI 166 碘 I2 254
今有分子量为58的几种有机物
今有分子量为58的几种有机物,试推断符合条件的有机物的分子式或结构简式 (1)若该有机物为烃,则分子式为,其中带有支链的同分异构体在核磁共振氢谱图中有个吸收峰 (2)若该有机物是一种饱和一元脂肪醛,则其与新制氢氧化铜悬浊液在加热条件下反应的化学方程式为。 (3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则其结构简式为。(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则其结构简式 为 ,(注羟基连在双键上的有机物极不稳定)该物质生成高分子化合物的化学方程式为。 答案 (1)C4H10 2 (2)CH3CH2CHO+2Cu(OH)2+NaOH Cu2O↓+CH3CH2COONa+3H2O (3)OHC-CHO (4)CH2=CH-CH2OH 试题分析:(1)由于――2,所以如果该有机物是烃,则应该是烷烃,分子式是C4H10;其中带有支链的同分异构体是异丁烷,在核磁共振氢谱图中有2个吸收峰。 (2)饱和一元脂肪醛的通式是CnH2nO,因此14n+16=58,解得n=3,即为丙醛,和新制氢氧化铜悬浊液在加热条件下反应的化学方程式为CH3CH2CHO+2Cu(OH)2+NaOH Cu2O↓+CH3CH2COONa+3H2O。(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,说明分子中含有2个醛基,因此应该是乙二醛,即结构简式是OHC-CHO。 (4)该有机物能与金属钠反应,说明含有羟基;又能使溴的四氯化碳溶液褪色,说明含有碳碳双键或碳碳三键。因此根据相对分子质量是58可知,应该是丙烯醇,即CH2=CH-CH2OH。碳碳双键能发生加聚反应,生成高分子化合物,反应的方程式是
有机物分子式
课题:§3.2有机化合物结构的确定(第一课时) 编写人:张娟定稿人:周红侠审批人:日期:2011-5-30 班组:学生: 师评:组评: 【学习目标】 1、了解有机化合物结构测定的一般步骤和程序。 2、能进行确定有机化合物分子式的简单计算 【自主学习】 研读课本108--110页填空 1、测定有机化合物结构的核心步骤是确定,检测分子中的,及其在。 2、确定有机化合物分子式的基本思路:知道,各元素的,必要是要测定其。 一、确定有机化合物的元素组成 1、碳、氢元素的测定:最常用的方法是 ,. 测定步骤是:取样品在中充分;燃烧后的和依次通过___________ 和;称重后根据反应前后的质量变化,计算出样品中。 2、氮元素的测定:利用氧化还原反应,通过测定生成的体积,可计算出氮元素在有机物中的质量分数。 3、卤元素的测定方法:利用的特性,测定生成的质量来确定。 4、氧元素的测定:得知C 、H、 N、 X的质量分数后,若总和,其差值一般是的质量分数。 【小结】见课本110页“图3-2-2” 【思考】1,在某个有机物中,已知各原子的质量分数,如何推导出原子的个数比(即如何知道该有机物的实验式)? 2,已知有机物的实验式,能否直接确定有机物的分子式? 【练习】某烃含氢元素的质量分数为17.2%,求此烃的实验式。又测得该烃的相对分子质量是58,求该烃的分子式。
二、测定有机化合物的相对分子质量 测定有机化合物相对分子质量的方法: 除这个方法,我们还可以利用学过的公式或方法,如下: 1、M表示有机物摩尔质量,m表示质量,n表示物质的量,则M== 2、已知有机物蒸气在标准状况下的密度:则M== 3、已知有机物蒸气与某物质(相对分子质量为M’)在相同状况下的相对密 度D:则M= 4、根据化学方程式计算确定。 【合作探究】 1某有机物A中含碳为72.0%、含氢为6.67%,其余含有氧,则该物质的实验式是 , 2,某气态烃含碳、氢元素质量比为6∶1, 又知同温、同压下该气体密度为氢气密度的14倍, 则烃A的分子式是 3,燃烧某有机物A 1.50g,生成1.12LCO2(标准状况)和0.05molH2O 。又测得A的相对分子质量是30,求该有机物的分子式。 4,某有机物组成中含碳54.5%, 含氢9.1%,其余为氧又知其蒸汽在标况下的密度为3.94g/L,试求其分子式。 6,某气态有机物标准状况下密度为1.34克/升, 取1.50克该有机物在足量的氧气中燃烧。将所得气体通过装有浓H2SO4的洗气瓶后再通过碱石灰干燥管, 结果洗气瓶和干燥管分别增重0.9克和2.2克, 测得尾气中除氧气外无其它物质, 求该有机物的分子式?
确定有机物分子式的解题策略
确定有机物分子式的解题策略 有机物分子式的求解是中学化学中的重要内容之一,也是高考中的热点 之一。现介绍有机物分子确定的常见技巧和方法。 一、由最简式和相对分子质量确定分子式。 通过测定有机物中各元素的质量分数,确定有机物的最简式,再依据 有机物的分子量来确定分子式。 例1.某有机物中含碳40%、氢6.7%、氧53.3%,且其相对分子质量 为90,求其分子式。 解析:该有机物中C、H、O的原子个数比为N(C):N(H):N(O) = 1:2: 1 。因此,该有机物的最简式为CH2O。设其分子式为(CH2O)n 。又其相对 分子质量为90,则n=3 。即其分子式为C3H6O3。 注意:(1)某些特殊组成的最简式,在不知化合物相对分子质量时,也可 根据组成特点确定其分子式。例如最简式为CH3的在机物,其分子式可表示 为(CH3)n,仅当n=2时,氢原子已达饱和,故其分子式为C2H6。同理,最 简式为CH3O的有机物,当n=2时,其分子式为C2H6O2 (2)部分有机物的最简式中,氢原子已达饱和,则该有机物的最简式即为 分子式。例如最简式为CH4、CH3Cl、C2H6O、C5H12O4等有机物,其最简式 即为分子式。 二、由通式确定分子式 烷烃通式为C n H2n+2,烯烃通式为C n H2n,炔烃通式为C n H2n-2,苯及同系物 的通式为C n H2n-6,饱和一元醇的通式为C n H2n+2O等,可以根据已知条件, 确定分子中的碳原子数(或分子量)再据通式写出分子式。 例2.某烃含氢元素17.2%,求此烃的分子式。 解析:该烃分子中各元素的原子个数之比为N(C)/ N (H) = 2∶5根据烃的 通式,C、H原子个数有三种情况。(1)烷烃:n/(2n+2)<1/2 ;(2)烯烃:n/2n = 1/2 ;(3)炔烃和芳香烃:n/(2n-2)和n/(2n-6)均>1/2 。题中N(C)/ N (H) = 2∶5, 符合(1)则有n/(2n+2)=2/5,n=4,所以烃的分子式为C4H10 三、由元素原子个数确定分子式 通过测定有机物中各元素的质量分数,再结合相对分子质量,可以确定有机物中各元素的原子个数,从而写出分子式。 例3.吗啡分子含C:71.58% H:6.67% N :4.91% , 其余为氧, 其相对分子质量不超过300。试确定其分子式。 解析:由已知条件可知含氧为16.84%,观察可知含N量最少,据原子量 可知,含N原子的个数最少,可设含n个N原子,则吗啡的分子量为14n/4.91% = 285n<300,即吗啡含有1个N,分子量为285。则吗啡分子中:N(C)=17 N (H)=19 N (O)=3 吗啡的分子式为C17H19NO3 四、商余法
各类有机物的一般通式及分子式的通式归纳如下
各类有机物的一般通式及分子式的通式归纳如下 1、烷烃的一般通式:CnH ( ≥1 ) 2、环烷烃的一般通式:CnH 2n ( n ≥3) 3、烯烃的一般通式:CnH 2n ( n ≥2) 4、二烯烃的一般通式:CnH 2n -2 (n ≥3) 5、炔烃的一般通式:CnH 2n -2 ( n ≥2) 6、苯和苯的同系物的一般通式:CnH 2n -6 7、一元卤代烃的一般通式:R —X (R 代表烃基,X 代表卤素原子) 8、饱和一元醇的一般通式:CnH 2n+1—OH (n ≥1) 饱和一元醇的分子式的通式:CnH 2n+2O (n ≥1) 乙二醇的结构简式: , 丙三醇的结构简式: (分子式:C 2H 6O 2) (分子式:C 3H 8O 3) 9、醚的一般通式:R —O —R (R,R 代表烃基,可以相同,也可以不同) 10、醛的一般通式:R (或H )—CHO (R 代表烃基) 饱和一元醛的通式:CnH 2n+1—CHO (n ≥1) 饱和一元醛的分子式的通式:CnH 2n O 11、酮的一般通式:R —CO —R (R ,R 代表烃基,可以相同,也可以不同) 12、羧酸的一般通式:R (或H )—COOH (R 代表烃基) 饱和一元羧酸的通式: CnH 2n+1—COOH 饱和一元羧酸的分子式的通式:CnH 2n O 2 13、酯的一般通式:R (或H )—COOR 饱和酯的分子式的通式:CnH 2n O 2 14、 葡萄糖的分子式:C 6H 12O 6 分子结构:多羟基醛的结构 葡萄糖的结构简式:CH 2OH (CHOH )4CHO 15、果糖的分子式:C 6H 12O 6 分子结构:多羟基酮的结构 果糖的结构简式:CH 2OH (CHOH ) 3COCH 2OH 16、蔗糖的分子式:C 12H 22O 11 分子结构:不含醛基 17、麦芽糖的分子式:C 12H 22O 11 分子结构:含有醛基 18、淀粉的分子式:(C 6H 10O 5)n 19、纤维素的分子式:(C 6H 10O 5)n 20、几种重要的氨基酸:(甘氨酸,丙氨酸,苯丙氨酸,谷氨酸)其结构简式如下。 2n +1 n 互为同分异构体 互为同分异构体 , , , CH 2 CH 2 OH OH CH 2 CH CH 2 OH OH OH , , , 醛和酮互为同分异构体 醇和醚互为同分异构 体 羧酸和酯互为同分异构体 葡萄糖和果糖互为同分构体 互为同分异构体 n 值不同,它们不互为同分异构体 甘氨酸 CH 2 NH 2 a —氨基乙酸 C OH O 丙氨酸 a —氨基丙酸 C OH O NH 2 CH 3—CH —— 苯丙氨酸 a —氨基β—苯基丙酸 C OH O CH — 2 2— 谷氨酸 a —氨基戊二酸 C OH O C HO O CH —CH 2—CH 2— NH 2
关于有机物分子式确定的计算例题及训练
一、有机物分子式的确定 【例1】实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。 【例2】2.3g某有机物A完全燃烧后,生成0.1 mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。 【例3】0.60g某饱和一元醇 A,与足量的金属钠反应,生成氢气112mL(标准状况)。求该一元醇的分子式。 [例4] 某烃含碳氢两元素的质量比为3∶1,该烃对H2的相对密度为8,试确定该烃的分子式. [例5]已知第一种气态有机物在标准状况下的密度为2.59g/L,第二种气态有机物对空气的相对密度为1.87,第三种气态有机物在标准状况下250mL质量为0.49g.求这三种有机物的相对分子质量. [例6]某气态碳氢化合物中含碳75%,它的密度是同温同压下氢气密度的8倍,求有机物的分子式. [例7] 某烃1.68g,完全燃烧生成CO25.28g和H2O2.16g,经测定这种烃在标准状况下的密度为3.75g/L则其分子式是 [例题8] 2.3g某有机物A完全燃烧后,生成0.1molCO2和2.7g H2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式. [例9]标准状况下,密度为0.717g/L的某气态烃0.56L,在足量氧气中充分燃烧,反应后的气体先通过无水氯化钙,氯化钙增重0.9g;再通过氢氧化钠溶液,溶液增重1.1g.通过计算判断此气态烃的分子式,并画出其分子空间结构的示意图. [例10] 标准状况下4.48L某烯烃和CO的混合气体与足量的氧气混合点燃,使之反应,将反应完毕后生成的气体通过浓硫酸,浓硫酸增重7.2g,并测得剩余气体中CO2为11.2L (标准状况),求此烯烃分子式.
相对分子质量(及常见化合物的相对分子质量)
氢气H2 2 氨气NH3 17 氮气N2 28 氧气O2 32 一氧化碳CO 28 二氧化碳CO2 44 一氧化硫SO 48 二氧化硫SO2 64 三氧化硫SO3 80 二氧化锰MnO2 87 二氧化硅SiO2 60 一氧化氮NO 30 二氧化氮NO2 46 三氧化钨WO3 232 二硫化碳CS2 76 二硫化亚铁 FeS2 120 五氧化二磷 P2O5 142 氧化铁Fe2O3 160 氧化亚铁FeO 82 四氧化三铁 Fe3O4 232 氧化铜CuO 80 氧化亚铜Cu2O 144 氧化钠Na2O 62 氧化镁MgO 40 氧化钙CaO 56 氧化铝Al2O3 102 氧化汞HgO 217 氧化银Ag2O 232 氧化铅PbO 223 氧化锌ZnO 81 过氧化氢H2O2 34 氯气Cl2 71 氯化钾KCl 74.5 氯化钠NaCl 58.5 氯化镁MgCl2 95 氯化钙CaCl2 111 氯化铜CuCl2 135 氯化锌ZnCl2 136 氯化钡BaCl2 208 氯化铝AlCl3 133.5 氯化铁FeCl3 162.5 氯化亚铁FeCl2 127 氯化银AgCl 143.5 氯化氢HCl 36.5
氯酸钾KClO3 122.5 氯化铵NH4Cl 53.5 硫酸H2SO4 98 硫酸锌ZnSO4 161 硫酸铵(NH4)2SO4 132 硫酸铜CuSO4 160 硫酸钡BaSO4 233 硫酸钙CaSO4 136 硫酸钾KSO4 135 硫酸钠Na2SO4 142 硫酸镁MgSO4 120 硫酸铁Fe2(SO4)3 400 硫酸亚铁FeSO4 152 硫酸铝Al2(SO4)3 342 硫酸氢钠NaHSO4 120 硫酸氢钾KHSO4 136 亚硫酸H2SO3 82 亚硫酸钠NaSO3 103 亚硫酸铁Fe2(SO3)3 352 亚硫酸亚铁 FeSO3 136 磷酸H3PO4 98 磷酸钠Na3PO4 164 磷酸钙Ca3(PO4)2 310 磷酸二氢铵 NH4H2PO4 115 羟基磷酸钙 Ca5(OH)(PO4)3 502 硝酸HNO3 63 亚硝酸HNO2 47 硝酸钠NaNO3 85 硝酸钾KNO3 101 硝酸银AgNO3 170 硝酸镁MgNO3 86 硝酸铜Cu(NO3)2 188 硝酸铵NH4NO3 80 硝酸钙Ca(NO3)2 164 碳酸H2CO3 62 碳酸钠Na2CO3 106 碳酸钙CaCO3 100 碳酸镁MgCO3 84 碳酸钾K2CO3 138 碳酸氢铵NH4HCO3 79 碱式碳酸铜 Cu2(OH)2CO3 222 氢氧化钠NaOH 40 氢氧化钙Ca(OH)2 74 氢氧化钡Ba(OH)2 171
有机物分子式计算专题
有机物分子式确定的方法简述 有机物分子式就是推导有机物结构的关键,快速准确的推导出分子式能使同学们在有机分析题中事半功倍,以下就是我就一些简单、常见的有机物分子式确定的方法作一个简单的归纳: 确定有机物分子式需要两个条件: 1、确定分子组成 2、确定分子中各元素对应的原子的个数 一、确定分子组成 确定分子组成最常见的方法就就是燃烧法,而燃烧法核心原理就就是质量守恒,有机物大多有 C、H、O构成,判断C、H很简单,而有机物中就是否含O则需要以下方法确定、 利用测定燃烧产物得到: m(CO2)→n(C)→m(C) m(H2O)→n(H)→m(H) m(C)+ m(H)就是否等于有机物中质量,如相等就证明有机物只含C H,反之则必定有O。 二、确定分子中各元素对应的原子的个数 1、实验式法(最简式法):分子式为实验式的整数倍,利用已知条件找到各个原子的个数比值确定 出实验式再结合分子相对分子质量推导出分子式 ①标准状况下某烃A气体密度为0、717g/L; ②某有机物B的蒸气密度就是相同条件下氢气的14倍; ③标准状况下测得0、56g某烃C气体的体积为448mL; 【例题分析】 例1、常温下某气态烃A的密度为相同条件下氢气密度的15倍,该烃中C的质量分数为80%,则该烃的实验式为,分子式为。 2、直接法:直接计算出1mol气体中各元素原子的物质的量,即可推出分子式。 【例题分析】 例2、某烃A 0、1 mol,完全燃烧只生成标况下的CO2 4、48L与水5、4g 例3、0、1L某气态烃完全燃烧,在相同条件下测得生成0、1LCO2与0、2L水蒸气,该烃的分子式就是( ) A、CH4 B、C2H4 C、C2H2 D、C3H6 3、通式法:根据有机物原子的组成通式来确定有机物分子式 烷烃C n H2n+2烯烃C n H2n炔烃C n H2n-2苯的同系物C n H2n-6烃C x H y 饱与一元醇C n H2n+2O 饱与一元醛C n H2n O饱与一元酸C n H2n O2
有机化合物分子式的确定
高中化学有机化合物分子式的确定 编稿老师佘平平一校林卉二校黄楠审核王慧姝 【考点精讲】 1. 元素分析 ①碳、氢元素质量分数的测定 一般来说,有机物完全燃烧后,各元素的对应产物为:C―→CO2,H―→H2O,将样品置于氧气流中燃烧,燃烧后生成的水和二氧化碳分别用吸水剂和碱液吸收,称重后即可分别计算出样品中碳、氢元素的质量分数。 ②氧元素质量分数的确定。 ③依据碳氢氧的质量分数可求出该物的实验式。 2. 相对分子质量的测定 (1)质谱法 ①原理 样品分子分子离子和碎片离子到达检测器的时间因质量不同而先后有别质谱图 ②质荷比:分子离子与碎片离子的相对质量与其电荷的比值。最大的数据即为有机物的相对分子质量。 由质谱图判断该有机物的相对分子质量为92。 (2)其他确定相对分子质量的方法: ①M=m/n ②根据有机蒸气的相对密度D,M1=DM2 ③标况下有机蒸气的密度为ρg/L,M=22.4L/mol·ρg/L 3. 确定有机物分子式的一般方法 (1)实验式法:
①根据有机物各元素的质量分数求出分子组成中各元素的原子个数比(最简式)。 ②求出有机物的摩尔质量(相对分子质量)。 (2)直接法: ①求出有机物的摩尔质量(相对分子质量)。 ②根据有机物各元素的质量分数直接求出1mol有机物中各元素原子的物质的量。 【典例精析】 例题1已知某有机物A的实验式为C2H4O,其质谱图如图所示: (1)该有机物的相对分子质量是。 (2)该有机物的分子式为。 思路导航:(1)质谱图最右方的E峰是分子离子产生的,所以其相对分子质量为88。(2)有机物表现的性质及相关结论―→官能团―→确定结构式。如能使溴的四氯化碳溶液褪色的有机物分子中可能含有CC,不能使溴的四氯化碳溶液褪色却能使酸性高锰酸钾溶液褪色的可能是苯的同系物等。实验式是C2H4O,可推出其分子式为C4H8O2。 答案:(1)88(2)C4H8O2 例题2 某有机物A 3.0 g,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式。 思路导航: (1)求有机物A中各元素的质量: m(C)=3.36 L 22.4 L·mol-1 ×12 g·mol-1=1.8 g。 m(H)=3.6 g 18 g·mol-1 ×2×1 g·mol-1=0.4 g。 因m(C)+m(H)=2.2 g<3.0 g,则有机物A中含有O元素,其质量为m(O)=3.0 g-2.2 g=0.8 g。 (2)求有机物A的实验式: n(C)∶n(H)∶n(O)=1.8 g 12∶ 0.4 g 1∶ 0.8 g 16=3∶8∶1。 则有机物A的实验式为C3H8O。 (3)求有机物A的相对分子质量:M r(A)=30×2=60。(4)求有机物A的分子式:
