8、氯、溴、碘及其化合物
氯、溴、碘及其化合物

►
7 构示意图为____________,氯原子最外层有________ 个电子,易得到________ 个电子而形成氯离子,是活泼的 1 非金属元素。在自然界中以化合态形式存在。
返回目录
第六单元 氯、溴、碘及其化合物
考 向 互 动 探 究
2.氯气的物理性质
颜色 状态 气味 密度 毒性 溶解性 是否 易液化 易液化 ______
- 橙色或橙红色,表明有 Br - 紫色或浅紫、紫红色,表明有I
返回目录
第六单元 氯、溴、碘及其化合物
考 向 互 动 探 究
问题导思
非金属氢化物的沸点递变性,一般随相对
分子质量的增大而升高,但卤族元素氢化物 HF 沸点反常的 原因是什么?
[答案] 提示:分子间存在氢键,使熔沸点升高。
3 . 1 mol Cl2 与 足 量 的铁 反 应 ,转 移 的 电 子 数 为 3NA( )
4. 电解 58.5 g 熔融的 NaCl,能产生 22.4 L 氯气(标准 状况)、23.0 g 金属钠( )
返回目录
第六单元 氯、溴、碘及其化合物
考 向 互 动 探 究
—— 核心突破 —— 1.氯水与液氯的区别
返回目录
第六单元 氯、溴、碘及其化合物
考 向 互 动 探 究
【触摸学考】 学考选项正误判断
1.
131 53
I 的化学性质与 53I 相同(
127
)
(
2. 二氧化氯具有还原性,可用于自来水的杀菌消毒 )
3. 同主族元素从上到下, 单质的熔点逐渐降低(
)
返回目录
第六单元 氯、溴、碘及其化合物
考 向 互 动 探 究
黄绿 ____ 色
2020年浙江高考化学复习:专题十从海水中获得的化学物质
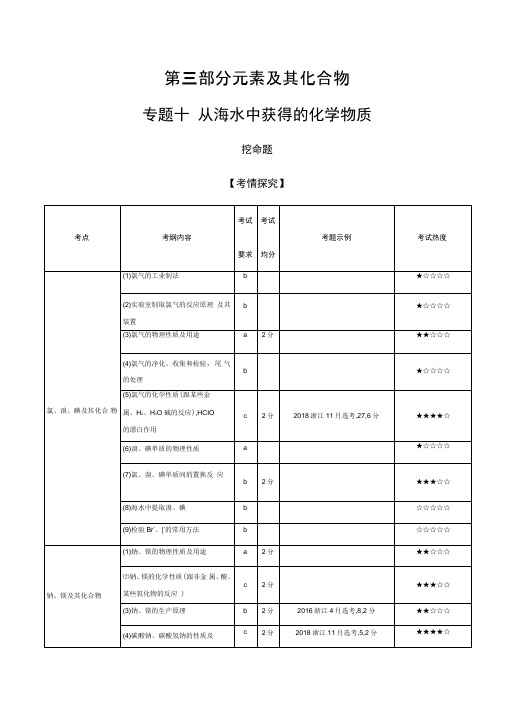
第三部分元素及其化合物专题十从海水中获得的化学物质挖命题【考情探究】分析解读本专题选择题重点考查点有二:一是氯气的性质及用途;二是钠、碳酸钠和碳酸氢钠的性质及用途,试题难度不大。
主观题部分单独命题的可能性不大 ,通常以元素化合物知识为载体,融离子反应、氧化 还原反应、反应速率与化学平衡、电化学及盐类的水解与电离等知识于一体进行考查。
预计今后高考对本 专题内容的考查方式基本不变。
【真题典例】--------------------------------------------------------- 於-(2018^11月选夸.27・6分}已知化讣物耳甫1种无武蛆盛*莘学习小範 进行丁如下实验:① 飙适贲X.加水完全瀋解.无气体产生*擀浚呈喊性;进甘焰色反应、 进过蓝色姑玻璃现泉到火焰呈購色 ②詳溥十水* iDA^HClO^OOftnol 的盐戕恰好屮狗;屮和右闸得蒂權与硝酸战化的过駄曲阻間液反逼•穆^14305曲色观金 谓岡答* 1(悄中3神无素是 _________ (用元素挣号表加)◎肚宾与比反应的化学片程式尼 __________________________________________[3JX 中-种尤我对应的单匮,可与足童的屉落襪反应谓到(斗打马川厦 反应的化学方程式;破考点 【考点集训】考点一 氯、溴、碘及其化合物1.(2019届浙江宁波镇海中学高一单元测试 ,6)下列离子方程式正确的是( )① 氯气与水反应:Cl 2+H — 2H ++CI+CI0-; ② 氯气与氢氧化钠溶液反应:Cl 2+2OHCl -+CIO+HO;■o itfflX'F 暂評屯虜.■ Q 長鸣儿耳TvK 乂匚兀。
为认 KCH*丄乂虫T.飆』o 檢心當点I, 物庫曲址的肖誥计卑 ♦甜LR 其去突此合输的性虜❷能力要求卄显时踪合论他力、力利恢 1受新知训及扶临有恢偵嵐繼力的考畫. @解题思路⑴根谣①和M 综合拆斷十135诅和木反 应生廣0E mnl SI 和n.H2 rnJ K 〔Hi ・曲*厂 <\ II II.-I^KIJ ■…. .|-I II : wl- ''ll| ] Z \ i' 恻 EX 刑ClgUU ind K ?9 肿iud+A5,脚叔”I flfil niDixlJad :由”化含辆、祁种元議 ffljR'W t 览合將中可舐飭扛元竄咸耙 元札Hff 9UK^AM«元轧K*廉的量为QDlnd*所口负为£00〔期L K 反应的化爭方程式为血H.U = 2K0H+Kd«(3)1CL+H J1O= 2IKI +CLO , 2Xd.CO J +2UU^^2\.^i j+2XdllU). HlhliW 2O S +2N^C0^M 3O=^!NJ1C0J +4 2\da+u,o "❹易信谆示勉引问屮色输35解液足ht.姑訴 月星式蜡写肖2“尹制屮1%^=1珂f +4 2Xd (J+< 1J ).❺答案(1M <X 0aiK/304^ ----------- BKOfbKi I(3)2N^C01+2O 1+H 1Q^-€l ]p4lNflH(:O.+2Nut3❺规律总结 几柑"瘪礼曲:牡徳闌息凰略_ (龙族Hi 实益議探中晡冇息山及魁] 谭赵卜T 估£1-什小时乩忡珀样屮附 e\~^救辿,衍nt W>5 p $疋逍L .2•「172.-5 于 4 I'' I'- I'f . 样丈霽直班叩Vr 域的愛邑*所毎辆 甩冷:咛F ;屮吋詁I <t-r i i(t<.- 址吐枠冷一馭Fhi.EL 4 n 餐盜CT * 山Z'.M iq, Bfi 册 厲、抻立M 豪.大IHfltt,金ID# ^iirffiriio (Viwn 跡 质的无盍,期股的化学KlUJtAOi f7'.>ntt'":详式△③浓盐酸与二氧化锰共热:MnC2+4HCI(浓)Mn2++2CI+Cl2 f +2H0;④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2CIO +HO+C — CaCO J +2HCIQA. ①③B.②④C.②③D.①④答案B2. (2019届浙江温州瑞安中学单元检测,3)下列与含氯化合物有关的说法正确的是()A. HCIO是弱酸,所以NaCIO是弱电解质B. 向沸水中逐滴加入少量饱和FeCb溶液,可制得Fe(OH)3胶体C. HCI溶液和NaCI溶液均通过离子导电,所以HCI和NaCI均是离子化合物D. 电解NaCI溶液得到22.4 L H 2(标准状况),理论上需要转移N A个电子(N A表示阿伏加德罗常数)答案B3. (2018浙江武义一中高一期末,12)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图所示装置进行氯、溴、碘的性质实验。
高中化学:第一单元 氯、溴、碘及其化合物

专题三非金属及其化合物考纲导学1 / 27第一单元氯、溴、碘及其化合物考点一氯气及其化合物的性质与应用1.判断正误,正确的画“√”,错误的画“✕”。
(1)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气( )(2)Cl2具有很强的氧化性,在化学反应中只能作氧化剂( )(3)Cl2与水反应的离子方程式:Cl2+H2O 2H++Cl-+ClO-( )(4)Cl2通入NaOH溶液中反应的离子方程式为Cl2+2OH- Cl-+ClO-+H2O ( )(5)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5N A ( )(6)“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性( )2 / 27(7)漂白粉溶于水后形成的溶液在空气中失效的离子方程式:ClO-+CO2+H2O HClO+HC O3-( )答案(1)√(2)✕(3)✕(4)√(5)✕(6)√(7)✕2.应用氯水中存在的平衡解释下列问题。
(1)氯水为什么要现用现配?实验室中怎样保存氯水?。
(2)为什么要用饱和食盐水除去Cl2中的HCl气体?。
(3)怎样利用氯水制备较浓的次氯酸溶液?为什么?。
答案(1)次氯酸不稳定,见光分解,2HClO 2HCl+O2↑,久置氯水最终变成稀盐酸。
氯水保存在棕色试剂瓶中并放置在阴暗处(2)在氯水中存在:Cl2+H2O H++Cl-+HClO,在饱和食盐水中Cl-的浓度较大,平衡逆向移动,减少氯气的消耗(3)往氯水中加入CaCO3;加入CaCO3,CaCO3与盐酸反应,促进Cl2+H2O H++Cl-+HClO平衡正向移动,同时酸性H2CO3>HClO,HClO与CaCO3不反应,可以制备较浓的次氯酸溶液1.氯气的性质(1)物理性质3 / 27提醒:闻氯气气味的方法是用手在瓶口轻轻扇动,使极少量的Cl2飘进鼻孔。
(2)化学性质A.与金属反应:与变价金属反应生成高价金属氯化物。
氯溴碘与氧化还原反应知识点与习题

Cl--35.5 Br--80 I--127一、氯、溴、碘及其化合物一、氯、溴、碘的提取(一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业我国主要以海盐为原料。
海盐中含硫酸钙、硫酸镁、氯化镁等杂质,要净化后制成饱和食盐水再电解。
2NaCl + 2H2O =通电= 2NaOH + H2↑+Cl2↑氯碱工业面临问题:①产品对设备腐蚀严重、环境污染显著。
②电能消耗量大。
(二)从海水中提取溴的常见工艺①浓缩并酸化海水后,通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2=Br2+2NaCl②向含溴单质的水溶液中通热空气和水蒸汽,使溴从溶液挥发,冷凝得到粗溴,精致后得到高纯度的溴单质。
(三)从海洋植物中提取碘的主要工艺①用水浸泡海带或海藻灼烧后的灰烬②向水中通入适量的氯气,使碘离子转化为碘单质:2NaI+Cl2 == I2+2NaCl③过滤,用有机溶剂萃取碘单质。
二、氯、溴、碘的性质和用途(一)氯气(chlorine gas)的性质和用途①实验室制氯气:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O②装置:固液加热型③收集:向上排空气法④验满:湿润的淀粉-碘化钾试纸(将试纸靠近瓶口,若试纸变色说明已搜集满)等⑤尾气吸收:NaOH溶液(排饱和食盐水)。
1、物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体。
能溶于水,有毒。
2、化学性质:氯原子易得电子,氯是活泼的非金属元素。
氯气与金属、非金属等发生氧化还原反应,一般作氧化剂。
与水、碱溶液则发生自身氧化还原反应,既作氧化剂又作还原剂。
与金属的反应:Cu+Cl2=点燃=CuCl2现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色。
2Na+Cl2=点燃=2NaCl(白烟)2Fe+3Cl2=点燃=2FeCl3现象:铁丝在氯气里剧烈燃烧,瓶里充满棕红色烟,加少量水后,溶液呈黄色。
常温下,干燥氯气或液氯不与铁反应,所以可用钢瓶储存氯气。
氯、溴、碘性质

卤化银的用途:课本P47
考点精讲
考点一 氯水的成分和性质 1.氯水的成分是什么微粒,为什么? 提示 氯气溶于水,发生反应的离子方程式是 Cl2 +
H2 共 4 种。
+
+Cl-+HClO, 其中含有的分子有 Cl2、 H2O、
- + - -
HClO,共 3 种;含有的离子有 Cl 、H 、OH 、ClO ,
思考 3
将 Cl2 通入石蕊试液中的现象是什么?
能用 pH 试纸测定氯水的 pH 值吗?
提示
现象是先变红后褪色。不能用pH试纸
测定,因为氯水中的HClO能将pH试纸漂白。
二、含氯化合物 1.次氯酸(HClO)
光(或△) (1)不稳定性:化学方程式为 2HClO========2HCl+O2↑ 。
三、氯气的生产原理 1.“氯碱工业”的生产原理(用化学方程式表示)
2NaCl+2H2O
2NaOH+Cl2↑+H2↑ 。
碳棒
铁棒
饱和食盐水
NaOH溶液
2.实验室制法: 反应原理: MnO2+4HCl(浓)
MnCl 。 2+Cl2↑+2H2O
四、溴、碘的提取 1.从海水中提取溴的常见工艺 从海水中提取溴,一般要经历三个步骤,即浓缩、氧化和 提取。 (1)浓缩并酸化海水后,通入适量的氯气,使溴离子转化为 溴单质,其化学方程式: 2NaBr+Cl2===Br2+2NaCl 。 (2)向含溴单质的水溶液中通热空气或水蒸气,将溴单质吹 入盛二氧化硫溶液的吸收塔内以达到富集的目的,其化学方程 式:
(2)置换 —萃取法 加适量新制饱和氯水 未知液———————————→ 振荡 加入 CCl4(下层)或汽油(上层) ————————————→ 有机层 振荡
氯、溴、碘及其化合物知识点整理

氯、溴、碘及其化合物知识点整理氯、溴、碘及其化合物考点一:氯气的性质与制法氯气是一种黄绿色气体,具有刺激性气味和强氧化性。
它的密度比空气大,有毒且可溶于水。
氯气在与金属反应时能生成高价金属氯化物,如与铁反应生成FeCl3,与铜反应生成CuCl2.它与非金属也能反应,如与氢气反应生成HCl。
此外,氯气还能与水反应生成HCl和HClO,与碱反应制取漂白粉。
工业上通常采用电解饱和食盐水的方法制取氯气,称为氯碱工业。
原料是NaCl和水,经过电解反应后生成NaOH、H2和Cl2.实验室制取氯气的方法有多种,常用的是浓盐酸与二氧化锰共热制取。
制备过程中需要用强氧化剂氧化浓盐酸,然后用饱和食盐水除去HCl气体,再用浓H2SO4除去水蒸气,最后用向上排空气法或排饱和食盐水法收集氯气。
在实验室中,可以用试纸来判断氯气是否已经集满。
常用的试纸有淀粉-KI试纸和蓝色石蕊试纸,将湿润的试纸靠近氯气瓶口,如果试纸立即变蓝或先变红后褪色,则证明已经集满氯气。
除了F2和I2以外,单质NaX可以通过2NaOH的反应制备得到,其中X可以是Cl2、Br2或I2.这些单质具有递变性,随着原子序数的增加,它们的颜色、熔点、沸点、密度和水溶性都逐渐增强或减弱,而氧化性则逐渐减弱,还原性则逐渐增强。
Br2是唯一在常温下呈液态的非金属单质,但易挥发且有毒,通常用水液封保存。
I2易升华,与淀粉反应会显蓝色,与Na2S2O3溶液反应会生成S4O6和I2,用于定量测定碘的含量。
Br2和I2都可以被某些有机溶剂(如四氯化碳)萃取。
氟元素无正价,F2与H2O反应会生成O2,与Xe、Kr等稀有气体反应会生成白色氟化物。
Cl2、Br2和I2之间可以发生置换反应,其中Cl2的氧化性最强,I2的还原性最强。
因此,它们可以发生如下反应:Cl2+2Br=2Cl+Br2;Cl2+2I=2Cl+I2;Br2+2I=2Br+I2.海水中可以提取溴和碘。
提取溴的过程包括将海水浓缩,加入Cl2使其与NaBr反应生成Br2,然后用蒸馏和H2SO4酸化将Br2提取出来。
氯溴碘及其化合物知识点整理
氯溴碘及其化合物知识点整理一、氯(Cl)1.物理性质:-氯是一种黄绿色气体,在常温常压下存在于二元分子(Cl2)的形式。
-它具有刺激性气味,是一种强氧化剂和消毒剂。
2.化学性质:-氯是一种非金属元素,能够与金属形成离子化合物,如氯化物(Cl-)。
-氯对大多数有机物具有强氧化性,可以与有机物发生取代反应。
-氯可以和氢反应生成氯化氢气体(HCl),这是一种强酸。
-氯和氧反应能够形成一系列的氧化物,如氯气分子可以与水反应形成亚氯酸(HClO)。
3.应用:-氯的化合物广泛应用于消毒、漂白、污水处理等领域。
- 氯和氟的混合物(氯氟烃)被用作制冷剂(如氯氟化甲烷,也称为Freon)。
二、溴(Br)1.物理性质:-溴是一种红棕色液体,在常温下存在于单质溴的形式。
-溴的蒸气具有刺激性气味。
2.化学性质:-溴同样是一种非金属元素,能够与金属形成离子化合物。
-溴的化学性质与氯相似,但比氯的活泼性较低。
-溴和氢反应生成溴化氢气体(HBr),也是一种酸性物质。
3.应用:-溴的化合物有广泛的应用,如溴化银被用于消化道造影剂,溴化钾用作阻火剂。
三、碘(I)1.物理性质:-碘是一种紫黑色固体,在常温下以单质碘的形式存在。
-碘可以升华为紫蓝色气体。
2.化学性质:-碘是一种卤素,化学性质与氯和溴类似,但比溴更不活泼。
-碘可以与金属反应形成离子化合物。
-碘和氢反应生成碘化氢气体(HI),是一种强酸。
3.应用:-碘的化合物广泛应用于药物、消毒剂、防火剂等领域。
碘酒和碘酊是常见的外用消毒剂。
四、氯、溴、碘化合物1.氯化物:-氯化物是氯与其他元素形成的化合物,如氯化钠(NaCl)是一种常见的食盐。
-氯化物在化学工业中广泛应用,如氯化铝(AlCl3)用于催化剂。
2.溴化物:-溴化物是溴与其他元素形成的化合物,如溴化钠(NaBr)被用作疗法中的抗癫痫药物。
-溴化钾(KBr)也被用作照相纸中的显影剂。
3.碘化物:-碘化物是碘与其他元素形成的化合物,如碘化钾(KI)是一种常用的抗甲状腺药物。
高考化学专题复习 氯、溴、碘及其化合物
3.下图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。向
KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 已知:2KMnO4+16HCl===2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是( )
实验现象
A
a处变蓝,b处变红棕色
B
c处先变红,后褪色
解析 A 项,该装置的错误有:没有用酒精灯加热,MnO2 不与浓盐酸发生反应,从 而得不到 Cl2;装置中没有用分液漏斗而采用长颈漏斗导致气体外逸和 HCl 的挥发; 没有进行尾气处理;B 项,Cl2 的密度比空气大,该收集方法正确;C 项,要得到干燥 纯净的 Cl2,首先应将气体通过饱和食盐水除去 HCl,再通过浓硫酸除去水蒸气;D 项,根据反应:MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O,盐酸浓度变稀后便不 再反应,使产生的 Cl2 的物质的量小于 0.5 mol,转移的电子小于 1 mol。 答案 A
2.某化学小组用如图所示装置制取氯气。下列说法正确的是( )
A.该装置图中至少存在三处明显错误 B.该实验中收集氯气的方法不正确 C.如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装 有浓硫酸的洗气瓶即可 D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电 子
C
d处立即褪色
D
e处变红色
解释或结论 氧化性:Cl2>Br2>I2 氯气与水生成了酸性物质 氯气与水生成了漂白性物质 还原性:Fe2+>Cl-
解析 选项A的实验现象只能说明氧化性:Cl2>Br2和Cl2>I2,不能说明氧化性Br2>I2; 选项B的实验现象还可以说明氯气与水生成了漂白性物质;选项C中,氯气与水生成 的酸性物质也可以使之出现对应的实验现象;e处变红色是氯气氧化Fe2+生成Fe3+的 结果,说明还原性Fe2+>Cl-,选项D正确。 答案 D
氯溴碘
掌握方法 技巧学习
HClO
参与反应的 粒子 Cl2 HClO、 、 H+
所加试 剂 FeCl2溶 液 石蕊试 液
实验现象 溶液由浅绿色变为 棕黄色 先变红后褪色
离子方程式或解释
+ + 2Fe2++Cl2 === 2Fe3++2Cl-
酸性和漂白性
+ 因发生反应Mg+ 因发生反应 +2H+ === Mg2+H2↑
Cl2、H+
2.溴及其化合物 . (1)Br2是深红棕色液体,易挥发. 是深红棕色液体,易挥发. (2)Br2易溶于有机溶剂. 易溶于有机溶剂. (3)盛溴的试剂瓶中加水,进行水封,保存液溴不能 盛溴的试剂瓶中加水,进行水封, 盛溴的试剂瓶中加水 用橡胶塞. 橡胶塞
3.碘及其化合物 (1)淀粉遇I2变蓝色. (2)I2加热时易升华. (3)I2易溶于有机溶剂. (4)食用盐中加入KIO3可预防甲状腺肿大.
) D.Cl2
C.漂粉精 C.漂粉精
【解析】选D。HClO只能存在于溶液中,溶液无色;漂粉精 解析】 HClO只能存在于溶液中,溶液无色; 只能存在于溶液中 是固体;NO有毒,但是是无色气体;只有Cl 是固体;NO有毒,但是是无色气体;只有Cl2为有毒且有色 有毒 的气体。 的气体。
卤素及其化合物的特性 1.氟及其化合物 (1)非金属性最强,F-的还原性最弱. (2)与H2反应在暗处即爆炸. (3)2F2+2H2O === 4HF+O2. (4)HF是弱酸;能腐蚀玻璃,保存在铝制器皿或塑料瓶中; 有毒;在HX中沸点最高.
在实验室中用MnO2和浓盐酸反应制取纯净干燥的氯 气时,用浓硫酸干燥氯气,用饱和食盐水吸收Cl2中的氯化 氢气体.Cl2在饱和食盐水中的溶解度很小.用氢氧化钠溶 液吸收多余的Cl2,以防止污染空气.下图是某学生设计的 实验装置图:
氯溴碘及其化合物知识点总结
氯、溴、碘及其化合物知识点总结一、氯气的性质1、实验室制法(1)反应原理:MnO 2+4HCl (浓)上=MnCl 2+C121+2H 2O(2)除杂气体:制得的氯气中有氯化氢杂质,常用饱和食盐水洗气。
有时要制得干燥的氯气,可以用浓硫酸洗气来除去水蒸气。
(3)收集方法:氯气可以用向上排空气法或排饱和食盐水法收集。
(4)尾气吸收:氯气有毒,有毒气体必须加以吸收,防止污染空气。
一般用氢氧化钠溶液吸收多余的氯气:Cl 2+2NaOH^=NaCl +NaClO +H 2O2、氯气的性质1. 物理性质通常情况下氯气是呈黄绿色的气体,密度比空气大,有刺激性气味,有毒,易液化, 能溶于水(在常温下1体积水约溶解2体积的氯气)。
注意:在实验室里闻氯气气味时,必须十分小心,采用正确的闻气味方法,即用手在瓶口轻轻扇动,仅使极少量的氯气飘进鼻孔。
在实验室中闻其他气体的气味时,也应采用这种方法。
2. 化学性质氯气是一种化学性质很活泼的非金属单质,能与多种金属和非金属直接化合,还能跟许多化合物发生反应,潮湿的氯气还具有漂白性。
<1>与金肩的反应:2NafCI 2==2NaCIf 产生召畑』2Fe+3CI 2=^2FeCI 3f 产生棕養邑畑丿洼鑫:JF<FeCl z 匀表侏备厲庆念*对生成,舍每砖CUH -CI 2==CUCI 2r 产主释黄色畑/C2)与非金屈的反应:HCIde.于水呑捋列誥咳。
工狂上普用此方鎂*1陋盘验刁、结t 氣气廷一科化孝也簌彳艮逶汝的非全属单烦>能与多齐全属升井全属直按化^令召说明:①纯净的H 2在Cl 2中可以安静地燃烧,发出苍白色火焰,在瓶口处有白雾生成。
② H 2和Cl 2混合后光照或点燃都可能爆炸。
③ 工业上制取HC1就是利用H 2在Cl 2中燃烧来制取的。
(3)氯气与水反应①氯气溶于水后可得到氯水02+日20=^HC1+HC1OH 2ICI 2=^2HCI新制的氯水中存在:Cl2(氯水呈黄绿色)、H2O、HClO(氯水有漂白性)、CIO-、H+、Cl-久置氯水中存在:HCl说明:I.氯水显酸性,放置一段时间后酸性增强,其原因是Cl2+H2o^=HC1+HC102HC1O光照2HC1+O2使氯气转化为盐酸,氢离子浓度增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯、溴、碘及其化合物一、选择题【】1、近年来我国太湖流域发生水体严重污染事故,引起了国务院的高度重视,决定采取有效措施对太湖流域进行环境治理.下列对环保知识的认识正确的是①酸雨的形成与大量燃烧含硫燃料有关,正常雨水的pH为7.0,酸雨的pH小于7.0②严格执行机动车尾气排入标准有利于防止大气污染③使用二氧化硫和某些含硫化合物进行增白的食品对人体健康有害④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼A.①②③ B.①④⑤C.②③④ D.③④⑤【】2、氯仿可用作全身麻醉剂,但在光照下,易被氧气氧化成剧毒的光气(COCl2):2CHCl3 + O22HCl + 2COCl2。
为防止发生医疗事故,在使用前要先检查是否变质,你认为检验用的最佳试剂是A、烧碱溶液B、溴水C、KI淀粉溶液D、AgNO3溶液【】3、将KCl和KBr混合物13.4 g溶于水配成500 mL溶液,通入过量的Cl2,反应后将溶液蒸干,得到固体11.175 g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为A.1︰2︰3 B.3︰2︰1 C.1︰3︰2 D.2︰3︰1【】4、已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O.如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是【】5、下列现象或事实可用同一原理解释的是A.浓硫酸和浓盐酸长期暴露在空气中浓度降低B.氯水和活性炭使红墨水褪色C.漂白粉和水玻璃长期暴露在空气中变质D.二氧化碳和二氧化硫都能使澄清石灰水变浑浊【】6、下列关于氯水的叙述正确的是①新制氯水中只含有Cl2和H2O分子②新制氯水可使蓝色石蕊试纸先变红后褪色③光照新制氯水有气泡逸出,该气体是Cl2④新制氯水放置数天后,酸性减弱(不考虑挥发)⑤新制的氯水呈黄绿色,久置的氯水无色⑥新制的氯水漂白作用强,而久置的氯水无漂白作用⑦新制的氯水所含成分多,而久置的氯水所含成分少⑧新制的氯水中无氯离子,而久置的氯水中则含氯离子A.②⑤⑥⑦ B.②③④⑤C.③⑤⑥⑧ D.①③④⑧【】7、海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列有关说法正确的是A.制取NaHCO3的反应是利用其溶解度小于NaClB.用澄清的石灰水可鉴别NaHCO3和Na2CO3C.在第③、④、⑤步骤中,溴元素均被氧化D.工业上通过电解饱和MgCl2溶液制取金属镁【】8、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。
玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是【】9、标准状况下a L H2和Cl2的混合气体,经光照充分反应后,所得气体恰好使溶液中b mol NaOH 完全转变成盐,则a、b的关系不可能是A.B.C.D.≥【】10、将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。
下列判断正确的是A.与NaOH反应的氯气一定为0.3 mol B.n(Na+):n(Cl-)可能为7:3C.若反应中转移的电子为n mol,则0.15<n<0.25D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1【】11、碘(ICl)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,能与许多非金属单质反应生成相应卤化物,能与水反应等。
其与水反应的方程式为ICl+H2O HCl+HIO。
下列关于ICl的叙述中不正确的是A.ICl是一种有色物质B.在许多反应中ICl是强氧化剂C.在ICl与水的反应中,它既是氧化剂又是还原剂D.与NaOH溶液反应生成的产物中有NaIO和NaCl【】12、具有漂白作用的物质有①氯水、②二氧化硫、③活性炭、④过氧化钠,漂白原理相同的是A.①③B.②③C.①④D.②④【】13、下列变化过程中不能直接实现的是①HCl ②Cl2③Ca(ClO)2④HClO ⑤CO2A.③→④B.①→② C.④→⑤D.②→③【】14、下列不能说明氯的非金属性比硫强的事实是①HCl比H2S稳定②HCl和H2S的水溶液前者的的酸性强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeSA. ①②④B.①②⑥C. ②⑤D.①③⑤【】15、某化学教师为“氯气与金属钠反应”设计了如图所示装置与操作以替代相关的课本实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。
以下叙述错误的是A.钠着火燃烧产生苍白色火焰B.反应生成的大量白烟是氯化钠晶体C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气D.管右端棉球处颜色变化可判断氯气是否被碱液完全吸收二、实验,探究题16、海带中含有丰富的碘。
为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.干燥器(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(3)仿照实验室中制取Cl2的原理,写出步骤④反应的离子方程式是。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是。
(5)实验中需用 2.0 mol/L H2SO4500mL,实验室配置该试剂所需的玻璃仪器有烧杯、玻璃棒和。
17、某学生利用以下装置探究氯气与氨气之间的反应。
其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:(1)装置F中发生反应的离子方程式为_____________________________________(2)NH3的结构式为________________(3)E装置的作用_________________________(4)通入C装置的两根导管左边较长、右边较短,目的是_________________________(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
请写出反应的化学方程式:____________________________________ ________(6)该实验明显需要改进之处是_________________________________________________18、氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气。
I.工业上通常采用电解法制氯气:观察左下图,回答:(1)若饱和食盐水中通电后b侧产生的气体通入NaOH溶液中所发生的反应的离子方程式为。
(2)电解反应的化学方程式为。
II.某学生设计如右上图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是。
(2)漂白粉将在U形管中产生,其化学方程式是。
(3)C装置的作用是。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是。
②试判断另一个副反应(用化学方程式表示) 。
为避免此副反应的发生,可将装置作何改进。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是。
A.食盐 B.食醋 C.烧碱 D.纯碱氯、溴、碘及其化合物参考答案一、选择题1-----------5、C D B DD 6------------10、A A A D C 11------15、C C C CA二、实验,探究题16、(1)BDE(2分)(2)过滤蒸馏(1+1=2分)(3)2I-+MnO2+4H+ = Mn2++I2+2H2O(2分)(4)苯与水互不相溶;碘在苯中的溶解度比在水中大(2分)(5)500mL容量瓶、胶头滴管(1+1=2分)17、(1)MnO2 + 4H+ + 2Cl- = Mn2+ + Cl2↑+ 2H2O (2’)(2)(1’)(3)除去Cl2中的HCl气体(4)使NH3与Cl2充分混和发生反应(1’)(5)8NH3 + 3Cl2 = N2 + 6NH4Cl (2’)(6)G处接naOH溶液的尾气处理装置(2’)18、I. (1)Cl2+2OH-= Cl –+ClO-+ H2O(2)2NaCl+2H2O2NaOH+H2↑+Cl2↑(注明反应条件:通电,若无酌情)II. (1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O , 2mol(2) 2Cl2+2Ca(OH)2 =CaCl2 + Ca(ClO)2 +2H2O(3) 吸收未反应完的氯气,防止污染空气(4) ①冷却B装置②2HCl+Ca(OH)2 =CaCl2 +2H2O 在A与B之间连接一个装有饱和氯化钠溶液的洗气瓶。
(5) B。
