1.9 陶瓷材料的晶体相结构解析
《陶瓷材料的结构》PPT课件
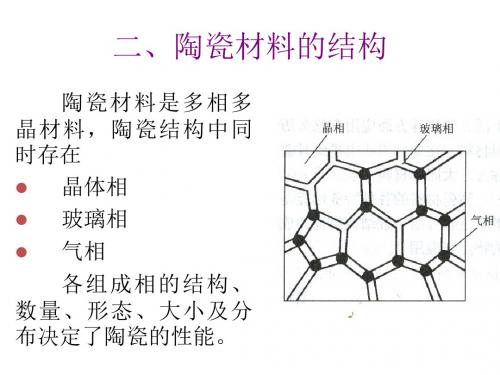
• 气相可使陶瓷的密度减小,并能 吸收振动;
• 用作保温的陶瓷和化工用的过滤 多孔陶瓷等需要增加气孔率,有 时气孔率可高达60%。
α -方石英
熔融SiO2
加热 急冷
180~270℃
163℃
573℃
β -石英
β -鳞石英
β -方石英
石英玻璃
117℃ห้องสมุดไป่ตู้
γ -鳞石英
• 实际陶瓷晶体与金属晶体一样也存在晶体 缺陷,这些缺陷可加速陶瓷的烧结扩散过 程,还影响陶瓷性能。
• 晶粒愈细,陶瓷的强度愈高。如刚玉 (Al2O3)晶粒平均尺寸为200μm时,抗弯 强 度 为 74MPa , 1.8μm 时 抗 弯 强 度 可 高 达 570MPa。
氧化物结构的结合键以离子键为 主,又称离子晶体。
Si3N4、SiC、BN等以共价键为主, 称共价晶体。
氧化物结构的主要特点是氧离子 紧密排列构成晶格骨架,组成六方或 面心立方点阵,而正离子位于骨架的 适当间隙之中。
如:CaO、MgO、Al2O3、ZrO2
硅酸盐结构
结构很复杂,但基 本结构单元为[SiO4]硅氧 四面体,结合键为离子 键、共价键的混合键;
玻璃相熔点低、热稳定性差,在 较低温度下开始软化,导致陶瓷在高 温下发生蠕变,且其中常有一些金属 离子而降低陶瓷的绝缘性。
故工业陶瓷中玻璃相的数量要予 以控制,一 般<20~40%。
3. 气相
气相指陶瓷孔隙中的气体即气孔。 是生产过程中不可避免的,陶瓷中的孔 隙率常为5~10%,要力求使其呈球状, 均匀分布。
每个氧原子最多只 有被两个[SiO4]所共有;
陶瓷材料的晶体结构

主要特征
8.63
无方向性,高配位数,
7.94
低温不导电,高温离子
7.20
导电
6.90
1.37 1.68 3.87 3.11
1.63 1.11 0.931 0.852
方向性,低配位数,纯 金属低温导电率很小
陶瓷无材方料向的性,化高学配键位?数,
密度高,导电性高,塑 性好
0.020 0.078
低熔点、沸点压缩系数 大,保留分子性质
原子对价电子的束缚强弱。
Company Logo
陶瓷的晶体结构
First ionization energies as a function of atomic number
C原子的电离能(eV) I1: 11.260 I2: 24.383 I3: 47.887 I4: 64.492 I5: 392.077 I6: 489.981
0.52 0.30
结合力高于无氢键分子
Company Logo
陶瓷的晶体结构
2.1 离子晶体的结构规则—鲍林规则
陶瓷化合物的结合键:离子键与共价键混合。 金属正离子与非金属离子组成的化合物通常不是纯粹的 离子化合物,性质不能只用离子键来解释。
离子键的比例取决于组成元素的电负性差,电负性相差 越大,离子键比例越高。
鲍林给电负性下的定义为“电负性是元素的原子在化合物中吸 引电子能力的标度”。
元素电负性数值越大,表示其原子在化合物中吸引电子的能力 越强;反之,电负性数值越小,相应原子在化合物中吸引电子 的能力越弱(稀有气体原子除外)。
Company Logo
陶瓷的晶体结构
2.1 离子晶体的结构规则—鲍林规则 原子负电性的概念:
Si
1.9 陶瓷材料的晶体相结构

• 可以是共价型的,价电子在很大程度上是共用的 ZnS是这类化合物的一个例子
2020/1/15
刘志勇 14949732@
7
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
AX型离子键结合陶瓷晶体
• AX化合物的特征 • A原子只被做为直接邻居的X原子所配位,X原子也只有A
2020/1/15
刘志勇 14949732@
11
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
离子键结合的陶瓷晶体结构
如Al2O 3及Cr2O3,α-Fe2O3,Ti2O3,V2O3的结构 • Al2O3又称刚玉,工业中运用广泛,如刀具,火花塞、金刚砂磨轮,耐
Cl-
2020/1/15
刘志勇 14949732@
10
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
AmXp型离子键结合的陶瓷晶体结构
• 并非所有的二元化合物都有相等的A原子和X原子 (离子)
• 如氟化钙(CaF2)型结构AX2的ZrO2及UO2, ThO2,CeO2以及Al2O3结构的Al2O3及Cr2O3,αFe2O3,Ti2O3,V2O3。CaF2型结构中A原子具有 面心立方点阵,X原子占据4个A原子之间的间隙 位置,相邻的X原子并不接触
酸泵和印刷线路的衬底的以及排气系统中催化剂支架的高温材料 Al2O3结构中O2-离子具有密排六方的结构,O2-位于密排六方的结点上, 为保持电荷平衡,三分之二的八面体间隙被Al3+离子占据 O2―与相邻的Al3+离子的原子间距很短,只有0.191nm,相互作用的键能 很高,因此熔点大于2000℃,硬度较高(莫氏硬度为9),能够抵抗大多 数的化学试剂腐蚀 Al2O3的低导电性和较高的热导率的结合使它能够用于各种电的用途中
材料科学与工程基础第七章 陶瓷的结构与性能

断裂强度决定于陶瓷的化学成分和组织结构, 但同时也随外界条件(温度、应力等)的变 化而变化。陶瓷的强度随气孔率增加而按指 数规律下降。陶瓷的强度与晶粒尺寸的关系 符合H-P公式,即晶粒越细强度越高。晶界相 的成分、性质及数量对陶瓷强度有影响。晶 界上的晶相能起到阻止裂纹扩展并松弛裂纹 尖端应力场的作用。此外,通过复合的方法 也是强化的途径之一。
一、陶瓷材料的力学性能
1.陶瓷的弹性模量
表7-7 常见陶瓷的弹性模量
陶瓷材料 烧结氧化铝 热压Si3N4 烧结氧化铍
热压BN 热压B4C
石墨 烧结MgO 烧结MoSi2
E/GPa 366 320 310 83 290 9 210 407
陶瓷材料
烧结MgAl2O4 致密SiC 烧结TiC 烧结ZrO2 SiO2玻璃 莫来石瓷
橄榄石
尖晶石
尖晶石 (倒反)
配位 数 8:8
6:6
6:6 4:4 4:4 8:4 6:3 4:2 4:8 2:4 6:4 12:6:6 6:6:4
6:4:4
4:6:4
4:6:4
表7-1 陶瓷典型结构
阴离子 堆积方式
简单立方
阳离子位置 全部立方体空隙
立方密堆
全部八面体空隙
六方密堆 立方密堆 六方密堆 简单立方 畸变立方
四面体 立方密堆 体心立方 六方密堆 六方密堆 六方密堆
六方密堆
立方密堆
立方密堆
全部八面体孔隙
1/2四面体空隙 1/2四面体空隙 1/2立方体空隙 1/2八面体空隙
四面体空隙
全部四面体空隙
八面体空隙
2/3八面体空隙 1/4八面体空隙 2/3八面体空隙 1/2八面体空隙A 1/8四面体孔隙B 1/8四面体空隙A 1/2四面体孔隙B 1/8四面体空隙B 1/2八面体孔隙AB
23陶瓷晶体结构

(1)特性- 硬、脆、耐高温、耐腐蚀; (2)组织- 由三相组成: 多晶相:硅酸盐、氧化物、非氧化物,习惯以主要晶相 命名; 玻璃相(非晶相):低熔点、起粘结作用; 玻璃相的数量,随不同陶瓷而异,在固相烧结的瓷料中 几乎不含玻璃相,在有液相参加烧结的陶瓷中则存在较多 的玻璃相。
气相(气孔):烧结前是开口孔、烧结后大多数转变闭孔。 一般陶瓷材料均不可避免地含有一定数量的气孔,通常 的残留气孔量为 5~10﹪(体积百分率),气孔含量在各种 陶瓷材料中差别很大,它可以在0~99﹪之间变化。气孔 的含量、形状、分布影响陶瓷材料的机械、热学、光学和 电学等一系列性能。
[FCa4 ]四 面 体 及 其 连 接
从空间格子看,CaF2结构由一套Ca2+离子的面心立方格子和2套F离子的面心立方格子相互穿插而成。
2. 金红石晶体结构
问题: ① 格子构造? ② 密堆积情况? ③ 单位晶胞内含TiO2的O数目?
Ti
整个结构由2套Ti4+的简单四方格子和4套O2_的简单四方格子相互穿插而成。
2.3 陶瓷的晶体结构
概述
一般可将材料分为有机和无机两大类,而无机材料又可分 为金属与非金属两大类;
无机非金属材料: 主要包括:通常概念的陶瓷、玻璃、水 泥、和耐火材料 西方国家将无机非金属材料通称陶瓷;
陶瓷材料的发展经历了三次重大飞跃。
从陶器发展到瓷器,是陶瓷发展史上的第一次重大飞跃; 从传统陶瓷发展到先进陶瓷,是陶瓷发展史上的第二次重大飞跃; 从先进陶瓷发展到纳米陶瓷是陶瓷发展史上的第三次重大飞跃。
球体堆积系统,其八面体空隙总数为 6 n n ;每个球体周围有8 个四 6
面体空隙,对n 个等大球体堆积系统,其四面体空隙总数为 8n 2n 。 4
陶瓷材料结构及性能分类新结构陶瓷材料科学基础

二、陶瓷材料的分类
1、按化学成分分类 可将陶瓷材料分为氧化物陶瓷、碳化物陶瓷、 氮化物陶瓷及其它化合物陶瓷。
玻璃幕 墙 导电玻 璃
2、按使用的原材料分类
可将陶瓷材料分为普通陶瓷和特种陶瓷。
普通陶瓷以天然的岩石、 矿石、黏土等材料作原 料。 特种陶瓷采用人工合成 的材料作原料。 3、按性能和用途分类 可将陶瓷材料分为结构 陶瓷和功能陶瓷两类。
玻璃相结构特点:硅氧四面体组成不规则的空间 网, 形成玻璃的骨架。 玻璃相成分:氧化硅和其它氧化物
(三)、气相
气相是陶瓷内部残留的孔洞;成因复杂,影 响因素多。 陶瓷根据气孔率分致密陶瓷、无开孔陶瓷 和多孔陶瓷。 气孔对陶瓷的性能不利(多孔陶瓷除外) 气孔率:普通陶瓷5%~10% 特种陶瓷5%以下 金属陶瓷低于0.5%。
(2) 硅酸盐化合物的几种类型
按照连接方式划分,硅酸盐化合物可以分为以下几 种类型: ①孤立状硅酸盐 ②复合状硅酸盐 ③环状或链状硅酸盐 ④层状硅酸盐 ⑤立体网络状硅酸盐
①孤立状硅酸盐(岛状结构单元)
其单元体(SiO44-) 互相独立,不发生相 互连接。 化学组成一般可以表 示为2RO· 2。 SiO 其中RO表示金属氧化 物如MgO、CaO、 FeO等。 具有这类结构的有橄 榄石和石榴石等。
AX化合物的特征是:A和X原子或离子 是高度有序的,属于这类结构的有: (1)CsCl型 (2)NaCl型 (3) ZnS闪锌矿型 (4)纤维锌矿型
(以下分别介绍)
(1)CsCl型 这种化合物的结构见图3-2。A原子(或离 子)位于8个X原子的中心,X原子(或离子) 也处于8个A原子的中心。但应该注意的是, 这种结构并不是体心立方的。确切的说,它 是简单立方的,它相当于把简单立方的A原 子和X原子晶格相对平移a/2,到达彼此的 中心位置而形成。
结合晶体结构说明陶瓷的同质异构转变特征

结合晶体结构说明陶瓷的同质异构转变特征陶瓷是一种重要的工程材料,具有优良的耐热、耐酸碱、绝缘和耐磨等特性。
它的性能受晶体结构的影响,而同质异构转变是陶瓷材料中晶体结构变化的一种重要现象。
本文将结合晶体结构来说明陶瓷的同质异构转变特征。
同质异构转变是指一种晶体结构从一种同质晶体转变为另一种同质晶体的过程。
在陶瓷材料中,同质异构转变通常发生在高温下,而且需要一定的条件才能发生。
我们来看陶瓷材料的晶体结构。
陶瓷材料通常由离子或离子化合物构成,其晶体结构可以分为离子晶体结构和共价晶体结构两种。
离子晶体结构是由正负离子通过离子键相互结合形成的,如氧化物陶瓷。
共价晶体结构是由共价键相互结合形成的,如碳化硅陶瓷。
在同质异构转变中,陶瓷材料的晶体结构发生变化,通常是由于温度或化学环境的改变。
例如,氧化铝陶瓷在高温下会发生从α相到γ相的转变。
α相是一种六方紧密堆积结构,而γ相是一种面心立方结构。
这种转变是由于温度升高导致晶格参数发生变化,使得原子间的排列方式发生改变。
同质异构转变的特征可以通过以下几个方面来描述。
首先是转变温度。
陶瓷材料的同质异构转变通常发生在高温下,而且转变温度一般比材料的熔点低。
这是因为同质异构转变是晶体结构的变化,而不是物质的相变。
其次是转变速率。
同质异构转变的速率取决于材料的性质和转变条件。
一般来说,转变速率较快的材料在改变温度或化学环境时会更容易发生同质异构转变。
而转变速率较慢的材料可能需要更高的温度或更长的时间才能完成转变。
同质异构转变还可以改变陶瓷材料的性能。
例如,转变后的晶体结构可能具有更好的热导性、机械强度或电导性等。
这些性能的改变可以使陶瓷材料在不同的应用领域中具有更广泛的应用。
陶瓷材料的同质异构转变是一种晶体结构发生变化的过程,通常发生在高温下,并受到温度和化学环境的影响。
同质异构转变的特征包括转变温度、转变速率和性能改变。
了解和控制同质异构转变对于陶瓷材料的制备和性能改进具有重要意义。
陶瓷的晶体结构PPT课件

4.离子堆积
• 负离子配位多面体:离子晶体中与某一正离子成 配位关系而邻接的各负离子中心线所构成的多面 体
CHENLI
2.3.2.2 离子晶体的结构规则—鲍林规则
负离子配位多面体规则 符合最小内能原理 电价规则 负离子多面体共用顶、棱、面的规则 共用点、 棱、面,会降低结构稳定性 不同种类正离子多面体间连接规则 节约规则 同种正离子和同种负离子的结合方式 应最大限度地趋于一致.
电子绝缘件
氧化锆陶瓷光学导管
CHENLI
陶瓷的组成
1.结晶相:主要组成相,由离 子键或共价键结合而成,决定 陶瓷的性能:高熔点、高耐热 性、高化学稳定性、高绝缘性、 高脆性。
2 玻璃相:非晶态固体,将晶相粘结 在一起,降低烧结温度,抑制晶相晶 粒长大和填充气孔。
3 气相:气孔(5%-10%)。
4 对性能的不利影响:增加脆性、降低强度、电击穿强度降 低,绝缘性能降低。
2.组群状硅酸盐:由[SiO4]4-通过共用氧(桥氧)相 生成2、3、4或者6个硅氧组群。绿宝石
3.链状硅酸盐:由[SiO4]4-通过桥氧的连接在一维 方向伸长成单链或双链、链与链间为正离子链结。 辉石
CHENLI
4.层状硅酸盐:由[SiO4]4-四面体某个面在平面 内以共用顶点的方式连接成六角对称的二维结 构,多为二节单层。当活性氧与其它负离子一起 与金属正离子组成八面体层,就与四面体构成双 层结构。 滑石,白云母
CHENLI
绝 缘 子
氧化铝陶瓷坩埚
CHENLI
2. 陶瓷的分类
结构陶瓷主要是用于耐磨损、高强度、耐热、耐热冲击、硬 质、高刚性、低热膨胀性和隔热等结构陶瓷材料
Si3N4轴承
不同形状的特种结构陶瓷件
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 材料的磁特性受阳离子的影响
2018/10/6
刘志勇 14949732@
17
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
离子键结合的复杂化合物陶瓷晶体结构--固溶体
• 离子化合物之间也可能形成固溶体,固溶体的形 成主要受到尺寸适应性和电荷平衡的影响。但是 并不严格,因为电荷可以进行补偿
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
硅酸盐结构分类
• 按照SiO4四面体在空间的组合,可以将硅 酸盐结构分成4类
• 1)含有限硅氧团的岛状硅酸盐结构 • 2)链状结构 • 3)层状结构 • 4)骨架状结构
2018/10/6
刘志勇 14949732@
12
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
AmXp型离子键结合的陶瓷晶体结构
• CaF2型结构是用于核燃 料元件的UO2燃料元件 的基础结构,又是ZrO2 的一种多晶型结构
CaF2型结构
2018/10/6
2018/10/6
刘志勇 14949732@
7
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
AX型离子键结合陶瓷晶体
• AX化合物的特征
• A原子只被做为直接邻居的X原子所配位,X原子也只有A 原子作为第一邻居。所以A和X原子或离子是高度有序的 • 形成AX化合物时,使两种原子数目相等而且具有如上所 述的有序配位的三种方法(原型) CN=8的CsCl型 CN=6的NaCl型 CN=4的ZnS型
2018/10/6
刘志勇 14949732@
8
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
AX型离子键结合陶瓷晶体结构
CsCl具有简单立方的原子排列 NaCl、ZnS具有面心立方的排列
NaCl可以看成由两个面心立方点阵 穿插而成的超点阵,将Na+和Cl- 看成一个集合体,即一个结点, 此结构则为FCC结构,单胞离子 数为4个Na+和4个Cl-
刘志勇 14949732@
13
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
离子键结合的陶瓷晶体结构
ZrO2及UO2,ThO2,CeO2的结构,属于CaF2结构
• ZrO2是有用的高温氧 化物,Zr4+位于结点 位置,O2-位于四面 体间隙
O 2Zr 4 +
2018/10/6
刘志勇 14949732@
6
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
AX型离子键结合陶瓷晶体结构
最简单的陶瓷化合物具有数量相等的金属原子和非金属原子
• 可以是离子型化合物 • 如MgO,其中两个电子从金属原子转移到非金属原 子,而形成阳离子Mg2+和阴离子O2- • 可以是共价型的,价电子在很大程度上是共用的 ZnS是这类化合物的一个例子
19
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
硅酸盐结构的基本结构单元为“SiO4”四面体
• 硅酸盐结构的基本结构单元为“SiO4”四面体,硅 原子位于四个氧原子四面体的间隙中
• 将四面体连接在一起的力包括离子键和共价键 • 硅-氧间结合主要为离子键,还有一定的共价键成分 • 因此硅-氧四面体的结合很牢固,(硅-氧间平均距离为 0.160nm,小于硅氧原子半径之和)
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
陶瓷材料的晶体相结构 • 陶瓷材料是金属元素和非金属元素的化合 而成的物相,如Al2O3,无机玻璃、粘土制 品,Pb(Zr、Ti)O3压电材料等,金属氧 化物是最常见的,有几百种化合物 陶瓷化合物在热和化学环境中比它的组元更 为稳定;如作为化合物的Al2O3就比单独的Al 和O更为稳定
CsCl(NaCl、ZnS)的原子排列
2018/10/6
刘志勇 14949732@
9
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
离子键结合的陶瓷晶体结构---NaCl型
NaCl可以看成由两个面心立方点阵穿插而成的超点阵 将Na+和Cl-看成一个集合 体,即一个结点,此结构 则为FCC结构,单胞离子 数为4个Na+和4个Cl-
刘志勇 14949732@
22
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
硅酸盐结构的特点与分类
• SiO4四面体可孤立存在或通过共顶点互相联结,形 成多重的四面体配位群
桥氧
SiO4四面体 双重四面体单元(Si2O7)623
2018/10/6
刘志勇 14949732@
陶瓷的键合方式决定着陶瓷的力学、物理、 化学性能,陶瓷比相应的金属或聚合物更 硬,对变形具有更大的抗力,而往往缺乏 塑性 某些陶瓷的介电性、半导体性和磁学特性对志勇 14949732@
4
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
Zr 4 +位于结点位置, O 2-位于四面体间隙
2018/10/6 刘志勇 14949732@ 14
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
离子键结合的复杂化合物陶瓷晶体结构 • a) AmBnXp型结构
三种原子存在从而使问题更加复杂,但是其中一些 化合物是非常有用的
2018/10/6
刘志勇 14949732@
21
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
硅-氧四面体
SiO44-的四面体排列 (a)和双四面体单元(b) 中心的氧原子被两个四 面体单元所共有,称为 桥氧
硅原子位于氧原子四面体的间隙中
2018/10/6
1.16.1 离子键结合的陶瓷晶体结构
• 离子键结合的陶瓷晶体中,两种异号离子半径比值决定了 配位数,配位数直接影响晶体结构,如表所示
表 配位数 2 3 4 6 8 间隙 线性 三角形 四面体间隙 四面体间隙 立方体间隙 结构的配位数 半径比 0~0.15 0.155~0.225 0.225~0.414 0.414~0.732 0.732~1.00
2018/10/6
刘志勇 14949732@
16
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
离子键结合的复杂化合物陶瓷晶体结构
• 复杂化合物可以是非金属基体,其中最普通的是成份为 MFe2O4的铁氧体尖晶石(通常称为铁氧体),其中M是 半径为0.075nm的二价阳离子,O2-为密排(面心立方)排 列,阳离子占据八面体间隙的一半和四面体间隙的八分之 一
2018/10/6
刘志勇 14949732@
20
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
硅-氧四面体
• 每个四面体的氧原子外层只有7个电子而不是八个,为-1 价,因此还可与其它金属离子键合 • 两种方法可以克服氧离子中电子的不足
• 一是可以从金属原子得到一个电子,这种情况下产生SiO44-离子 和M+离子 • 二是每个氧可以与第二个硅共用电子对,在这种情况下形成多个 四面体配位群 • 共用的氧称为桥氧。每一个氧最多只能被两个SiO4四面体共有
2018/10/6
刘志勇 14949732@
2
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
陶瓷的晶体结构
陶瓷的晶体结构特征
• 晶体结构复杂,原子排列不紧密 • 配位数低 • 没有大量自由电子
• 晶体相是陶瓷基本相,决定陶瓷的力学、物理、化学性能
2018/10/6
刘志勇 14949732@
5
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
离子键结合的陶瓷晶体结构
离子化合物结构与正常价化合物基本相同 结合键主要为离子键 有一定比例的共价键 有确定的成分,可用准确分子式表示
• 1.AX型陶瓷晶体 • 2.AmXp型陶瓷晶体 • 3.复杂化合物: a)AmBnXp型结构; b)固溶体 • 4.硅酸盐
4、 硅酸盐结构
• 硅酸盐:普通水泥,砖,瓦,玻璃,搪瓷 • 硅酸盐矿物:长石,高岭土,滑石,镁橄榄石 • 硅酸盐的其它工程应用包括电绝缘体、化学容器 和增强玻璃纤维 • 硅酸盐结构:成分、结构复杂,起决定作用的是 硅-氧间的结合,即硅酸盐四面体单元
2018/10/6
刘志勇 14949732@
2018/10/6 刘志勇 14949732@ 1
吉 首 大 学 物 理 与 机 电 工 程 学 院 JiShou University
陶瓷材料的晶体相结构
• 比它们的相应组元包含更为复杂的原子配 位,陶瓷的晶体中没有大量自由电子,电 子通过共价键与相邻原子共有,或通过电 子转移而形成离子键,形成以离子键为主的 离子晶体(MgO,Al2O3)或共价键为主的 共价晶体(SiC,Si3N4)
如MgO中,如果F-离子取代了O2-离子,Li+离子可同时取代Mg2+离 子,MgO可以溶于LiF中 当然还可以是Mg2+溶于LiF中,这时没有相应的O2-离子,这种情况 下必须包含阳离子空位,结果两个Li+离子被Mg2+离子所替代
2018/10/6
刘志勇 14949732@
