分子轨道(课堂PPT)
合集下载
无机化学 分子轨道理论 PPT课件
共
理论
价 (量子力学)
现代价键 理论
分子轨道
键 (1927年)
理论
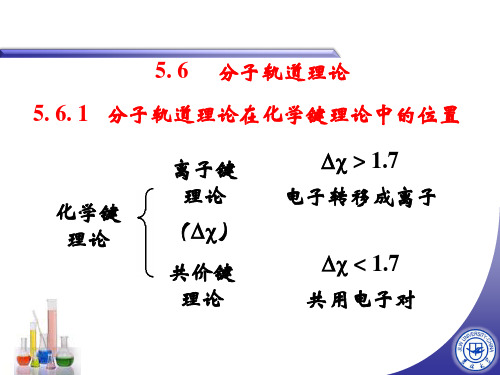
理 路易斯理论 论 (经典)
价键理论
杂化轨道 理论
价层电子对 互斥理论
5. 6. 2 分子轨道 —— 原子轨道的线性组合
分子轨道由原子轨道线性 组合而成。
分子轨道的数目与参与组 合的原子轨道数目相等。
H2 中的两个 H,共有两个
1s,可组合成两个分子轨道:
1s 1s
AO
B 图适用于 B2,C2,N2 等分子
*2 py
*2 px *2 pz
2p 2 py
2s
1s
2p
2 px 2 pz *2s 2s 2s *1s
1s 1s
AO MO AO
必须注意 A 图和 B 图之间的差别
*2 py 2p
2 py
A图
*2 px *2 pz
+
轨道没有通过两核连线的这种节面。
5. 6. 3 线性组合三原则 1. 对称性一致原则
对核间连线呈相同对称性的 轨道可以进行线性组合。
除上述的 s - s ,p - p 之外, 还有 s - px 沿 x 方向的组合, 两者 的对称性一致。组成 分子轨道。
+
+
s
px
py - dxy 沿 x 方向,也可以 组合成有效的 分子轨道。
有量子力学的 计算基础
1927 年以后
价键理论
现代 共价键理论
现代 价键理论
(?)
分子轨道 理论
杂化轨道 理论
价层电子对 互斥理论
现代价键理论 电子在原子轨道中运动 电子属于原子
第二节分子轨道理论ppt课件

例如,对于 H2(在此并不研究 H2 )而言,如果我们忽略 Vei项(略去 排斥势能项,不影响电子的波函数),并在方程两端添加一项1/R(添加
的排斥势能项1/R 可作为常数看待,并吸收到能量 E 中),则,H2 的波 动方程就可改写为:
<
Hψ =[-
1 2
▽2
-
1 r1
-
1 r2
+
1 R
]ψ
=
Eψ
可见,当忽略了电子间的排斥势能后,H2 的波动方程就变成H2+ 的波
令: 2h = [(αa-αb)2 + 4β2]1/2 - (αa-αb)
即:
E2 =
(αa +αb) + [(αa -αb)2 + 4β2]1/2 2
= 2αa -(αa -αb) + [(αa -αb)2 + 4 β2]1/2
2
=
2αa + 2h 2
= αa + h
同理:
E1 = αb - h 即:
例如:
++
ns
ns
σh
+
- 反对称 记为:σu 或 σ*
(antibonding σ orbital)
+
对称 记为:σg 或 σ
(bonding σ orbital)
± ±
-+
np
+-
np
- + - + 反对称
记为:σu 或 σ*
-+
对称
- 记为:σg 或 σ
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
配合物-分子轨道理 22页PPT文档

σ –π型
σ– π键的形成,加强了中心金属和N2分子间的结 合。同时削弱了配体N2分子的内p结合,使被活化 。
6、5有机金属络合物
有机金属络合物事指以有机基团为过渡金 属原子的配体的化合物。
最早的有机金属络合物事蔡斯盐,单直到 1952年夹心型二茂铁结构被确定之后,才引 起人们的极大兴趣,使有机过渡金属化学迅 速发展。C来自IrC P Br
2 、环多烯配合物
许多环多烯具有离域π键的结构,离域π键 可以
作为一个整体和中心金属原子通过多中心π 键形成
配环位丙化烯合基物。环平丁面二对烯称的环环戊多二烯烯基有很多,苯 下
图C3只H3列
C4H4
C5H5
C6H6
出其中一些比较常见的环多烯的结构式和电
子数。M
M
M
M
3 、夹心化合物—二茂铁的结构
2( 1πu )4( 3σg )2(1 π g)0
基本上定域于两氮原子上的孤对电子。 在分子氮配合物中,N—N键键长略有增
加,表 明氮分子内键强度有一定程度的削弱,即N2
2 、N2分子配合物
过渡金属eg空 N2的最高被占轨道 3σg 1πu
最低空轨道 1 π g
过渡金属t2g 满
σ配键
反馈π键
Cr与CO的5σ轨道形成6个σ分子轨道,由6个 CO的12个5σ电子填充。同时Cr的一个电子被推 3d上去,使Cr有6个d电子。这6个d电子占用的 t2g轨道与配体CO的高能空π轨道形成的 t2gSALC组成成键π分子轨道。这样成键t1g分子 轨道由Cr的6个d电子占据。这相当于把中心Cr 原子的d电子送回到配体空轨道上去,使中心原 子上的过量负电荷减少,这样的π键叫反馈π键。
二茂铁是这类化合物的典型代表。它由二个环 茂二烯游离基夹一个铁原子二形成。分子式为: (C5H5)2Fe 它的结构为:
第7章 Huckel分子轨道理论 PPT课件

其中的原子轨道 为C原子的pz轨道
• 久期方程式:
E
0
0
E
0
0 E
0 c1
0
c2
c3
0
Ec4
(7 7)
或系数非零解久 期行列式方程为
x 1 0 0
1 0
x 1
1 x
0 1
0
0 0 1 x
(7 8)
其中x=(α-E)/β
上一内容 下一内容 回主目录
返回
2020/7/24
Hˆ E
(7 1)
采用变分法,将π电子分子轨道表为所有碳原子的pz原子 轨道的线性组合:
c11 c22 cNN
(7 2)
上一内容 下一内容 回主目录
返回
2020/7/24
7.1 Hückel分子轨道理论
代入(7-1)式,按线性法处理得有关系数线性齐次方程组:
(H11 E)c1 (H12 ES12)c2 (H1N ES1N )cN 0
0.37171 0.60152 0.60153 0.37174
上一内容 下一内容 回主目录
返回
2020/7/24
7.1 Hückel分子轨道理论
• 分子轨道和能级示意图
上一内容 下一内容 回主目录
返回
2020/7/24
7.1 Hückel分子轨道理论
• 对称性与群论得应用
对于具有某些对称性的分子,可利用其对称性使HMO
为jπ,故有: k j, j k /(n 1)
上一内容 下一内容 回主目录
返回
2020/7/24
7.1 Hückel分子轨道理论
于是: cj.p Bsin(p j ) Bsin[pj /(n 1)]
分子轨道理论教学课件

密度泛函理论
01
密度泛函理论是一种更高效的计算方法,它将多电子系统的薛 定谔方程简化为单电子系统的方程。
02
它通过电子密度而不是波函数来描述多电子系统,从而大大减
少了计算量。
密度泛函理论在计算化学中得到了广泛应用,可以用于预测分
03
子的电子结构和性质。
分子力学方法
1
分子力学方法是一种基于经典力学原理的计算方 法,它通过势能面来描述分子的运动。
分子轨道理论认为分子中的电子是在一系列的分子轨道上运 动,每个分子轨道都由一个波函数表示,描述了电子在分子 中的运动状态。
分子轨道理论的发展历程
分子轨道理论的起源可以追溯到20世纪初,当时科学家开始尝试用量子力学来描述 分子中的电子行为。
在20世纪30年代,德国物理学家马克思·玻恩和英国化学家罗伯特·玻恩等人发展了 分子轨道理论的基本框架,为后续的研究奠定了基础。
或能级表。
分子轨道能级与化学反应的关系
03
分子轨道能级与化学反应的活化能、反应速率和反应机理等密
切相关,是理解和预测化学反应的重要依据。
03
分子轨道的计算方法
哈特里-福克方法
01
哈特里-福克方法是分子轨道理论 中最早的数值计算方法,它基于 变分原理,通过求解薛定谔方程 来计算分子轨道。
02
该方法适用于较小的分子,但对 于较大的分子和复杂的化学环境 ,计算量会变得非常大。
原子轨道有特定的形状和取向,如球 形、哑铃形、纺锤形等,这些形状和 取向决定了原子中电子云的分布。
分子轨道的形成
1 2 3
分子轨道的概念
分子轨道是指由两个或多个原子轨道相互作用形 成的能量状态,是分子整体的运动状态。
(精品课件)7.分子轨道理论-new

H2:
1
ψ H2 = σ1s (1) + σ1s (2) = 2 ⎡⎣ϕ A,1s (1) + ϕ B,1s (1)⎤⎦ ⎡⎣ϕ A,1s (2) − ϕ B,1s (2)⎤⎦
S-S轨道 LCAO
5. 分子轨道理论:
p-p轨道LCAO σ键 σ* 键
π 键 π* 键
5. 分子轨道理论:
BO = 1 BO = 0.5 (三电子σ键 ) BO = 0 (不形成稳定分子)
He2分子不能稳定存在,但是He2+或He22+可以稳定存在
5. 分子轨道理论:
Li2
Be2
气体 r = 267.3 pm D= 101kJ/mol
不存在
5. 分子轨道理论:
顺 磁 性 成 单 电 子
B2只存在 π 键无 σ 键
2s AO of O
σs
MO of NO
00 NO
NO
5. 分子轨道理论:
5. 分子轨道理论:
5. 分子轨道理论:
5. 分子轨道理论:
共轭π键 离域π键 大 π键
Π
6 6
5. 分子轨道理论:
形成π键的电子不局限于两个原子的区域,而是在参加成键
的多个原子形成的分子骨架中运动,这种化学键称为离域π键。
若满足以下两个条件,就可形成离域π键:
(1) 成键的原子共面(或共曲面),每个原子可提供一个垂直
于平面的p轨道 。
(2) π电子数小于参加成键原子的p轨道总数的二倍。
离域π键一般用
Π
m n
表示,n为参与成键的原子轨道数,m为电
子数。
5. 分子轨道理论:
非键轨道 n : nonbonding molecular orbital 能量较之原子轨道基本不变的分子轨道。
分子轨道和配位化合物ppt课件
上页 下页 目录 返回
电子填入分子轨道时服从以下规则
1. 尽量先占据能量最低的轨道, 低能级轨道填满 后才进入能级较高的轨道;
2. 每条分子轨道最多只能填入 2 个自旋相反的 电子;
3. 分布到等价分子轨道时总是尽可能分占轨道。
上页 下页 目录 返回
1. H2 和 “He2 ” 中的分子轨道
两个H原子相互接近时, 由两条 1s 轨道组合得到能 级不同、在空间占据的区域亦不同的两条分子轨道。能 级 较 低 的 一 条 叫 成 键 分 子 轨 道 ( bonding molecular orbital), 能级较高的一条叫反键分子轨道(antibonding molecular orbital)。
上页 下页 目录 返回
分子轨道理论很好地解释了H2+离子的存在。这个 离子分子的s-成键轨道里只有1个电子,键级等于0.5, 仍可存在。这说明,量子化学的化学键理论并不受路 易斯电子配对说的束缚,只要形成分子体系能量降低, 就可形成分子,并非必须电子“配对”。
H 1s
H2+上页分子下轨页道目能录级返图回
O2 分子中还有两个
π
3 2
键,即 :O
O: ,当然具有顺磁性
键级 BO = ( 8 - 4 ) /2 = 2
上页 下页 目录 返回
若分子中无成单电子时,电子自旋磁场抵消,物质显抗磁性 ( 逆磁性或反磁性 ) ,表现在于外磁场作用下出现诱导磁矩,与外 磁场相排斥,故在磁天平中略减重。
实验表明,氧气单质是顺磁性的。用分子轨道理论解释,见
组合而成 。例如: A+B→AB
ΨI CaΨACbΨB ΨⅡC'aΨA- C'bΨB
(本课程不要求,结构化学再讲! )
电子填入分子轨道时服从以下规则
1. 尽量先占据能量最低的轨道, 低能级轨道填满 后才进入能级较高的轨道;
2. 每条分子轨道最多只能填入 2 个自旋相反的 电子;
3. 分布到等价分子轨道时总是尽可能分占轨道。
上页 下页 目录 返回
1. H2 和 “He2 ” 中的分子轨道
两个H原子相互接近时, 由两条 1s 轨道组合得到能 级不同、在空间占据的区域亦不同的两条分子轨道。能 级 较 低 的 一 条 叫 成 键 分 子 轨 道 ( bonding molecular orbital), 能级较高的一条叫反键分子轨道(antibonding molecular orbital)。
上页 下页 目录 返回
分子轨道理论很好地解释了H2+离子的存在。这个 离子分子的s-成键轨道里只有1个电子,键级等于0.5, 仍可存在。这说明,量子化学的化学键理论并不受路 易斯电子配对说的束缚,只要形成分子体系能量降低, 就可形成分子,并非必须电子“配对”。
H 1s
H2+上页分子下轨页道目能录级返图回
O2 分子中还有两个
π
3 2
键,即 :O
O: ,当然具有顺磁性
键级 BO = ( 8 - 4 ) /2 = 2
上页 下页 目录 返回
若分子中无成单电子时,电子自旋磁场抵消,物质显抗磁性 ( 逆磁性或反磁性 ) ,表现在于外磁场作用下出现诱导磁矩,与外 磁场相排斥,故在磁天平中略减重。
实验表明,氧气单质是顺磁性的。用分子轨道理论解释,见
组合而成 。例如: A+B→AB
ΨI CaΨACbΨB ΨⅡC'aΨA- C'bΨB
(本课程不要求,结构化学再讲! )
分子轨道理论ppt课件
1、s-s重叠。两个轨道相加成为成键轨道σ,
两者相减则成为反键轨道σ*。若是1s轨道,
则分子轨道分别为σ1s、σ1s*,若是2s轨道,
则写为 σ2s、σ2s*。
节面
σ *ns 能
量
σ ns 11
2、 s-p重叠:形成一个成键轨道 s-p 一个反键轨道 s-p*
2s
2p
σ* s-p
σs-p
12
3、p-p重叠。两个原子的p轨道可以有两 种组合方式,其一是“头碰头”,两个原 子的px轨道重叠后,形成一个成键轨道σp 和一个反键轨道σp*。其二是两个原子的py 或pz轨道垂直于键轴,以“肩并肩”的形 式发生重叠,形成的分子轨道称为π分子轨 道,成键轨道πp,反键轨道πp*。两个原子 各有3个p轨道,可形成6个分子轨道,即 σpx 、σpx* 、πpy 、πpy* 、πpz 、πpz* 。
22
Be2 2s
1s
σ *2s 2s
σ 2s σ *1s
1s σ 1s
(
1s
)
2
(
1s
)
2
(
2s
)
2
(
2s
)
2
KK
(
2
s
)2
(
2s
)2
键级为0,所以Be2不存在。 23
B2
(
1s
)
2
(
1s
)
2
(
2
s
)
2
(
2s
)
2
2 2
1 py
1 pz
键级为0,故不能稳定存在。
18
(3)第二周期,同核双原子分子的分子轨道
分子轨道理论 (2)ppt课件
···
σ 2s σ *1s
1个σ键、 2个三电子键
1s
1s
σ 1s
O2为顺磁性物质
A.O M.O A.O
17
无机化学多媒体电子教案
第四节结束
第六章 分子结构与性质
第四节 结束
18
σ 1s
分子轨道式 He2[(1s)2(*1s)2] He+2 [(2s)2(*1s)1]
价键结构式
-
键的名称
-
[He ··He]+
三电子σ键
是否存在
不存在
存在
14
描述分子的结构稳定性
键级——分子中净成键电子数的一半
键注级意=:成对键净键大级成轨小只键道,能2电电实粗子子际略数数上估-键计反级分键相子轨同稳道的定电分性子子的数稳相 = 定性也有差别。 2
无机化学多媒体电子教案
第六第章四分节子结分子构轨与道理性论质 第四节
分子轨道理论
1
价键理论的局限性
不能解释有的分子的结构和性质
如 O2 O 2s 2p
¨O¨׃׃O ¨O=¨O
O
¨¨ ¨¨
2p
2s
根据价键理论,氧分子中有一个键和一个
键,其电子全部成对。
但经磁性实验测定,氧分子有两个不成对
的电子,自旋平行,表现出顺磁性。
σ 1s
M.O A.O
分子结构式 ¨׃F—¨F׃ ¨ ¨9
第一、二周σ期*同2p 核双原子的分分子子(除轨O道2、能F2级外)
能
2p π *2p 2p
量
σ 2p
π 2p 2s σ *2s 2s
σ 2s
1s σ *1s 1s σ 1s
A.O M.O A.O
σ 2s σ *1s
1个σ键、 2个三电子键
1s
1s
σ 1s
O2为顺磁性物质
A.O M.O A.O
17
无机化学多媒体电子教案
第四节结束
第六章 分子结构与性质
第四节 结束
18
σ 1s
分子轨道式 He2[(1s)2(*1s)2] He+2 [(2s)2(*1s)1]
价键结构式
-
键的名称
-
[He ··He]+
三电子σ键
是否存在
不存在
存在
14
描述分子的结构稳定性
键级——分子中净成键电子数的一半
键注级意=:成对键净键大级成轨小只键道,能2电电实粗子子际略数数上估-键计反级分键相子轨同稳道的定电分性子子的数稳相 = 定性也有差别。 2
无机化学多媒体电子教案
第六第章四分节子结分子构轨与道理性论质 第四节
分子轨道理论
1
价键理论的局限性
不能解释有的分子的结构和性质
如 O2 O 2s 2p
¨O¨׃׃O ¨O=¨O
O
¨¨ ¨¨
2p
2s
根据价键理论,氧分子中有一个键和一个
键,其电子全部成对。
但经磁性实验测定,氧分子有两个不成对
的电子,自旋平行,表现出顺磁性。
σ 1s
M.O A.O
分子结构式 ¨׃F—¨F׃ ¨ ¨9
第一、二周σ期*同2p 核双原子的分分子子(除轨O道2、能F2级外)
能
2p π *2p 2p
量
σ 2p
π 2p 2s σ *2s 2s
σ 2s
1s σ *1s 1s σ 1s
A.O M.O A.O
《分子轨道理论》PPT课件
O2~F2:σ1s<σ*1s<σ2s<σ*2s <σ2pz<π2py=π2px<π*2py=π*2px<σ*2pz
异核双原子分子: 1σ<2σ<3σ<4σ<5σ<1π<2π<6σ
分子轨道理论(MOT)
三十年代,MOT不仅解决了VBT不能解决的许多 问题,并且提出了“单电子键”、“三电子键”等新 化学键,有效地处理多原子的π键体系,解释了诱导 效应、离域效应等。 从三十年代到五十年代,MOT只能作近似的计算, 主要是借助于半经验的方法来总结和探索各种分子中 化学键的本质。 由于计算机的引入,MOT在五十年代得到较快的 发展。 六十年代,定量的分子轨道研究方法(包括从头计 算的自洽场法和半经验法)得到发展。
Hˆ n
E E1 E2 En
分子的波函数
11 n
2 原子轨道线性组合
Linear Combination of Atomic Orbitals(LCAO)
j C j1 1 C j22
分子轨道
n
C jn n C ji i i 1
原子轨道
py、pz、dxy、dxz、dyz py、pz、dxy、dxz、dyz s、px、pz、dyz、dx2-y2、dz2 s、px、py、dxy、dyz、dx2-y2 s、px、pz、dyz、dxz 、dx2-y2 、dz2 s、px 、py 、pz、dxy、dxz 、dx2-y2 、dz2 s、px、py、pz、dxz、dyz、dzy
第三章
结构化学 ——第三章 双原子子的结构
三 分子轨道理论
分子轨道近似 原子轨道线性组合 分子轨道的成键三原则 分子轨道的表示方法
1 分子轨道近似
分子轨道理论假定分子中每个电子是在原子核 形成的库仑场和其它电子形成的平均势场中运 动,其运动状态可用单电子波函数-分子轨道 ψ来描述。
异核双原子分子: 1σ<2σ<3σ<4σ<5σ<1π<2π<6σ
分子轨道理论(MOT)
三十年代,MOT不仅解决了VBT不能解决的许多 问题,并且提出了“单电子键”、“三电子键”等新 化学键,有效地处理多原子的π键体系,解释了诱导 效应、离域效应等。 从三十年代到五十年代,MOT只能作近似的计算, 主要是借助于半经验的方法来总结和探索各种分子中 化学键的本质。 由于计算机的引入,MOT在五十年代得到较快的 发展。 六十年代,定量的分子轨道研究方法(包括从头计 算的自洽场法和半经验法)得到发展。
Hˆ n
E E1 E2 En
分子的波函数
11 n
2 原子轨道线性组合
Linear Combination of Atomic Orbitals(LCAO)
j C j1 1 C j22
分子轨道
n
C jn n C ji i i 1
原子轨道
py、pz、dxy、dxz、dyz py、pz、dxy、dxz、dyz s、px、pz、dyz、dx2-y2、dz2 s、px、py、dxy、dyz、dx2-y2 s、px、pz、dyz、dxz 、dx2-y2 、dz2 s、px 、py 、pz、dxy、dxz 、dx2-y2 、dz2 s、px、py、pz、dxz、dyz、dzy
第三章
结构化学 ——第三章 双原子子的结构
三 分子轨道理论
分子轨道近似 原子轨道线性组合 分子轨道的成键三原则 分子轨道的表示方法
1 分子轨道近似
分子轨道理论假定分子中每个电子是在原子核 形成的库仑场和其它电子形成的平均势场中运 动,其运动状态可用单电子波函数-分子轨道 ψ来描述。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
43
44
45
46
47Leabharlann 33CF和CF+的键能分别为 548kJ/mol和753kJ/mol。试用 MOT解释。
CF的键级为2.5、CF+的键级为3 键级越大,键能越大。
34
分子极性 偶极矩
在任何一个分子中都可以找到一个正电荷中心和一个负电荷中心。 正、负电荷中心不重合的分子为极性分子。 正、负电荷中心重合的分子为非极性分子
iii) O2 分子有两个成单电子,所以氧分子有顺磁性。
21
F2 分子,含18个电子
[(1s)2 (1s*)2 (2s)2 (2s*)2 (2px)2 (2py)2 =(2pz)2 (2py*)2 =(2pz*)2]
KK 能量抵消
能量抵消 能量抵消
i) F2 分子中有一个 键。
ii)
F2 分子键级=
13
(b) 适用于 1~7 号元素形成的分子或离子
对于 N,B,C原子,2s 和 2p 轨道间能量差小, 相互间排斥作用大,形成分子轨道后,σ2s和σ2Px之间 的排斥也大,结果,出现 B图中σ2Px 的能级反比 π2Py, π2Pz 的能级高的现象。
(Be2)(2py)(2pz) (2px) (2py*)(2pz*) (2px*) KK(2s)(2s*) (2py)(2pz) (2px) (2py*)(2pz*) (2px*) (1s)(1s*) (2s)(2s*) (2py)(2pz) (2px) (2py*)(2pz*) (2px*)14
偶极矩还可帮助判断分子可能的空间构型。例如NH3和BCl3 都是由四个原子组成的分子,可能的空间构型有两种,一种是平 面三角形,一种是三角锥形,根据
(NH3)=5.001030 Cm (BCl3)= 0.00 Cm
可知,BCl3分子是平面三角形构型,而NH3分子是三角锥形构型。 38
分子间作用力 i. 取向力 极性分子有偶极矩, 偶极子之间 存在静电相互作用, 这种分子间的相互作用称 为取向力, 如下图:
18
C2能否稳定存在?
画出O2的分子轨道 排布式
19
20
O2 分子,含16个电子。
三电子 键
[(1s)2 (1s*)2 (2s)2 (2s*)2 (2px)2 (2py)2 =(2pz)2 (2py*)1 =(2pz*)1]
KK 能量抵消
三电子 键
i) O2 分子键级 = 2 。
ii) O2 分子有两个三电子键。 O O
由于填充满了一对成键轨道和反键轨道,故分子的能量与原子单独存在时 能量相等。故 He2 不存在,键级为零,He之间无化学键。
16
问:H2+和He2+能否稳定存在?
He2+ 的存在用价键理论不好解释,无两个单电子的成对问题。但用分子轨道 理论则认为有半键。这是分子轨道理论较现代价键理论的成功之处。
17
2. 在分子轨道中电子填充次序所遵循的原则和在原子轨道中 填充电子的原则相同。即按能量最低原理,泡利不相容原理和 洪特规则进行填充。
3. 原子轨道有效地组成分子轨道必须符合能量近似、轨道最 大重叠和对称性匹配这三个成键原则。
6
成键三原则: 1) 能量近似的原子轨道才能有效组合
2) 轨道最大重叠原则 原子轨道重叠程度越大,越有利于分
35
同核双原子分子:原子的电负性相同,原子之间的化学键是非极性键,分 子是非极性分子。
异核双原子分子:由于电负性不同,两个原子之间的化学键为极性键,分 子是极性分子。
多原子分子:如是相同原子组成的、且仅有非极性键,则分子通常是非极 性分子,如P4、S8等。如果组成原子不相同,那么分子的极性不仅与元 素的电负性有关,还与分子的空间结构有关。
有H:1σ 2σ 3σ 1π 4σ 2π 5σ 6σ 无H:1σ 2σ 3σ 4σ 1π 5σ 2π 6σ 25
异核双原子分子HF
26
CO
2π
1π
6σ 2π 5σ 1π
4σ
3σ
K
K
27
NO CN-
1π
2π
5σ 1π 4σ
3σ
K
K
28
在NO,C2,CN中,哪几个得 电子变为AB-后比原来中性分子键 能大,哪几个失电子变为AB+后比 原来中性分子键能大?
CO 0.003 0.008 8.75
HI 0.025 0.113 25.87
HBr 0.69 0.502 21.94
HCl 3.31 1.00 16.83
NH3 13.31 1.55 H2O 36.39 1.93
14.95 9.00
8.50 8.75 26.00 23.11 21.14 29.60 47.31
2. 分子的磁性
i) 分子的顺磁性:分子或离子内有成单电子存 在时,该分子能被外磁场所吸引。
ii) 分子的反磁性:分子或离子内没有成单电子 存在时,该分子能被外磁场所排斥。
4
分子轨道理论的基本概念
分子中的电子是以多个原子核所组成的骨架 为中心进行运动的,每个电子的运动状态不同于 在原子中的运动状态。在分子中各个电子的运动
29
30
31
判断 NO 和 CO 哪一个的第一电离能小,原因是什么? CO: KK (3)2(4)2(1)4(5)2 NO: KK (3)2(4)2(1)4(5)2(2)1 NO 在高能反键轨道上有一电子, I1较低。
32
例:试用分子轨道理论讨论SO分子的电子结构, 说明基态时有几个不成对电子。
=qd
偶极矩是个矢量,它的方向规定为从正电荷中心指向负电荷 中心。其单位是库仑米 (Cm),实验中常用德拜(D)来表示:
1D = 3.336 1030Cm
例如 (H2O) = 6.171030 Cm = 1.85 D
实际上,偶极矩是通过实验测得的
37
偶极矩大小可以判断分子有无极性,比较分子极性的大小。 = 0,为非极性分子;值愈大,分子的极性愈大。
41
需要注意的是:取向力和诱导力只存在于极性分子之间, 色散
力不管是极性分子还是非极性分子之间都存在。这些作用力不
仅存在于分子之间, 而且还存在于同一分子内的不同原子或基团
之间。下面列出了某些分子分子间力的数值(kJ/mol):
分子 取向力 诱导力 色散力 总作用力
Ar 0.000 0.000 8.50
等电子原理: 具有相同电子数的分子称为等电子体。等电子体在分
子轨道中的电子排布和成键情况相似,称之为等电子原理。
24
每条MO的形式与同核双原子分子相似, 但两个AO对同一个MO的贡献不 相等。因此轨道对称性消失。 通常情况是:
(1)对成键MO的较大贡献来自电负性较大的原子. (2) 对反键MO的较大贡献来自电负性较小的原子. (3)不同原子的AO重叠引起的能量降低不象同核双原子分子中相 同能级的AO重叠引起的能量降低那样显著. 根据“等电子原理”, CO、NO、CN-的分子轨道与N2相似.
分子性质与分子轨道
1
指出下列物质的杂化类型和空间构型
SCl2 ClF3
[SiF6]2‾ AsF5
2
指出下列物质的π键类型
CO32– NO2– ClO2 ClO3–
3
尚需解决的问题:
1. 按照价键理论的观点,分子内原子通过外层 电子配对成键,应该无成单电子。但 H2+ , NO 等分子或离子含有成单电子,却也能稳定存在。
--
++
- ++
+ +
+
--
- ++ -
+
原子轨道同号部分重叠 —— 有效重叠
10
11
12
(a) 适用于 O, F 元素形成的分子或离子
KK(2s)(2s*) (2px) (2py)(2pz) (2py*)(2pz*) (2px*) (Be2)(2px) (2py)(2pz) (2py*)(2pz*) (2px*) (1s)(1s*) (2s)(2s*) (2px) (2py)(2pz) (2py*)(2pz*) (2px*)
39
ii. 诱导力 极性分子的偶极矩会诱导临近分 子, 使其电荷发生位移, 产生诱导偶极子, 偶极子和 诱导偶极子之间存在吸引作用, 这种分子间的相互 作用称为诱导力, 如下图:
-
O
-
+H
H
+
-+-
+
40
iii. 色散力 由于电子和原子核的运动, 使非 极性分子存在瞬间偶极矩, 产生的瞬间偶极矩会诱 导临近分子, 使其产生诱导偶极矩, 诱导偶极矩之 间存在吸引作用, 这种分子间的相互作用称为色散 力, 如下图:
状态可用 表示,与之对应的称为分子轨道。
原子轨道 AO
电子属某原子
AO 有不同的能级 AO 有不同的符号,如
s,p,d,f…
分子轨道 MO
电子属整个分子
MO 也有不同的能级
MO 也有不同的符号, 如, , …
5
分子轨道理论的基本内容:
1. n个原子轨道经线性组合可形成n个分子轨道。其中包括相 同数目的成键分子轨道(HOMO)和反键分子轨道(LUMO),或一 定数目的非键分子轨道。所有分子轨道的总能量与组成分子轨 道的全部原子轨道的总能量相等。
H2分子,含2个电子, (1s)2,能稳定存在。
电子只填充在成键轨道中,能量比在原子轨道中低。这个能量差,就是分子
轨道理论中化学键的本质。可用键级表示分子中键的个数:
键级(BO) =(成键电子数-反键电子数)/ 2
H2分子中,键级 = (2 – 0)/ 2 = 1,单键。
15
He2 分子,含4个电子, (1s)2 (1s*)2 , 不能稳定存在
