高一化学命题双向细目表(期中考试)
合集下载
高一上学期期中考试双向细目表

0.6
22
细胞核的功能
1.5
0.7
借用
0.8
23
染色体成分
1.5
0.7
借用
0.7
24
细胞器的功能
1.5
0.6
改编
0.5
25
细胞器的功能
1.5
0.5
借用
0.4
26
细胞膜是选择透过性膜
1.5
0.5
借用
0.6
27
生物大分子的基本骨架
1.5
0.7
借用
0.5
28
细胞膜的功能
1.5
0.8
借用
0.9
29
细胞膜的成分
1.5
0.7
借用
0.6
30
物质跨膜运输方式
1.5
0.6
借用
0.6
31
物质跨膜运输方式
1.5
0.7
借用
0.6
32
细胞膜是选择透过性膜
1.5
0.5
借用
0.6
33
氨基酸的结构
1.5
A0.5B0.6
借用
A0.6B0.
7
34
蛋白质的结构
1.5
A0.7B0.7
借用
A0.9B0.5
35
蛋白质的结构、脱水缩合
1.5
质壁分离和复原
1.5
A0.6B0.6
借用
A0.7B0.6
41
蛋白质的结构、脱水缩合
8
0.7
改编
0.6
42
检测生物组织中有机物
6
0.8
改编
0.6
43
细胞膜系统的结构和功能
22
细胞核的功能
1.5
0.7
借用
0.8
23
染色体成分
1.5
0.7
借用
0.7
24
细胞器的功能
1.5
0.6
改编
0.5
25
细胞器的功能
1.5
0.5
借用
0.4
26
细胞膜是选择透过性膜
1.5
0.5
借用
0.6
27
生物大分子的基本骨架
1.5
0.7
借用
0.5
28
细胞膜的功能
1.5
0.8
借用
0.9
29
细胞膜的成分
1.5
0.7
借用
0.6
30
物质跨膜运输方式
1.5
0.6
借用
0.6
31
物质跨膜运输方式
1.5
0.7
借用
0.6
32
细胞膜是选择透过性膜
1.5
0.5
借用
0.6
33
氨基酸的结构
1.5
A0.5B0.6
借用
A0.6B0.
7
34
蛋白质的结构
1.5
A0.7B0.7
借用
A0.9B0.5
35
蛋白质的结构、脱水缩合
1.5
质壁分离和复原
1.5
A0.6B0.6
借用
A0.7B0.6
41
蛋白质的结构、脱水缩合
8
0.7
改编
0.6
42
检测生物组织中有机物
6
0.8
改编
0.6
43
细胞膜系统的结构和功能
2017学年第一学期期中杭州地区五校联考高一化学双项细目表

2017 学年第一学期期中联考双向细目表(高一年级化学学科)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26
知识点 物质的分类 实验仪器 电解质 电离方程式 物质的分离方法 核素 氧化还原反应概念 分散系 原子结构模型 物质体积的影响因素 氯气的性质 氧化还原反应的判断 物质的量浓度 物质的保存 反应类型 实验方案 物质的量简单计算 常见物质的检验 原子结构 氧化还原反应的应用 氯气的化学性质 阿伏伽德罗常数 氧化还原反应规律 氧化还原反应综合应用 物质的推断 Ⅰ有关物质的量计算和化学用语 Ⅱ氧化还原反应的应用
分值 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 15
7 6 12
10
1
27 氯水的性质 28 氯气性质的综合应用 29 物质的量浓度配制及误差分析、电
子转移的表示方法
30、31 有关物质的量的综合计算
能力层级 a a b a b a b a a a a a b a b b b b b c b c b c c b b b b b
c
Hale Waihona Puke 题型 单项选择题填空题 填空题 实验题 实验题 计算题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26
知识点 物质的分类 实验仪器 电解质 电离方程式 物质的分离方法 核素 氧化还原反应概念 分散系 原子结构模型 物质体积的影响因素 氯气的性质 氧化还原反应的判断 物质的量浓度 物质的保存 反应类型 实验方案 物质的量简单计算 常见物质的检验 原子结构 氧化还原反应的应用 氯气的化学性质 阿伏伽德罗常数 氧化还原反应规律 氧化还原反应综合应用 物质的推断 Ⅰ有关物质的量计算和化学用语 Ⅱ氧化还原反应的应用
分值 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 15
7 6 12
10
1
27 氯水的性质 28 氯气性质的综合应用 29 物质的量浓度配制及误差分析、电
子转移的表示方法
30、31 有关物质的量的综合计算
能力层级 a a b a b a b a a a a a b a b b b b b c b c b c c b b b b b
c
Hale Waihona Puke 题型 单项选择题填空题 填空题 实验题 实验题 计算题
高中化学双向细目表
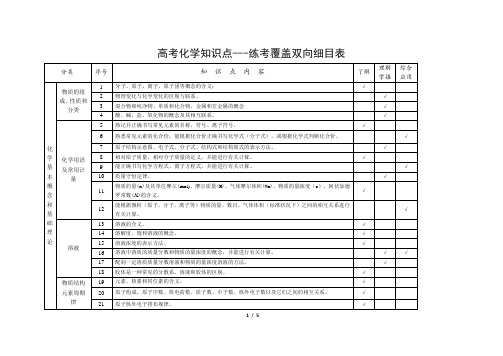
√
化学反应速率和化学平衡
41
化学反应速率的概念、反应速率的定量表示方法。
√
42
能正确计算化学反应的转化率(α)。
√
43
反应活化能的概念,催化剂的重要作用。
√
44
化学反应的可逆性及化学平衡的建立。
√
45
化学平衡的特征。
√
46
化学平衡常数的含义,能够用化学平衡常数进行简单计算。
√
√
47
外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。
√
81
常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
√
82
常见物质进行检验、分离和提纯的方法。
√
83
溶液配制方法。
√
84
根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改进实验方案。
√
10
质量守恒定律。
√
11
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。
√
12
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
√
溶液
13
溶液的含义。
√
14
溶解度、饱和溶液的概念。
合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
√
物质结构与性质模块
原子结构与元素性质
102
原子核外电子的运动状态、能级分布和排布原理。
化学反应速率和化学平衡
41
化学反应速率的概念、反应速率的定量表示方法。
√
42
能正确计算化学反应的转化率(α)。
√
43
反应活化能的概念,催化剂的重要作用。
√
44
化学反应的可逆性及化学平衡的建立。
√
45
化学平衡的特征。
√
46
化学平衡常数的含义,能够用化学平衡常数进行简单计算。
√
√
47
外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。
√
81
常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
√
82
常见物质进行检验、分离和提纯的方法。
√
83
溶液配制方法。
√
84
根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改进实验方案。
√
10
质量守恒定律。
√
11
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。
√
12
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
√
溶液
13
溶液的含义。
√
14
溶解度、饱和溶液的概念。
合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
√
物质结构与性质模块
原子结构与元素性质
102
原子核外电子的运动状态、能级分布和排布原理。
浙江省钱塘联盟2023-2024学年高一上学期期中联考化学双向细目表

第二章第一节
18
氯水的性质
第二章第二节
19
物质(离子)检验
物质的性质
20
氧化还原
第一章第三节
21
实验操作
物质综合性质
22
阿伏伽德罗常数及应用
第二章第三节
23
氧化性的比较
第一章第三节
24
次氯酸分解实验
第二章第二节
25
计算
守恒法应用
26
化学用语、电解质、电离方程式、双线桥法
综合
27
溶液的配制实验
第二章实验活动1
9
关于氯气化学实验现象的描述
第二章第二节
10
焰色试验、钠的化合物性质及侯氏制碱法
第二章第一节
11
四大反应与氧化还原的关系
第一章第三节
12
求氯离子浓度相同
第二章第三节
13
物质间的转化
第一章第一节
14
离子共存
第一章第二节
15
离子方程式正误判断
第一章第二节
16
反应条件对产物的影响
综合物质的性质
17
碳酸钠和碳酸氢钠性质的比较
28
物质的推断
综合
29
实验室制氯气
第二章第二节
30Байду номын сангаас
计算(碳酸钠碳酸氢钠的性质)
综合
题号
知识点
1
钠的主要存在形式
第二章第一节
2
物质的分类(碱性氧化物)
第一章第一节
3
与实验有关的图标
第一章第一节
4
分散系
第一章第一节
5
对摩尔质量、质量、阿伏伽德罗常数准确应用
18
氯水的性质
第二章第二节
19
物质(离子)检验
物质的性质
20
氧化还原
第一章第三节
21
实验操作
物质综合性质
22
阿伏伽德罗常数及应用
第二章第三节
23
氧化性的比较
第一章第三节
24
次氯酸分解实验
第二章第二节
25
计算
守恒法应用
26
化学用语、电解质、电离方程式、双线桥法
综合
27
溶液的配制实验
第二章实验活动1
9
关于氯气化学实验现象的描述
第二章第二节
10
焰色试验、钠的化合物性质及侯氏制碱法
第二章第一节
11
四大反应与氧化还原的关系
第一章第三节
12
求氯离子浓度相同
第二章第三节
13
物质间的转化
第一章第一节
14
离子共存
第一章第二节
15
离子方程式正误判断
第一章第二节
16
反应条件对产物的影响
综合物质的性质
17
碳酸钠和碳酸氢钠性质的比较
28
物质的推断
综合
29
实验室制氯气
第二章第二节
30Байду номын сангаас
计算(碳酸钠碳酸氢钠的性质)
综合
题号
知识点
1
钠的主要存在形式
第二章第一节
2
物质的分类(碱性氧化物)
第一章第一节
3
与实验有关的图标
第一章第一节
4
分散系
第一章第一节
5
对摩尔质量、质量、阿伏伽德罗常数准确应用
高中化学模块学业考试命题双向细目表
第一章 第二节 24 第一章 第四节
各官能团的性质
16 4
第三章 第一节
了解碳原子的成键特点
11 3
有机化学实验
3 23
10
22
8
1
4
7
主
题
烃及其衍生物的性质与应用 11
13 6 15
2
17 8 18
高分子化合物
19 7 12 10 2
第一章 第二节 第一章 第四节 第三章 第三节
第二章 第三章 47
高中化学模块学业考试命题双向细目表
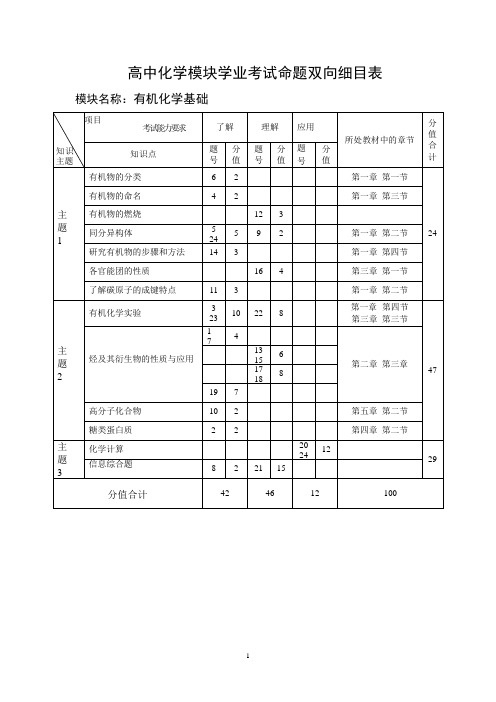
模块名称:有机化学基础
项目
考试能力要求
知识 主题
知 知识 识点 点 有机物的分类
了解
理解 应用
分
题 分 题 分题
分
所处教材中的章节
值 合
号 值 号 值号 值
计
62
第一章 第一节
有机物的命名
42
第一章 第三节
主 有机物的燃烧
题
同分异构体
1
研究有节
糖类蛋白质
主 化学计算
题
信息综合题
3
22
第四章 第二节
20 12
24
29
8 2 21 15
分值合计
42
46
12
100
1
2023-2024学年度第二学期九县(区市)一中(高中)期中联考双向细目表
掌握
运用
18
6分
0.7
有机物乙烯性质、有机化学方程式书写、同分异构体书写、有机反应类型判断Biblioteka 掌握运用1911分
0.65
原电池工作原理、电极方程式书写、原电池的有关计算
掌握运用综合
20
13分
0.6
氨气、NO2制取、性质、实验操作、现象描述;
化学方程式书写、物质的量浓度计算
掌握运用综合
20232024学年第二学期九县(区、市)一中(高中)期中联考
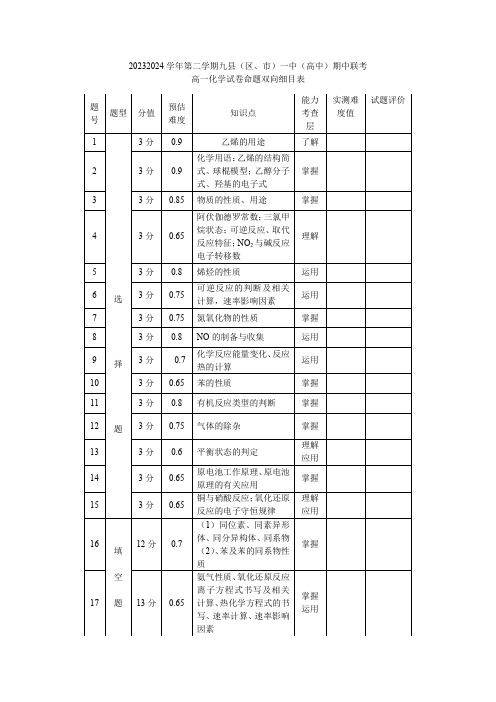
高一化学试卷命题双向细目表
题号
题型
分值
预估难度
知识点
能力考查层
实测难度值
试题评价
1
选
择
题
3分
0.9
乙烯的用途
了解
2
3分
0.9
化学用语:乙烯的结构简式、球棍模型;乙醇分子式、羟基的电子式
掌握
3
3分
0.85
物质的性质、用途
掌握
4
3分
0.65
阿伏伽德罗常数:三氯甲烷状态;可逆反应、取代反应特征;NO2与碱反应电子转移数
理解
5
3分
0.8
烯烃的性质
运用
6
3分
0.75
可逆反应的判断及相关计算,速率影响因素
运用
7
3分
0.75
氮氧化物的性质
掌握
8
3分
0.8
NO的制备与收集
运用
9
3分
0.7
化学反应能量变化、反应热的计算
运用
10
3分
0.65
苯的性质
掌握
11
3分
0.8
有机反应类型的判断
运用
18
6分
0.7
有机物乙烯性质、有机化学方程式书写、同分异构体书写、有机反应类型判断Biblioteka 掌握运用1911分
0.65
原电池工作原理、电极方程式书写、原电池的有关计算
掌握运用综合
20
13分
0.6
氨气、NO2制取、性质、实验操作、现象描述;
化学方程式书写、物质的量浓度计算
掌握运用综合
20232024学年第二学期九县(区、市)一中(高中)期中联考
高一化学试卷命题双向细目表
题号
题型
分值
预估难度
知识点
能力考查层
实测难度值
试题评价
1
选
择
题
3分
0.9
乙烯的用途
了解
2
3分
0.9
化学用语:乙烯的结构简式、球棍模型;乙醇分子式、羟基的电子式
掌握
3
3分
0.85
物质的性质、用途
掌握
4
3分
0.65
阿伏伽德罗常数:三氯甲烷状态;可逆反应、取代反应特征;NO2与碱反应电子转移数
理解
5
3分
0.8
烯烃的性质
运用
6
3分
0.75
可逆反应的判断及相关计算,速率影响因素
运用
7
3分
0.75
氮氧化物的性质
掌握
8
3分
0.8
NO的制备与收集
运用
9
3分
0.7
化学反应能量变化、反应热的计算
运用
10
3分
0.65
苯的性质
掌握
11
3分
0.8
有机反应类型的判断
高一化学双向细目表1-6班 (1)

2014年高二年级化学学科期末考试命题双向细目表1-6班
知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.高分子材料成分识别及简单性质
√
选择
5
0.6
2.糖类、油脂、蛋白质结构与性质
√
选择
5
0.72
3.醇类,醛类等有机物生活中应用及性质
√
选择,填空
20
0.6
4.脂肪烃与含氧衍生物性质的综合考察
√
选择,
√
选择
20
0.5
19.同分异构、同系物、性质的综合考察
√
选择、填空
15
0.5
20.有机物性质、结构推断综合考察
√
选择、填空
35
0.5
试卷评价:
√
选择
5
0.5
12.有机物的实验室制备及其知识迁移
√
填空、填空
26
0.6
13.烷烃混合气体燃烧的计算与判断
√
选择
2.5
0.5
14.有机物的有关计算
√
选择、填空、计算
10
0.4
15.有机物的鉴别
√
填空
5
0.6
16.有机物除杂
√
填空
5
0.45
17.酸与醇酯化的实质考察
√
选择
2.5
0.8
18.有机物性质的迁移考察
5
0.6
5.有机物成分、结构的综合考察
√
选择
25
0.6
6、研究有机物一般经过以下几个基本方法
知识点
了
解
理
解
掌
握
应
用
题型
分
值
预设
难度
实测
难度
1.高分子材料成分识别及简单性质
√
选择
5
0.6
2.糖类、油脂、蛋白质结构与性质
√
选择
5
0.72
3.醇类,醛类等有机物生活中应用及性质
√
选择,填空
20
0.6
4.脂肪烃与含氧衍生物性质的综合考察
√
选择,
√
选择
20
0.5
19.同分异构、同系物、性质的综合考察
√
选择、填空
15
0.5
20.有机物性质、结构推断综合考察
√
选择、填空
35
0.5
试卷评价:
√
选择
5
0.5
12.有机物的实验室制备及其知识迁移
√
填空、填空
26
0.6
13.烷烃混合气体燃烧的计算与判断
√
选择
2.5
0.5
14.有机物的有关计算
√
选择、填空、计算
10
0.4
15.有机物的鉴别
√
填空
5
0.6
16.有机物除杂
√
填空
5
0.45
17.酸与醇酯化的实质考察
√
选择
2.5
0.8
18.有机物性质的迁移考察
5
0.6
5.有机物成分、结构的综合考察
√
选择
25
0.6
6、研究有机物一般经过以下几个基本方法
高一化学试卷命制双向细目表

高 一 化学 试卷命制双向细目表
序号
考查知识点
认知目标 分值
识记 理解 应用 综合
题型
题号
1
绿色化学与生活常识2.5 √ Nhomakorabea选择题 1
2
化学键、离子键、共价键、离子 化合物及共价化合物的概念
2.5
√
3
海水资源的利用
2.5 √
4
化学反应中的能量变化,吸热与 放热反应的概念
2.5
√
5
同分异构体及同素异形体等概念 的辨析
12
√
实验题 22
23
元素周期表的结构及周期律的综 合应用
12
√
填空题 23
24
海水资源的综合利用、工艺流程 原理的应用
15
√ 综合题 24
合计
100 6
8
5
5
24
及格 率
备课组 长
命题人
教研组 长
及格 率
备注:
备课组 长
命题人
教研组 长
√
选择题 10
11
甲烷等烷烃的性质
2.5 √
选择题 11
12 元素周期表及周期律的应用 2.5
√
选择题 12
13 化学反应速率及限度的综合应用 2.5
√ 选择题 13
14
化学平衡状态的理解
2.5
√
15
可逆反应的概念及速率的影响因 素
2.5
√
16 有机化学基本反应类型的判断 2.5
√
选择题 14 选择题 15 选择题 16
2.5
√
6
有机物中阿伏伽德罗定律及推论 的综合应用
2.5
√
序号
考查知识点
认知目标 分值
识记 理解 应用 综合
题型
题号
1
绿色化学与生活常识2.5 √ Nhomakorabea选择题 1
2
化学键、离子键、共价键、离子 化合物及共价化合物的概念
2.5
√
3
海水资源的利用
2.5 √
4
化学反应中的能量变化,吸热与 放热反应的概念
2.5
√
5
同分异构体及同素异形体等概念 的辨析
12
√
实验题 22
23
元素周期表的结构及周期律的综 合应用
12
√
填空题 23
24
海水资源的综合利用、工艺流程 原理的应用
15
√ 综合题 24
合计
100 6
8
5
5
24
及格 率
备课组 长
命题人
教研组 长
及格 率
备注:
备课组 长
命题人
教研组 长
√
选择题 10
11
甲烷等烷烃的性质
2.5 √
选择题 11
12 元素周期表及周期律的应用 2.5
√
选择题 12
13 化学反应速率及限度的综合应用 2.5
√ 选择题 13
14
化学平衡状态的理解
2.5
√
15
可逆反应的概念及速率的影响因 素
2.5
√
16 有机化学基本反应类型的判断 2.5
√
选择题 14 选择题 15 选择题 16
2.5
√
6
有机物中阿伏伽德罗定律及推论 的综合应用
2.5
√
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学期中考试命题双向细目表
能力要求 题型 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 考察知识点 化学反应与能量 元素周期表 化学键 化学反应速率 化学用语 同位素 影响反应速率的因素 元素周期律 化学反应与能量 原电池原理 设计原电池 元素性质 元素周期律 反应速率综合 原子结构 平衡计算 原电池原理 平衡状态判断 化学反应与热量 原电池应用 化学反应与能量 元素周期表、周期律应用 原电池原理综合应用 甲烷取代反应综合实验 化学平衡 预估难度系数 了解 灵活 分值 理解 掌握 识记 运用 0.9 √ 2 0.7 √ 2 0.7 √ √ 2 0.8 √ √ 2 0.7 √ √ 2 0.8 √ 2 0.7 √ 2 0.5 √ √ 2 0.65 √ 2 0.7 √ 2 0.6 √ 2 0.6 √ √ 2 0.4 √ √ 2 0.5 √ √ 2 0.4 √ √ 2 0.5 2 0.4 2 0.5 2 0.6 2 0.6 2 0.6 √ √ 13 0.6 √ √ 14 0.65 √ √ 14 0.4 √ √ 11 0.65 √ √ 8
选择题
填空题 计算题
整套试题的难度系数0.55-0.6
1.8 1.4 1.4 1.6 1.4 1.6 1.4 1 1.3 1.4 1.2 1.2 0.8 1 0.8 1 0.8 1 1.2 1.2 7.8 8.4 9.1 4.4 5.2
能力要求 题型 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 考察知识点 化学反应与能量 元素周期表 化学键 化学反应速率 化学用语 同位素 影响反应速率的因素 元素周期律 化学反应与能量 原电池原理 设计原电池 元素性质 元素周期律 反应速率综合 原子结构 平衡计算 原电池原理 平衡状态判断 化学反应与热量 原电池应用 化学反应与能量 元素周期表、周期律应用 原电池原理综合应用 甲烷取代反应综合实验 化学平衡 预估难度系数 了解 灵活 分值 理解 掌握 识记 运用 0.9 √ 2 0.7 √ 2 0.7 √ √ 2 0.8 √ √ 2 0.7 √ √ 2 0.8 √ 2 0.7 √ 2 0.5 √ √ 2 0.65 √ 2 0.7 √ 2 0.6 √ 2 0.6 √ √ 2 0.4 √ √ 2 0.5 √ √ 2 0.4 √ √ 2 0.5 2 0.4 2 0.5 2 0.6 2 0.6 2 0.6 √ √ 13 0.6 √ √ 14 0.65 √ √ 14 0.4 √ √ 11 0.65 √ √ 8
选择题
填空题 计算题
整套试题的难度系数0.55-0.6
1.8 1.4 1.4 1.6 1.4 1.6 1.4 1 1.3 1.4 1.2 1.2 0.8 1 0.8 1 0.8 1 1.2 1.2 7.8 8.4 9.1 4.4 5.2
