初三化学:物质的鉴定、鉴别及物质、离子的共存和除杂质的问题
《中考化学》离子共存、除杂质、鉴别--解题技巧和方法

《中考化学》离子共存、除杂质、鉴别
⑥ZnCl2(CuCl2)加Zn Zn +CuCl2 ==== ZnCl2 + Cu
⑦CaCl2(HCl)加CaCO3 CaCO3 + 2HCl===CaCl2 + CO2↑ + H2O
C. CO32-、Na+、K +、Cl-
D. Na+、Cl-、Ba2+、NO3-
《中考化学》离子共存、除杂质、鉴别
附加题:
某河道两旁,有甲、乙两个工厂,它们所排放的工业 废水中共含有六种离子:K+ 、Ag+ 、Fe3+ 、Cl- 、 NO3- 、OH- 的三种,其中乙厂的废水显碱性,故 甲厂废水中所含的三种离子是 Ag+__、_F_e_3_+_、__N_O_3_-___;乙 厂废水中所含的三种离子是__O_H_-_、__K_+ 。、 Cl-
练习2 下列混合物适宜用结晶法分离的是:( B) A.NaNO3、 Na2CO3 B.NaNO3、 NaCl C.NaOH、 Mg(OH)2 D.NaCl 、BaSO4
《中考化学》离子共存、除杂质、鉴别
二、化学方法
(一) 、原理 1、加入的试剂只与杂质反应,不与原物反应。 2、反应后不能带入新的杂质。 3、反应后恢复原物状态。 4、操作方法简便易行。
A.K+、Na+、H+、Cl- B.Na+、Ba 2+、 SO42- 、NO3-
D
C.NH4+、K+、Cl-、NO3-
D.K+、Na+、CO32-、SO4 2-
4.在能与镁粉反应生成H2的溶液中,能大量共存,且其溶液为 无色的是:
A. Ca 2+、Cl-、MnO4-、Na+
初三化学物质的鉴别、除杂、离子共存问题

初中化学常见实验题型解题技法总结(除杂、分离、鉴别、鉴定、推断)知识要点:1. 除杂题:解答除杂质一类的题LI时,要注意三原则;三要领;五种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
除杂质思路分析方法:(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题U时要审清题LI要求,分析理顺思路且与题目要求吻合,才能准确解题。
2-混合物的分离:(1)可溶性与难溶性物质的混合物一一常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。
如:粗盐的提纯;BaSOq和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑一一结晶法。
即冷却热饱和溶液的方法加以分离。
如:NaCl 和KNO3的混合物。
(3)两种物质均溶于水时,可考虑用化学方法分离。
如BaCS和NaCl的混合物。
可将混合物先溶于水,加入适量NazCCh溶液,得到BaCO3和NaCl溶液。
BaCb+ Na2CO3=BaCO3 I +2NaClo将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCS溶液,C02逸出。
BaCO3+2HCl =BaCl2+H2O+CO2 t <> 最后分别将NaCl溶液和BaCb溶液蒸发,分别得到纯净的NaCl固体和BaCb固体。
注意:用化学方法或用物理方法进行混合物分离时,要区别除杂质与分离物质的不同点是:除杂质时只要求把杂质除掉、保留原物质即可;而混合物分离是儿种物质用一定的方法分开,原混合物中各成分都必须保留。
3•物质的鉴别:鉴别是通过化学实验将儿种不同特性的物质区别开来。
除杂、鉴别、检验、离子共存

CaO(CaCO3) Na2SO4(Na2CO3) NaOH(Na2CO3)
CuO(Cu) NaCl(Na2SO4)
(2)将杂质转化吸收
CO2(水蒸气) CO(CO2)
H2(水蒸气) Cu(Fe)
NaCl(CuS的方法使物质产生
一、除杂与分离
首选:物理分离除杂:
①利用水溶性不同:过滤
NaCl(CaCO3)
②利用溶解性不同:蒸发结晶NaCl(KNO3)
冷却热饱和溶液KNO3 ( NaCl )
③磁性不同:C(Fe)
其次除杂方法:化学转化
基本原则:
①不与要的物质反应
②不引入新的杂质
③反应要便于分离(生成气体、沉淀、 水)
化学转化的几种情况
共存
OH-与H+、NH4+、 Mg2+、Al3+、Cu2+、
Fe3+、Fe2+、Zn2+不能共存
CO32-与H+ 、Ca2+、Ba2+…不能共存
SO42-与Ba2+不能共存 Cl-与Ag+不能共存
银白色固体:Mg Fe Zn Al
③沉淀:红褐色絮状沉淀:Fe(OH)3 蓝色絮状沉淀:Cu(OH)2 不溶于水也不溶于酸的白色沉淀: AgCl BaSO4 能溶于酸的白色沉淀:
CaCO3
Zn(OH)2
BaCO3
Mg(OH)2
气味
臭鸡蛋气味:H2S
刺激性气味:HCl SO2 NO2
NH3
(2)加水鉴别
CaO H2SO4 NaOH NH4NO3
①加水后有明显的吸热、放热现象: ②在水中的溶解性不同:NaCl CaCO3 ③在水中显示出特殊颜色
中考化学专题突破4 物质的共存、检验、鉴别、分离与提纯

专题突破四物质的共存、检验、鉴别、分离与提纯类型1物质的共存【题型特征】判断物质之间能否相互反应,若能相互反应则不能共存。
其中考查的主要内容是溶液中的共存问题。
对于物质在溶液中的共存,从实质上来讲也就是构成物质的离子间的共存。
离子共存的意思是不发生反应,不共存的意思是会发生反应。
【解题策略】1.初中阶段只需掌握复分解反应中的离子共存问题,即同一溶液中离子之间符合下列三个条件之一就会发生反应:(1)生成气体:如:H+与HCO-3或CO2-3结合产生CO2,不能共存;NH+4与OH-结合产生NH3,不能共存。
(2)生成沉淀:酸、碱、盐溶液之间反应有沉淀生成则会发生复分解反应,不能共存。
常见的九种沉淀:四种碱Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2;五种盐CaCO3、BaCO3、BaSO4、AgCl、Ag2CO3。
(3)生成水:酸和碱会发生反应生成水,因此溶液中不能同时存在酸性物质和碱性物质。
2.解题技巧(1)方法步骤阅读题干→寻找隐含条件→分析物质是否可溶→组内物质(离子)之间是否反应,即是否产生气体、沉淀或水→得出结论。
(2)熟记常见的在溶液中不能共存的离子对(3)注意物质共存题中的隐含条件①“溶液酸碱性”条件型:若题目的叙述有酸性溶液、pH<7的溶液、能使紫色石蕊溶液变红的溶液、加入某活泼金属(K、Ca、Na除外)能产生氢气的溶液等,说明溶液中一定存在H+,有H+存在溶液中就不能出现OH-、CO2-3、HCO-3等离子。
若题目的叙述有碱性溶液、pH>7的溶液、能使无色酚酞变红的溶液、能使紫色石蕊溶液变蓝的溶液等,说明溶液中一定存在OH-,有OH-存在溶液中就不能出现H+、NH+4、Mg2+、Al3+、Cu2+、Fe3+等离子。
②溶液为“无色透明”条件型:若题目限定溶液是“无色”,则不含有颜色的离子,如:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO-4 (紫红色)等离子。
九年级化学复习第16讲 物质的检验与鉴别、除杂、共存
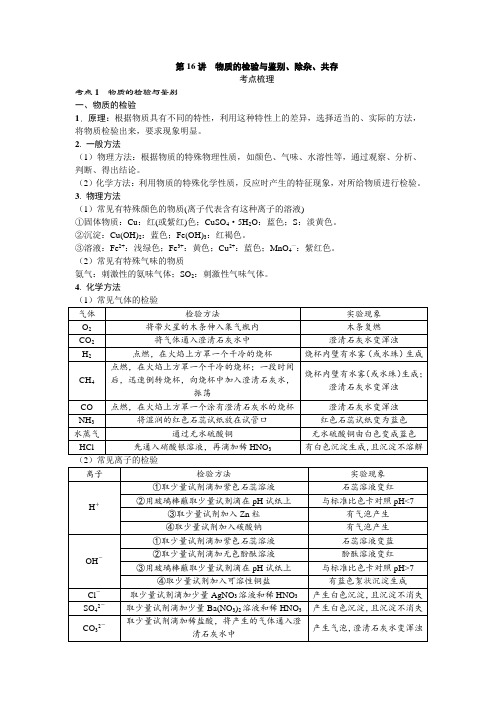
第16讲物质的检验与鉴别、除杂、共存考点梳理考点1 物质的检验与鉴别一、物质的检验1. 原理:根据物质具有不同的特性,利用这种特性上的差异,选择适当的、实际的方法,将物质检验出来,要求现象明显。
2. 一般方法(1)物理方法:根据物质的特殊物理性质,如颜色、气味、水溶性等,通过观察、分析、判断、得出结论。
(2)化学方法:利用物质的特殊化学性质,反应时产生的特征现象,对所给物质进行检验。
3. 物理方法(1)常见有特殊颜色的物质(离子代表含有这种离子的溶液)①固体物质:Cu:红(或紫红)色;CuSO4·5H2O:蓝色;S:淡黄色。
②沉淀:Cu(OH)2:蓝色;Fe(OH)3:红褐色。
③溶液:Fe2+:浅绿色;Fe3+:黄色;Cu2+:蓝色;MnO4—:紫红色。
(2)常见有特殊气味的物质氨气:刺激性的氨味气体;SO2:刺激性气味气体。
4. 化学方法(1)常见气体的检验1. 物质的鉴别原则:操作简单、试剂种类少、现象明显。
2. 物质鉴别的方法:应先简后繁,先用物理方法后用化学方法。
(1)物理方法:依据物质的特殊的物理性质(如颜色、状态、气味、溶解性、溶解时的吸放热现象)进行观察、分析、判断,得出结论。
(2)化学方法:依据物质间反应时所产生的特殊反应现象(如变色、放出气体、生成沉淀、放热等)进行鉴别。
3. 物质鉴别的形式(1)一种试剂鉴别:选择一种试剂,分别加入待测物质中,观察实验现象。
(2)多种试剂鉴别:选择多种试剂,依次加入待测物质中,会出现明显不同现象。
(3)无试剂鉴别:先利用物质物理性质不同或物质间的相互反应(包括与生成物反应)而产生不同现象把物质鉴别出来。
考点2 物质的除杂1. 除杂原则:不增、不减、易分(1)主不减:所选试剂不能与被提纯物质(主要成分)反应。
(2)杂不增:在除去杂质的同时,不能产生新的杂质。
(3)易分离:除杂后生成的产物的状态与被提纯物质的状态要不同,方便除去。
2. 除杂方法(1)气体的除杂方法一:将杂质气体通过物质吸收、反应除去,如氧气中的水蒸气可通过浓硫酸吸收除去、一氧化碳中的二氧化碳可通过氢氧化钠溶液吸收除去。
2025年中考化学复习专题二:物质的共存、检验、鉴别和除杂课件

3、常见离子的检验
离子名称
检验方法
①取少量试剂滴加紫色石蕊溶液
H+
(酸)
②用玻璃棒蘸取少量试剂滴在pH试纸上
③取少量试剂加入Zn粒
①取少量试剂滴加紫色石蕊溶液
OH- (碱)
②用玻璃棒蘸取少量试剂滴在pH试纸上 ③取少量试剂滴加无色酚酞溶液
④取少量试剂加入可溶性铜盐
实验现象
紫色石蕊溶液变红 与标准比色卡对照,pH<7 有气泡产生 紫色石蕊溶液变蓝
物质 HCl溶液 NaCl溶液 MgCl2溶液 Cu(NO3)2溶液 NaCl溶液 KNO3溶液
杂质 H2SO4溶液 Na2CO3溶液 HCl溶液 AgNO3溶液 KNO3溶液 NaCl溶液
所选试剂或方法 加入适量氯化钡溶液,过滤
加入适量的稀盐酸 加入足量镁粉,过滤 加入足量铜粉,过滤
蒸发结晶 冷却热饱和溶液
澄清石灰水变 浑浊
①视察颜色 ②取少量试剂滴加可溶性碱
溶液呈蓝色 有蓝色絮状沉淀生成
类型二 检验和鉴别
Fe3+ Fe2+
①视察颜色 ②取少量试剂滴加可溶性碱 视察颜色
溶液呈黄色 有红褐色沉淀生成 溶液呈浅绿色
NH4+
取少量试剂滴加可溶性碱,加热,把湿润的红色石蕊 产生有刺激性气味的气体,红色
试纸放在试管口
加水溶解,过滤
考B
鉴别Fe、CuO、C三种黑色固体粉末
滴加稀硫酸
C
检验碳酸钠溶液中是否含有氯化钠
加过量的稀盐酸后,再滴加硝酸
银溶液
D 从含有少量氯化钠的饱和硝酸钾溶液中提纯
蒸发溶剂
硝酸钾
4、以下对不同工业废水的处理措施及对应的方法,都正确的是( D )
选项
废水中的主要污染物
最新中考化学物质的共存、检验与鉴别、除杂

被分离的物质和杂质的溶解度随 温度的变化差别较大
利用混合物中某些物质的特性进 特殊性质法
行分离
举例 粗盐提纯 NaCl 和 KNO3 固体混合物的 分离
Cu 粉中的 Fe 粉可用磁铁分离
16
(2)化学方法:沉淀法(设法将杂质变为沉淀)、化气法(设法将杂质变为气体逸出)、置 换法、转纯法(将要除去的杂质变为提纯的物质)、吸收法(常用于气体的提纯)等。
检验方法
实验现象
O2
将带火星的木条伸入集气瓶内
木条复燃
CO2
将气体通入澄清石灰水中
澄清石灰水变浑浊
H2 点燃,在火焰上方罩一个干冷的烧杯 烧杯内壁有水雾(或水珠)生成
点燃,在火焰上方罩一个干冷的烧
烧杯内壁有水雾(或水珠)生成;澄
CH4 杯;一段时间后,迅速倒转烧杯,向
清石灰水变浑浊
烧杯中加入澄清石灰水,振荡
实验目的
所用试剂或方法
A
检验氧气
通入澄清石灰水
B
鉴别硬水和软水
取样,加入明矾
C
除去氯化钾溶液中的碳酸钾
加入适量的稀硝酸
D
自制酸碱指示剂
将捣烂的牵牛花用酒精浸泡后过滤
34
5.(2020 德州)依据实验目的,下列设计的实验方案中不合理的是( D )
实验目的
实验方案
A
区分氧气和氮气
分别把燃着的木条伸入盛放气体的集气瓶中
5
【例】下列各组离子能在 pH=2 的溶液中大量共存的是( ) A.NH+ 4 、Na+、NO- 3 、CO23- B.NO- 3 、Cu2+、SO24-、OH- C.Mg2+、K+、SO24-、Cl- D.Ca2+、Na+、HCO- 3 、Cl- 【答案】C
中考化学专题复习物质的检验、鉴别、除杂与共存

Cu
Cu
Fe
CuO
CuO
2.初中常见物质的除杂分为三类:气体除杂、液体除
杂、固体除杂
(1)气体除杂(2017.9A;2015.10A;2011.9A)
根据物质的性质差异选用固体或液体除杂试剂。
方法一:将杂质气体通过物质吸收、反应除去,如氧气
中的水蒸气可通过浓硫酸吸收除去、一氧化碳中的二氧
化碳可通过氢氧化钠吸收除去;
方法二:将杂质气体转化为主气体,如二氧化碳中的一 氧化碳可通过灼热的氧化铜,使一氧化碳转化成二氧化 碳。
(2)固体除杂(2017.9C;2013.8D;2012.7AD;2011.9BD) 方法一:将杂质转化为气体除去,如氧化铜中的炭粉通 过在空气中灼烧除去; 方法二:将杂质转化为溶液除去,如铜中的铁可通过与 盐酸反应除去。
【常见固体除杂举例】
主物质
CuO
杂质
Cu
除杂方法
在空气(或氧气)中灼烧混合物 稀硫酸(或稀盐酸) ,过滤 加入足量的________________ 稀硫酸(或稀盐酸) ,过滤 加入足量的________________
氢气
产生淡蓝色火焰,烧 点燃,在火焰上方罩干冷烧杯 杯内壁上有水珠 产生淡蓝色火焰,干 点燃,分别用干冷的烧杯和内 冷的烧杯内壁出现水 壁涂有澄清石灰水的烧杯罩在 雾,涂有澄清石灰水 火焰上方 的烧杯内壁出现浑浊
甲烷
2. 常见离子的检验(2015.10B)
方法 离子 说明与解释 蓝 色;含Fe2+的溶 观察 Cu2+、 Fe2+、 含Cu2+的溶液呈____ 浅绿 色;含Fe3+的溶液呈____ 黄 色 Fe3+ 液呈_____ 法 红 色;OH-能 H+能使紫色石蕊试液变___ 变色 蓝 色,能使无色酚 H+、OH- 使紫色石蕊试液变___ 法 红色 酞试液变___
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学:物质的鉴定、鉴别及物质、离子的共存和除杂质的问题
一、物质的鉴定与鉴别
↓鉴定与鉴别的定义
鉴定是根据一种物质的特性,确定被检验的物质就是原物质,对于组成物质的各部分,一定要分别给予证明。
鉴别是根据物质的不同特性,通过实验将一直的几种物质加以区别,对组成物质的各部分不必一一鉴别出来。
↓物质的鉴定、鉴别的注意与顺序
1.先取样,后操作。
如果样品是固体,一般先用水溶解,配成溶液再检验。
2.各取少量溶液分别加入若干支试管中进行检验,禁止在原瓶中进行检验。
3.回答时先现象,后结论。
↓物质、离子的共存问题
要判断几种物质在同一溶液中能不能大量共存,关键是看这几种物质能不能发生反应。
若能反应,则不能共存,反之,则能共存。
要判断几种离子在同一溶液中能不能大量共存,关键是看这几种离子相互结合能不能生成沉淀、气体、水。
若能,则不能共存,反之,则能共存。
如果物质或离子是在酸性溶液(或pH<7的溶液)中共存,则提供的物质或离子不能与H+反应。
如果物质或离子是在碱性溶液(或pH>7的溶液)中共存,则提供的物质或离子不能与OH-反应。
如果是无色溶液,则溶液中不能有Fe2+(浅绿色),Fe3+(黄色),Cu2+(蓝色)等离子存在。
二、去除杂质的方法
去除杂质的原则:去除杂质时不能引入新的杂质,不能改变被提纯的物质。
↓物理方法
过滤,结晶。
↓化学方法
1.沉淀法:将杂质转化为沉淀过滤除去。
〔如NaOH(Na2CO3)Na2CO3+Ca(OH)2=CaCO3↓
+2NaOH〕
2.化气法:试剂与杂质反应产生气体去除杂质。
〔如Na2SO4(Na2CO3)Na2CO3+H2SO4=
Na2SO4+CO2↑+H2O〕
高温
3.加热法:杂质如果受热易分解,通过加热将杂质除去。
〔如CaO(CaCO3)CaCO3
Na2SO4+CO2↑+H2O〕
4.置换法:将杂质通过置换反应除去。
〔如FeSO4(CuSO4)Fe+CuSO4=FeSO4+Cu〕
5.吸收法:将气体混合物通过洗气装置,杂质可被洗气装置内盛的药品吸收除去。
〔如CO(CO2)
CO2+NaOH=Na2CO3+H2O〕
6.溶解法:向混合物中加入试剂,使杂质与试剂反应而溶解,以除去杂质。
〔如Cu(CuO)
CuO+2HCl=CuCl2+H2O〕。
