顺、反式-甘氨酸合铜的制备及成份分析
铜离子配合物的合成及应用讲解

铜离子配合物的合成及应用吴天昊袁航张俊焦卓浩唐琦王琪席鑫张存忠次仁旺加中南大学化学化工学院应用化学1301班指导老师张寿春摘要:铜元素是普遍存在于动植物中的生命必需的微量元素之一,在生命过程中起着重要作用。
许多金属酶和金属蛋白的活性部位均含有双核铜(Ⅱ)结构单元。
此外,铜的配位点较多,有很好的配位性能,能够跟绝大多数配体形成铜配合物,使得铜在配位催化上的研究更加方便。
铜配合物在催化、光电材料等方面的应用逐渐成为研究重点。
本文介绍了一些配合物的常用合成方法并对铜离子配合物的应用前景作出了介绍与展望。
关键词:配位化学;金属配合物;铜离子;合成方法;光学应用;医学应用1.引言近年来.由于金属配合物在日常生活和工业上都有广泛的应用,尤其过渡金属对探索和研究药物分子抗菌、抗肿瘤的作用机制具有重要意义。
在催化、光学材料以及电学材料等方面具有新型功能的金属配合物的研究也受到人们的广泛关注。
铜元素在动植物中是普遍存在的,它是生命必需的微量元素之一,在生命过程中起着重要作用。
许多金属酶和金属蛋白的活性部位均含有双核铜(Ⅱ)结构单元.铜化合物具有多变的配位结构和活化小分子的催化特性,常被用作双取代过氧化物分解的催化剂。
此外,铜的配位环境易于调变,结构的易变性导致合成了多种单核或多核的铜配合物。
铜配合物以其独特的性能、结构优势,在催化、光电材料等方面的应用逐渐成为研究重点。
我国的铜资源丰富,分布广泛,铜的开采技术也相当成熟,因此,获取铜的成本并不高,这为铜在配位化学各领域中的应用提供了先决条件。
2.铜离子配合物简介铜是人类发现最早的金属之一,是人类广泛使用的一种金属,属于重金属,电子排布式:1s22s22p63s23p63d104s1 最常见的价态是+1和+2。
铜的配位环境易于调变,结构的易变性导致合成了多种单核或多核的铜配合物。
2.1 Cu(I)配合物中心离子为一价铜离子的单核配合物称为Cu(I)配合物。
Cu(I)的核外电子排布为d10,d轨道填充电子全满使铜原子的电荷排布趋于对称。
顺式二甘氨酸合同的制备方法

顺式二甘氨酸合同的制备方法
哇塞,你知道顺式二甘氨酸铜的制备方法有多神奇吗?就好像变魔术一样!
想象一下,你把一些看似普通的化学物质放在一起,然后通过一系列巧妙的操作,嘿,居然就变出了顺式二甘氨酸铜!
比如说,先准备好甘氨酸,这就像是搭积木的基础块。
然后呢,再加入一些其他的试剂,就如同给这个基础块添上各种各样的装饰。
“嘿,小李,把那个瓶子拿过来!”“好嘞!”在实验过程中,大家相互配合。
一点一点地,顺式二甘氨酸铜就在我们眼前逐渐形成了。
这感觉太棒了,就好像看着一幅美丽的画作慢慢呈现出来!
不试试看,怎么能知道其中的乐趣和奇妙呢?我的观点就是,顺式二甘氨酸铜的制备虽然有一定难度,但真的超级有趣,值得大家去探索和尝试呀!。
甘氨酸铜螯合物

甘氨酸铜螯合物1. 介绍甘氨酸铜螯合物是一种由甘氨酸和铜离子形成的化合物。
甘氨酸是一种非必需氨基酸,具有良好的可溶性和生物相容性,被广泛应用于医药、食品和化妆品等领域。
而铜离子具有多种生物学功能,包括参与细胞呼吸、免疫系统功能和胶原合成等。
通过形成甘氨酸铜螯合物,可以进一步增强铜离子的生物利用度和稳定性,从而发挥更多的生理效应。
2. 合成方法甘氨酸铜螯合物的合成方法主要包括溶液法和固相法。
其中,溶液法是最常用的方法之一。
2.1 溶液法合成溶液法合成甘氨酸铜螯合物的步骤如下: 1. 准备甘氨酸和铜盐的溶液。
通常选择氯化铜或硫酸铜作为铜盐。
2. 将两种溶液混合,并控制pH值在适当的范围内。
pH值的选择对于合成产物的结构和纯度至关重要。
3. 在合适的温度下搅拌反应溶液一段时间,使甘氨酸与铜离子形成螯合结构。
4. 过滤得到沉淀,用纯水洗涤沉淀物以去除杂质。
5. 干燥沉淀物,得到甘氨酸铜螯合物。
2.2 固相法合成固相法合成甘氨酸铜螯合物的步骤如下: 1. 准备甘氨酸的固相载体。
常用的固相载体包括硅胶、聚合物和树脂等。
2. 将铜离子与固相载体接触,使其吸附在载体上。
3. 用甘氨酸溶液洗涤载体,使甘氨酸与铜离子形成螯合结构。
4. 再次洗涤载体,去除杂质。
5. 将载体经过干燥或其他处理方法,得到甘氨酸铜螯合物。
3. 物化性质甘氨酸铜螯合物具有一系列特殊的物化性质,包括溶解性、稳定性和光学性质等。
3.1 溶解性甘氨酸铜螯合物在水中具有良好的溶解性,可以形成透明的溶液。
此外,它还可以在一些有机溶剂中溶解,如乙醇和二甲基亚砜等。
3.2 稳定性甘氨酸铜螯合物具有一定的稳定性,可以在一定范围的pH值和温度下保持其结构完整性和活性。
然而,过高或过低的pH值以及极端的温度可能会影响其稳定性。
3.3 光学性质甘氨酸铜螯合物在紫外-可见光谱范围内具有吸收和发射光谱特征。
通过控制产物的合成条件,可以调节其最大吸收波长和荧光强度。
蓝金雨
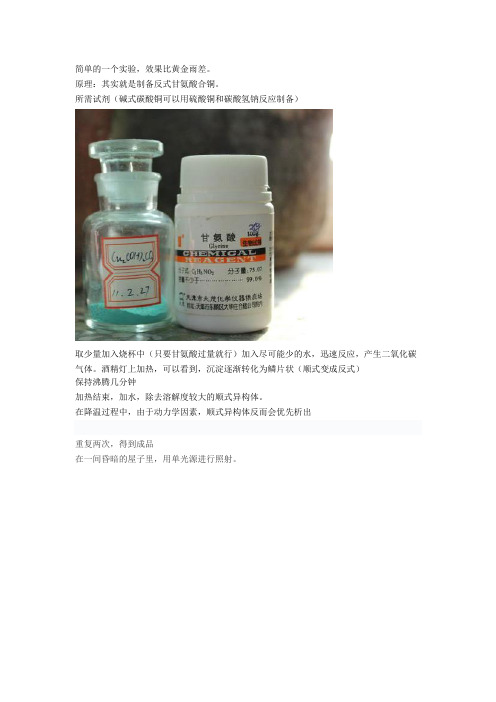
简单的一个实验,效果比黄金雨差。
原理:其实就是制备反式甘氨酸合铜。
所需试剂(碱式碳酸铜可以用硫酸铜和碳酸氢钠反应制备)
取少量加入烧杯中(只要甘氨酸过量就行)加入尽可能少的水,迅速反应,产生二氧化碳气体。
酒精灯上加热,可以看到,沉淀逐渐转化为鳞片状(顺式变成反式)
保持沸腾几分钟
加热结束,加水,除去溶解度较大的顺式异构体。
在降温过程中,由于动力学因素,顺式异构体反而会优先析出
重复两次,得到成品
在一间昏暗的屋子里,用单光源进行照射。
一种甘氨酸铜络合物的制备方法

一种甘氨酸铜络合物的制备方法
一种常见的甘氨酸铜络合物的制备方法如下:
1.实验材料和仪器:
a)氨基酸甘氨酸
b)无水氯化铜
c)双针筒过滤器
d)乙醇
e)氯仿
f)蒸馏水
g)热水浴
h)洗涤瓶
2.实验步骤:
步骤1:准备无水氯化铜溶液
在一个干净的500mL锥形瓶中,称取适量的无水氯化铜。
然后,加入适量的蒸馏水来溶解氯化铜,制备无水氯化铜溶液。
步骤2:制备甘氨酸溶液
在另一个锥形瓶中,称取适量的甘氨酸。
然后,加入适量的蒸馏水来溶解甘氨酸,制备甘氨酸溶液。
步骤3:制备甘氨酸铜络合物
将制备好的甘氨酸溶液缓慢加入无水氯化铜溶液中,并边加边快速搅拌,直到溶液变成深蓝色。
步骤4:晶体的形成
将甘氨酸铜溶液转移至洗涤瓶中,并加入对应体积的甲醇。
然后,将洗涤瓶放入冷水中,使其缓慢冷却。
在这个过程中,甘氨酸铜络合物晶体会逐渐结晶出来。
步骤5:过滤和干燥
使用双针筒过滤器将溶液过滤,以除去杂质。
然后,将过滤后得到的固体沉淀用氯仿洗涤,并用蒸发器蒸发氯仿。
最后,将甘氨酸铜络合物的沉淀在热水浴中干燥。
3.结果和讨论:
根据实验步骤中的操作,预计可以得到甘氨酸铜的蓝色结晶。
该络合物在固态下具有良好的稳定性,并可在化学实验室中广泛应用。
值得注意的是,实验过程中应注意安全操作,并严格遵守操作规程。
铜离子配合物的合成及应用

铜离子配合物的合成及应用吴天昊袁航张俊焦卓浩唐琦王琪席鑫张存忠次仁旺加中南大学化学化工学院应用化学1301班指导老师张寿春摘要:铜元素是普遍存在于动植物中的生命必需的微量元素之一,在生命过程中起着重要作用。
许多金属酶和金属蛋白的活性部位均含有双核铜(Ⅱ)结构单元。
此外,铜的配位点较多,有很好的配位性能,能够跟绝大多数配体形成铜配合物,使得铜在配位催化上的研究更加方便。
铜配合物在催化、光电材料等方面的应用逐渐成为研究重点。
本文介绍了一些配合物的常用合成方法并对铜离子配合物的应用前景作出了介绍与展望。
关键词:配位化学;金属配合物;铜离子;合成方法;光学应用;医学应用1.引言近年来.由于金属配合物在日常生活和工业上都有广泛的应用,尤其过渡金属对探索和研究药物分子抗菌、抗肿瘤的作用机制具有重要意义。
在催化、光学材料以及电学材料等方面具有新型功能的金属配合物的研究也受到人们的广泛关注。
铜元素在动植物中是普遍存在的,它是生命必需的微量元素之一,在生命过程中起着重要作用。
许多金属酶和金属蛋白的活性部位均含有双核铜(Ⅱ)结构单元.铜化合物具有多变的配位结构和活化小分子的催化特性,常被用作双取代过氧化物分解的催化剂。
此外,铜的配位环境易于调变,结构的易变性导致合成了多种单核或多核的铜配合物。
铜配合物以其独特的性能、结构优势,在催化、光电材料等方面的应用逐渐成为研究重点。
我国的铜资源丰富,分布广泛,铜的开采技术也相当成熟,因此,获取铜的成本并不高,这为铜在配位化学各领域中的应用提供了先决条件。
2.铜离子配合物简介铜是人类发现最早的金属之一,是人类广泛使用的一种金属,属于重金属,电子排布式:1s22s22p63s23p63d104s1 最常见的价态是+1和+2。
铜的配位环境易于调变,结构的易变性导致合成了多种单核或多核的铜配合物。
2.1 Cu(I)配合物中心离子为一价铜离子的单核配合物称为Cu(I)配合物。
Cu(I)的核外电子排布为d10,d轨道填充电子全满使铜原子的电荷排布趋于对称。
顺、反式-二甘氨酸合铜的制备及成份分析

— (II) 黄微化学与材料科学学院实验原理实验原理2 仪器试剂仪器试剂 3 实验内容实验内容 4 实验目的实验目的 1 实验思考实验思考了解无机配合物的制备原理和制备方法;巩固溶解, 减压抽滤, 沉淀的洗涤, 水浴加热等基本操作; 章鱼保罗章鱼保罗阿凡达阿凡达相似之处相似之处——蓝色血液!蓝色血液!运载O 2 得到血蓝蛋白-软体动物,节肢动物运载O 2 得到血红蛋白-人类,但在Fe 2+ 转变成Fe 3+ 时,依赖血蓝蛋白的氧化作用图1.常见的蓝血动物在生命活动中占有举足轻重的地位,缺铜会造成:贫血,记忆力减退,反应迟钝,运动失常的摄取来源:无机铜源:CuSO 4 (有毒!有机铜源:葡萄糖酸铜,叶绿素铜,甘氨酸合铜,鱼,肉蔬菜等(生物相容性好!)Cu(OH) 2 + 2 H 2 NCH 2 COOH ==== Cu(gly) 2 xH 2 O 65~70℃Cu(gly) 2 xH 2 O 甘氨酸合铜N Cu N O O gly gly 顺式结构天蓝色针状N Cu O O N gly gly 反式结构蓝紫色鳞片状反应所需活化能低;极性大,溶于高极性溶剂中. 反应所需活化能高;极性小,溶于低极性溶剂中热力学& 动力学化学热力学:研究化学反应进行的可能性以及进行的程度(决定因素!)化学动力学:研究化学反应进行的快慢动力学& 热力学控制的反应动力学控制的反应反应体系离平衡尚远,宏观上原料不断消耗,产物不断积累,主产物为动力学上生成速率较快的产物-活化能低-顺式热力学控制的反应体系已达平衡,各种产物的转化宏观上已停止,产物的热稳定性相对较高,主产物为热力学稳定性较高的产物-反式动力学控制-顺式为主热力学控制-反式为主顺式反式lnk=lnA-E a /RT 能量产物反应物反应过程 E 活化能顺式反式实验仪器布氏漏斗、抽滤瓶、烧杯、量筒、玻棒、表面皿、温度计实验试剂甘氨酸、CuSO 4 ·5H 2 O、1:1氨水、1:3乙醇水溶液、丙酮 1 MH 2 SO 4 、3 M NaOH溶液、95%乙醇、1% BaCl的制备 6.3 g CuSO 4 ·5H 2 O 20 mL H 2 O 滴加NH 3 ·H 2 O至沉淀溶解加入25 mL NaOH (3M)Cu(OH) 2 沉淀抽滤、洗涤至无SO 4 2-干燥稍加热搅拌思考:为何要现用现制?能否由CuSO 4 和NaOH 直接制备注意事项:缓慢滴加氨水,并不断搅拌,氨水量适中,少(×) 多双层滤纸—无定形沉淀抽滤步骤洗涤产品遵循“少量多次”原则,洗涤时勿抽滤检验—表面皿洗涤,少量多次1. 裁剪滤纸2. 润湿滤纸4. 开泵5. 抽滤,洗涤图2. 减压抽滤流程 3. 侧口相对顺式—二甘氨酸合铜(II)水合物的制备Cu(gly) 2 ·xH 2 O溶液干燥 3.8 g甘氨酸15 mL H 2 O 新制Cu(OH) 2 65~70℃, 搅拌热过滤收集滤液加入10 mL 乙醇(95%) 冷却析晶1:3 乙醇洗涤65 ℃, 搅拌丙酮洗涤思考:比较95%乙醇、V 水:V 乙醇= 1:3 混合液、丙酮的极性大小, 各溶液的作用分别为何?注意事项:甘氨酸溶于60~65 ℃热水,完全溶解后再加入碾碎的Cu(OH) 2 ,不断搅拌,若有Cu(OH) 2 沉积于烧杯底部,应将其碾碎,并充分搅起严格控制温度勿超过70 ℃,反应时间不可过长;乙醇、丙酮远离明火;丙酮为脱水剂,脱脂剂,勿与皮肤直接接触。
甘氨酸合铜(Ⅱ)配合物的固、液相反应合成与表征

甘氨酸合铜(Ⅱ)配合物的固、液相反应合成与表征
朱妙琴
【期刊名称】《光谱实验室》
【年(卷),期】2006(023)001
【摘要】以固相反应与液相反应两种方法合成了甘氨酸合铜(Ⅱ)配合物,研究了不同研磨时间对甘氨酸合铜(Ⅱ)配合物生成结果的影响.通过元素分析,红外光谱分析,紫外光谱分析,热重-差热等方法对产物进行了表征.实验结果表明,随着固相反应研磨时间的不同,对甘氨酸合铜(Ⅱ)配合物的生成结果有一定的影响,固、液相反应结果基本相同.
【总页数】5页(P110-114)
【作者】朱妙琴
【作者单位】浙江教育学院化学系,杭州市文三路140号,310012
【正文语种】中文
【中图分类】O657.32;O657.33
【相关文献】
1.两种体系中甘氨酸合铜配合物稳定常数的测定 [J], 张有娟;陈静;朱艳玲;郎丽杰
2.N—水杨醛甘氨酸合铜(Ⅱ)的混配配合物研究 [J], 王成刚;张超灿
3.谷氨酸甘氨酸合铜(Ⅱ)混配配合物的制备 [J], 窦后松;徐小平
4.双—β—二酮缩甘氨酸合双铜(Ⅱ)配合物的合成及非等温热分解反应动… [J], 单纯;耿超英
5.几种吡唑啉酮衍生物铜(Ⅱ)配合物的固、液相反应合成与表征 [J], 冯婷;刘浪;张丽;贾殿赠
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
能 顺式 量
❖ 热力学控制-反式为主
反式
反应物
E活化能
产物
反应过程
顺式
仪器试剂
实验仪器
布氏漏斗、抽滤瓶、烧杯 、量筒、玻棒、表面皿、1:1氨水、1:3乙醇水溶液、丙酮 1 M H2SO4、3 M NaOH溶液、95%乙醇、1% BaCl2
实验内容
➢ Cu(OH)2的制备
阿凡达
章鱼保罗
背景介绍
➢ Cu2+运载O2 得到血蓝蛋白-软体动物,节肢动物 ➢ Fe2+运载O2 得到血红蛋白-人类,但在Fe2+转变成Fe3+
时,依赖血蓝蛋白的氧化作用
图1.常见的蓝血动物
背景介绍
➢ Cu 在生命活动中占有举足轻重的地位,缺铜会造成:
贫血,记忆力减退,反应迟钝,运动失常
➢ Cu 的摄取来源:
仪器试剂
➢ 碘量瓶
瓶口呈喇叭形,与磨口瓶塞之间形成一圈水槽的锥形瓶。使 用时,槽中加纯水可以形成水封,防止瓶中反应生成的I2,Br2 等逸失。
实验内容
➢ 重铬酸钾溶液的配制 ❖ 实验步骤
K2Cr2O7 50 mL H2O
0.11~0.13 g
转移、定容
(重铬酸钾溶液)
❖ 减量法
适用范围:称量易吸水、易氧化还原、易与CO2反应的试 剂,如无水碳酸钠、各类固体基准物。
析出的I2用Na2S2O3滴定,以淀粉为指示剂,计算配合物含量。
I2 +2S2O32- =S4O62- +2I-
实验原理
➢标准Na2S2O3溶液的标定
基准物? 标定法? 标定Na2S2O3的常见基准物为:K2Cr2O7,KBrO3,KIO3
Cr2O72 6I 14H == 3I2 2Cr3 7H2O
实验内容
减量法称量步骤:将适量试样装入称量瓶中,称得总质量 m1 g,用一干净的纸条套在称量瓶上,将其取出并置于容器(如 小 坩埚)上方,倾斜称量瓶并用瓶盖轻敲瓶口上部,使试样落 入坩埚中。准确称出此时称量瓶和剩余样品的重量m2 g,试样
➢ 注意事项:
❖ 甘氨酸溶于60~65 ℃热水,完全溶解后再加入碾碎的 Cu(OH)2,不断搅拌,若有Cu(OH)2沉积于烧杯底部, 应 将其碾碎,并充分搅起;
❖ 严格控制温度勿超过70 ℃,反应时间不可过长; ❖ 乙醇、丙酮远离明火; ❖ 丙酮为脱水剂,脱脂剂,勿与皮肤直接接触。
无机化学基础实验
顺式甘氨酸合铜水合物成份分析
实验大纲
1
实验目的
2
实验原理
3
仪器试剂
4
实验内容
5
实验思考
实验目的
➢ 熟练掌握间接碘量法的测定原理和操作流程; ➢ 进一步熟练称量操作和移液﹑滴定操作。
实验原理
➢ 酸碱滴定
➢ 络合滴定
➢ 沉淀滴定
➢ 氧化还原滴定
❖ 碘量法
直接碘量法 : 利用I2 的氧化性进行滴定 间接碘量法 : 利用I- 的还原性进行滴定
反应所需活化能低; 极性大,溶于高极性溶剂中.
N
O
gly
Cu
gly
O
N
反式结构 蓝紫色鳞片状
反应所需活化能高; 极性小,溶于低极性溶剂中.
实验原理
➢ 热力学 & 动力学
❖ 化学热力学:研究化学反应进行的可能性以及进行的程度 (决定因素!)
❖ 化学动力学:研究化学反应进行的快慢
➢ 动力学 & 热力学 控制的反应
I2 2S2O32- == 2I S4O62-
仪器试剂
实验仪器
容量瓶 (250 mL)×2、移液管 (20 mL)×2、滴定管 (25 mL) 、 表面皿、吸耳球、锥形瓶
实验试剂
1 M H2SO4、0.01 M Na2S2O3溶液 (待标)、K2Cr2O7标准溶液、 1%淀粉溶液、10% NH4SCN溶液、甘氨酸合铜 (自制)
3.8 g甘氨酸 15 mL H2O
65 ℃, 搅拌
新制Cu(OH)2 65~70℃, 搅拌
Cu(gly)2·xH2O溶液
热过滤
收集滤液 加入10 mL 乙醇(95%)
1:3 乙醇洗涤
冷却析晶
干燥
丙酮洗涤
实验内容
➢ 思考:
❖ 比较95%乙醇、 V水:V乙醇 = 1:3 混合液、丙酮的极性大小, 各溶液的作用分别为何?
❖ 缓慢滴加氨水,并不断搅拌,氨水量适中,少(×) 多(×) ❖ 双层滤纸—无定形沉淀 ❖ 抽滤步骤 ❖ 洗涤产品遵循“少量多次”原则,洗涤时勿抽滤 ❖ 检验—表面皿洗涤,少量多次
减压抽滤
1. 裁剪滤纸
2. 润湿滤纸
5. 抽滤,洗涤
4. 开泵
图2. 减压抽滤流程
3. 侧口相对
实验内容
➢ 顺式—二甘氨酸合铜(II)水合物的制备
实验原理
➢ cis-Cu(gly)2·xH2O 中铜含量的测定
甘氨酸(gly)为双基配合物,其在70℃时会与Cu(OH)2 发生 如下反应:
在酸性介质中,Cu(gly)2中gly发生质子化,破坏配合物, 采用间接碘量法测定Cu含量。
Cu2+先与过量的I-反应; 2 Cu2 4I == 2 CuI I2
顺、反式—二甘氨酸合铜(II) 水合物的制备及成份分析
黄微 化学与材料科学学院
实验大纲
1
实验目的
2
实验原理
3
仪器试剂
4
实验内容
5
实验思考
实验目的
➢ 了解无机配合物的制备原理和制备方法; ➢ 巩固溶解, 减压抽滤, 沉淀的洗涤, 水浴加热等
基本操作;
背景介绍
背景介绍
背景介绍
相似之处—蓝色血液!
❖ 无机铜源:CuSO4 (有毒!) ❖ 有机铜源:葡萄糖酸铜,叶绿素铜,甘氨酸合铜,鱼,肉
蔬菜等(生物相容性好!)
实验原理
65~70℃
Cu(OH)2 + 2 H2NCH2COOH ==== Cu(gly)2 xH2O
Cu(gly)2 xH2O
甘氨酸合铜
N
N
gly
Cu
gly
O
O
顺式结构 天蓝色针状
20 mL H2O 稍加热
6.3 g CuSO4·5H2O
滴加NH3·H2O至沉淀溶解 搅拌
加入25 mL NaOH (3M) Cu(OH)2沉淀 抽滤、洗涤至无SO42- 干燥
实验内容
➢ 思考:
❖ Cu(OH)2为何要现用现制? ❖ 能否由CuSO4和NaOH 直接制备Cu(OH)2?
➢ 注意事项:
❖ 动力学控制的反应 反应体系离平衡尚远,宏观上原料不断消耗,产物不断积
累,主产物为动力学上生成速率较快的产物-活化能低-顺式. ❖ 热力学控制的反应
体系已达平衡,各种产物的转化宏观上已停止,产物的热 稳定性相对较高,主产物为热力学稳定性较高的产物-反式.
实验原理
❖ 动力学控制-顺式为主
lnk=lnA-Ea/RT
