离子方程式的书写及判断正误的方法整理版
离子方程式书写要点总结

离子方程式书写要点总结一、化学方程式学习思维导图定义: 用化学式来表示化学反应的式子表示反应物和生成物质的意义各物质间的质量关系 各物质间粒子数日比原则 以客观事实为基础书写 遵守质量守恒定律步骤 : 写 → 配 → 标 → 查质量守恒定律依据电荷守恒定律看——看反应条件、物质的溶解性 写——写化学方程式步骤 标——标相关物质反应前后分子数量与电荷数配——列比例式,并配平查——查符号、两个守恒、电子得失总数是否正确二、离子方程式书写规则:1、只能将强电解质(指溶于水中的强电解质)写出离子形式,其它(包括难溶强电解质)一律写成分子形式。
因此熟记哪些物质是强电解质、哪些强电解质能溶于水是写好离子方程式的基础和关键。
2、不在水溶液中反应的离子反应,不能书写离子方程式。
3、碱性氧化物虽然是强电解质,但它只能用化学方程式写在离子方程式中。
如CuO 与盐酸的反应:CuO+2H +=Cu 2++H 2O化学方程式表示反应条件 量的意义离子方程式意义4、有酸式盐参加的离子反应,对于弱酸酸式根离子不能拆成H+和酸根阴离子(浓硫酸在离子反应方程式中应写成H2SO4)。
5、书写氧化还原反应的离子方程式时,首先写好参加反应的离子,然后确定氧化产物和还原产物,再用观察配平并补齐其它物质即可。
6、书写盐类水解的离子方程式时,先写好发生水解的离子,然后确定产物,再配平并补足即可。
7、必须遵守质量守恒和电荷守恒定律,即离子方程式不仅要配平原子个数,还要配平离子电荷数和得失电子数。
8、必须考虑反应的用量问题。
因反应物用量不同,产物不尽相同,其离子方程式也就不同。
如“过量”、“少量”、“适量”、“足量”等。
例1:将少量Cl2通入H2S水溶液中:Cl2+H2S=S↓+2H++2Cl-;将过量Cl2通入H2S水溶液中:4Cl2+H2S+4H2O=10H++SO42-+8Cl-例2:Ca(HCO3)2溶液与适量或过量NaOH溶液作用:①Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O;若与少量NaOH溶液作用,则应写为:②Ca2++HCO3-+OH-=CaCO3↓+H2O9、操作顺序不同,其离子方程式有时也不相同。
离子方程式正误判断

离子方程式正误判断快解四步曲离子方程式正误的判断是化学考试中常见的一种题型。
一般书写离子方程式的基本步骤是一“写”:正确写出反应的化学方程式;二“拆”:把易溶于水且完全电离的物质拆写成离子形式;三“删”:删去方程式中两边不参加反应的离子;四“查”:检查方程式两边各元素的原子个数和电荷总数是否相等。
但在判断离子方程式正误的选择题中也按照这样的方法进行解答不仅所需时间比较长,而且学生自己在改写过程中也可能出现许多的错误。
影响答题的正确率。
由于判断离子方程式正误的选择题大多数让学生选择“下列离子方程式书写正确的是”,而且学生往往选“错”的容易,选“对”的难。
所以我们可以运用一些基本原理和方法,找出题中所给的离子方程式的错误之处,轻松快速的用排除法完成判断离子方程式正误的选择题的解答。
大多数的选择题都可以通过以下四步走完成:第一步:查看反应生成物是否正确。
在判断离子方程式是否正确的选项中常常会出现与反应事实不相符的情况。
例如铁与稀盐酸反应,写成3Fe+6H+=2Fe3++3H2↑就错了,因为该反应只能生成Fe2+;又如K2S的水解,写成S2-+2H2O==H2S+2OH-也错了,因为S2-是分步水解,第一步只能生成HS-。
再如Ba (OH)2溶液与硫酸铜溶液反应,如果离子方程式只写成Ba2++SO42-==BaSO4↓,那么就是漏了Cu2+与OH-的反应,也是不符合反应事实的。
这类情况一般比较容易判断,一旦遇到这种不符合客观反应事实的情况,我们就可以把该项排除。
而如果是由于参与反应的反应物量的不同导致的生成物不同的情况,很多同学就很难判断出来。
例如:如把过量的NaHCO3溶液与Ca(OH)2溶液混合的离子方程式写成:HCO3-+Ca2++OH- === CaCO3↓+ H2O,而NaHCO3溶液与过量的Ca(OH)2溶液混合的离子方程式写成2HCO3- +Ca2+ +2OH- === CaCO3↓+ 2H2O + CO32- ,其错均在于未考虑正确反应物中量的关系。
化学离子方程式的书写,正误判断,离子共存

化学离⼦⽅程式的书写,正误判断,离⼦共存⼀、离⼦⽅程式离⼦⽅程式书写的基本规律要求。
(1)合事实:离⼦反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离⼦符号使⽤正确合理。
(3)号实际:“=”“ ”“→”“↑”“↓”等符号符合实际。
(4)两守恒:两边原⼦数、电荷数必须守恒(氧化还原反应离⼦⽅程式中氧化剂得电⼦总数与还原剂失电⼦总数要相等)。
(5)明类型:依据离⼦反应原理,分清类型,总结⽅法技巧。
(6)检查细:结合书写离⼦⽅程式过程中易出现的错误,细⼼检查。
⼆、离⼦共存1.由于发⽣复分解反应,离⼦不能⼤量共存。
(1)有⽓体产⽣。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能⼤量共存。
(2)有沉淀⽣成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等⼤量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-⼤量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能⼤量共存。
(3)有弱电解质⽣成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN -、等与H+不能⼤量共存;⼀些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-⼤量共存;NH4+与OH-不能⼤量共存。
*(4)⼀些容易发⽣⽔解的离⼦,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离⼦不能同时存在在同⼀溶液中,即离⼦间能发⽣“双⽔解”反应。
如3AlO2-+ 3Al3++6H2O=4Al(OH)3↓等。
2.由于发⽣氧化还原反应,离⼦不能⼤量共存。
(1)具有较强还原性的离⼦不能与具有较强氧化性的离⼦⼤量共存。
高三化学一轮复习易错题:离子方程式正误判断

精品基础教育教学资料,仅供参考,需要可下载使用!离子方程式正误判断【易错分析】(1)离子方程式正误判断时,要看是否符合客观事实,如铁与稀盐酸反应:3Fe+6H+=2Fe3++3H2↑,书写错误的原因是铁与稀盐酸反应生成Fe2+。
(2)要看拆分是否正确,如石灰石与稀盐酸反应:CO32- +2H+ = CO2 ↑+ H2O,书写错误的原因是难溶的CaCO3不能拆写;向NaHCO3溶液中滴加盐酸:CO32—+2H+===H2O+CO2↑,书写错误的原因是弱酸酸式根离子HCO3—不能拆写;Na2O固体与水反应:O2—+H2O===2OH-,书写错误的原因是氧化物Na2O不能拆写;醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑,书写错误的原因是弱酸醋酸(CH3COOH)不能拆写;Mg(OH)2和稀盐酸的反应:OH-+H+===H2O,书写错误的原因是难溶的Mg(OH)2不能拆写。
(3)要看是否符合原子守恒和电荷守恒,如氯化铁溶液与铜反应:Fe3++Cu== Fe2++Cu2+,书写错误的原因是左右两边电荷不守恒;如金属钠与水反应:Na+H2O== Na++OH– +H2↑,书写错误的原因是反应前后H原子的数目不等。
(4)要看是否漏写离子反应,如Ba(OH)2溶液与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓,书写错误的原因是漏掉Cu2+与OH-生成Cu(OH)2沉淀。
要看是否符合题设条件,如过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3- +Ca2+ +OH-= CaCO3↓+ H2O,书写错误的原因是该离子方程式表示的是NaHCO3溶液与过量的Ca(OH)2溶液混合。
(5)要看是否符合组成,如稀硫酸与Ba(OH)2溶液反应:H++SO42–+Ba2++OH–== BaSO4↓+H2O,书写错误的原因是离子的个数比应与化学式中的组成不一致。
(6)要看离子方程式的条件注明是否正确,如制取氢氧化铁胶体:Fe3++3H2O =Fe(OH)3↓+3H+,书写错误的原因是未标注加热符号。
离子方程式正误判断

离子方程式是指用实际参加反应的离子符号表示离子反应的式子,它不但表示一定物质间的某个反应,而且表示了所有同一类型的离子反应。
所以,准确书写离子方程式是准确把握化学反应实质的关键。
而准确书写离子方程式须按照合理的书写规则和规范的书写方式实行书写,一般书写离子方程式的基本步骤依次是“写”、“拆”、“删”、“查”。
这四个基本步骤中,“查”是把关的一步,查的时候需要判断书写的正误,所以如何判断离子方程式书写的正误是非常重要的。
离子方程式正误的判断也是化学考试中常见的一种题型。
现将离子方程式书写的正误判断方法和步骤归纳如下,简称“九看”。
1、一看离子方程式是否符合客观事实书写的离子方程式要与题给条件和实验事实相符合。
例如铁与稀盐酸反应,写成3Fe+6H+=2Fe3++3H2↑就错了,因为该反应只能生成Fe2+。
2、二看发生的反应能否用离子方程式表示一般情况下,只有在水溶液中或熔融状态下发生的化学反应才能书写离子方程式。
如:固体NH4Cl和Ca(OH)2反应制取NH3的反应,因为是固体和固体的反应,不是在溶液中,也不是在熔融状态下,所以它不能书写离子方程式。
3、三看各物质拆写成离子的时候拆写是否准确书写离子方程式的时候,强酸、强碱、可溶性盐要拆写成离子形式,而难溶于水的物质、难电离的物质(包括水、弱酸、弱碱、多元弱酸的酸式酸根)和有机物不能拆写成离子。
但需要注意的是,浓硫酸参与的反应一般不能将浓H2SO4拆写成离子。
此外,Ca(OH)2作为反应物的时候,如果Ca(OH)2是浊液或固体,如被称作石灰乳、石灰浆则Ca(OH)2不能拆写成离子;如果Ca(OH)2是溶液,如被称作澄清石灰水则Ca(OH)2理应拆写成离子。
4、四看生成物中的“↑”和“↓”是否标注准确离子方程式的书写要准确的标明反应生成的沉淀或气体的符号,化学式的书写也应规范。
所以在判断离子方程式书写是否准确时,理应考虑这个点。
5、五看离子方程式从左到右电荷是否守恒、原子是否守恒在离子反应方程式中要满足反应前后各元素的原子种类和数目不变的质量守恒定律和离子方程式两边的离子所带的正负电荷的代数和相等的电荷守恒。
离子方程式的书写及正误判断
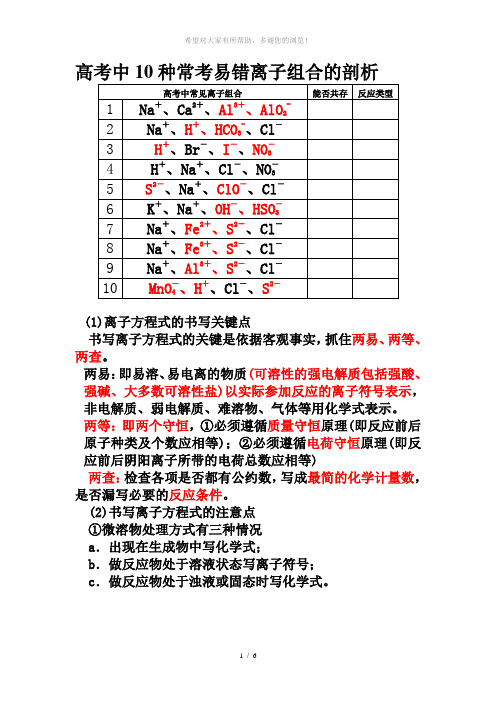
高考中10种常考易错离子组合的剖析(1)离子方程式的书写关键点书写离子方程式的关键是依据客观事实,抓住两易、两等、两查。
两易:即易溶、易电离的物质(可溶性的强电解质包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示,非电解质、弱电解质、难溶物、气体等用化学式表示。
两等:即两个守恒,①必须遵循质量守恒原理(即反应前后原子种类及个数应相等);②必须遵循电荷守恒原理(即反应前后阴阳离子所带的电荷总数应相等)两查:检查各项是否都有公约数,写成最简的化学计量数,是否漏写必要的反应条件。
(2)书写离子方程式的注意点①微溶物处理方式有三种情况a.出现在生成物中写化学式;b.做反应物处于溶液状态写离子符号;c.做反应物处于浊液或固态时写化学式。
②盐类水解的离子方程式不要忘记“”。
③溶液中铵盐与碱反应加热放出NH3↑,不加热写NH 3·H2O。
④浓HCl、浓HNO3在离子方程式中写离子符号,浓H2SO4不写离子符号。
⑤HCO-3、HS-、HSO-3等弱酸的酸式酸根不能拆开写。
离子反应中的多重反应两种电解质溶液混合,至少电离出两种阴离子和两种阳离子,这四种(或更多种)之间都能两两结合成难电离(或难溶)的物质。
这样的离子反应称为多重反应。
在写这类反应的离子方程式时易丢其中的一组反应。
【例题】完成下列反应的离子方程式:(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:(2)NH4HCO3与过量NaOH溶液混合:(3)Fe2O3溶于HI溶液中:(4)FeBr2溶液中通入过量Cl2:用分类思想突破跟量有关的离子方程式的书写1.连续型(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。
如CO2通入NaOH溶液中:①碱过量:______________________________②碱不足:___________________________(2)多元弱酸盐与强酸反应。
如Na2CO3溶液与稀盐酸:盐酸不足:_______________________________;盐酸过量:_______________________________。
【整理】】】离子方程式的书写规律

“离子方程式”书写技巧离子方程式是用实际参加反应的离子符号表示离子反应的式子。
其重要意义在于不仅表示某一特定的化学反应,还在于表示所有同一类型的离子反应,比化学方程式更能揭示反应的实质。
离子方程式是历年高考的重点和热点,着重考查方式是离子方程式的书写或离子方程式的正误辨析,掌握解答此类题的“钥匙”,就会迎刃而解。
一、离子方程式书写方法离子方程式书写概括为“一写二拆三删四查”。
“一写”指写出反应的化学方程式;“二拆”是指将易溶且易电离的物质改写成离子;“三删”是指删去方程式两边未参加反应的相同离子;“四查”是指①查生成物是否符合反应事实,②查拆写过程中是否错写、多写或遗漏,③查反应前后的质量、离子电荷、氧化还原反应的得失电子等是否守恒,④查符号,如=、、↑、↓等是否正确。
二、离子方程式书写注意离子方程式书写关键是第二步“拆”,抓住以下几点,对正确书写离子方程式大有裨益。
1、掌握物质的溶解性,熟记教材附录中的《酸、碱、盐溶解性表》。
掌握常见的一些难电离的物质,如弱酸:HF、HClO、H2S、HCN、CH3COOH、H2CO3、HNO2、H3PO4(中强酸);弱碱:NH3•H2O;水:H2O。
2、未处于自由移动离子状态的反应不能写离子方程式。
如加热条件下,铜与浓硫酸、氯化钠固体与浓硫酸、氯化铵固体与氢氧化钙固体反应等。
3、单质、氧化物、气体以及难溶、难电离的物质一律保留化学式。
4、微溶物处理:微溶物在稀溶液中为反应物时写成离子,生成物时常保留化学式。
5、多元弱酸酸式根离子,不能拆写离子形式。
6、某些离子方程式的书写,要注意“量”的关系。
如Ca(HCO3)2溶液与NaOH溶液反应、NaHSO4溶液与Ba(HCO3)2溶液反应、Cl2通入FeBr2溶液等7、某些反应要考虑离子的配比与物质组成的关系,不可局部约简。
如Ba(OH)2溶液与H2SO4溶液反应,不可写成Ba2++OH-+ H++SO42-=BaSO4↓+H2O。
【整理】】】离子方程式的书写规律

“离子方程式”书写技巧离子方程式是用实际参加反应的离子符号表示离子反应的式子。
其重要意义在于不仅表示某一特定的化学反应,还在于表示所有同一类型的离子反应,比化学方程式更能揭示反应的实质。
离子方程式是历年高考的重点和热点,着重考查方式是离子方程式的书写或离子方程式的正误辨析,掌握解答此类题的“钥匙”,就会迎刃而解。
一、离子方程式书写方法离子方程式书写概括为“一写二拆三删四查”。
“一写”指写出反应的化学方程式;“二拆”是指将易溶且易电离的物质改写成离子;“三删”是指删去方程式两边未参加反应的相同离子;“四查”是指①查生成物是否符合反应事实,②查拆写过程中是否错写、多写或遗漏,③查反应前后的质量、离子电荷、氧化还原反应的得失电子等是否守恒,④查符号,如→、、↑、↓等是否正确。
二、离子方程式书写注意离子方程式书写关键是第二步“拆”,抓住以下几点,对正确书写离子方程式大有裨益。
1、掌握物质的溶解性,熟记教材附录中的《酸、碱、盐溶解性表》。
掌握常见的一些难电离的物质,如弱酸:HF、HClO、H2S、HCN、CH3COOH、H2CO3、HNO2、H3PO4(中强酸);弱碱:NH3•H2O;水:H2O。
2、未处于自由移动离子状态的反应不能写离子方程式。
如加热条件下,铜与浓硫酸、氯化钠固体与浓硫酸、氯化铵固体与氢氧化钙固体反应等。
3、单质、氧化物、气体以及难溶、难电离的物质一律保留化学式。
4、微溶物处理:微溶物在稀溶液中为反应物时写成离子,生成物时常保留化学式。
5、多元弱酸酸式根离子,不能拆写离子形式。
6、某些离子方程式的书写,要注意“量”的关系。
如Ca(HCO3)2溶液与NaOH溶液反应、NaHSO4溶液与Ba(HCO3)2溶液反应、Cl2通入FeBr2溶液等7、某些反应要考虑离子的配比与物质组成的关系,不可局部约简。
如Ba(OH)2溶液与H2SO4溶液反应,不可写成Ba2++OH-+ H++SO42-→BaSO4↓+H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子方程式的书写及判断正误的方法
一、高考展望:
离子方程式的书写及判断正误是历年高考中必考的试题之一。
主要以选择题形式出现。
重点考查客观性原理、等电性原理、书写规则和规范原则。
不过,也要注意反应物的物质的
量之间的关系,哪种反应物过量的问题。
从命题的内容上看,存在以下四个特点:?所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、
电荷是否配平、产物是否合理和是否漏掉部分反应等;
?所涉及的化学反应类型以复分解反应为主,溶液中氧化还原反应所占比例较小。
?一些重要的离子反应方程式,在历年高考卷中多次重复。
如:碳酸盐与酸反应,Na与H2O 反应,金属Al或Fe与盐酸或稀硫酸的反应等。
?根据信息或实验现象书写离子方程式。
这类题型多贯穿在实验或简答题中。
二、考点归纳:
1. 判断离子方程式书写正误的方法:
?看离子反应是还符合客观事实,不事主观臆造产物及反应。
?看“==”“”“↓”“↑”等是否正确。
?看表示各物质的化学式是否正确。
如HCO3-不能写成 CO32- +H+ ,HSO4-通常写成SO42-+H+ ,HCOO-不可写成COOH–等。
?看是否漏掉离子反应。
如Ba(OH)2溶液与CuSO4溶液反应,既要写Ba2+与SO42-的离子反应,又要写Cu2+与OH-的离子反应。
?看电荷是否守恒。
如FeCl2溶液与Cl2溶液反应,不能写成Fe2++Cl2 ==2Fe3++2Cl-,应写成2Fe2++Cl2 ==2Fe3++2Cl-,同时两边的各原子数也应相等。
?看反应物与产物的配比是否正确。
如稀H2SO4与Ba(OH)2溶液反应不能写成 H++OH-+SO42-+Ba2+==BaSO4↓+H2O ,应写成2H++2OH-+SO42-+Ba2+==BaSO4↓+2H2O 。
