蛋白质(4)
第17章氨基酸和蛋白质-新(4)

(一)两性电离和等电点
分子内部酸性基团和碱性基团所形成的盐称 为内盐。内盐分子中包含正、负离子两部分, 所以又称为两性离子(zwitter-ion)或偶极 离子。偶极离子即可与较强的酸反应,又可 与较强的碱反应,表现出两性化合物的特性。
(二)蛋白质的高级结构
蛋白质分子的多肽链并不是以完全伸展的线 状形式存在,而是通过分子中Cα —H、Cα — N单键的旋转而盘曲、折叠形成特定的三维 空间结构,这种空间结构称为蛋白质的高级 结构。
1.蛋白质的二级结构
蛋白质的二级结构主要指的是多肽链中 原子的空间排布。
N原子上的孤电子对与羰基之间形成共 轭体系,使得C—N单键具有部分双键性质, 限制了肽键的自由旋转。实际上,肽键具有 平面结构,称为肽键平面。其中Cα 1、羰基 碳和氧、氮和氢以及Cα 2共六个原子在同一 平面上,氧原子和氢原子呈反式。
中性氨基酸的pI在5.1~6.5之间
(二)显色反应
α -氨基酸与水合茚三酮在水溶液中加热时, 能放出二氧化碳,并生成紫色的化合物,称 为罗曼氏紫。
O OH
-
R-CH-COO
2
+ OH
N+ H3
O
ONH4 O
N=
O
O
+ RCHO + CO2
水合茚三酮
罗曼氏紫
此反应灵敏度高,是鉴定α -氨基酸简 便而迅速的方法,常用于层析时显色。还可 根据颜色的深浅程度及放出的二氧化碳的量 测定α -氨基酸的含量。
a- 螺旋(b)
(2)β—折叠 又称为β—片层结构。β—折 叠指多肽链呈一种铺开的折扇形状,相邻两 个氨基酸残基的距离约700pm。若干条多肽 链或一条多肽链的若干片段平行排列,维系 和固定β—折叠的作用力仍然是氢键。 β-折叠有两种类型,一种是多肽链从N-末端 到C-末端的排列是同方向的,称为平行β-折 叠,另一种是从N-末端到C-末端的排列是反 方向的叫反平行β-折叠。
蛋白质四级结构名词解释生物化学

蛋白质是生命体内重要的有机分子,它们是生命的基本构造和功能单位,对维持细胞内外环境平衡、调节生物体的代谢和生长发育起着重要作用。
蛋白质的结构决定了其功能,而蛋白质的四级结构则是蛋白质结构的最高层次,其包括了蛋白质的主要结构特征和功能特点。
本篇文章将对蛋白质的四级结构进行详细解释。
一、一级结构蛋白质的一级结构是指其氨基酸序列的排列方式。
氨基酸是蛋白质的构建单元,蛋白质的一级结构由若干个氨基酸组成,氨基酸之间通过肽键相互连接形成线性的多肽链,这种链状结构被称为蛋白质的一级结构。
蛋白质的一级结构决定了其二级、三级和四级结构,是蛋白质结构的基础。
二、二级结构蛋白质的二级结构是指其局部区域内氨基酸残基之间的空间排布方式。
常见的二级结构有α-螺旋、β-折叠、无规卷曲等形式。
α-螺旋是一种螺旋形的结构,氨基酸残基呈螺旋状排列;β-折叠是一种具有平行或反平行排布的β-片层结构,氨基酸残基相互之间通过氢键相连。
二级结构对蛋白质的稳定性和折叠方式具有重要影响。
三、三级结构蛋白质的三级结构是指其整个分子在空间上的立体构象。
不同的氨基酸残基之间通过蛋白质内部和外部的相互作用形成了多种空间结构,如疏水作用、氢键、离子键和范德华力等非共价相互作用。
这些相互作用使得蛋白质分子能够折叠成特定的空间构象,形成其独特的结构特征。
蛋白质的功能很大程度上取决于其三级结构。
四、四级结构蛋白质的四级结构是指多个多肽链或亚基之间的空间排布方式。
在由多个多肽链或亚基组成的蛋白质分子中,这些链或亚基之间通过各种非共价相互作用相互连接或结合,形成了特定的空间结构。
已知的含有四级结构的蛋白质有许多酶和结构蛋白,其中含有多个亚基,它们之间通过离子键、氢键和疏水作用等相互作用形成了复杂的立体结构。
蛋白质的四级结构决定了其生物学功能,对于一些具有多种生物学功能或具有复杂生物学结构的蛋白质来说,其四级结构的理解和研究显得尤为重要。
在生物化学领域,对蛋白质四级结构的深入研究不仅有助于更好地理解蛋白质的生物学功能和在细胞内外的作用机制,也为疾病的治疗和药物的研发提供了理论基础和实验依据。
蛋白质的四个功能

蛋白质的四个功能
1、构建细胞结构:蛋白质是所有生物细胞的主要建筑材料,它们形成我们身体中不同部位和组织的主要成分。
它们是细胞壁、膜、骨骼和构造元件的主要组件,可以把细胞和组织联系起来,从而维持细胞结构的稳定性。
2、合成营养物质:蛋白质的另一个重要功能就是合成和供应营养物质。
它合成和储存许多有机物,包括氨基酸、脂肪酸、碳水化合物和保护物质。
这些物质不仅能够为生命过程提供必要的能量,同时,还能促进细胞的生长和复制,帮助细胞生成新的蛋白质。
3、反应调节和传递信号:蛋白质在细胞信号传导中起着重要作用,它能够帮助细胞及时反应内外环境的变化,调节内外环境和稳定细胞。
蛋白质也能够及时传递细胞信号,影响和调控生物体的发育、增殖和衰老过程。
4、激活药物作用:蛋白质也可以用于激活药物的作用,使药物及其他物质能够穿透细胞膜,影响细胞的正常功能;蛋白质还可以通过干扰蛋白质的交互作用来阻止疾病的发生以及病毒的传播。
生物化学 第4章 蛋白质蛋白质三维结构

第四章蛋白质的三维结构稳定蛋白质三维结构的作用力一、多肽主链折叠的空间限制从理论上讲,一个多肽主链能有无限多种构象。
从理论上讲个多肽主链能有无限多种构象但是,只有一种或很少几种天然构象,且相当稳定。
但是只有种或很少几种天然构象且相当稳定因为:天然蛋白质主链上的单键并不能自由旋转1、肽链的二面角★只有α碳原子连接的两个键(C α—N 和C α-C )是单键,能自由旋转。
★扭角:环绕C α—N 键旋转的角度为Φ,环绕C α—C 键旋转的角度称Ψ。
可旋转±180度,一般呈顺时针旋转。
旋转受H.O 基的限制多肽主链的构象可以用每个C 的对原子以及R 基的限制。
多肽主链的构象可以用每个a-C 的一对扭角来描述。
★当Φ(Ψ)旋转键两侧的主链呈顺式时,规定Φ(Ψ)=0°★从Cα沿键轴方向看,顺时针旋转的Φ(Ψ)角为正值,反之为负值。
2、拉氏构象图:可允许的Φ和Ψ值Φ和Ψ同时为0的构象实际不存在二面角(Φ、Ψ)所决定的构象能否存在,主要取决于两个相邻肽单位中非键合原子间的接近有无阻碍。
个相邻肽单位中非键合原间的接有Cα上的R基的大小与带电性影响Φ和Ψ◆拉氏构象图:Ramachandran根据蛋白质中非键合原子间的最小接触距离(范德华距离),确定了哪些成对二面角(Φ、Ψ)所规定的两个相邻肽单位的构象是允许的,哪些是不允许的,并且以Φ为横坐标,以Ψ为纵坐标,在坐标图上标出,该坐坐标以为纵坐标在坐标图上标出该坐标图称拉氏构象图。
⑴实线封闭区域一般允许区,非键合原子间的距离大于一般允许距离,此区域内任何二面角确定的构象都是允许的,且构象稳定。
的且构象稳定⑵虚线封闭区域是最大允许区,非键合原子间的距离介于最小允许距离和般允许距离之间,立体化学允许,但许距离和一般允许距离之间,立体化学允许,但构象不够稳定。
⑶虚线外区域是不允许区,该区域内任何二面角确定的肽链构象,都是不允许的,此构象中非键合原子间距离象都是不允许的此构象中非键合原子间距离小于最小允许距离,斥力大,构象极不稳定。
蛋白质的功能 (4)

(3)肌红蛋白的构象保证了血红素与氧的结合 在溶液中血红素能短暂结合氧,但二价铁很快被氧化成三价 铁,而失去结合氧的能力。 经研究发现,氧化过程是通过一个配合物中间体,两个血红 素和一个氧分子的夹心结合体来完成的。 肌红蛋白为血 红素提供了一个 疏水环境,保证 铁不被氧化。
(二)肌红蛋白氧合曲线
subunit of Hb A
subunit of Hb S
底氧浓度时,HbS的溶解度下 降(下降了96%),HbS发生线 性缔合,形成长链,由多条链 再进一步聚集成多股螺旋的微 管纤维素(17nm),结果导致 了细胞呈镰刀状。
疏水口袋
带电荷的Glu不能结合
Electron micrograph of deoxy-Hb S fibers spilling out of a ruptured erythrocyte.
ห้องสมุดไป่ตู้
过肌红蛋百贮氧和分配氧,使这些动物能够保持长时间潜水。
2.
折8段 段长:7-24AA ——α螺旋结构 转弯处1-8AA 松散结构 pro,Ile,Gly 螺旋区:A、B、C、D、E、F、G和H 非螺旋区:NA,AB,BC,CD,DE,EF,FG,GH,HC 9区
3.极性氨基酸侧链在蛋白质分子表面(肌红蛋白溶于水)。非 极性侧链位于空穴周围,不接触水,保证二价铁不被氧化成 三价铁失去与氧结合的能力。 4.血红素辅基垂直伸出分子表面,通过组氨酸(F8 近组氨酸) 的米唑基与Fe形成第五个配位键,氧与Fe形成第六个配位键。 由于近组氨酸的作用,是二价铁原子向组氨酸F8 的方向外 偏血红素平面0.3Å,氧分子结合在血红素的另一边的Fe的 第六个配位键上,位于铁原子偏离后留出的空间,组氨酸E7 在氧的一旁,它不与血红素相连,称为远组氨酸。 高铁血红素中的三价铁F偏离血红素平面只有0.2Å,留 出的 空间不够进入一个氧分子,它的第六个配位键水,因 此高铁血红素不能结合传递氧。
蛋白质化学:第四部分

•
方法:① 用SDS和巯基乙醇(打开二硫键)处理,蛋白质变性(肽链伸展) 并与SDS结合,形成SDS-蛋白质复合物,使得不同蛋白质分子
均带负电(SDS带负电),且荷质比相同(蛋白质分子大,结
合SDS多;分子小,结合SDS少); 不同蛋白质分子具有相似的构象。 ② 用几种标准蛋白质相对分子质量的对数值对它们的迁移率作图 ③ 测出待测样品的迁移率 ④ 从标准曲线上查出样品的相对分子质量
2. 蛋白质的沉淀:
如果加入适当的试剂,使蛋白质分子处于等电点状态或失去
水化层(消除相同电荷,除去水膜),蛋白质胶体溶液就
不再稳定而出现沉淀现象。
导致蛋白质沉淀的常用方法:
① 高浓度中性盐(盐析)
② 等电点沉淀
③ 有机溶剂沉淀
④ 重金属盐类沉淀 ⑤ 生物碱试剂和某些酸类沉淀 ⑥ 加热变性沉淀
水化层
和无机盐等小分子自由通过,此方法只能将蛋白质和小分子 物质分开,不能将不同蛋白质分开。 (2)超过滤:是利用外加压或离心使水和其他分通过半 透膜,蛋白质留在膜上。
透析与超过滤简易装置
2. 密度梯度离心:
a. 蛋白质颗粒沉降不仅决定于它的大小也取决于它的密度。
b. 颗粒沉降到与自身密度相等的介质梯度时,即停止不前。
素作用下,其特定的空间构象被破坏,即有序的空间结构 变成无序的空间结构,从而导致其理化性质改变和生物活 性的丧失。
2.变性的本质
—— 破坏蛋白质的空间结构,不改变蛋白质的一级结构。
蛋白质变性后,由于维持溶液稳定的条件仍然存在而并不 析出,例如:在强酸碱中,变性的蛋白质在强酸碱溶液 中仍存在电荷效应,所以不表现为沉淀现象。
蛋 白 质 胶 体 溶 液 沉 淀 作 用 示 意 图
食品生物化学 第4章 蛋白质
(三)、蛋白质的两性解离及等电点
蛋白质与多肽一样,能够发生两性离解,也有等电点。 在等电点时(Isoelectric point pI),蛋白质的溶解度最小, 在电场中不移动。
(四)、蛋白质的变性
当天然蛋白质受到某些物理因素和化学因素的影响,使其分 子内部原有的高级构象发生变化时,蛋白质的理化性质和生物学 功能都随之改变或丧失,但并未导致其一级结构的变化,这种现 象称为变性作用(denaturation)。 蛋白质的变性作用如果不过于剧烈,则是一种可逆过程,变 性蛋白质通常在除去变性因素后,可缓慢地重新自发折叠成原来
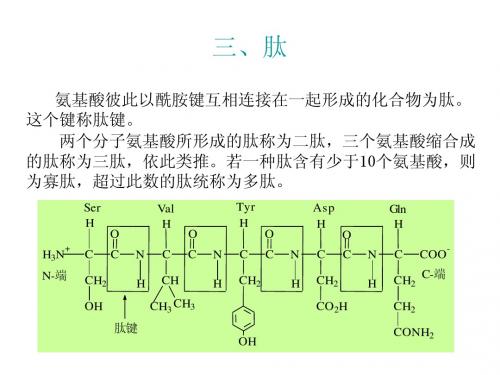
三、肽
氨基酸彼此以酰胺键互相连接在一起形成的化合物为肽。 这个键称肽键。 两个分子氨基酸所形成的肽称为二肽,三个氨基酸缩合成 的肽称为三肽,依此类推。若一种肽含有少于10个氨基酸,则 为寡肽,超过此数的肽统称为多肽。
Ser H H3N
+
O C N H
Val H C CH
O C N H
Tyr H C CH2
(五)、蛋白质的颜色反应
1、双缩脲反应 2、米隆(Millon)反应 3、酚试剂反应 4、乙醛酸反应 5、水合茚三酮反应 6、蛋白黄色反应 7、醋酸铅反应
红色或蓝紫色 砖红色沉淀 蓝色 色环 蓝紫色 黄色 黑色的硫化铅沉淀
六、蛋白质的功能
催化功能(酶);结构功能;调节功能;防御功
能;运动功能;运输功能;信息功能;储藏功能
超二级结构类型
Β-链
αα
β ×β
β αβ
1
β -迂回 2 -迂回 4 β 3
5
βββ
5
回形拓扑结构
2 3 4 1 回形拓扑结构
超二级结构类型立体图
丙酮酸激酶结构域4
什么是蛋白质

什么是蛋白质
蛋白质是生物体内一类重要的大分子有机化合物,由氨基酸构成。
它们在生命体内担任着多种关键的生物学功能,包括结构支持、酶催化、运输、信号传导等。
蛋白质是生命体内最复杂、最多样化的大分子之一,对维持细胞结构和功能至关重要。
蛋白质的基本结构单位是氨基酸。
氨基酸是由氨基基团(NH₂)、羧基基团(COOH)、一个氢原子和一个侧链组成的。
蛋白质是通过氨基酸之间的肽键形成的多肽链。
蛋白质的氨基酸序列编码了其结构和功能。
蛋白质的功能非常多样,包括:
1. 结构:一些蛋白质在细胞和组织中提供支持和结构。
例如,胶原蛋白是结缔组织中的主要蛋白质,赋予组织强度和弹性。
2. 酶:酶是催化生化反应的蛋白质,可以加速化学反应的进行,从而维持细胞代谢。
3. 运输:携带和传递物质,如血液中的血红蛋白负责输送氧气。
4. 免疫:免疫球蛋白参与免疫系统的功能,识别和抵御外部入侵的病原体。
5. 信号传导:通过激活或抑制细胞内信号通路来调节细胞功能的蛋白质。
6. 运动:肌肉中的肌动蛋白和微管蛋白等负责细胞和组织的运动。
蛋白质的功能和结构高度特异,它们的三维结构决定了它们的功能。
蛋白质的合成由基因编码的DNA信息进行,遵循中心法则,即DNA 转录成mRNA,再由mRNA翻译成蛋白质。
蛋白质的合成过程发生在细胞的核糖体中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
训练5 蛋白质的结构和功能
基础过关
知识点一氨基酸及其种类
1.组成蛋白质的氨基酸的R基 ( )
A.与一个氢原子和一个—C2H4O2N相连
B.约有20种
C.至少有一个氨基和一个羧基
D.至少有一个氨基或一个羧基
2.同为组成生物体蛋白质的氨基酸,酪氨酸几乎不溶于水。
而精氨酸易溶于水,这种差异的产生取决于( )
A.两者R基组成的不同
B.两者的结构完全不同
C.酪氨酸的氨基多
D.精氨酸的羧基多
3.下列有关氨基酸结构的叙述中,不正确的是
( )
A.每种氨基酸只有一个氨基、一个羧基
B.每种氨基酸都有一个氨基和一个羧基连接在同一个碳原子上
C.连接一个氨基和一个羧基的碳原子上还连接一个氢原子和一个侧链基团
D.侧链基团(R基)不同,氨基酸就不同
知识点二蛋白质的形成与鉴定
4.下列能正确表示蛋白质分子由简到繁的结构层次的一组是
( )
①氨基酸②C、H、O、N等元素③氨基酸分子脱水缩合④多肽⑤形成一定的空间结构
A.①②③④⑤
B.②①④③⑤
C.②①③⑤④
D.②①③④⑤
5.如图为某二肽分子结构示意图,已形成肽键和可能形成肽键的—NH2分别是( )
A.①③
B.②④
C.④③
D.⑤⑥
6.已知20种氨基酸平均相对分子质量为a,现有某蛋白质分子由n条多肽组成且相对分子质量为b,此蛋白质分子中的肽键数为( )
A.b-18n
a-18
B.
b-an
a-18
C.b-an
a-18
-1 D.b-na
7.蛋白质能与双缩脲试剂发生作用产生紫色反应的原因是蛋白质中有肽键,而肽键可以与双缩脲试剂发生反应产生紫色的络合物。
那么下列物质中可以与双缩脲试剂发生紫色反应的化合物是( )
知识点三蛋白质结构和功能的多样性
8.生物体内的蛋白质千差万别,其原因不可能是( )
A.组成肽键的化学元素不同
B.组成蛋白质的氨基酸的种类和数量不同
C.氨基酸的排列顺序不同
D.蛋白质的空间结构不同
9.美国威斯康星大学的一个研究小组发现:用合成的蛋白质可以抑制艾滋病病毒的关键蛋白质gp41,使其不能与宿主细胞中的蛋白质相互作用,从而使病毒无法顺利入侵细胞。
下列叙述不正确的是 ( )
A.构成艾滋病病毒的所有蛋白质中一定都含有20种氨基酸
B.鉴定多肽和蛋白质时都可以使用双缩脲试剂
C.某些蛋白质具有催化功能
D.有些蛋白质具有传递信息的作用,进而调控生命活动
能力提升
10.如图是某蛋白质分子的结构示意图,图中“”表示不同种类的氨基酸,图
中甲链由21个氨基酸,乙链由19个氨基酸组成,图中“—S—S—”是在蛋白质加工过程中由两个“—SH”脱下2个H形成的。
下列有关叙述中,错误的是( )
A.该蛋白质多样性的主要原因是氨基酸的种类和排列顺序
B.该蛋白质分子中至少含有两个羧基
C.图中“-S—S-”代表的化学键也是肽键
D.形成该蛋白质分子时相对分子质量减少了686
11.下图为某细胞中一条肽链的结构简式,R1、R2和R3是3个不同的化学基团。
下列有关分
析中不正确的是( )
A.这条肽链中的肽键数是2
B.该肽链是由3个氨基酸脱去3分子水缩合形成的
C.该肽链中至少含有1个氨基和1个羧基
D.该化合物能与双缩脲试剂发生紫色反应
12.下面是某蛋白质的肽链结构示意图(图甲,其中数字为氨基酸序号)及部分肽链放大图(图乙),请据图判断下列叙述中正确的是( )
A.该蛋白质中含有两条肽链,52个肽键
B.图乙中含有的R基是①②④⑥⑧
C.从图乙可推知该蛋白质至少含有4个游离的羧基
D.若氨基酸的平均相对分子质量为128,则该蛋白质的相对分子质量为5 646
13.下列关于氨基酸和蛋白质的叙述,错误的是 ( )
A.甲硫氨酸的R基是CH2CH2SCH3,则它的分子式是C5H11O2NS
B.分子式为C63H105O45N17S2的多肽化合物中,最多含有的肽键数目是16个
C.两个氨基酸脱水缩合过程中失去的H2O中的氢来源于氨基和羧基中的氢
D.10个氨基酸构成的多肽有9个CONH,称为九肽
14.下列为某一多肽化合物的分子结构式,请回答有关问题:
(1)上述结构中,代表氨基的结构式为________;代表肽键的结构式为______________;
其中________、__________为R基。
(2)上述化合物是由________种氨基酸组成。
(3)该化合物是由____个氨基酸失去________分子水形成的,该化合物称为________,这样的反应叫做________________。
水分子中的氧来自于________,氢来自于________________________。
15.如图表示人体内几种化学元素和化合物的相互关系,其中a表示有机小分子物质,A表示有机高分子物质。
请据图分析回答:
(1) A可分为A1、A2、A3等,其原因是:从a分析是由于_____________________________;从A分析是因为__________________________________。
(2) A3是由574个氨基酸,4条肽链组成的,在形成1分子A3的过程中,共脱去____________分子水。
目
(1)表中①、②、③的氨基酸数目虽然相同,但其生理作用彼此不同,这是因为它们的______________________________________________不同。
(2)表中③与④、⑤与⑥虽然功能相似,但各自具有专一性,它们之间的差异主要取决于________________________________________。
(3)⑧的生理功能说明蛋白质具有__________作用;⑨的生理功能说明蛋白质具有____________作用;⑩的生理功能说明蛋白质具有______________作用。
(4)组成上述10种化合物的所有氨基酸所共有的结构是____________。
(5)这些实例说明蛋白质的分子结构具有__________,这种特点决定了________________________________。
个性拓展
17.近年,利用肉毒素去皱美容的做法受到很多专家的质疑。
肉毒梭菌是一种致死性很高的病原体,其致病性在于产生的神经麻痹毒素,即肉毒类毒素。
它是由两条肽链盘曲、折叠构成的一种生物大分子,1 mg可毒死20亿只小鼠。
煮沸1 min或75 ℃下加热5~10 min 就能使其完全丧失活性。
可能引起肉毒梭菌中毒的食品有腊肠、火腿、鱼及鱼制品、罐头食品、臭豆腐、豆瓣酱、面酱、豆豉等。
下面是肉毒类毒素的局部结构简式,请据此回答:
(1)肉毒类毒素的化学本质是________________,其基本组成单位的结构通式是__________________________________________。
(2)高温可使肉毒类毒素失活的主要原理是________________________________________ ________________________________________________________________________。
(3)由上图可知,该片段由________种单体组成,有____个肽键,在形成该片段时要脱去________分子水。
(4)一分子肉毒类毒素至少含有__________个氨基和________个羧基。
答案
1.B 2.A 3.A 4.D 5.C 6.B 7.A 8.A 9.A 10.C 11.B 12.C 13.D 14.(1)—NH2—CO—NH——CH3
—CH2OH (2)2 (3)3 2 三肽脱水缩合—COOH —NH2和—COOH
15.(1)氨基酸的种类、数目和排列顺序的不同DNA分子结构具有多样性(不同的基因控制合成的蛋白质不同) (2)570
16.(1)氨基酸的种类和排列顺序(2)氨基酸的种类、数目和排列顺序(3)调控免疫运输
(4)
(5)多样性蛋白质具有多种功能
17.(1)蛋白质
(2)高温导致蛋白质空间结构被破坏(3)5 4 4 (4)2 2。
