羧酸酯结构式
第4讲 醛 羧酸 酯

【跟踪训练 2】 (2013 福建质量检测)下列实验合理的 是( D )
解析:A 项量取 5.00 mL 盐酸应选用滴定管;B 项检 验 Fe ,应先加入 KSCN 溶液后滴入氯水;C 项制备 乙酸乙酯时导管末端不能插入饱和碳酸钠溶液中 , 容易引起倒吸,且酯化反应应使用浓硫酸;D 项汽 油和水互不相溶,可以用分液漏斗分离。
(5)乙酸乙酯能在碱性条件下水解,甲同学加入的碱量不 足,有酸剩余,所以蒸馏后得到含有乙酸的酯;乙同学加入 的碱过量,使生成的酯发生了水解,所以得到了大量水溶 性的物质。 答案:(1)碎瓷片 防止暴沸
(2)提高乙酸的转化率 (3)及时地蒸出生成物,有利于酯化反应向生成酯的方向 进行 (4)饱和 Na2CO3 溶液 分液 蒸馏 硫酸 蒸馏
和—CHO 时,先用溴水检验
后再
用银氨溶液检验醛基
解析:A 项乙酸与氢氧化钠溶液反应生成乙酸钠溶液,与乙 醛互溶,不能用分液法分离,错误;B 项甲酸甲酯和乙醛都 能与新制银氨溶液反应,错误;C 项 CH3CH CHCH2OH 和 CH3CH2CH2CHO 都能使酸性 KMnO4 溶液褪色,错误;D 项可用新 制的 Cu(OH)2 悬浊液鉴别甲酸、乙醛、乙酸,正确;F 项应先 用银氨溶液检验醛基,再用溴水检验 氧化—CHO,错误。 答案:DE ,因为溴水会
基础梳理
巩固演练
要点突破 点滴积累
基础梳理
知识导图
抓主干、固双基
交流展示
知识梳理 一、醛的结构与性质
1.概念 由烃基与醛基相连而构成的化合物。 2.分子结构
分子式 甲醛 乙醛 CH2O C2H4O 结构简式 HCHO CH3CHO 官能团 —CHO
3.物理性质
颜色 甲醛 乙醛 无色 无色 状态 气体 液体 气味 刺激性气味 刺激性气味 溶解性 易溶于水 与水、乙醇 等互溶
酯

【重点内容】第三节羧酸酯【重要知识点】1.酯类的通式2.酯类的物理性质和化学性质【内容讲解】一、酯类的通式1.酯类结构特征(R-COOR')(R和R'可相同可不同)2.通式C n H2n O23.酯的同分异构体:酯类和饱和一元酸互为同分异构体二、酯类的命名酯类的命名:某酸某(醇)酯(醇字可省略)CH3CH2COOOCH3丙酸甲酯三、酯的类别1.小分子链状酯,例如CH3COOC2H5等。
2.内酯一个分子内既含-COOH又含-OH,脱去一分子H2O,形成的酯。
例如内酯3.环酯例如:环酯4.聚酯羧酸和醇通过酯化缩聚反应,生成的高分子化合物。
例如:聚酯5.酚酯四、酯类物理性质无色油状具有芳香味的液体,密度小于水,难溶于水,易溶于有机溶剂。
五、酯类化学性质酯在稀硫酸或稀碱液做催化剂,加热条件下可与H2O发生水解反应。
例如:类似反应:说明:(1)酯类在碱性溶液中水解生成羧酸盐CH3COOCH2CH3+NaOH CH3COONa+C2H5OHRCOOR'+NaOH RCOONa+R'OH(2)酯化反应和酯的水解反应互为可逆(3)甲酸某酯中,含有醛基,表现还原性,能和银氨溶液,新制氢氧化铜反应。
【例题讲解】1.有机物A、B、C、D、E有如下衍生关系又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C6H12O2。
试推断A、B、C、D、E各为何物?并写出结构简式。
解析:根据信息,C和E在浓H2SO4作用下加热得到一种具有果香味的液体,说明C6H12O2为酯,且C是醇E为羧酸。
因E 是由C氧化得到,在此过程中碳原子个数不变,所以C为1-丙醇,C若为2-丙醇,则D为丙酮,丙酮不能氧化成羧酸。
E 为丙酸,D为丙醛。
B能和银氨溶液反应说明B中含有醛基,且A在NaOH作用下生成醇C,可知A为酯,B则为HCOONa。
因此结构简式为:A.HCOOCH2CH2CH3 B.HCOONaC.CH3CH2CH2OH D.CH3CH2CHOE.CH3CH2COOH2.有一元羧酸和一元醇形成的酯A。
羧酸 酯
5、酯的分类
无机酸酯 如:CH3CH2-O-NO2
①酸的不同
硝酸乙酯
分
有机酸酯 如:CH3COOH
类
一元酸酯
②酯基的数目 二元酸酯 如:乙二酸二乙酯
多元酸酯 如:油脂
第6一、节酯的酯命名:
酯是按照生成酯的羧酸和醇来命名的。
羧酸的名称在前,醇的名称在后,将“醇”字换成 “酯”字,称为“某酸某酯”。
酸的部分
(1)酯在酸性条件下不完全水解反应式:
O|| R1—C—O—R2
+
H—
OH
稀硫酸
O
|| R1—C —OH
+ H—O— R2
(2)酯在碱性条件下完全水解反应式为:
O R C O R′ + NaOH
R COONa +R′OH
如:乙酸乙酯的水解
(1)酸性条件下不完全水解反应式:
CH3COOC2H5 +H2O
软脂酸C15H31COOH
油酸C17H33COOH
3、羧酸的通式
①一元羧酸通式:R(H)—COOH ②饱和一元羧酸的通式: CnH2n+1COOH
或CnH2nO2
4、羧酸物理性质:
①溶解性:低级酸能与水互溶,酸分子中随碳原 子的增多,溶解度逐渐减小。
②熔点:随碳原子个数增长而升高
稀H2SO4 △
CH3COOH + C2H5OH
(2)碱性条件下完全水解反应式为:
CH3COOC2H5 + NaOH
CH3COO Na + C2H5OH
O
※ 酯的水解时的断键位置 C O 注 ※ 酯的水解与酯化反应互为可逆反应。
※ 无机酸只起催化作用不影响化学平衡。 意 ※ 碱除起催化作用外,它能中和生成的
酯化反应归纳

关于酯的考点常出现在高考试题中,成为测试的热点;现归纳例举如
下:
1、反应条件:一般需加热,用浓硫酸作催化剂和吸水剂。
2、反应物:醇是任意的醇,酸可以是有机酸,也可以是无机含氧酸。
3、反应机理:一般是羧酸脱羟基醇脱氢,且羧基与醇羟基数目比为
1: 1。
4、反应方式:
⑴无机含氧酸与醇形成的酯 如: CH 3CH 2OH+HO — NO2 浓 H2SO4 CH 3CH2—O— NO 2+H 2O
CH 3COOCH 2—CH 2COOCH 3+2H 2O
此类酯的结构特点也是含有两个“ —C —O—” 结构的二元链酯。书写
此酯结构式时,一定要注意中间是二元醇, O 万不可将羧基碳和羟基碳换
位。如写成 CH 3COOCH 2— COOCH 2CH 3 等就错了。 ④环酯
a、二元酸与二元醇生成环酯
浓 H2SO4 △
CH 3CH 2OOC— COOCH 2CH 3+2H 2O
—C —O—” 结构的二元链酯。书写此
酯结构式时, 一定要注意中间是二元酸, O 即两个羧基为同一碳链相连, 两
个醇的羟基分列两端。
③一元酸与二元醇生成的酯
浓
如:HOCH 2— CH2OH+2CH 3COOH
H 2 SO4 △
如:COOH
+ COOH
HOCH 2 HOCH 2
O==C — O— CH2 + 2H 2O
O==C — O— CH2
b、由两个同一种羟基酸分子生成的环酯
如: COOH + COOH
HOCH 2 HOCH 2
O==C —O— CH 2 O==C — O— CH 2
羧酸-酯

酯水解的规律: 酯 + 水
无机酸 △
酸+ 醇
酯 +碱
有机酸盐 + 醇
△
酯在无机酸、碱催化下,均能发生水解反应,其中在酸 性条件下水解是可逆的,在碱性条件下水解是不可逆的。
小结:几种衍生物之间的关系
①
③
⑤
②
④
⑧ ⑦
⑥ ⑨⑩
CH3COO
COOCH3
2、1mol有机物
与足量NaOH 溶
3.导管不伸入液面下的作用? 防止饱和碳酸钠溶液倒吸
4.浓硫酸的作用? 催化剂和吸水剂
5.三种反应物如何混合? 乙醇-浓硫酸-乙酸
酯化反应:取代反应,也是分子间脱水的反应
O
浓H2SO4
O
CH3-C-O-H+H-O-CH2-CH3 △
CH3-C-O-CH2-CH3+H2O
概念 酸和醇作用生成酯和水的反应
一、分子组成与结构
乙酸
HO
分子式:C2H4O2 结构式:H C C O H
结构简式: CH3COOH
H
官能团: —C—OH羟基 (或—COOH)
羰基 O
羧基
二、物理性质
无色刺激性气味液体,熔点 16.6℃,低于16.6℃就凝结成冰 状晶体,所以无水乙酸又称冰醋 酸。乙酸易溶于水和酒精。
三、乙酸的化学性质
1、乙酸的酸性
⑴.电离方程式:CH3COOH
⑵.具酸的通性:
CH3COO- + H+
弱酸性
1.与指示剂反应 2.与金属反应 3.与碱反应及碱性氧化物反应 4.与更弱酸的盐反应
【思考
交流】
你能用几种方法证明乙酸是弱酸?
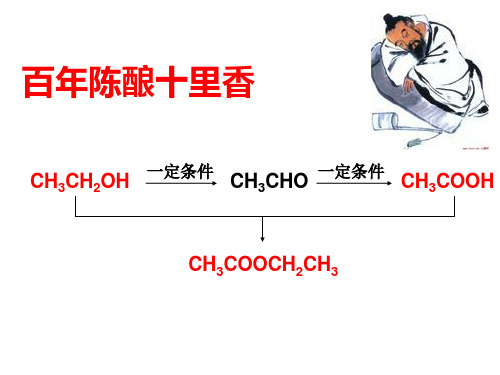
第三章第三节羧酸酯

①含有邻二取代苯环结构
②与B有相同官能团 ③不与FeCl3溶液发生显色反应
变式训练
2.某有机化合物X(C7H8O)与另一有机化 合物Y发生如下反应生成化合物Z(C11H14O2)。
X+Y
浓H2SO4 △
Z+H2O
(1)X是下列化合物之一,已知X不能与
(2)酯化反应(或取代反应) ①含义:酸和醇作用生成 酯和水 的反
应。 ②断键方式:酸脱 羟基,醇脱 氢。
③乙酸与乙醇的反应:
CH3COOH+
CH3CH2OH
浓H2SO4 △
CH3COOC2H5
+H2O。
三、酯
2.酯的性质 酯一般难溶于水,主要化学性质是易发 生水解反应,其条件是酸催化 或碱催化 ,有 关化学方程式: (1)酸性条件
①能使紫色石蕊试液 变红 ; ②能与活泼金属(如Na)反应放出氢气 :
2CH3COOH+2Na―→2CH3COONa+H2↑;
③能与碱(如NaOH)发生中和反应:
CH3COOH+OH-―→CH3COO-+H2O; ④能与碱性 氧化物(如MgO)反应:
2CH3COOH+MgO―→Mg(CH3COO)2+H2O; ⑤能与比醋酸酸性弱的弱酸盐反应,如碳酸钠与醋酸反应: 2CH3COOH+CO32-―→2CH3COO-+CO2↑+H2O 。
(4)乙酸乙酯在饱和Na2CO3溶液中的溶解度很小, 而蒸出的乙酸和乙醇在其中的溶解度很大,因此便于分 离出乙酸乙酯。
(5)试管内液体分层,上层为透明的油状液体。 【答案】 (1)先加入乙醇,然后边摇动试管边慢慢 加入浓H2SO4,再加入冰醋酸 (2)在试管中加入几粒沸石(或碎瓷片) (3)①加快反应速率 ②及时将产物乙酸乙酯蒸出,有利于平衡向生成乙 酸乙酯的方向移动
专题16 酯(教师版)
专题16 酯1.组成和结构(1)酯是羧酸分子中羧基上的—OH被—OR'取代后的产物,简写成RCOOR',R和R'可以相同,也可以不同。
其中R是烃基,也可以是H,但R'只能是烃基。
(2)羧酸酯的官能团是。
(3)饱和一元羧酸C n H 2n +1COOH 和饱和一元醇C m H 2m +1OH 生成酯的结构简式为,故饱和一元酯的通式为C n H 2n O 2(n ≥2)。
(4)命名:根据生成酯的酸和醇命名为某酸某酯,如CH 3COOCH 2CH 3:乙酸乙酯;HCOOCH 2CH 3:甲酸乙酯。
2.性质(化学性质以CH 3COOC 2H 5为例)(1)物理性质:低级酯是具有芳香气味的液体,密度一般比水小,难溶于水,易溶于有机溶剂。
(2)化学性质(水解反应):①酸性条件:CH 3COOC 2H 5+H 2O CH 3COOH +C 2H 5OH ②碱性条件:CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH 【典例1】下列有关羧酸和酯的叙述中,正确的是( )A .羧酸和酯的通式均可以用C n H 2n O 2表示B .酯都能发生水解反应C .羧酸的酸性都比碳酸弱D .羧酸均易溶于水,酯均难溶于水 【答案】B【解析】只有饱和一元羧酸与饱和一元醇形成的酯才可用通式C n H 2n O 2(n ≥2)表示,A 选项错误;乙酸可以与CaCO 3反应制备CO 2,C 选项错误;高级脂肪酸也不溶于水,D 选项错误。
1V 2O 5△ 高温、高压催化剂浓硫酸Δ180℃催化剂充电放电催化剂Δ放电充电CH3COOH+C2H518OH CH3CO18OC2H5+H2O 2(1)1 mol水解一般需要1 molH2O(或1 mol NaOH)生成1 mol —COOH(或—COONa)和1 mol—OH,酯化反应中,1 mol —COOH和1 mol —OH酯化生成1 mol和1 mol H2O。
【知识解析】醇、羧酸、酯的结构与性质
醇、羧酸、酯的结构与性质典型例题有机物A是一种重要的工业原料,其结构简式如图:试回答下列问题:(1)有机物A的分子式为;(2)有机物A中含有的含氧官能团名称是;(3)0.5 mol该物质与足量金属钠反应,能生成标准状况下的氢气L;(4)该物质能发生的反应有(填序号)。
①能与NaOH溶液反应②能与溴的四氯化碳溶液反应③能与甲醇发生酯化反应④可以燃烧⑤能发生水解反应【答案】(1)C11H12O3(2)羟基、羧基(3)11.2(4)①②③④【解析】(1)根据有机物成键特点,其分子式为C11H12O3。
(2)含有的官能团是碳碳双键、羧基、羟基,其中含氧官能团是羧基和羟基。
(3)能和Na反应的官能团是羧基和羟基,1mol此有机物产生1molH2,则0.5mol 此有机物能产生0.5×22.4 L=11.2 L。
(4)①羧基具有酸性,能和NaOH反应,故正确;②含有碳碳双键能和溴的四氯化碳溶液发生加成反应,故正确;③羧基和醇发生酯化反应,故正确;④大多数有机物能燃烧,故正确;⑤不含卤原子、酯基、肽键,不能发生水解,故错误。
解题必备一、醇的结构特点与化学性质醇可看做是烷烃中的氢原子被羟基取代后的产物,其官能团为羟基。
(1)与钠的反应:醇与金属钠能发生取代反应,放出氢气(以乙醇为例写方程式:2Na+2CH 3CH 2OH ―→2CH 3CH 2ONa+H 2↑)。
(2)催化氧化:醇在铜或银做催化剂的条件下,可以被空气中的氧气氧化为醛(以乙酸为例写方程式:2CH 3CH 2OH+O 2Cu−−→△2CH 3CHO+2H 2O);也可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,生成羧酸。
二、羧酸的结构特点与化学性质羧酸的官能团为羧基,事实上有机物只要存在羧基,就有羧酸的通性,在化学性质上可以将乙酸的化学性质进行迁移:(1)弱酸性①弱酸性:羧酸在水中会发生电离,是弱酸,具有酸的通性。
②羧酸的酸性要强于碳酸,因此将羧酸通入碳酸钠溶液中,生成的气体能使澄清石灰水变浑浊,说明生成的气体为二氧化碳。
羧酸和酯
一、羧酸1、羧酸:由烃基与羧基相连而构成的有机物。
2、羧酸的分类(1)按分子中烃基的结构分类低级脂肪酸:如乙酸CH3COOH硬脂酸:C17H35COOH羧酸高级脂肪酸:软脂酸:C15H31COOH油酸:C17H33COOH芳香酸:如苯甲酸 C6H5COOH(2)按分子中羟基的数目分类一元酸:乙酸CH3COOH俗名蚁酸二元羧酸:如乙二酸HOOC-COOH多元羧酸:柠檬酸3、一元羧酸和饱和一元羧酸的通式和分子式一元羧酸的通式:R-COOH 饱和一元羧酸通式:CnH2n+1COOH(n ≥0)饱和一元羧酸的分子式:CnH2nO2(n≥1)4、酸的命名:与醛的命名方法相同HCOOH(甲酸)、 CH3COOH(乙酸)、CH3CH2COOH(丙酸)CH3CH2CHCOOH 2-甲基丁酸CH35、羧酸的化学通性羧酸分子中都有含有羧基官能团,因此都有酸性,且都能与醇发生酯化反应。
二、乙酸1、乙酸分子结构结构式:结构简式:CH3COOH 官能团:2、乙酸的物理性质强烈刺激性气味;常温下为无色液体;与水、酒精以任意比互溶;熔点:16.6℃,易结成冰一样的晶体。
(冰醋酸由此得名)受C=O的影响:断碳氧单键氢氧键更易断受-O-H的影响:碳氧双键不易断3、乙酸的化学性质1)、酸的通性:(酸性:乙酸>碳酸>苯酚)A、使紫色石蕊试液变色:B、与活泼金属反应:C、与碱性氧化物反应:D、与碱反应:E、与盐反应:代表物 结构简式 羟基氢的活泼性酸性 与钠反应 与NaOH 反应与Na 2CO 3反应 与NaHCO 3反应乙醇 CH 3CH 2OH 中性 能 不能 不能 不能苯酚 C 6H 5OH 比碳酸弱 能 能 能,不产生CO 2 不能 乙酸 CH 3COOH比碳酸强能能能能2)、酯化反应 方程式:定义:含氧酸和醇起作用,生成酯和水的反应叫做酯化反应。
浓硫酸作用:催化剂、吸水剂1. 药品的添加顺序 往乙醇中滴入浓硫酸和乙酸2.试管倾斜加热的目的是什么? 增大受热面积3.浓硫酸的作用是什么? 催化剂,吸水剂4.得到的反应产物是否纯净?主要杂质有哪些? 不纯净;乙酸、乙醇5.饱和Na 2CO 3溶液有什么作用?① 中和乙酸,消除乙酸气味对酯气味的影响,以便闻到乙酸乙酯的气味. ② 溶解乙醇。
酯
苹果含有:戊酸戊酯 菠萝含有:丁酸乙酯 梨含有:异戊酸异戊酯 香蕉含有:乙酸异戊酯 1
一、酯的组成和结构
1. 酯的定义:酸(羧酸或无机含氧酸)跟醇反应生成的一类有机 化合物。 2.羧酸酯的一般通式为: 官能团:酯基 饱和一元酯通式:CnH2nO2 饱和一元羧酸与饱和一元酯互为同分异构体
二、酯的物理性质
△
RCOOH+R’OH
在酸性条件下水解生成相应的羧酸和醇 2. 酯的碱性水解 RCOOR’ + NaOH
△
RCOONa+R’OH
在碱性条件下水解生成相应的羧酸盐和醇 【注】 (1) 酯水解反应断键位置:酯基中碳氧单键断 (2) 酯水解反应与酯化反应互为可逆反应
(3) 稀硫酸:催化作用 (4) 氢氧化钠的作用:中和生成的酸,使水解程度增大,若 碱过量则水解进行到底
4
三. 酯的命名:某酸某酯。
四、酯的同分异构体
1、酯类:(书写思路) 2、官能团异构:(与羧酸)
5
【理解与应用】
1. 如何出去下列有机物中的杂质(括号中为杂质),写出有关的 试剂及分离方法。 (1) 乙酸乙酯(乙酸) (2) 乙醇(乙酸) (3) 甲烷(乙烯) 2. 某有机物的结构简式为,它不可能具有的性质是 A. 能使酸性高锰酸钾溶液褪色 B. 能水解 C. 能使溴的四氯化碳溶液褪色 D. 能与Na2CO3溶液反应 D
——水解反应 酸性条件下的水解反应:
三、酯的化学性质
CH3COOC2H5 + H2O △ CH3COOC2H5 + NaOH H+ CH3COOH+C2H5OH
碱性条件下的水解反应:
△
CH3COONa+C2H5OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羧酸酯结构式
简介
羧酸酯(carboxylic acid ester)是一类有机化合物,由羧酸和醇反应生成。
羧
酸由羧基(-COOH)和一个连接在羧基碳原子上的官能团组成。
酯是由羧酸和醇经过酯化反应得到的衍生物,由酯基(-COOR)和一个连接在酯基碳原子上的官能团组成。
在羧酸中,羧基为亲电性基团,而醇中的酯基为亲核性基团,因此它们之间能够发生酯化反应。
结构式表示
羧酸酯的结构式可以用简略式或完整式表示。
在简略式表示中,羧基和酯基都用R
表示,简化了结构的表示。
例如,一个羧酸酯可以表示为R─COO─R’,其中R和R’分别代表有机基团。
在完整式表示中,使用具体的有机基团来表示羧基和酯基。
例如,苯乙酸乙酯的结构式可以表示为CH3─C6H5─COO─CH2CH3。
其中,CH3表示乙基,C6H5表示苯基,COO表示酯基,CH2CH3表示乙基。
合成方法
羧酸酯可以通过酯化反应合成。
酯化反应是酸催化下,羧酸和醇发生脱水缩合反应。
一般情况下,酸催化剂选择常用的有机酸,如硫酸、磷酸等。
反应条件可以根据羧酸的活性和醇的反应性进行调节,常用的反应温度为60-100℃。
羧酸酯的合成方法还包括酰氯与醇的反应。
这种方法是羧酸与有机羰基化合物(如酰氯)反应生成羧酸酯。
反应条件一般是在氯化剂(如五氯化磷)的催化下进行,温度较低,常在0-5℃。
此外,羧酸酯还可以通过烷解反应得到。
烷解反应是羧酸酯和醇在碱催化下发生反应,生成对应的醇和碱盐。
烷解反应条件温和,常在室温下进行。
物化性质
羧酸酯具有一定的物化性质。
其中,熔点和沸点受羧酸和醇的结构和取代基的影响。
一般来说,羧酸酯的熔点和沸点都比相应的羧酸和醇低。
羧酸酯的溶解性与羧酸结构、醇结构、取代基以及溶剂的性质有关。
羧酸酯一般可溶于有机溶剂,如醚、酯类溶剂等。
但在水中溶解度较低。
羧酸酯具有较好的稳定性和化学惰性,不容易被水分和氧气分解。
这也是为什么羧酸酯常被用作有机合成中的中间体和溶剂的原因之一。
应用领域
羧酸酯是一类重要的有机化合物,在化学和工业应用中具有广泛的用途。
首先,羧酸酯是合成高分子聚合物的重要中间体。
通过聚合反应,羧酸酯可以得到聚酯类高分子材料。
这些高分子材料具有良好的机械性能、耐化学性和耐热性,被广泛用于工程塑料、纤维和薄膜等领域。
其次,羧酸酯也被广泛用作增塑剂和溶剂。
通过调整取代基的结构,可以得到具有不同性能的羧酸酯,如柔软度、耐热性和耐寒性等。
这些羧酸酯可以用于塑料制品、涂料、胶粘剂和油墨等领域。
另外,羧酸酯还有一些其他应用。
例如,某些羧酸酯具有抗菌、杀虫和抑制氧化等活性,被应用于医药和农药领域。
同时,羧酸酯也可以作为香精和香料的成分,为食品和化妆品增添特殊的气味和滋味。
结语
羧酸酯作为一类重要的有机化合物,具有丰富的结构和广泛的应用领域。
它们的合成方法多样,物化性质复杂,但在有机合成和工业应用中扮演着重要角色。
通过深入了解羧酸酯的结构和性质,可以更好地探索其潜力和应用前景,为科学研究和产业发展做出贡献。
