国家药监局批准通过GLP认证的机构名单
截止至2014年国内GLP认证实验室一览表(全)
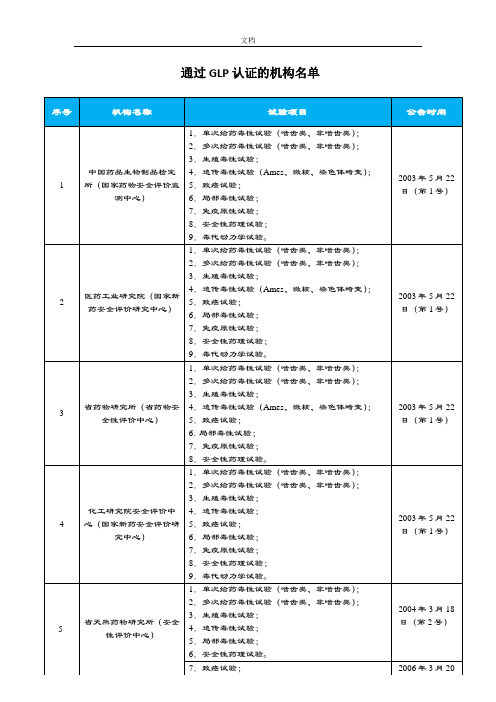
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
化工研究院安全评价中 4.遗传毒性试验;
4 心(国家新药安全评价研 5.致癌试验;
究中心)
6.局部毒性试验;
7.免疫原性试验;
8.安全性药理试验;
9.毒代动力学试验。
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
5
省天然药物研究所(安全 性评价中心)
3.生殖毒性试验; 4.遗传毒性试验; 5.局部毒性试验;
6.安全性药理试验。
7.致癌试验;
公告时间
2003 年 5 月 22 日(第 1 号)
2003 年 5 月 22 日(第 1 号)
2003 年 5 月 22 日(第 1 号)
2003 年 5 月 22 日(第 1 号)
文档
通过 GLP 认证的机构名单
序号
机构名称
试验项目
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
中国药品生物制品检定 4.遗传毒性试验(Ames、微核、染色体畸变);
1 所(国家药物安全评价监 5.致癌试验;
测中心)
6.局部毒性试验;
7.免疫原性试验;
8.安全性药理试验;
9.毒代动力学试验。
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
医药工业研究院(国家新 4.遗传毒性试验(Ames、微核、染色体畸变);
2
药安全评价研究中心) 5.致癌试验;
6.局部毒性试验;
7.免疫原性试验;
国家食品药品监督管理局公告2012年第37号――药品GLP认证公告(第27号)

国家食品药品监督管理局公告2012年第37号――药
品GLP认证公告(第27号)
文章属性
•【制定机关】国家食品药品监督管理总局(已撤销)
•【公布日期】2012.06.28
•【文号】国家食品药品监督管理局公告2012年第37号
•【施行日期】2012.06.28
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局公告
(2012年第37号)
药品GLP认证公告(第27号)
根据《中华人民共和国药品管理法》、《药物非临床研究质量管理规范》(GLP)和《药物非临床研究质量管理规范认证管理办法》的有关规定,国家食品药品监督管理局组织有关专家对成都华西海圻医药科技有限公司(国家成都中药安全性评价中心)等7家机构进行了检查。
经审核,该7家机构的单次和多次给药毒性试验(啮齿类)等试验项目符合GLP要求(见附件),特此公告。
附件:药品GLP认证目录
国家食品药品监督管理局
二○一二年六月二十八日附件:
药品GLP认证目录。
22家单位被确认为国家保健食品注册检验机构

22家单位被确认为国家保健食品注册检验机构中国质量新闻网消息国家食品药品监督管理总局办公厅8月5日发布通知,依据《保健食品注册检验机构遴选管理办法》及《保健食品注册检验机构遴选规范》等规定,遴选国家食品安全风险评估中心等22家单位为国家食品药品监督管理总局保健食品注册检验机构。
根据通知,注册检验机构名单包括:国家食品安全风险评估中心、中国检验检疫科学研究院综合检测中心、总后勤部卫生部药品仪器检验所、天津市疾病预防控制中心、辽宁省食品药品检验所、辽宁省疾病预防控制中心、上海市食品药品检验所、上海市疾病预防控制中心、江苏省食品药品检验所、江苏省疾病预防控制中心、安徽省食品药品检验所、福建省疾病预防控制中心、江西省食品药品检验所、江西省疾病预防控制中心、河南省食品药品检验所、湖北省食品药品监督检验研究院、湖北省疾病预防控制中心、湖南省食品药品检验研究院、湖南省疾病预防控制中心、湖南省职业病防治院、四川省食品药品检验所、四川省疾病预防控制中心22家单位为保健食品注册检验机构。
上述注册检验机构检验资质有效期为5年,各注册检验机构应在被确定的检验项目范围内,自2013年10月1 日起,按照保健食品注册检验机构有关规定开展国产和进口保健食品注册检验、复核检验工作,并出具检验报告。
保健食品注册检验机构编号及检验项目范围表编号检验机构名称注册检验项目范围011国家食品安全风险评估中心安全性毒理学试验、功能学动物试验(1.增强免疫力功能;2.辅助降血脂功能;3.辅助降血糖功能;4.抗氧化功能;5.辅助改善记忆功能;6.促进排铅功能;7.清咽功能;8.辅助降血压功能;9.改善睡眠功能;10.促进泌乳功能;11.缓解体力疲劳功能;12.提高缺氧耐受力功能;13.对辐射危害有辅助保护功能;14.减肥功能;15.改善生长发育功能;16.增加骨密度功能;17.改善营养性贫血功能;18.对化学性肝损伤有辅助保护功能;19.调节肠道菌群功能;20.促进消化功能;21.通便功能;22.对胃粘膜损伤有辅助保护功能)、功效成分或标志性成分检测、卫生学试验、稳定性试验、复核检验。
国家食品药品监督管理局公告2009年第36号――药品GLP认证公告(第20号)

国家食品药品监督管理局公告2009年第36号――药
品GLP认证公告(第20号)
文章属性
•【制定机关】国家食品药品监督管理总局(已撤销)
•【公布日期】2009.06.29
•【文号】国家食品药品监督管理局公告2009年第36号
•【施行日期】2009.06.29
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局公告
(2009年第36号)
药品GLP认证公告(第20号)
根据《中华人民共和国药品管理法》的有关规定,依据《药物非临床研究质量管理规范》(GLP)和《药物非临床研究质量管理规范认证管理办法》,国家食品药品监督管理局组织有关专家对苏州西山中科实验动物有限公司和重庆市中药研究院(重庆市药物安全评价中心)进行了检查。
经审核,以上2家机构的单次和多次给药毒性试验(非啮齿类)等试验项目基本符合GLP要求(见附件),特此公告。
附件:药品GLP认证目录
国家食品药品监督管理局
二○○九年六月二十九日附件:
药品GLP认证目录。
药物GLP认证概述

• 每天检查结束后,检查组汇总检查情况,必要 时与被检查机构沟通。
SFDA
CCD
现场检查(续)
• 现场检查结束后,召开由认证中心人员、检查 组成员、省级药品监督管理部门人员、省级卫 生主管部门人员等参加的会议,主要内容是: (1)情况汇总:检查组成员对所负责检查的 项目进行情况汇总,提出问题清单。
SFDA
CCD
药物GLP认证程序
•申 请
•SFDA受理 •SFDA-CCD
•资 料审 查
•检查 前准 备
•公 告
•现 场检 查
•撰写 审核
件
•SFDA注册司
SFDA
CCD 药物GLP认证检查程序
• 申请 • 受理 • 资料审查 • 现场检查 • 审核 • 公告
SFDA
CCD
申请与受理
• 申请 电子申请 书面申请
安全性评价技术审评一般原则 • ……
SFDA
CCD 药物非临床研究的监督管理
• 安全性评价研究中心 药物GLP中心认证 定期检查、整改检查
• 项目检查 药品注册现场核查 有因检查
• 日常监管
SFDA
CCD
GLP的适用范围
• 各国的GLP适用的范围不尽相同
• 美国FDA——色素和食品添加剂、饲料添加剂 、人用药品、兽用药品、生物制品、人用医疗 器具、电子产品等
化学药 :新药毒理学研究资料就有9项(资料1826),约占总数的1/3
中药 :新药毒理学研究资料就有7项 (资料2127),约占总数的1/4
药物GLP认证

现场检查(续)
末次会议 1、检查组召开由检查组成员、参加现场检查 的相关工作人员及被检查单位负责人和有关人 员参加的结束会议,通报检查情况。 2、被检查单位对所通报情况如有异议,可提 出意见或针对问题进行说明和解释。对有明显 争议的问题,必要时可进行重新核对。 3、如仍不能达成共识的问题,检查组应做好 记录,经检查组全体成员和被检查单位负责人 签字,双方各执一份。 4、对现场检查发现的问题,被检查机构十日 内向认证中心提交整改报告。
•资 料审 查
•检查 前准 备
•公 告
•现 场检 查
•撰写 审核
件
•SFDA注册司
药物GLP认证检查程序
申请 受理 资料审查 现场检查 审核 公告
申请与受理
申请 电子申请 书面申请
受理 国家局行政受理服务中心
资料审查
资料审查是对申请机构提供的各项申报资 料进行书面审阅并给出审查意见的过程。
26
化学药 :新药毒理学研究资料就有9项(资料1826),约占总数的1/3
中药 :新药毒理学研究资料就有7项 (资料2127),约占总数的1/4
治疗用生物制品 :新药毒理学研究资料就有10项 (资料18-28) ,约占总数的1/4
实施GLP的目的
GLP已成为国际上药物安全性试验研究共同遵 循的规范 世界各国的GLP虽然各有特点,但是基本原则 是一致的 1. 提高药品非临床研究的质量 2. 确保试验数据的真实性、完整性和可靠性 3. 最大限度地避免人为因素产生的错误和误差, 尽可能在试验早期发现并修正
SFDA药品认证管理中心
国家食品药品监督管理局药品认证 管理中心
办
信
检
检
检
公
息
查
国内GLP实验室清单(优选借鉴)
序号
机构名称
试验项目
认证批件编号
1
中国药品生物制品检定所
(国家药物安全评价监测中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2003年5月22日(第1号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
7.免疫原性试验;
8.安全性药理试验。
6
中国科学院上海药物研究所
(药物安全评价研究中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年8月3日(第3号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
5.致癌试验;
6.局部毒性试验;
7.免疫原性试验;
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
5.致癌试验;
6.局部毒性试验;
7.免疫原性试验;
8.安全性药理试验。
11
北京协和建昊医药技术开发有限责任公司
(中国医学科学院中国协和医科大学新药安全评价研究中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年12月23日(第7号)
8.安全性药理试验;
9.毒代动力学试验。
7
广州市医药工业研究所
(新药安全评价研究重点实验室)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年9月6日(第4号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.局部毒性试验;
4.免疫原性试验;
5.安全性药理试验。
通过GLP认证实验室清单
通过GLP认证实验室清单1 中国药品生物制品检定所(国家药物安全评价监测中心)2 上海医药工业研究院(国家上海新药安全评价研究中心)3 江苏省药物研究所(江苏省药物安全性评价中心)4 沈阳化工研究院安全评价中心(国家沈阳新药安全评价研究中心)5 四川省天然药物研究所(安全性评价中心)6 中国科学院上海药物研究所(药物安全评价研究中心)7 广州市医药工业研究所(新药安全评价研究重点实验室)8 浙江省医学科学院(新药安全评价研究重点实验室)9 国家成都中药安全性评价中心10 北京协和建昊医药技术开发有限责任公司11 湖北省医药工业研究院有限公司(湖北省药物安全性评价中心)12 军事医学科学院毒物药物研究所(国家北京药物安全评价中心)13 山东大学(山东大学新药评价中心药物安全性评价实验室)14 北京昭衍新药研究中心15 云南省药物研究所(药物安全性评价中心)16 山东省医药工业研究所(药物安全性评价中心)17 中国辐射防护研究院(药物安全性评价中心)18 新疆维吾尔自治区维吾尔医研究所(药物安全性评价中心)19 四川抗菌素工业研究所有限公司(国药控股安全性评价研究中心)20上海中医药大学(药物安全评价研究中心)21 第二军医大学(药物安全性评价中心)22 湖北省预防医学科学院(食品药品安全性评价研究所)23 中国医学科学院实验动物研究所2(非啮齿类)24 天津药物研究院(天津市新药安全评价研究中心)25 广州中医药大学科技产业园有限公司(新南方药物安全性评价中心)26 辽宁省食品药品检验所(药物安全评价中心)27 北京市药品检验所(药物安全评价中心)28 青岛市药品检验所(新药安全评价中心)29 山东大学(新药评价中心药物安全性评价实验室)30上海市计划生育科学研究所(中国生育调节药物毒理检测中心)31 山东绿叶制药有限公司(山东绿叶药物安全评价中心)32 苏州西山中科实验动物有限公司(苏州药物安全性评价研究中心)33 重庆市中药研究院(重庆市药物安全评价中心)34 郑州大学(郑州大学药物安全性评价研究中心)35 上海市食品药品检验所(药物安全评价中心)36 海南海医药物安全性评价研究有限责任公司(海南医学院海南省药物安全性评价研究中心)37 海南省药品检验所(安全性评价研究中心)38 河北医科大学(新药安全评价研究中心)。
截止至2014年国内GLP认证实验室一览表(全)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
四川抗菌素工业研究所 4.遗传毒性试验(Ames、微核、染色体畸变); 20 有限公司 (国药控股安 5.致癌试验;
全性评价研究中心) 6.局部毒性试验;
2006 年 3 月 20 日(第 12 号)
7.免疫原性试验;
8.安全性药理试验;
9.毒代动力学试验。
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
沈阳化工研究院安全评 4.遗传毒性试验;
4 价中心(国家沈阳新药安 5.致癌试验;
全评价研究中心) 6.局部毒性试验;
7.免疫原性试验;
8.安全性药理试验;
9.毒代动力学试验。
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
2004 年 3 月 18 日(第 2 号) 2006 年 3 月 20
8. 免疫原性试验。
日(第 12 号)
1.单次和多次给药毒性试验(啮齿类);
2.生殖畸变); 4.局部毒性试验; 5.免疫原性试验;
2010 年 03 月 26 日(第 23 号) GLP10002016
6.安全性药理试验。
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变); 5.致癌试验; 6.局部毒性试验;
2004 年 8 月 3 日 (第 3 号)
7.免疫原性试验;
8.安全性药理试验;
中国科学院上海药物研 9.毒代动力学试验。
类);
3.生殖毒性试验(Ⅱ段);
2010 年 9 月 7 日
全国过GMP保健品企业名录
全国过GMP保健品企业名录随着人们对健康的重视,保健品市场也越来越火热。
然而,保健品市场的乱象也屡屡被曝出。
为了保障消费者的权益,国家对保健品进行了一系列的监管和管理,其中GMP认证就是其中之一。
本文将介绍全国过GMP保健品企业名录,以帮助大家了解GMP认证的重要性。
GMP是Good Manufacturing Practices的缩写,即良好的生产规范。
它是保障药品、医疗器械、保健食品等在生产、加工、储存过程中质量安全的最基本的规范之一,是保障消费者安全的关键。
在中国,关于GMP认证的标准主要有药品GMP、保健食品GMP、医疗器械GMP等,而在本文中,我们主要介绍保健食品GMP认证。
国家食品药品监督管理局是负责GMP认证的主管机构。
经过审核并符合标准的企业,将会获得GMP认证,并被列入国家发布的名录中。
对于消费者而言,购买这些企业生产的保健品将具有一定的安全性保障。
保健品企业通过GMP认证,必须遵守《保健食品GMP规范》和《保健食品生产质量管理规范指南》两个文件的要求,严格控制生产流程,确保每批产品符合标准。
全国过GMP保健品企业名录,是指经过国家食品药品监督管理局审核通过的保健品企业清单。
这些企业经过严格的筛选和审查,是保健品市场中具有一定规模、技术实力和诚信经营的企业。
在掌握这份名录后,消费者可以更加针对性地选择保健品,增强了对消费者的保障,支持了健康产业的健康发展。
保障消费者的权益,提升安全保障是保健品GMP认证的初衷。
相信随着政策的逐步完善和推广,越来越多的企业将会获得GMP认证并被纳入全国过GMP保健品企业名录中。
对于企业而言,获得GMP认证有助于提升企业的声誉和品牌形象,增加消费者的信任度;对于消费者来说,购买GMP认证企业的保健品,可以有效地保障自己的身体健康,减轻食品安全的后顾之忧。
总之,保障消费者健康,改善保健品行业乱象,是全社会共同的责任。
GMP认证作为保障消费者安全的重要标准之一,具有重要的意义,需要得到更加广泛的推广。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
17
山东省医药工业研究所(药物安全性评价中心)
1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);.局部毒性试验;3.免疫原性试验;4
.安全性药理试验5
2006年3月20日(第12号)
18
云南省药物研究所(药物安全性评价中心)
非啮齿类)1.单次给药毒性试验(啮齿类、;非啮齿类)2.多次给药毒性试验(啮齿类、
通过GLP认证的机构名单(国食药监安[2006]587号,2006.11.20)
序号
机构名称
试验项目
公告时间
1
中国药品生物制品(国家药物安检定所全评价监测中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);.致癌试验;5.局部毒性试验;6
.免疫原性试验;7
.安全性药理试验;8
9.毒代动力学试验。
号)1(第日22月5年2003
2
上海医药工业研究院(国家上海新药安全评价研究中心)
;非啮齿类)单次给药毒性试验(啮齿类、1.
;(啮齿类、非啮齿类)2.多次给药毒性试验
.生殖毒性试验;3
、微核、染色体畸4.遗传毒性试验(Ames变);.致癌试验;5.局部毒性试验;6
6
中国科学院上海药物研究所(药物安全评价研究中心)
;非啮齿类).1单次给药毒性试验(啮齿类、
;(啮齿类、非啮齿类)多次给药毒性试验2.
.生殖毒性试验;3
、微核、染色体畸Ames4.遗传毒性试验(变);.致癌试验;5.局部毒性试验;6
.免疫原性试验;7
.安全性药理试验;8
9.毒代动力学试验。
号)3日(第3月8年2004
.局部毒性试验;6
.免疫原性试验;7
8.安全性药理试验。
7200423月年12日(第号)
11
北京协和建昊医药技术开发有限责任公司(中国医学科学院中国协和医科大学新药安全评价研究中心)
;单次给药毒性试验1.(啮齿类、非啮齿类)
;(啮齿类、非啮齿类)多次给药毒性试验2..生殖毒性试验;3、微核、染色体畸Ames4.遗传毒性试验(变);.致癌试验;5.局部毒性试验;6.免疫原性试验;7
7
广州市医药工业研(新药安全评价究所研究重点实验室)
;(啮齿类、.1单次给药毒性试验非啮齿类);.2非啮齿类)多次给药毒性试验(啮齿类、.局部毒性试验;3.免疫原性试验;4
号)4日(第6月9年2004
5.安全性药理试验。
8
浙江省医学科学院(新药安全评价研究重点实验室)
1.单次给药毒性试验(啮齿类、非啮齿类);
.毒代动力学试验。9
号)1(第日22月5年2003
5
四川省天然药物研(安全性评价中究所心)
;非啮齿类).单次给药毒性试验(啮齿类、1
;非啮齿类)多次给药毒性试验(啮齿类、2.
.生殖毒性试验;3.遗传毒性试验;4.致癌试验;5局部毒性试验;6.
.免疫原性试验;7
8.安全性药理试验。
2日月年2004318(第号)12月32006年日(第20号)
.生殖毒性试验;3、微核、染色体畸.遗传毒性试验(Ames4变);.局部毒性试验;5
.免疫原性试验;6
7.安全性药理试验。
号)8(第日24月1年2005
13
军事医学科学院毒(国家物药物研究所北京药物安全评价中心)
非啮齿类)1.单次给药毒性试验(啮齿类、
;非啮齿类).多次给药毒性试验(啮齿类、2
.生殖毒性试验;3
、微核、染色体畸Ames4.遗传毒性试验(变);.致癌试验;5.局部毒性试验;6.免疫原性试验;7
.免疫原性试验;7
.安全性药理试验;8
.毒代动力学试验。9
号)1(第日22月5年2003
3
江苏省药物研究所(江苏省药物安全性评价中心)
;.非啮齿类)单次给药毒性试验(啮齿类、1
;(啮齿类、2.多次给药毒性试验非啮齿类)
.生殖毒性试验;3、微核、染色体畸Ames4.遗传毒性试验(变);.致癌试验;5
局部毒性试验;6.
.安全性药理试验;8
.依赖性试验;9 10.毒代动力学试验。
号)9日(第6月2年2005
14
(新药评价山东大学中心药物安全性评价实验室)
;(啮齿类、1.单次给药毒性试验非啮齿类)。非啮齿类)2.多次给药毒性试验(啮齿类、
号)10(第日6月2年2005
15
北京昭衍新药研究中心
非啮齿类).1单次给药毒性试验(啮齿类、
.局部毒性试验;6
.免疫原性试验;7
.安全性药理试验;8
.毒代动力学试验。9
号)6(第日9月12年2004
10
吉林天药科技药物安全评价有限公司
;(啮齿类、非啮齿类)1.单次给药毒性试验
;非啮齿类)2.多次给药毒性试验(啮齿类、
.生殖毒性试验;3
、微核、染色体畸.遗传毒性试验(Ames4变);.致癌试验;5
.安全性药理试验。8.
712年2004月日(第23号)
12
湖北省医药工业研究院有限公司(湖北省药物安全性评价中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
.局部毒性试验;5
.免疫原性试验;6
2.多次给药毒性试验(啮齿类);3.生殖毒性试验;4.遗传毒性试验;
.局部毒性试验;5
.免疫原性试验;6
.安全性药理试验。7
号)5日(第7月9年2004
9
国家成都中药安全性评价中心
;.1单次给药毒性试验(啮齿类、非啮齿类)
;2.多次给药毒性试验(啮齿类、非啮齿类)
.生殖毒性试验;3
、微核、染色体畸Ames4.遗传毒性试验(变);.致癌试验;5
.免疫原性试验;7
号)1(第日22月5年2003
8.安全性药理试验。
4
沈阳化工研究院安(国家沈全评价中心阳新药安全评价研究中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;4.遗传毒性试验;5.致癌试验;.局部毒性试验;6.免疫原性试验;7
.安全性药理试验;8
;(啮齿类、.多次给药毒性试验非啮齿类)2
Байду номын сангаас.生殖毒性试验;3
、微核、染色体畸.遗传毒性试验(4Ames变);.致癌试验;5
.局部毒性试验;6
.免疫原性试验;7
8.安全性药理试验。
号)11(第日5月7年2005
16
中国辐射防护研究(药物安全性评价院中心).
1.单次给药毒性试验(啮齿类);.多次给药毒性试验(啮齿类)。2
