化学官能团相互转换大全(part2)
有机合成中的官能团互变与官能团保护

有机合成中的官能团互变与官能团保护官能团互变和官能团保护是有机合成中常用的两种策略,用于在合成过程中对官能团进行转化或保护,以达到所需的目的。
本文将具体介绍官能团互变和官能团保护的原理和应用。
一、官能团互变官能团互变是指将一个官能团转化为另一个官能团,通常通过一系列的反应步骤实现。
这种方法在有机合成中广泛应用,可以有效地构建复杂有机分子。
下面以几种常见的官能团互变反应为例进行介绍。
1. 羰基互变反应羰基互变反应是一种常见的官能团互变方法,通常通过氧化、还原或加成等反应来实现。
例如,醛和酮可以通过还原反应互变,常用的还原剂有金属碱金属催化剂或氧化铝。
此外,也可以通过氧化反应将醇氧化为醛或酮。
2. 环化反应环化反应是官能团互变的重要手段之一,可以将直链分子转化为环状分子。
常见的环化反应有氧化环化和还原环化。
例如,氧化还原反应可以将烯烃转化为环烃,通常采用氢化反应或氧化反应。
3. 置换反应置换反应是官能团互变的一种常见方法,通过官能团之间的取代反应来实现。
例如,烷基取代反应可以将一个烷基官能团替换为另一个烷基官能团,常用的取代试剂有碱金属、烷基卤化物等。
二、官能团保护官能团保护是在有机合成中常用的一种策略,用于保护特定的官能团,以防止其在反应过程中发生不需要的反应。
在合成过程中,有时需要对某些官能团进行保护,以确保其他官能团能够正常进行反应。
下面以几种常见的官能团保护反应为例进行介绍。
1. 羟基保护反应羟基保护反应是一种常见的官能团保护方法,通常通过酯化或硅醚化反应来实现。
酯化反应将羟基转化为酯基,以保护羟基。
硅醚化反应则将羟基转化为硅醚基,以保护羟基。
这些保护基在需要时可以通过去保护反应去除。
2. 氨基保护反应氨基保护反应是一种常见的官能团保护方法,通常通过酰化或巯基化反应来实现。
酰化反应将氨基转化为酰基,以保护氨基。
巯基化反应则将氨基转化为巯基,以保护氨基。
这些保护基在需要时可以通过去保护反应去除。
有机化学中的碳氢键官能团转化方法

有机化学中的碳氢键官能团转化方法有机化学是研究碳基化合物的科学,其中碳氢键官能团的转化是有机合成中至关重要的一步。
官能团的转化可以改变分子的性质和功能,为有机化学研究和应用提供了广阔的空间。
本文将介绍有机化学中常用的碳氢键官能团转化方法。
一、氧化还原反应氧化还原反应是有机化学中常用的转化方法之一。
在碳氢键官能团的转化中,常用的氧化剂包括酸性高锰酸钾、过氧化苯甲酸等;常用的还原剂包括亚铁氯化物、氢气等。
例如,苯可以通过酸性高锰酸钾氧化为苯酚:C6H6 + KMnO4 + H2SO4 → C6H5OH + MnSO4 + H2O二、酸碱反应酸碱反应也是有机化学中常用的转化方法。
碳氢键上的氢原子可以被酸基或碱基取代,从而引入新的官能团。
例如,甲烷可以和氢氟酸反应生成氟甲烷:CH4 + HF → CH3F + H2O三、卤代反应卤代反应是将碳氢键官能团转化为卤素取代物的常用方法。
常用的卤化剂包括氯化亚铁、溴代甲烷等。
例如,乙烷可以通过氯化亚铁反应生成氯乙烷:C2H6 + FeCl2 → C2H5Cl + HCl四、还原反应还原反应是将碳氢键上的官能团还原成烷烃的方法。
常用的还原剂包括氢气和金属催化剂。
例如,乙醛可以通过氢气还原为乙烷:CH3CHO + H2 → CH3CH3 + H2O五、亲电取代反应亲电取代反应是将碳氢键上的氢原子被亲电试剂取代的常用方法。
常用的亲电试剂包括卤素、酸酐、酰卤等。
例如,甲烷可以被溴取代为溴甲烷:CH4 + Br2 → CH3Br + HBr六、核苷取代反应核苷取代反应是一类特殊的碳氢键官能团转化方法,常用于催化剂的存在下进行。
这种反应可以将一个核苷取代为另一个核苷,引入新的官能团。
例如,氯乙烷可以和氢氧化钾反应生成乙醇:C2H5Cl + KOH → C2H5OH + KCl总结:有机化学中的碳氢键官能团转化方法包括氧化还原反应、酸碱反应、卤代反应、还原反应、亲电取代反应和核苷取代反应。
官能团转化
acidic
C6H13
thioketal: inert to LAH; react with RaNi; smell terrible and stay long; discard shoses
neutral basic O Pd-C Ph HCO2NH4 Ph Ph
(3). Wolff-Kishner reduction:
1-a C-OH
(1). for 1', 2' alcohol:
C-H
O CH3 S Cl O
O RCH2 O S O O CH3 tosylate mesylate triflate toluenesulfonyl chloride (s) ~ $ 30 / Kg methanesulfonyy chloride (l) ~ $ 30 / Kg purification textbook dry pyridine: from CaH2 and distilled
C=O 5- a b c d e f g h i j k C=O C=S C=N-OH, C=N-H C C C N C=C-OR; C=C-SR C(OR)2; C(SR)2 C-OH C-NH2; C-NO2 C-Br C-H
2- a C-OH b C-(OR)2 c C(O)OR d C-H e C=C f C-CN
(1). RCH2NH2
C-H
p-TsCl BuLi LiAlH4 RCH2-H
ArSO2Cl RCH2NH2 Hinsberg's test
O
RCH2NH
SO2Ar
BuLi - BuH N SO2Ar
RCH2N SO2Ar
tosylamide RCH2
最全官能团转换

1-a C-OH
(1). for 1', 2' alcohol:
C-H
O CH3 S Cl O
O RCH2 O S O O CH3 tosylate mesylate triflate toluenesulfonyl chloride (s) ~ $ 30 / Kg methanesulfonyy chloride (l) ~ $ 30 / Kg purification textbook dry pyridine: from CaH2 and distilled
Functional Group Interconversion
C-H 1- a b c d e f g h i j C C 6- a b c d e f g h i RC CH RCH2-SO2Ph C C C=C RCH(CO2H)-CH3 -C(O)-CH3
O X O O
C-OR C-OH C-X C-NH2 C-S C=O C=C C-CN C-CO2H C-CHO C(O)X C=C 7- a CH-CX b CH-CH c CX-CY
(4). RCH2NH2
RCH2NMe3 X
-
Ag2O
RCH2NMe3 OH-
R=CH2
R-CH3
1-d
C-S
C-H
radical mechanism
EtO2C HN MeO2C S N O
JOC, 1985, 50, 427.
EtO2C CH2Ph
Raney Nickel: Ni - Al alloy, suspension
iii NaBH3CN
NaBH3CN: stable at pH 5-6 JOC, 1976, 41, 3064. Br
官能团相互转换大全(part1)

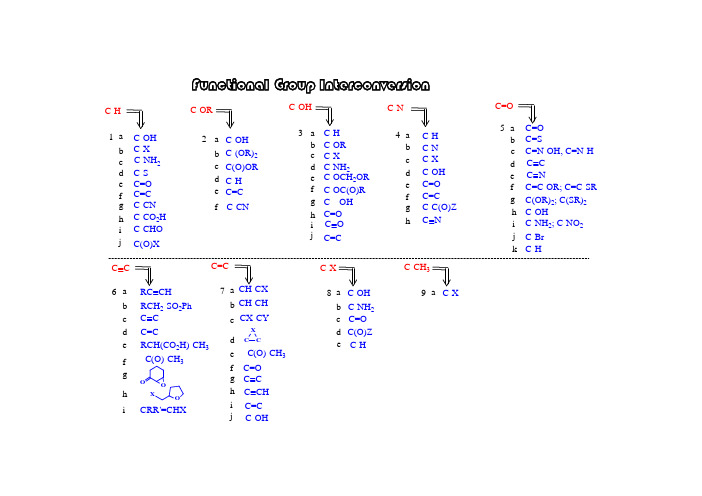
i 5-7-g f e d c b a e d c b a i h g f ed c ba h g f e d cb a h g f e dc b a 6-4-3-1-2-i h g f ed c b a C=C -C(O)-CH 3CH-CH CH-CX F u n c t i o n a l G r o u p I n t e r c o n v e r s i o nC=CC C C=CC C RCH 2-SO 2Ph RC CHC C C-NH 2; C-NO 2C-OHC(OR)2; C(SR)2C=C-OR; C=C-SR C C C NC=N-OH, C=N-H C=SC=O C=O C-C(O)Z C=C C=O C-OH C-X C-N C-H C-N C=O C---OH C-OC(O)R C-X C-OCH 2OR C-NH 2C-OR C-H C-OH C=C C-H C(O)OR C-(OR)2C-OH C-ORC-CHO C-CO 2H C-CN C=C C=O C-S C-X C-OH C-H C=C j C(O)XhC Nj kC-HC-Br 8-C-Xi C-OHC-OH C(O)Z d c b a e d c b a f C-NH 2C-Hj CX-CYC CXC=O h g f iC CH RCH(CO 2H)-CH 3-C(O)-CH 3O OOXCRR'=CHXjC O C-NH 2C-CN9-C-CH 3C-Xa e C=O1-adry pyridine: from CaH 2 and distilledtriflatemesylate tosylate S O O O RCH 2CF 3S OO O RCH 2CH 3CH 3CH 3CH 3OH (2). for 3' alcohol:LiAlH 4(1). for 1', 2' alcohol:1-i h g f e dc b a C-CHO C-CO 2HC-CN C=C C=O C-SC-NH 2C-X C-OH C-H CH 3CH3CH 3H n -Bu SnH C S O PhClRCH 2-HCH 3SOO O RCH 2CH 3S OOCl RCH 2OHpurification textbook~ $ 30 / Kg toluenesulfonyl chloride (s)methanesulfonyy chloride (l)~ $ 30 / Kg jC(O)XPh 2SiHCl / InCl 3PhPhPhPhJOC, 2001, 66, 7741.ii. Ph 2SiHCl / InCl 3i. p -TsCl // LiAlH 4i. ClC(S)OPh // n -Bu 3SnH Cl 2via:a unique Lewis acid catalyst, acceleratedeoxgyenationInCl 3indium trichlorideii. Et 3SiH / Lewis acidJ. Org. Chem. 2000, 65, 6179JOC, 2000, 65, 6179.CHCl 2rt, 3 hr1-bBu 3SnH: (l), easy to remove Ph 3SnH: (s), hard to remove Me 3SnH: too volatile, toxicunstable in acid, form H 2 gas; stable in weak baseNaBH 3CN: stable at pH 5-6hygroscopic, dried self, suggest: buy small amount each time(Grignard reagent)H OJOC, 1969, 34, 3923.HBrNa / NH 3; Li / NH 3; Na / EtOH Zn; Fe; Sn; Mg(3). metal reduction(2). hydride reduction(1). free radical reductionJACS, 1972, 94, 8905.n -Bu 3SnH HBrNaBH 4 / InCl 3 / CH 3CNradical reagentn -Bu 3SnH / AlBN JA CS, 2002, 124, 906.i iii NaBH 3CNi LiAlH 4i ii ii NaBH 4ii THL, 1969, 3095.JOC, 1976, 41, 3064.iv LiBHEt 3 (super hydride)mechanism uncertain, probably radicalburn filter paper if dryRaney Nickel: Ni - Al alloy, suspensionJCS Perkin Trans I, 1973, 654.(3). L iAlH 4 / CuCl 2NaBH 4 / NiCl 2NaBHEt 3 / FeCl 2 (or CoCl 2, VCl 3)(2). Li / NH 3(1). Raney NiBuLi1-d1-c 4RCH 2-HRCH 2NH 2radical mechanismChemistry:R-SH R-S-R R 2SO R 2SO 2R-SS-Rremove: Hg +; Ni(1).(2).Ar-H2Ar-NH 2RCH 2NH 2RCH 2NMe 3R=CH 2R-CH 3(4).X-RCH 2NMe 3OH -2NaH 2(3).Ar-NH 2Ar-H1-e(2). thioketal:(3). Wolff-Kishner reduction:(6). enol derivatives:SHSH/ BFTf2similar:(4). Pd-C / HCO2NH4(7). Et3SiH / CF3COOH1-fb.p. ~ 230 Chighly toxic, cancer suspected agent?= HMPT: h exa m ethyl p hosphoric t riamide (Me 2N)3P=O 1-g (1). K / Al 2O 3 K / HMPA (2). Na / NH 31-h JOC, 1980, 45, 3227HMPA: h exa m ethyl p hosphor a mide (Me 2N)3P=O yes for white mouse, uncertain for humanmodified to: NN O1-i(1). RhCl(PPh 3)3 (Wilkinson's cat)(2). Rh(DPPD)2+ Cl -DPPD = Ph 2P-CH 2CH 2-PPh 21-jHSiEt 3 / B(C 6F 5)3activator / hydride sourceRCH 2OROO RR OROR RCH 2 OCH 2CH 2OH(1). h ν / HSiCl 32-bN NH/ TBDMS-ClTBDPS-ClEt 3N / TMS-Clacid: H 2SO 4H 3PO 4BF 3-Et 2O RC-OCH 2CH=CH2RC-OCPh 3 = RC -OTr RC-O t Bu RC-OCH 3RC-OSiR 3RC-OCH 2Ph = RC-OBZl = RC-OBni. Willianson synthesis OK: Si - Cl bond longii. stability of silyl in acid/base: RC-O-TBDPS > RC-O-TBDMS >> RC-O-TBS iii. abbrev.: TBDMS = tert-butyl-dimethylsilyl = TBS =Silyl group:(RO-Tr)Trityl group: (tirphenylmethyl)i. S N 1 reactionii. abbreviation: triphenylmethyl = trityl = -CPh 3 = -Tr iii. advantage: high MW, easy to handle (small amount become large amount)baseBr Willianson synthesis (base, S N 2) not work: elimination side-product with base t -Butyl group:i. abbreviation: benzyl = PhCH 2 = Bzl = Bn ii. deprotecting: H 2 / Pd-CPhCH 2-ClPhCH 2-Br: reactivity goodPhCH 2-I: reactivity better than PhCH 2Br, generated in situ, PhCH 2Br + NaIPhCH 2-X: Benzyl- group:i. Williamson ether synthesis, S N 2 typeii. not a good protecting group, too stable to convert back to alcohol Me group:CH 3-X: CH 3I; CH 3OSO 2R; (CH 3)3O + BF 4-, (CH 3)2SO 4base: NaH, n -BuLi, Ag 2O(4). t -Bu: acid cat /(3). allyl: base /Br (6). silyl: Et 3N / R 3SiCl (5). trityl: py // Ph 3C-Br(2). PhCH 2-: base / PhCH 2-X e d cb a 2-RC=C RC-H RC(O)ORRC-(OR)2RC-OH RC-OR (1). Me: base / CH 3-X2-a (7). acetal / ketal: (see 3e)fRC-CNgenerate H 2, or butane gasJOC, 1988, 53, 2985.trimethyloxonium tetrafluoroborateJCS, 1930, 2166.(8). ArF / CsFROHradical mechanism: SiCl 3RaNi with C=S2-c2-d (1). hv / HSiCl 3(2). HCl / tBu-OO-t Bu(4). BF 3 / NaBH 42-eC-OH C-H C-OR C-NH 2C-X 3-a b c d3-a(1). [PhI(OAc)-O]2-Mn(TPP)(2). organic electrochemistry(3). X 2 / hv // OH -3-a.13-a.23-a.3(1) Me 3SiCl // MPCBA//H 3O +(2). O 2, LDA, (EtO)3PJA CS, 1975, 97, 6909.i h g f e C=O C---OH C-OC(O)RC-OCH 2OR C=Cj C O(1). Me: application: deprotecting (2). PhCH 2-(5). trityl:(6). silyl: (3). allyl: (4). t-Bu: RC-OCH 2RC-OSiR 3RC-OCH 3RC-OtBuRC-OCPh 3 = RC-OTr RC-OCH 2CH=CH 232Oi. HOAc: weak acid: good leaving groupii. H 2i. F - : HF, Py-H + F -; n -SiMe 3-SiBuMe 2-SiBuPh 2if HOBr: OK for TMDMSJOC, 1987, 52, 4973.OCOCF 3+3-b triphenylmethylorganic base: TMG3-c(1). O H -(2). K O 2 / D M S O 3-d not practically useful: R -O H cheaper than R -XJO C , 1975, 40, 1678.(2). N a 2[F e(C N )5(N O )] / K 2C O 3 / H 2O3-e(1). S ym m etry:ketal: use H 3O +acetal: use H 3O +(2). unsym etry:R O -M O M R O -M E M R O -M T M R O -T H Pi. H 3O +; ii. H C l / M eO H p -T sO H / M eO Hi. H 3O +; ii. Z nB r 2 / C H 2C l 2H gC l 2 / C H 3C N (aq.)actually, a c e t a l e x c h a n g e (3). A g 2O / H 2OT H L , 1975, 3183.JO C , 1986, 51, 3913.R O 2C(C H 2)3H RN H 2R O 2C(C H 2)3H RO H2323-f(1). base: KHCO 3 (or K 2CO 3, NH 3) / MeOH; NaOH (1 %, or 0.5 N)(3). RED: (2). acid: H 3O +PPh 3 / DEAD / RCO 2H // OH -3-gMitsunobu inversionSynthesis, 1981, 1.JOC, 1987, 52, 4235.common esters:formate = HCO 2R ------------------------ KHCO 3 (or K 2CO 3, or NH 3) / MeOH trifluoroacetate = CF 3CO 2R ------------ KHCO 3 (or K 2CO 3, or NH 3) / MeOHacetate = CH 3CO 2R = ROAc --------- KHCO 3 (or K 2CO 3, or NH 3) / MeOH benzoate = PhCO 2R = ROBz -------- NaOH (1 %) / MeOH pivalate = t Bu-CO 2R = ROPv ------ NaOH (0.5 N) / EtOH*HOi LiAlH 4ii. NaAlH 2(OCH 2CH 2OCH 3)CH 3O 2CCO 2CH 3HOOH3)266hydride:electron:Na / NH 3AGIEE, 2002, 41, 3028.。
有机官能团的转换-127页文档资料

实际上,纯粹SN2与SNl反应仅仅是亲核取代的两种 极限情况。大多数情况下,两种机理并存.并表现为竞
争反应。作用物结构、试剂以及反应条件将对反应产生 很大的影响。
作用物中心碳原子的空间效应对SN2反应影响很大。 中心碳上取代基增多,试剂进攻中心碳受阻,SN2反应
的相对速度便减小。不同结构的作用物进行SN2反应的 活性顺序是:
当取代芳烃再度发生取代时,环上巳存在的基团将
对新基进入芳坏的难易和位置产生很大的影响。这一现 象称为取代基的定位效应。一些基团使取代反应比苯更 易进行,而且将新基主要引入原有取代基的邻、对位, 这类基团称为邻对位定位基;另一类基团使芳环上的取 代比苯难于进行,新基主要进入其间位,称为间位定位 基。一般邻对位定位基对芳环的亲电取代起活化作用, 间位定位基起钝化作用。但卤原子例外,卤原子是吸电 子基因,它们的存在使苯环比较难于取代,但它们所具 有的未共用电于对与苯环组成P—共轭体系,使取代基 的邻、对位电子云密度比间位大一些,因而起邻、对定 位作用。
如果苯环上含有一个以上的取代基时,新基进入的
位置往往受定位效应最强的取代基支配。取代基定位效 应的相对强度同反应类型和反应条件有关,相同的基团
在不同的反应或不同的反应条件下,其相对活性往往有 所不同。根据单取代苯溴代的相对反应速度一些常见邻 对位定位基的定位效应的相对活性顺序为:
根据单取代苯硝化时,问硝基衍生物的产率,一些间位 定位基的相对强度如下顺序:
SN2 机理包括一个由作用物与试剂分子形成的过渡 态,反应按协同方式进行。即试剂从离去基团相反的方 向上进攻中心碳原于,试剂同中心碳之间键的形成,与
离去基团与中心碳之间键的断裂是同时进行的。在过渡 态中,进攻试剂、中心碳原子和离去基团大约处于同一 直线位置。而中心碳上的其余三个原子或基团则位于同 该直线垂直的平面上。这时,进攻试剂与离去基团分别 处于平面的两边。随着新键的逐渐形成,离去基团与中 心碳之间的键逐渐削弱,最后完全脱离中心碳,而完成 反应。
官能团化和官能团转换的基本反应

第二章 官能团化和官能团转换的基本反 应
25
(d)Reimer- Tiemann反应 将酚及其某些杂环化合物与NaOH溶液和过量的CHCl3一起加 热形成芳醛的反应称为Reimer- Tiemann反应。
OH NaOH/CHCl3/B-CD 60 C , 20min CHO
NEt2 + CHCl3 hv NEt2
Z= Hal, R'COO-; R'O- ; et.al.
酰氯为酰化剂, Lewis 酸用量需与酰氯等摩尔数,酸酐作酰化 剂,需用2摩尔以上Lewis 酸。
CH3 O CH3CH CHC Cl/AlCl3 3~4h OCH3 CH3 CH CH3 CH C OCH3 O AlCl3 AlCl3 O CH3 + O CH3 OH O 产物为混合物 CH3 CH3
(或 HBr
光照
链增长: CH3CH
CH2 + Br
CH3CHCH2Br CH3CH2CH2Br + Br
CH3CHCH2Br + HBr
链终止: (略)
第二章 官能团化和官能团转换的基本反 应 9
3. 双键的硼氢化及硼氢化-氧化,硼氢化-卤解反应 *硼氢化反应的机理
B2H 6 亲电加成 CH3CH CH2 + H BH2 - + B:电负性2.0 H:电负性2.2
+ CH3CH2
-
CH2 BH2 +
H
-
CH3CH2 H
CH2 CH3CH2CH2BH2 BH2
四中心过渡态
顺式加成
第二章 官能团化和官能团转换的基本反 应 10
* 硼氢化-氧化
1. B2H6 Et2O 2. H2O2, OH+
第二章 官能团化和官能团转化的基本反应

2 与卤化磷和亚硫酰氯反应
3ROH + PX3(P + X2) 3R-X + P(OH)3 X = Br 、 I ( 制备溴代或碘代烃) ROH + PCl5 ROH + SOCl2 R-Cl + POCl3 + HCl R-Cl + SO2 + HCl 制氯代烃
此反应产物纯净
3 与酸反应(成酯反应)
为什么简单杂环化合物的亲电取代反应一般发生在α位?
+
进攻2位
E X H E
+
E X E H X H
+ X
E H
X
+ E
+
进攻3位
H X
+
2、加成-加H2
X H2/Ni X X= O 、S、NH (THF是良好的溶剂,b.p65℃)
3、呋喃的共轭二烯性质 (吡咯、噻吩较难)呋喃芳香性最差
O
O 30℃
Br
Cl2
N H
-40℃
N H
Cl
Br2 S CH3COOH, 0 ℃ S Br
(2) 硝化
+ HNO3 N H (CH3COO)2O 5℃ N H 83% NO2 + NO2 N H 7%
(3)磺化:吡咯,呋喃对强酸敏感,需要较缓和的磺化剂, SO3-吡啶
SO3 C5H5N O O SO3H
活泼性:吡咯>呋喃>噻吩>苯
构效关系
1 烷烃的官能团化
结构特点: C:SP3杂化 正四面体 σ键
碳氢键极性较小
(特殊条件) 碳氢键断裂: 氢原子被取代
自由基机理:
Cl CH 3 33.5% 22% 28% 16.5% CH 3 CH 3 CH 3CHCH 2CH 3 Cl 2 光 CH 3-C-CH2CH 3 Cl CH 3CH CHCH 3 CH 3 Cl CH 3CHCH 2CH 2 CH 3 Cl CH 2-CHCH 2CH 3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
JA C S, 1972, 94, 7159.L A H ------------ alm ost all: ald, ketone, acie, ester, acyl X, anhydrideN aB H4 --------------- not for acid, ester (but L iB H4 w ork for ester)B2H6 --------------- not for ester, acyl X, anhydride;from top:L iA lH4; N aB H4; N a / N H3A l (O i Pr)3 / i PrO H ----------- M eerw ein-Pondorf-V erley rxnIrC l4 / i P rO H / P(O M e)3 ------ H enbest rxnL iB H(sec Bu)3 ------------------ H. C. B row nfrom bottom:(2). stereoselective:(1). regioselective:3-h(3). H C H O reagent:M e C H O M eO HH C H OJA C S, 1935, 511, 903.C H3C H O C(C H2O H)42O rg.Syn, 1925, 4, 53.H C H O / K O HH C H O / C a(O H)2S ynthesis, 1994, 1007.PhN O2OPhN O2H O HB H / SM eJO C, 2001, 66, 7514.JO C, 2003, 68, 2030.OB H3 / T H F99.5 % transsolvent: T H F, S M e23-iR3B, H O C H2C H2O H // H2O2 // N aO HJO C, 1986, 51, 4925.C O RRR3BRRRRR3C B OH O C H2C H2O HR3C BOOH2O2O HR3HO BOOR3CH2OR3C O Hp ra c tic e3-k OO HHO HO HOO HO HHO HO HJO C , 1967, 32, 3452.H 2O 2: dangerous,skin w hiten, m etal decom poseH g (O A c)2: toxic, hard to rem ove (3). B 2H 6, H 2O 2 / O H -, H 2O(2). H g(O A c)2, H 2O // N aB H 4(1). H 3O +3-j3-j.13-j.2hydration:(1). K M nO 4 / N aO H (2). O sO 4(3). H 2O 2/H C O 2H (4). N a / E tO HH Hcis tran cis +trancisM e 2NNNC H 3HC lH 3N C H 3H H N C H 3CH H+NC H 3C l N H H C H OCO O HA C H 21. L A H R 3C N H 2RCN R 2R C N H R R 3CO HR 2C O H R C O H R C N H 2tertiarysecondary prim ary C om pare nom enclature class:not a very useful reactionC -NC -H C -N C -X C -O H C =OC =C 4-abc d ef g 4-aSO 2N H 2Ph IO A c O A cS O ON H S OON I P h Fe (T PP )C lS O ON H 2(insertion)T P PN NNNP h2. N aN 3N C O1. SO 2C l 2O 2CCO O h iC N C (O )X C -C (O )XN H 2H 2R C N O 2R C N H 2i ii4-b C F 3C O 3H // F e / H O A c1. m an y red u cin g ag en ts4-b.14-b.21.2.3.4.F e 3(C O )12 / C H 3O HJO C , 1972, 37, 930.N aB H 4 / P d -C N a 2S S n / H C l V o g el's 12.57V o g el's 12.58V o g el's 12.595.H 2 / P t (S )-CJA C S , 1965, 87, 2767.su lfid ed p latiu mn o t affect: aro m atic rin g s, k eto n es, h alid es, n itriles, am id e, eastersJA CS, 1933, 55, 4579.2H CH O N M e 2CO 2EtN H 2CO 2EtRC N CC NRCCRC N H 2iC N R N N+-C N R R'ii 1. H CH O / H CO 2H 1. RBCl 2 / base1. H C(O Et)3 // N aBH 4;2. R 2CO // N aBH 3CN N H 2NCH 3CH 3H CH O H CO O HN 3N HBCl 2N H 2C O O HN CO O HHCH 3H C(O Et)N aBH 4b.3 2. H CH O // H 2 / Pd-CN 3N O 2M eO 2CN aBH 4CoCl 26H 2O (cat)rtN H 2N O 2M eO 2CSynthesis, 1979,537.m ild conditionhigh yieldnot affect:: N O 2, C=C, CN , CO O R, CO O H2. N aBH 4 / CoCl 2-6H 2Ono t g o od , u su ally co n tain p o lyalk ylatio n p ro d u cts2. D elep in e3. N aN 3 / R E D4-d4-c 5. U n p o lu n g4. N aN 3 / R E D3. D elep in e2. G ab riel:1. N H 3N OK N 2H 42Oi. L A H , N aB H 4ii. H 2 / catiii Z n / H C l; A l (H g )i. M g // N H 2C lii. M g // P h S C H 2-N 3co m m ercial av ailab le, tetram er o f M e 3N24. C B r 4, P P h 3, N aN 3, D M F // P P h 3 / T H FJO C , 2000, 65, 7110.u ro tro p in e (乌洛托品)m eth en am in e (六甲烯胺)h ex am eth ylen etetram in e (环六亚甲基四胺)内服后遇酸分解出 H C H O ,可做尿道消毒剂, 治膀胱炎B 2H 6 / H 2N O SO 3HB 2H 6 / H 2N OC H 3C N / H 3O +B 2H 6 / N H 2C l C =CC -C -N H C O C H 3C =C C -C -N H 24-f4-e5. P 4S 10 // R aN i4. E t 3O + B F 4- // N aB H 43. B 2H 62. N aB H 3(O C O R )1. L iA lH 46. L aw esson's reagent // R 4-h4-g4-g.a4-g.b RC N H 2R C N H 2R 'formformA lH 3 / T H FB rCNB r N H 2JO C , 2000, 65, 8152.A lH T H FT H , 1989, 30, 5137.JO C , 1987, 52, 3901.R 'L i // N aB H 4R 'M gX // N aB H 4R 'M gX // L i/N H 3(l)R '2C uL i // N aB H 4T H , 1989, 30, 5139.JO C , 1993, 58, 4313.RCNR CN H 2R 'R 'M // H4-iN H 2ON HO C H 3O PhI(O A c)23JO C , 1993, 58, 2478.RCON H 2RCONIPhO A c RNCOR N HCOO C H 3C H 3O HPhI, O A ccPhI(O A c)4-i.2CN H 2R C H 2PhI(O A c)2 // K O H / C H 3O HC(O R)2C(S R)2hC-N H2C-N O2C NC C5-agfdcba5-C=C-O RC=C-S RC-O HC=N-O HC=N-HC=SC=OC=Ov. via: epox ysilan eR COC RR COC H2R242H3O+C O2H3OOO2-4OO3H3O+Z nT sN H N H2M eL i T M S C l M C P B A L A H24C H2ORRC H2ORRaq C H3C N/C H2CORRi. via:α-C O2Hii. via: α-haloketon eiii. via: ald ol p ro cessiv. via: thioen ol etherROC H2Rd raw back: req uire sim ple stru cture, use m an y p ow erful ag ents: M eL i, L A H, M C P B Aeij C-B rk C-Hii. M C P B Ai. h yd ro lysis 5-b5-c C =N -O HC =N -Hi. R aN i ii. T iC l 3iii. K M n O 4 / A l 2O 3H 3O+5-dH g 2+ / H 2OJO C , 1972, 37, 2138.JO C , 1970, 35, 858.H g S O 4 / H 2O / H 2O5-c.15-c.2T H L , 2001, 42, 4775.1. D IB A L / H 3O +5-eS tenphen reductionm ostly forJ.O rg.S yn , 1925, 3, 1874.2. H C l./ S nC l 2 / E t 2O 5-e.1R -CH 2-CN5-e.25-e.3-C H 2-C OHR -C H -C OH R 'R -C H -C OR "R 'R 'X / n -B uL i C H 3I R ''M gB r H 3O+3.O HO HH 3O +O HO H5-fH 3O +H g 2+ / C H 3C N (aq)C =C -O RC =C -SRO C H 3OH 3O +SC H 3OH g 2+3H 3O H g2+3H 3O+OO O SSS S SR SR O O O R O R 5-gH g 2+/ H 3O+H 3O + / solv (aq)H 3O + / solv (aq)H g 2+ / H 3O +O R O RO H O HH 3O +/ solv (aq)acid catalysta very com m on protecting group, deprotect back to ketoneHCO E t O E tO E tR M gX / H 3O +HCO E t O E tO E tR M gXRCHO。
