大学化学电化学
大学电化学试题及答案

大学电化学试题及答案一、单项选择题(每题2分,共20分)1. 电化学中,原电池的工作原理是基于哪种效应?A. 光电效应B. 热电效应C. 电磁感应D. 化学能转化为电能答案:D2. 电化学腐蚀中,阳极材料发生的反应是:A. 氧化反应B. 还原反应C. 电离反应D. 聚合反应答案:A3. 电化学中,法拉第常数的单位是:A. 库仑B. 摩尔C. 伏特D. 安培答案:A4. 以下哪种电解质溶液的导电性最强?A. 稀硫酸B. 稀盐酸C. 稀硝酸D. 蒸馏水答案:A5. 在电化学中,电池的电动势(E)与电池反应的哪个参数成正比?A. 反应物的浓度B. 反应的熵变C. 反应的吉布斯自由能D. 反应的摩尔数答案:C6. 电化学中的Nernst方程描述的是:A. 电池的电动势与温度的关系B. 电池的电动势与反应物浓度的关系C. 电池的电动势与电流的关系D. 电池的电动势与电压的关系答案:B7. 电化学腐蚀中,阴极材料发生的反应是:A. 氧化反应B. 还原反应C. 电离反应D. 聚合反应答案:B8. 电化学中,电解液的pH值对电池性能的影响是:A. 无影响B. 影响电池的电动势C. 影响电池的电流D. 影响电池的寿命答案:B9. 电化学腐蚀中,金属的腐蚀速率与金属的哪种性质有关?A. 硬度B. 密度C. 电导率D. 电化学活性答案:D10. 电化学中,电池的内阻与电池的哪个参数有关?A. 电池的电动势B. 电池的电流C. 电池的电压D. 电池的电解质答案:D二、填空题(每题2分,共20分)1. 电化学腐蚀中,金属的腐蚀速率与金属的______有关。
答案:电化学活性2. 电化学腐蚀中,阳极材料发生______反应。
答案:氧化3. 电化学中,法拉第常数的单位是______。
答案:库仑4. 电化学中,电解液的pH值影响电池的______。
答案:电动势5. 电化学中,电池的电动势(E)与电池反应的______成正比。
答案:吉布斯自由能6. 电化学中,Nernst方程描述的是电池的电动势与______的关系。
大学化学-第4章-电化学原理及应用
氧化剂与还原剂在反应中的变化规律
氧化剂 得电子 还原剂 失电子
氧化数降低 具有氧化性 使还原剂氧化
本身被还原
氧化数升高 具有还原性 使氧化剂还原
本身被氧化
+1 +2 -1 +3 NaClO + 2FeSO4 + H2SO4 = NaCl + Fe2(SO4)3 + H2O
氧化剂 还原剂 还原产物 氧化产物
第 章 电化学原理及应用
4
4.2 原电池与电极电势
氧化-还原电极 电极
Fe3+(c1), Fe2+(c2) | Pt Cu2+(c1), Cu+(c2) | Pt
电极反应
Fe3+(c1) + e- →Fe2+(c2) Cu2+(c1) + e- →Cu+(c2)
Sn4+(c1), Sn2+(c2) | Pt
第 章 电化学原理及应用
4
4.2 原电池与电极电势
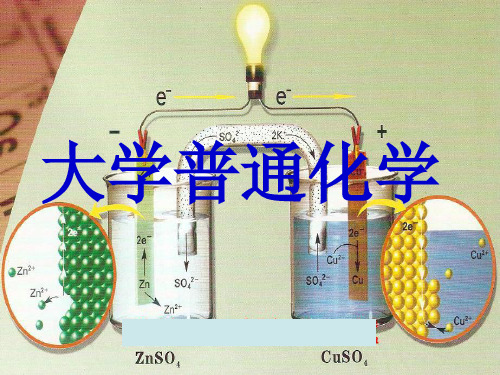
工作原理:Zn比Cu活泼,Zn原子失去电子被氧 化成 Zn2+进入ZnSO4 溶液;电子沿导线流向Cu片,
CuSO4 溶液中的Cu2+ 从 Cu片上获得电子还原成Cu
原子沉积在Cu片上。外电路上电子的定向流动产生 了电流 , 所以指针偏转,原电池对外做了电功。
氧化还原反应 直观的认识(20世纪):氧化数变化 2e如:电子得失: Zn + Cu2+ 电子偏移: 2H2 + O2 氧化数变化: Zn + Cu2+
0 +2 0 0
本质的认识(19世纪):电子得失或偏移
Zn2+ + Cu 2H2O
大学电化学教案设计模板

教学目标:1. 让学生掌握电化学的基本概念、原理和应用;2. 培养学生分析问题和解决问题的能力;3. 提高学生的实验操作技能和科学素养。
教学重点:1. 电化学基本概念;2. 电化学原理;3. 电化学应用。
教学难点:1. 电化学原理的理解;2. 电化学实验操作。
教学过程:一、导入1. 引导学生回顾电化学的基本概念,如氧化还原反应、电极、电解质等;2. 通过生活中的实例,激发学生对电化学的兴趣。
二、讲授新课1. 电化学基本概念:- 氧化还原反应:介绍氧化还原反应的基本概念,包括氧化剂、还原剂、氧化产物、还原产物等;- 电极:介绍电极的种类、作用和分类;- 电解质:介绍电解质的性质、分类和导电原理。
2. 电化学原理:- 介绍电化学电池的工作原理,如原电池、电解池等;- 介绍电化学方程式的书写方法;- 介绍电化学势、电极电势、电池电动势等概念。
3. 电化学应用:- 介绍电化学在能源、材料、环境等领域的应用;- 举例说明电化学在实际生活中的应用,如电池、电解、电镀等。
三、实验操作1. 介绍电化学实验的基本操作步骤;2. 指导学生进行电化学实验,如原电池、电解池等实验;3. 分析实验数据,验证电化学原理。
四、课堂小结1. 总结电化学的基本概念、原理和应用;2. 强调电化学在科学研究和实际生活中的重要性;3. 鼓励学生课后查阅资料,深入了解电化学。
五、作业布置1. 完成课后习题,巩固所学知识;2. 查阅资料,了解电化学在某一领域的应用。
教学反思:1. 教学过程中,注重理论与实践相结合,提高学生的实际操作能力;2. 针对教学难点,采用多种教学方法,如实例分析、实验演示等,帮助学生理解电化学原理;3. 鼓励学生积极参与课堂讨论,提高学生的思考能力和表达能力;4. 关注学生的学习反馈,及时调整教学策略,提高教学质量。
大学电化学试题及答案

大学电化学试题及答案一、选择题1. 电化学中的“电位”是指:A. 电压B. 电流C. 电极电位D. 电动势答案:C2. 原电池中,正极发生的反应是:A. 氧化反应B. 还原反应C. 电解反应D. 电离反应答案:B3. 根据电化学理论,下列哪种物质不能作为电解质:A. 氯化钠B. 硫酸C. 氢氧化钠D. 二氧化碳答案:D二、填空题1. 电化学腐蚀的两种主要类型是______和______。
答案:氧化还原腐蚀;电偶腐蚀2. 电化学中,电极电位的单位是______。
答案:伏特(V)三、简答题1. 什么是法拉第定律?请简要说明其内容。
答案:法拉第定律是电化学中描述电流通过电解质时,物质转移量与通过的电荷量之间关系的定律。
它表明,在电化学反应中,物质的转移量与通过的电荷量成正比,比例系数为法拉第常数。
2. 什么是电化学工作站?它在电化学研究中有何作用?答案:电化学工作站是一种用于电化学实验的设备,它可以控制和测量电化学过程中的电流、电压等参数。
在电化学研究中,电化学工作站用于研究电极反应的动力学特性、电位-电流曲线、电化学阻抗谱等,是电化学分析和研究的重要工具。
四、计算题1. 假设一个原电池的电动势为1.05V,通过该电池的电流为0.5A,求该电池在10分钟内能产生多少焦耳的能量?答案:首先计算电池在10分钟内通过的总电荷量,Q = It = 0.5A × 600s = 300C。
然后根据能量公式E = VQ,计算得到能量E =1.05V × 300C = 315J。
五、论述题1. 论述电化学在能源存储和转换中的应用,并举例说明。
答案:电化学在能源存储和转换领域有着广泛的应用。
例如,在电池技术中,电化学过程用于将化学能转换为电能,或者反之。
锂离子电池就是一种常见的电化学储能设备,它通过锂离子在正负极之间的移动来存储和释放能量。
燃料电池则是另一种电化学能源转换设备,它通过氢气和氧气的电化学反应产生电能,同时生成水,是一种清洁高效的能源转换方式。
大学无机化学-第七章-氧化还原反应-电化学基础-课件

种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
电化学教学实验心得体会

作为一名大学生,我有幸参加了电化学教学实验课程,这是一门理论与实践相结合的课程。
通过这次实验,我对电化学有了更深入的了解,也收获了许多宝贵的经验和体会。
一、实验背景电化学是一门研究电与化学之间相互作用的学科,它在能源、环保、材料等领域有着广泛的应用。
电化学教学实验课程旨在让学生通过实验,掌握电化学的基本原理、实验技能和方法,培养实际操作能力和创新意识。
二、实验过程本次实验主要包括以下内容:1. 电化学基本原理实验:通过观察电极反应、电解质溶液的导电性、电极电势等实验现象,加深对电化学基本原理的理解。
2. 电解质溶液导电性实验:通过测量不同浓度电解质溶液的导电性,分析电解质浓度与导电性之间的关系。
3. 电极电势实验:通过测定标准电极电势、氧化还原反应的平衡常数,验证电化学基本原理。
4. 电解实验:通过电解水、电解铜盐溶液等实验,观察电解过程,分析电解产物的性质。
5. 原电池实验:通过设计、组装原电池,观察电池的工作原理和性能。
三、实验心得1. 理论与实践相结合:电化学教学实验课程让我深刻体会到理论与实践相结合的重要性。
通过实验,我不仅巩固了电化学理论知识,还掌握了实验操作技能,提高了动手能力。
2. 培养实验思维:在实验过程中,我学会了如何观察实验现象、分析实验数据、提出问题、解决问题。
这种实验思维对于我今后的学习和工作具有重要意义。
3. 培养创新意识:实验过程中,我尝试了不同的实验方案,对实验结果进行了分析和讨论,提出了一些改进建议。
这让我认识到创新意识的重要性,激发了我探索未知的热情。
4. 培养团队协作精神:实验过程中,我与同学们分工合作,共同完成实验任务。
这使我体会到团队协作精神的重要性,学会了与他人沟通、协调、合作。
5. 培养严谨的科学态度:实验过程中,我遵循实验规范,严谨对待每一个实验步骤,确保实验结果的准确性。
这使我认识到严谨的科学态度对于科研工作的重要性。
四、实验总结通过电化学教学实验,我收获颇丰。
大学电化学教案设计
课时:2课时教学目标:1. 让学生了解电化学的基本概念、基本原理和基本规律。
2. 培养学生运用电化学原理分析和解决实际问题的能力。
3. 培养学生的实验操作技能和科学思维方法。
教学重点:1. 电化学基本概念、基本原理和基本规律。
2. 电化学实验操作技能。
教学难点:1. 电化学基本概念的理解和应用。
2. 电化学实验操作的正确性和准确性。
教学内容:一、电化学基本概念1. 电化学的定义及发展简史2. 电化学中的基本概念:氧化还原反应、电极、电解质、电池等3. 电化学中的基本定律:法拉第定律、欧姆定律等二、电化学基本原理1. 电池的工作原理2. 电解质溶液中的离子迁移3. 电极反应及其影响因素4. 电化学势和电极电势三、电化学实验操作技能1. 电池的制作与测试2. 电解质溶液的配制与测试3. 电极反应的观察与测量教学过程:第一课时:一、导入1. 引导学生回顾化学反应的基本概念,引入电化学的概念。
2. 提问:什么是电化学?电化学有哪些应用?二、新课讲解1. 讲解电化学的基本概念、基本原理和基本规律。
2. 通过实例讲解电池的工作原理、电解质溶液中的离子迁移、电极反应及其影响因素、电化学势和电极电势。
三、课堂练习1. 学生分组讨论,解答以下问题:a. 电池的工作原理是什么?b. 电解质溶液中的离子迁移有何特点?c. 影响电极反应的因素有哪些?d. 如何计算电极电势?四、总结与布置作业1. 总结本节课的主要内容,强调重点和难点。
2. 布置作业:阅读教材相关内容,完成课后习题。
第二课时:一、复习导入1. 复习上节课的主要内容,提问学生掌握情况。
2. 引导学生思考电化学实验操作的重要性。
二、电化学实验操作技能讲解1. 讲解电池的制作与测试、电解质溶液的配制与测试、电极反应的观察与测量等实验操作技能。
2. 通过视频或实物展示实验操作步骤,让学生了解实验操作的要点。
三、课堂练习1. 学生分组进行实验操作练习,教师巡视指导。
大学化学电化学思政教案
标题:大学化学电化学课程思政教学设计一、教学背景电化学是大学化学课程中的一门重要分支,它研究电化学反应的基本规律和电化学装置的性质。
在当今社会,电化学应用广泛,如能源转换与储存、腐蚀与防护、电化学分析等。
为了提高学生的科学素养,培养他们的创新能力和环保意识,我们将思政教育融入电化学课程教学,以期达到知识传授与价值引领的有机结合。
二、教学目标1. 知识与技能目标:使学生掌握电化学的基本概念、原理和方法,能够运用电化学知识分析实际问题。
2. 过程与方法目标:通过实验和案例分析,培养学生的动手能力、观察能力和问题解决能力。
3. 情感态度与价值观目标:培养学生对科学的热爱和敬业精神,提高他们的环保意识和社会责任感。
三、教学内容与思政要素1. 电化学基本概念:介绍电化学的定义、发展历程和电化学研究的对象,强调科学发展的连续性和创新精神。
2. 电解质溶液:讲解电解质的电离、离子浓度和电解质溶液的导电性,引入环保意识,如废水电解质的处理和回收。
3. 电极过程:分析电极反应的类型和动力学,结合案例介绍电极过程在能源转换和腐蚀防护中的应用,强调安全意识。
4. 电化学装置:介绍电化学电池、电解池和电容器等装置的工作原理和应用,展示电化学技术在新能源和环保领域的贡献。
5. 电化学分析:讲解电化学分析方法的基本原理和应用,如滴定、极谱和电化学传感器等,强调电化学分析在水质监测和环境检测中的重要性。
四、教学方法与手段1. 讲授与互动:采用启发式教学,引导学生思考和讨论,提高他们的科学素养。
2. 实验与实践:组织学生进行电化学实验,培养他们的动手能力和实验技能。
3. 案例分析:选取与电化学相关的环保、安全案例,引导学生运用所学知识分析和解决问题。
4. 多媒体教学:利用PPT、视频等手段,丰富教学手段,提高学生的学习兴趣。
五、教学评价1. 平时成绩:考察学生的课堂表现、作业完成情况和实验报告等。
2. 考试成绩:通过期末考试,检验学生对电化学知识的掌握程度。
大学普通化学电化学教案
课时安排:2课时教学目标:1. 理解电化学的基本概念和原理。
2. 掌握原电池和电解池的工作原理和特点。
3. 学会原电池和电解池的电极反应式书写方法。
4. 理解电化学在生产和生活中的应用。
教学内容:一、电化学基本概念和原理1. 电化学的定义和分类2. 电荷、电流和电势的基本概念3. 电化学方程式和电化学平衡二、原电池1. 原电池的工作原理和特点2. 原电池的组成和电极反应3. 原电池的电动势和电极电势4. 原电池的实验操作和计算三、电解池1. 电解池的工作原理和特点2. 电解池的组成和电极反应3. 电解池的电流和电压4. 电解池的实验操作和计算四、电化学在生产和生活中的应用1. 电解水制氢2. 铝的电解提取3. 铅酸电池4. 镍氢电池教学重点与难点:重点:1. 原电池和电解池的工作原理和特点2. 原电池和电解池的电极反应式书写方法3. 电化学在生产和生活中的应用难点:1. 原电池和电解池的电极反应式书写方法2. 电化学在生产和生活中的应用教学过程:一、导入1. 提问:什么是电化学?电化学有什么应用?2. 引导学生思考电化学的基本概念和原理。
二、电化学基本概念和原理1. 讲解电荷、电流和电势的基本概念2. 介绍电化学方程式和电化学平衡三、原电池1. 讲解原电池的工作原理和特点2. 讲解原电池的组成和电极反应3. 讲解原电池的电动势和电极电势4. 实验操作:原电池的制作和测量5. 计算练习:计算原电池的电动势四、电解池1. 讲解电解池的工作原理和特点2. 讲解电解池的组成和电极反应3. 讲解电解池的电流和电压4. 实验操作:电解池的制作和测量5. 计算练习:计算电解池的电流和电压五、电化学在生产和生活中的应用1. 介绍电解水制氢、铝的电解提取、铅酸电池、镍氢电池等应用2. 讨论电化学在生产和生活中的重要意义六、总结与作业1. 总结本节课的主要内容2. 布置作业:阅读教材相关内容,完成课后习题教学评价:1. 学生对电化学基本概念和原理的理解程度2. 学生对原电池和电解池的电极反应式书写方法的掌握程度3. 学生对电化学在生产和生活中的应用的认识程度。
大学化学第4章 电化学原理及应用
4
Ⅱ条件
任何自发进行的氧化还原(oxidation-reduction) 反应,只要设计适当,都可以设计成原电池用 以产生电流。
Ⅲ构成
将Zn浸入CuSO4溶液中 (△rGm =-271kJ/mol<0)。 可知反应能够自发发生,但不能形成电流。 原因:设计不合理。 但如果设计合理可以形成电流,A.Volta电池
法拉第
(Michael Faraday 1791-1867)
英国物理学家、化学家,也是著名的自学成才的科学家。出生在一 个贫苦铁匠家庭。仅上过几年小学,13岁时便在一家书店里当学徒。 在 此读到许多科学书籍。在送报、装订等工作之余,自学化学和电 学,并动手做简单的实验,验证书上的内容。利用业余时间听自然 哲学讲演,因而受到了自然科学的基础教育。1813年3月由戴维举荐 到皇家研究所任实验室助手。这是法拉第一生的转折点,从此他踏 上了献身科学研究的道路。同年10月戴维到欧洲大陆作科学考察, 讲学,法拉第作为他的秘书、助手随同前往。历时一年半,先后经 过法国、瑞士、意大利、德国、比利时、荷兰等国,结识了安培、 盖.吕萨克等著名学者。沿途法拉第协助戴维做了许多化学实验,这 大大丰富了他的科学知识,增长了实验才干,为他后来开展独立的 科学研究奠定了基础。1824年1月当选皇家学会会员,1825年2月任 皇家研究所实验室主任,1833----1862任皇家研究所化学教授。1846 年荣获伦福德奖章和皇家勋章。1867年8月25日逝世。
5
eA -Zn +Cu
Zn2+ SO42-
KCl饱 和溶液 胶冻
Cu2+ SO42-
铜-锌原电池
6
Ⅳ原电池的图示(cell diagram)表示 1负极(anode)写左边,正极(cathode)写右边;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Zn2+ (C) Zn(+) (-) Zn Zn2+ (C)
Zn2+ + 2e - Zn
气体分子同 相应离子间
同一元素 不同价态间
H+ / H2
H+ (C) H2 (P) Pt (+) (-) Pt H2 (P) H+ (C)
Fe3+ (C) ,Fe2+ (C) Pt(+) Fe3+/ Fe2+
(-) Pt Fe3+ (C) ,Fe2+ (C)
零。在多原子的离子中,所有元素氧化数的代 数和等于离子所带的电荷数。
应用举例 1、计算S4O62-中硫的氧化数。 解:设其中硫的氧化数是x, 则
4x + (-2) × 6= -2 , x = +5/2 氧化数不仅有正、负值,而且有分数。
氧化还原反应伴随着电子转移,所以反应前后元素的 氧化数会发生变化:
+
-
-
+
+-- +
+-- +
+
+
双电层 的电势差
电极电势
- ++ - ++ - ++ - ++ -
原电池电动势
E= 正- 负
a. 不同电极由于沉积和溶解速率不同,电极电势 也不同。
b. 电极电势与温度、浓度有关。 c. 电极电势反映物质在水溶液中得失电子的能力。
金属越活泼 , 失电子能力越强,电极电势越小。 金属越不活泼 , 失电子能力越弱,电极电势越大。
氧化数升高的过程叫氧化; 氧化数降低的过程叫还原。
5.2 原电池及原电池的电动势
原电池组成 电极电势 电动势与吉布斯函数变 能斯特方程 电极电势的应用
1. 原电池组成
Cu – Zn 原电池(丹尼尔电池)
Cu2+ (aq) + Zn (s)
Zn2+ (aq) + Cu(s)
△Gθ(298.15K) = - 212.55kJ·mol-1
第五章 氧化还原反应与 电化学
氧化还原反应
1、光合作用 2、制造印刷电路版
以上反应中,反应物间直接接触,电子的转移是无序 的,不会产生电流。 3、原电池
借助氧化还原反应直接产生电流。
Zn2+ SO42-
Cu2+ SO42-
(-) Zn | ZnSO42-(C) || CuSO42-(C) | Cu (+)
如 Zn2+ / Zn
Eθ= 0.7618V
Eθ= θ( H+ / H2 ) - θ(Zn 2+ / Zn) = 0.7618V θ( Zn2+ / Zn ) = - 0. 7618V
c. 参比电极
标准氢电极虽然具有准确度高等优点,但制备较 复杂,且易吸附其它杂质而中毒,失去活性,因此一 般不用。在实际应用中,经常用的参比电极是饱和甘 汞电极和银-氯化银电极。
b. 其它电对 θ的确定 (相对电极电势)
方法:将待测电极与标准氢电极组成 原电池
E θ = θ正- θ负
由于电极电势与温度、浓度有 关,所以采用标准态。
如 Cu2+ / Cu
Eθ= 0.3419V
Eθ= θ(Cu 2+ /Cu) - θ( H+ / H2 ) = 0.3419V θ( Cu2+ / Cu ) = 0.3419V
中性或弱碱性介质 θ( MnO4- / MnO2 ) = 0.588V
e- -
Zn
Cl-
ZnSO4
沟通回路
盐桥
+ e-
Cu
K+
CuSO4
饱和KCl溶液琼脂胶冻
原电池图示(符号)
( - ) Zn ZnSO4 (C1) CuSO4(C2) Cu ( + ) 电池反应
Cu2+ (aq) + Zn (s)
Zn2+ (aq) + Cu (s)
电极反应
阳极 ( - ) Zn (s)
Zn2+ (aq) + 2e- Zn(s) θ( Zn2+/Zn ) = - 0.7618V Zn(s) Zn2+ (aq) + 2e- θ( Zn2+/Zn ) = - 0.7618V
2) 电极反应同乘(除)以某数时,电极电势值不变
2Zn2+(aq) + 4e- 2Zn(s) θ( Zn2+/Zn ) = - 0.7618V
2H+ + 2e Fe3+ + e -
H2 Fe2+
金属同
Cl - (C) AgCl Ag (+)
金属难溶盐间
AgCl / Ag (-) Ag
AgCl
AgCl + e Cl - (C)
Cl - + Ag
2. 电极电势
1). 电极电势的产生
溶解
M (s) + m H2O( l ) 沉积 [M(H2O)m]n+ + ne -
3) 查阅时注意具体的电对形式
θ( Cu2+/Cu) θ( Cu2+/Cu+) θ( Cu+/Cu) θ( Hg2Cl2 / Hg)= 0.26808V θ( Hg22+ / Hg)= 0.851V
4) 同一氧化态,介质不同,还原产物有差异
酸性介质
θ( MnO4- / Mn2+ ) = 1.507V
Zn2+ (aq) + 2e- 氧化过程
阴极 ( + ) Cu2+ (aq) + 2e -
Cu (s) 还原过程
通式 a(氧化态)+ ne-
b(还原态)
氧化还原电对及其种类
电对: 氧化态/还原态 如 Zn2+/Zn Cu2+/Cu
种类 电对 电极符号 电极反应
金属同 金属离子间 Zn2+ / Zn
2). 电极电势的确定
无法测得 其绝对值
a. 标准氢电极 θ (H+/H2) = 0.0000V
标准氢电极符号
H + (1.0 mol / dm3) | H2 ( 100kPa ) | Pt (+)
电对符号
H+ / H2
T = 298.15 K Pθ= 100 kPa
H2 Pt
H2SO4
C( H+ ) = 1.0 mol / dm3
电化学
化学能
原电池 电解
电能
5.1 氧化数
一个原子在化合物状态时的形式电荷数为氧 化数。
1、单质: 0 2、 碱金属:+1 ; 碱土金属:+2 3、卤素:-1 4、氢:一般, +1 ;活泼金属氢化物中, -1 5、氧:一般, -2;过氧化氢中,-1;超氧化
氢中,-1/2, +2 6、在多原子分子中,各元素氧化数的代数和为
饱和甘汞电极
组 成:Hg、Hg2Cl2和饱和KCl溶液 电极符号:KCl(C)| Hg2Cl2|Hg|Pt 电极反应: Hg2Cl2(s)+2e- = 2Hg(l) + 2Cl-(aq)
298.15K时, θ( Hg2Cl2 / Hg ) = 0.2412V 二级标准电极
注意
1) 电极反应不管是氧化形式,还是还原形式, 其电极电势值不变。
