大学化学基础-刘静-第九章滴定分析法概论
合集下载
第九章 滴定分析法

2 2 3 3 2 3
湖 3 南 农 业 大 学 应 用 化 学 系
K a3 3.2 1012 107
不能被滴定
第九章 滴定分析方法
无 机 (2) 多元碱的滴定 及 多元碱的滴定与多元酸的滴定相似,滴定判据中的 Ka 分 析 换成 Kb 即可。 化 学 湖 南 农 业 大 学 应 用 化 学 系
例题2 Na 2CO3 的滴定
2 CO3 +H 2O=HCO3 +OH HCO3 +H 2O=H 2CO3 +OH
K b 1.8 104 1 K b2 2.38 108
第九章 滴定分析方法
无 机 及 分 析 化 学 湖 南 农 业 大 学 应 用 化 学 系
第九章 滴定分析方法
无 机 4 应用示例 及 分 (1) 混合碱的测定(双指示剂法) 析 a. Na2CO3 与 NaHCO3 混合碱的测定 化 学 HCl标液滴定 湖 南 Na2CO3 + NaHCO3 农 V1 0 业 大 酚酞终点 NaHCO3 NaHCO3 学 V1 V2-V1 应 用 甲基橙终点 H2O + CO2 化 学 系
20.00 19.98 pK a lg 0.1000 7.74 19.98
第九章 滴定分析方法
无 机 及 分 析 化 学
3 理论终点时 溶液为0.05mol L -1 NaAc c(OH- ) K b c(Ac ) mol L-1 5.6 1010 0.050 00 mol L-1 5.34 106 pH 14 pOH 8.72
湖 南 4 理论终点后 当加入VNaOH 20.02mL Er 0.1% 农 业 pH 9.70 大 学 可见,该滴定的滴定突跃范围 7.74~9.70,选择酚酞、 应 用 百里酚酞作指示剂 化 学 系
湖 3 南 农 业 大 学 应 用 化 学 系
K a3 3.2 1012 107
不能被滴定
第九章 滴定分析方法
无 机 (2) 多元碱的滴定 及 多元碱的滴定与多元酸的滴定相似,滴定判据中的 Ka 分 析 换成 Kb 即可。 化 学 湖 南 农 业 大 学 应 用 化 学 系
例题2 Na 2CO3 的滴定
2 CO3 +H 2O=HCO3 +OH HCO3 +H 2O=H 2CO3 +OH
K b 1.8 104 1 K b2 2.38 108
第九章 滴定分析方法
无 机 及 分 析 化 学 湖 南 农 业 大 学 应 用 化 学 系
第九章 滴定分析方法
无 机 4 应用示例 及 分 (1) 混合碱的测定(双指示剂法) 析 a. Na2CO3 与 NaHCO3 混合碱的测定 化 学 HCl标液滴定 湖 南 Na2CO3 + NaHCO3 农 V1 0 业 大 酚酞终点 NaHCO3 NaHCO3 学 V1 V2-V1 应 用 甲基橙终点 H2O + CO2 化 学 系
20.00 19.98 pK a lg 0.1000 7.74 19.98
第九章 滴定分析方法
无 机 及 分 析 化 学
3 理论终点时 溶液为0.05mol L -1 NaAc c(OH- ) K b c(Ac ) mol L-1 5.6 1010 0.050 00 mol L-1 5.34 106 pH 14 pOH 8.72
湖 南 4 理论终点后 当加入VNaOH 20.02mL Er 0.1% 农 业 pH 9.70 大 学 可见,该滴定的滴定突跃范围 7.74~9.70,选择酚酞、 应 用 百里酚酞作指示剂 化 学 系
滴定分析法概论
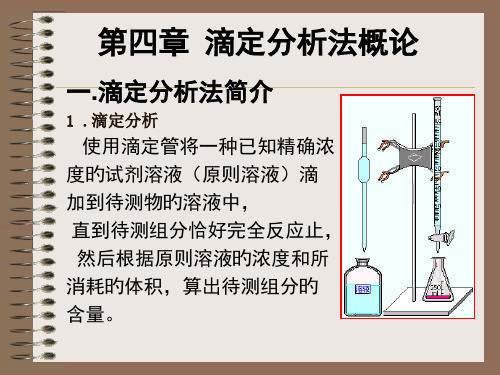
合用于反应较慢或难溶于水旳固体试样。
例:Al3+ +
一定过量EDTA标液 剩余EDTA Zn2+标液 EBT
返滴定
n(EDTA)总 - n(EDTA )过量 = n(Al)
( c ·V) (EDTA)总 - (c·V )(Zn) = (c·V )(Al)
例:固体CaCO3 + 一定过量HCl标液
mA 1000 MA
=CBVB
a b
mA VB
1000=CB
MA
a b
T
B/
A
=
CBMA 1000
a b
CB
=
TB/A 1000 MA
ba
例4 试计算0.02023mol/L K2Cr2O7溶液对Fe和 Fe2O3旳滴定度。
解:Cr2O72- + 6Fe2+ +14 H+ =2Cr3+ + 6Fe3+ +7H2O
剩余HCl标液 NaOH原则溶液
返滴定
例 : Cl- + 一定过量AgNO3 原则溶液 剩余AgNO3 原则溶 NH4SCN原则溶液 返滴定 Fe3+ 指示剂
淡红色[Fe(SCN)]2+
(3)间接滴定法 经过另外旳化学反应,以滴定法定量进行。 合用于不能与滴定剂起化学反应旳物质
例:Ca2+
CaC2O4沉淀 H2SO4
VT
VT单位为 L
mA
a t
CT
VT
M
A
/1000
注意:化学反应配平;单位换算 VT单位为 mL
例3 用Na2B4O7·10H2O标定HCl溶液旳浓 度,称取0.4806g硼砂,滴定至终点时消耗
例:Al3+ +
一定过量EDTA标液 剩余EDTA Zn2+标液 EBT
返滴定
n(EDTA)总 - n(EDTA )过量 = n(Al)
( c ·V) (EDTA)总 - (c·V )(Zn) = (c·V )(Al)
例:固体CaCO3 + 一定过量HCl标液
mA 1000 MA
=CBVB
a b
mA VB
1000=CB
MA
a b
T
B/
A
=
CBMA 1000
a b
CB
=
TB/A 1000 MA
ba
例4 试计算0.02023mol/L K2Cr2O7溶液对Fe和 Fe2O3旳滴定度。
解:Cr2O72- + 6Fe2+ +14 H+ =2Cr3+ + 6Fe3+ +7H2O
剩余HCl标液 NaOH原则溶液
返滴定
例 : Cl- + 一定过量AgNO3 原则溶液 剩余AgNO3 原则溶 NH4SCN原则溶液 返滴定 Fe3+ 指示剂
淡红色[Fe(SCN)]2+
(3)间接滴定法 经过另外旳化学反应,以滴定法定量进行。 合用于不能与滴定剂起化学反应旳物质
例:Ca2+
CaC2O4沉淀 H2SO4
VT
VT单位为 L
mA
a t
CT
VT
M
A
/1000
注意:化学反应配平;单位换算 VT单位为 mL
例3 用Na2B4O7·10H2O标定HCl溶液旳浓 度,称取0.4806g硼砂,滴定至终点时消耗
大学化学基础——刘静——第九章_滴定分析法概论

计量点之间的差别。
精选课件ppt
4
1.滴定方法介绍及分类
滴定分析法特点
• 简便、快速,适于常量分析(含量>1%) • 准确度高(相对误差 0.2%) • 应用广泛
精选课件ppt
5
1.滴定方法介绍及分类
按被测物与标准溶液的反应类型,可将滴定分 析法分为四类:
按反应类型分类
酸碱滴定法:酸碱中和反应; 配位滴定法:配位反应; 氧化还原滴定法:氧化还原反应; 沉淀滴定法:沉淀反应。
精选课件ppt
14
间接滴定法
例:Ca2+ 的测定
Ca2+
CaC2O4沉淀
H2SO4
KMnO4标液
C2O42-
间接测定
精选课件ppt
15
4.基准物及标准溶液的配制
4.1 概念 ➢ 标准溶液:浓度准确已知的溶液
➢ 基准物质:能用于直接配制或标定标准溶 液的物质
精选课件ppt
16
4.基准物及标准溶液的配制
4.2 对基准物质的要求:
a.试剂的组成与化学式完全相符 b.具有较大的摩尔质量 c.纯度高(含量≥99.9%) d.性质稳定
精选课件ppt
17
4.基准物及标准溶液的配制
4.3 标准溶液的配制方法
(1)直接配制法: 基准物质 称量 溶解 定量转移至 容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
注意:要“准确”地称取、转移。
精选课件ppt
18
4.基准物及标准溶液的配制
(2)间接配制法
标定法:利用基准物质确定溶液准确浓度。
比较法:用一种已知浓度的标液来确定另 一种溶液的浓度方法。
精选课件ppt
精选课件ppt
4
1.滴定方法介绍及分类
滴定分析法特点
• 简便、快速,适于常量分析(含量>1%) • 准确度高(相对误差 0.2%) • 应用广泛
精选课件ppt
5
1.滴定方法介绍及分类
按被测物与标准溶液的反应类型,可将滴定分 析法分为四类:
按反应类型分类
酸碱滴定法:酸碱中和反应; 配位滴定法:配位反应; 氧化还原滴定法:氧化还原反应; 沉淀滴定法:沉淀反应。
精选课件ppt
14
间接滴定法
例:Ca2+ 的测定
Ca2+
CaC2O4沉淀
H2SO4
KMnO4标液
C2O42-
间接测定
精选课件ppt
15
4.基准物及标准溶液的配制
4.1 概念 ➢ 标准溶液:浓度准确已知的溶液
➢ 基准物质:能用于直接配制或标定标准溶 液的物质
精选课件ppt
16
4.基准物及标准溶液的配制
4.2 对基准物质的要求:
a.试剂的组成与化学式完全相符 b.具有较大的摩尔质量 c.纯度高(含量≥99.9%) d.性质稳定
精选课件ppt
17
4.基准物及标准溶液的配制
4.3 标准溶液的配制方法
(1)直接配制法: 基准物质 称量 溶解 定量转移至 容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
注意:要“准确”地称取、转移。
精选课件ppt
18
4.基准物及标准溶液的配制
(2)间接配制法
标定法:利用基准物质确定溶液准确浓度。
比较法:用一种已知浓度的标液来确定另 一种溶液的浓度方法。
精选课件ppt
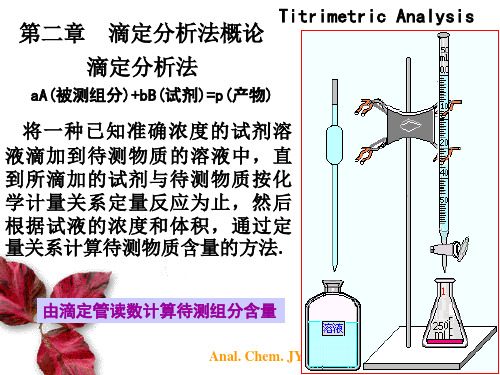
大学分析化学经典课件04-滴定分析概论

A%
TT A VT S
100%
0.0056 10 CaO% 100% 93.33% 0.06000
26
第四节
一、基本概念
滴定分析中的化学平衡
分析浓度是平衡体系中各种存在型体的平衡浓
度之和,以符号c表示,即该物质总的浓度。
平衡浓度是指平衡状态时溶液中溶质的各种型
体的浓度,用[ ]表示,溶质各型体浓度之和必等 于总浓度。
返滴定法(剩余滴定法) 置换滴定法 其他间接滴定法
5
返滴定法(剩余滴定法) 先准确加入过量标准溶液,使与试液中的待 测物质或固体试样进行反应,待反应完成以 后,再用另一种标准溶液滴定剩余的标准溶 液的方法 适用:反应较慢或难溶于水的固体试样
6
例1:Al3+ +定过量EDTA标液
剩余EDTA Zn2+标液
例6:测定药用Na2CO3的含量,称取试样0.1230 g,溶 解后用浓度为0.1006mol/L的HCl标准溶液滴定, 终点时消耗该HCl标液23.50 mL,求试样中Na2CO3 的百分含量。 解:
nNa2CO3 nHCl 1 2
a CT VT M A A% 100% t S 1000
概述
将一种已知准确浓度的试剂溶液-标准 溶液滴加到待测物质的溶液中,直到 所滴加的试剂与待测物质按化学计量 关系定量反应为止,然后根据标准溶 液的浓度和体积,通过定量关系计算 待测物质含量的方法。
2
基本术语:
滴定:将滴定剂通过滴定管滴入待测液中的过程
滴定剂:浓度准确已知的试样溶液
指示剂:滴定分析中能发生颜色改变而指示 终点的试剂 滴定终点(ep):滴定分析中指示剂发生颜色 改变的那一点(实际) 化学计量点(sp):滴定剂与待测溶液按化学计量 关系反应完全的那一点(理论)
2-滴定分析法概论0
n m/M m C (取4位有效数字) V V M V
Anal. Chem. JYPC
2.间接配制法: (1)配制溶液(粗配) 步骤:
配制成近似于所需浓度的溶液。 (2)标定——通过滴定来确定溶液浓度的过程 用基准物质(标定法)或另一种已知浓度的标准溶液 (比较法)来滴定。 (3)确定浓度 由基准物质的量(体积、浓度),计算溶液浓度。
解:
法一: 浓盐酸中: 1L mHCl V 1.19 1000 1190 g m 1190 nHCl 12mol M 36.5
由cV c V
' '
cHCl (浓) 12mol/L
c 'V ' 0.1 500 V 4.2mL c 12
Anal. Chem. JYPC
Anal. Chem. JYPC
一、基准物质 1.对基准物质的要求 试剂的组成与化学式相符,包括结晶水 纯度高,性质稳定 具有较大的摩尔质量 试剂参加滴定反应时,定量进行,无副反应 2.常用的基准物(P23表2-1)
无水Na2CO3、Na2B4O7· 2O 10H KHC8H4O4、H2C2O4· 2O 10H CaCO3、Zn、ZnO K2Cr2O7、Na2C2O4 、H2C2O4· 2O 2H NaCl Anal. Chem. JYPC
Cr2O72-+14H++6Fe2+ =2Cr3++6Fe3+ + H2O 适用:不能与滴定剂起化学反应的物质
Anal. Chem. JYPC
Cr2O72-
§2.2 溶液浓度的表示方法 一、物质量的浓度:
B—基本单元
单位体积溶液所含B物质的物质的量
分析化学第9讲滴定分析法概论3

解:以邻苯二甲酸氢钾(KHP)为基准物质,其滴 定反应为:
KHP + NaOH = KNaP + H2O
即
nKHP nNaOH
mKHP (cV )NaOH MKHP
V=20 mKHP=0.10 mol·L-1 2010-3L204.22 g.mol-1=0.40g
V=25 mKHP=0.10 mol·L-1 2510-3L204.22 g.mol-1=0.50g
例. 写出Na(NH4)HPO4 溶液的质子条件式
[H+]+[
H
2
PO
- 4
]+2[H3PO4]
=[
NH3]+[
PO
3- 4
]+[
OH–]
注意:①质子参考水准,是溶液中大量存在并参与质子
1. 分析浓度:
·指单位体积的溶液中含有某种溶质的物质的量。 ·包括:已离解的溶质的浓度和未离解溶质的浓度。 ·单位:mol·L-1 ·表示:c
2.平衡浓度
• 指平衡状态时,溶液中溶质存在的各种型体的实 际浓度称为平衡浓度。
• 单位:mol·L-1 • 表示:[ ] • 例如:[HAc]
3. 分析浓度与平衡浓度的关系
三、溶液中化学平衡的处理方法
1. 质量平衡(Mass balance) 在平衡状态下某一组分的分析浓度等于该组分各种型 体的平衡浓度之和。 用质量平衡式(Mass balance equation)表示
例如, c mol/L Na2CO3溶液的质量平衡式为: [Na+] = 2c
[H2CO3]+
[HCO
③ 通过控制溶液的酸度可得到所需的型体。
HAc、Ac-分布系数与溶液pH值的关系曲线
滴定分析法概论
aA
(被测物)
+
(滴定液)
tT
=
(生成物) (生成物)
cC
+ dD
n A : nT a : t
nA : CTVT a : t
全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
2.1.1 滴定反应的基本术语
指示剂:滴定过程中,加入被测溶液中,利用
它的颜色变化指示实验终点到达的辅助试剂。
tT + aA = cC + dD
a nT t 2.3.2 滴定分析计算公式应用 nA =
1.有关配制滴定液的计算 例2-2 准确称取基准物质K2Cr2O7 2.9418g,用适量的溶剂溶 解后,定量转移到500.00mL容量瓶中并稀释至刻度,计算溶液 物质的量浓度是多少?
CK 2C r 2O 7 = m K 2Cr 2O 7 / M K 2Cr 2O 7 VK 2Cr 2O 7 = 2.9418 / 294.18 -1 = 0.02000mol L 500.0 10- 3
全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
《分析化学》
电子配套课件
全国高职高专 “十二五”规划教材
Analytical Chemistry
分析化学
第2章
2.1 概述 2.2 标准溶液
滴定分析法概论
2.3 滴定分析的计算 2.4 小结
2.5 能力检测
全国高职高专 “十二五”规划教材
2MnO4 5C2O42- +16H+ = 2Mn 2+ +10CO2 +8H2O
分析化学 滴定分析法概述PPT课件
实验室常用试剂分类
级别
1级 2级 3级 生化试剂
中文名 优级纯 分析纯 化学纯
英文标志 GR AR
CP
BR
标签颜色 绿 红 蓝 咖啡色
注意标准试剂、高纯试剂、专用试剂的区别
2.3 基准物质和标准溶液
二.标准溶液的配制:
标准溶液具有准确的浓度。配制方法有两种: 1.直接法
准确称取一定量的基准物质,溶解后定量的转移至容量瓶 中,冲释到刻度,根据称取物质的量和容量瓶的体积计算钙标 准溶液的浓度。 直接配制:K2Cr2O7、KBrO3 2.标定法
I=0.5×(c1z12+c2z22+···+cizi2) 式中c1,c2,···,ci,z1,z2,···,zi分别为溶液中各种离子的浓度和 所带电荷数。
中性分子的活度系数常粗略的视为等于1。
二、活度常数、浓度常数和混合常数
假如溶液中有下式反应
A+B=C+D
2.4 活度、活度系数和平衡常数
根据化学平衡原理
(二)配位滴定法
以配位反应为基础的滴定分析法。
(三)沉淀滴定法 利用沉淀反应的分析法。目前应用最广的是生成难溶银
盐的反应,称为银量法。 (四)氧化还原滴定法
以氧化还原反应为基础的滴定分析法。
2.2 滴定方式和滴定分析对反应的要求
1. 按一定的反应式定量进行(99.9%以上) 2. 快(或可加热、催化剂) 3. 有适当的方法确定终点(指示剂)
直接 滴定
置换滴定:用K2Cr2O7标定Na2S2O3(KI)
Zn2+
NaOH
返滴定: Al+EDTA(过量)、 CaCO3+HCl(过量) KMnO4
间接滴定:Caቤተ መጻሕፍቲ ባይዱ+
滴定分析概论
例:用KMnO4法测定Ca2+, 经过如下环节:
Ca2 C2O42 CaC2O4 H H2C2O4 MnO4 2CO2
1: 1
:1
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5 :2
5 nCa2 nH2C2O4 2 nMnO4
2、返滴定法:与直接法比较,不同点是,此 法在测定物质旳含量时,要用到两种原则溶液。
1: 1
COOH
COONa
COOK
COOK
c(NaOH) V(NaOH) m(KHC8H4O4 ) M(KHC8H4O4 )
c(NaOH)
m(KHC8H4O4 )
M(KHC8H4O4 ) V(NaOH)
若称取邻苯二甲酸氢钾0.4302g,所用 NaOH溶液旳体积为23.36ml,代入上式得:
例:石灰石样品(CaCO3)0.2250g,加入 0.1050mol/L HCl 40.00ml与CaCO3作用,剩余 旳HCl用0.1000mol/L NaOH回滴,用去15.20ml, 计算样品CaCO3%。
解:CaCO3 + 2HCl(过量) = CaCl2 + H2O + CO2↑ 1 :2
滴定分析旳关键:怎样选择合适旳指示剂,尽 量使理论终点与滴定终点一致,降低或降低终 点误差。
终点误差是滴定分析旳主要误差起源之一,它 旳大小主要取决于滴定反应旳完全程度和指示 剂旳选择是否合适。
滴定分析特点:(与重量分析比较)
1、仪器简朴、操作简便、迅速。 2、精确度高,相对误差在0.1~0.2%左右。 3、合用于测定>1%以上旳常量组分物质。 4、应用范围较广泛。
《滴定分析概论》课件
化工原料检测
滴定分析用于检测化工原料的质量 ,如酸碱度、纯度等,确保生产过 程的稳定性和产品质量。
在食品工业中的应用
食品添加剂检测
滴定分析用于检测食品中添加剂 的种类和浓度,确保食品的安全
性和合规性。
食品营养成分分析
通过滴定分析测定食品中的营养 成分,如蛋白质、脂肪、碳水化 合物等,为消费者提供准确的产
环境误差
实验环境的变化,如温度、湿 度、气压等,可能会对实验结 果产生影响,从而引入误差。
方法误差
实验方法本身可能存在的缺陷 或局限性,也会导致误差的产
生。
误差的表示方法
绝对误差
表示测量值与真实值之间的差值,其大小直接反 映了测量结果的准确性。
相对误差
表示绝对误差与真实值之间的比值,用于比较不 同测量值的准确性。
选择合适的测量方法
根据实验需求和实际情况,选择合适的方法 ,并了解其局限性,以减小方法误差。
05
滴定分析的发展趋势与 展望
滴定分析的发展历程
早期滴定分析
01
起源于18世纪,主要用于酸碱滴定和氧化还原滴定。
现代滴定分析
02
20世纪中叶以后,随着仪器分析的发展,滴定分析与其他分析
方法结合,形成了多种现代滴定分析方法。
保持实验室温度、湿度适 宜,避免气流、振动等因 素对实验造成干扰。
滴定管的使用
01
02
03
04
洗涤
使用前应将滴定管彻底洗涤干 净,确保内壁不挂水珠。
装液
根据实验需要,将试剂装入滴 定管中,并确保液面在刻度线
以下。
排气泡
在使用前应将滴定管中的气泡 排出,以免影响读数的准确性
。
读数
滴定分析用于检测化工原料的质量 ,如酸碱度、纯度等,确保生产过 程的稳定性和产品质量。
在食品工业中的应用
食品添加剂检测
滴定分析用于检测食品中添加剂 的种类和浓度,确保食品的安全
性和合规性。
食品营养成分分析
通过滴定分析测定食品中的营养 成分,如蛋白质、脂肪、碳水化 合物等,为消费者提供准确的产
环境误差
实验环境的变化,如温度、湿 度、气压等,可能会对实验结 果产生影响,从而引入误差。
方法误差
实验方法本身可能存在的缺陷 或局限性,也会导致误差的产
生。
误差的表示方法
绝对误差
表示测量值与真实值之间的差值,其大小直接反 映了测量结果的准确性。
相对误差
表示绝对误差与真实值之间的比值,用于比较不 同测量值的准确性。
选择合适的测量方法
根据实验需求和实际情况,选择合适的方法 ,并了解其局限性,以减小方法误差。
05
滴定分析的发展趋势与 展望
滴定分析的发展历程
早期滴定分析
01
起源于18世纪,主要用于酸碱滴定和氧化还原滴定。
现代滴定分析
02
20世纪中叶以后,随着仪器分析的发展,滴定分析与其他分析
方法结合,形成了多种现代滴定分析方法。
保持实验室温度、湿度适 宜,避免气流、振动等因 素对实验造成干扰。
滴定管的使用
01
02
03
04
洗涤
使用前应将滴定管彻底洗涤干 净,确保内壁不挂水珠。
装液
根据实验需要,将试剂装入滴 定管中,并确保液面在刻度线
以下。
排气泡
在使用前应将滴定管中的气泡 排出,以免影响读数的准确性
。
读数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021/3/7
CHENLI
16
4.基准物及标准溶液的配制
4.2 对基准物质的要求:
a.试剂的组成与化学式完全相符 b.具有较大的摩尔质量 c.纯度高(含量≥99.9%) d.性质稳定
2021/3/7
CHENLI
17
4.基准物及标准溶液的配制
4.3 标准溶液的配制方法
(1)直接配制法: 基准物质 称量 溶解 定量转移至 容量瓶 稀释至刻度 根据称量的质量 和体积计算标准溶液的准确浓度
滴定分析法概论
Titration Introduction
2021/3/7
CHENLI
1
滴定分析法概论
1.滴定方法介绍及分类
2.滴定分析反应的条件
3.滴定方式分类
4.基准物及标准溶液的配制
5.滴定分析的计算(略)
2021/3/7
CHENLI
2
1.滴定方法介绍及分类 滴定分析法
标准溶液(B) 被测溶液(A)
将被测物配制成溶液置于锥 形瓶中,用滴定管将已知浓度的 试剂(滴定剂或标准溶液)逐渐 加入,直到二者完全反应为止。 按所消耗的滴定剂用量,确定被 滴定物的含量。
2021/3/7
CHENLI
3
1.滴定方法介绍及分类
滴定分析基本术语
• 滴定(Titration):滴加标准溶液的操作过程。 • 化学计量点(Stoichiometric point):滴加标准溶液与待测组分恰好完
2021/3/7
CHENLI
8
➢返滴定法(剩余滴定法)
先准确加入过量标准溶液,使与试液中的待测 物质或固体试样进行反应,待反应完成以后,再用 另一种标准溶液滴定剩余的标准溶液的方法。
✓ 适用:反应较慢或难溶于水的固体试样
2021l3+的测定 Al3+ + 定量过量EDTA标液 剩余EDTA Zn2+标液,EBT
全反应之点。 • 指示剂(Indicator):滴定分析中能发生颜色改变而指示终点的试剂。 • 终点(End point):指示剂变色之点。 • 终点误差(Error of end point) :实际分析操作中指示剂变色点与化学
计量点之间的差别。
2021/3/7
CHENLI
4
1.滴定方法介绍及分类
✓适用:不能与滴定剂起化学反应的物质
2021/3/7
CHENLI
14
间接滴定法
例:Ca2+ 的测定
Ca2+
CaC2O4沉淀
H2SO4
KMnO4标液
C2O42-
间接测定
2021/3/7
CHENLI
15
4.基准物及标准溶液的配制
4.1 概念 ➢ 标准溶液:浓度准确已知的溶液
➢ 基准物质:能用于直接配制或标定标准溶 液的物质
2021/3/7
返滴定
CHENLI
10
返滴定法
例2:固体CaCO3 的测定 固体CaCO3 + 定量过量HCl标液
2021/3/7
剩余HCl标液 NaOH标液 返滴定
CHENLI
11
➢置换滴定法
先用适当试剂与待测物质反应,定量 置换出另一种物质 ,再用标准溶液去滴定 该物质的方法。
✓适用:无明确定量关系的反应
注意:要“准确”地称取、转移。
2021/3/7
CHENLI
18
4.基准物及标准溶液的配制
(2)间接配制法
标定法:利用基准物质确定溶液准确浓度。 比较法:用一种已知浓度的标液来确定另
一种溶液的浓度方法。
2021/3/7
CHENLI
19
2021/3/7
CHENLI
12
置换滴定法 例:Na2S2O3溶液浓度的标定
Na2S2O3+K2Cr2O7
K2Cr2O7 +过量KI
S4O62-+SO42-
无定量关系
定量生成 I2
Na2S2O3标液 淀粉指示剂
2021/3/7
置换滴定法
CHENLI
13
➢ 间接滴定法
通过另外的化学反应,以滴定法定量进行
滴定分析法特点
• 简便、快速,适于常量分析(含量>1%) • 准确度高(相对误差 0.2%) • 应用广泛
2021/3/7
CHENLI
5
1.滴定方法介绍及分类
按被测物与标准溶液的反应类型,可将滴定分 析法分为四类:
按反应类型分类
酸碱滴定法:酸碱中和反应; 配位滴定法:配位反应; 氧化还原滴定法:氧化还原反应; 沉淀滴定法:沉淀反应。
2021/3/7
CHENLI
6
2.滴定分析反应的条件
➢ 反应必须具有确定的化学计量关系 ➢ 反应定量地完成(≧99.9%) ➢ 反应速度要快 ➢ 无副反应 ➢ 能用比较简便的方法确定滴定终点
2021/3/7
CHENLI
7
3.滴定方式分类
3.1 直接滴定法:标液直接滴定待测物(基本) 3.2 返滴定法(剩余滴定法) 3.3 置换滴定法 3.4 间接滴定法
