氨基酸PPT下载
合集下载
氨基酸组成分析课件

色谱技术的引入为氨基酸分析打开了一扇新的大门。 1941年,Martin等运用色层法分析氨基酸,主要采用乙酰 化氨基酸在硅胶柱上或滤纸上半定量;随后,Moore、 Stein应用离子交换柱直接分离游离的氨基酸,在1958年, Spackman、Stein、Moore制造了自动化的氨基酸分析 仪,使氨基酸定量分析进入了一个崭新的阶段,至今仍是 经典的方法。
以下是几种常见的氨基酸分析方法。
《氨基酸组成分析》PPT课件
(1)茚三酮法 Spackman等人最早将茚三酮试剂运用到氨基酸组成分
析上。离子交换层析后,各种氨基酸与茚三酮反应形成紫色 化合物,最大光吸收在570nm,摩尔消光系数2X104,茚 三酮和二级胺(脯氨酸和羟脯氨酸)形成黄色产物,在 440nm检出,摩尔消光系数3X103。目前此法的灵敏度可 达100pmol,但茚三酮试剂易氧化,必须隔绝空气避光保 存,试剂本身黏性大,需要有个柱后混合器才能与氨基酸充 分反应,对仪器要求较高。
氧化反应被用来转化半胱氨酸和胱氨酸成为半胱磺酸,过 甲酸氧化反应的缺点是它会影响其他氨基酸特别是甲硫氨酸 会转变成甲硫氨酸砜,酪氨酸会降解。为克服这一 缺点,必 须准备能分析两次的样品量,一次提供半胱氨酸数据,另一 次则提供其他氨基酸的组成数据。
《氨基酸组成分析》PPT课件
第四节 氨基酸组成原位分析
《氨基酸组成分析》PPT课件
第一节 氨基酸组成分析的目的
现代分离提纯技术的发展使蛋白质操作微量化,但也给 定量带来了困难,一般很难通过常规的称量或测蛋白质溶液 在280nm的光吸收值来准确定量蛋白质。所以如果在蛋白 质酶解或测序前,取蛋白质样品的一部分进行氨基酸组成分 析,根据结果便可以推算出蛋白量的可靠值。 另外,在蛋白质测序中有时遇到测不出结果的情况, 一种可能是蛋白质的N端封闭, 另一种可能则是样品本身不是蛋白质或绝大部分是非蛋白质 物质, 解决这个问题的很好途径便是做氨基酸组成分析以确定样品 的成分。
以下是几种常见的氨基酸分析方法。
《氨基酸组成分析》PPT课件
(1)茚三酮法 Spackman等人最早将茚三酮试剂运用到氨基酸组成分
析上。离子交换层析后,各种氨基酸与茚三酮反应形成紫色 化合物,最大光吸收在570nm,摩尔消光系数2X104,茚 三酮和二级胺(脯氨酸和羟脯氨酸)形成黄色产物,在 440nm检出,摩尔消光系数3X103。目前此法的灵敏度可 达100pmol,但茚三酮试剂易氧化,必须隔绝空气避光保 存,试剂本身黏性大,需要有个柱后混合器才能与氨基酸充 分反应,对仪器要求较高。
氧化反应被用来转化半胱氨酸和胱氨酸成为半胱磺酸,过 甲酸氧化反应的缺点是它会影响其他氨基酸特别是甲硫氨酸 会转变成甲硫氨酸砜,酪氨酸会降解。为克服这一 缺点,必 须准备能分析两次的样品量,一次提供半胱氨酸数据,另一 次则提供其他氨基酸的组成数据。
《氨基酸组成分析》PPT课件
第四节 氨基酸组成原位分析
《氨基酸组成分析》PPT课件
第一节 氨基酸组成分析的目的
现代分离提纯技术的发展使蛋白质操作微量化,但也给 定量带来了困难,一般很难通过常规的称量或测蛋白质溶液 在280nm的光吸收值来准确定量蛋白质。所以如果在蛋白 质酶解或测序前,取蛋白质样品的一部分进行氨基酸组成分 析,根据结果便可以推算出蛋白量的可靠值。 另外,在蛋白质测序中有时遇到测不出结果的情况, 一种可能是蛋白质的N端封闭, 另一种可能则是样品本身不是蛋白质或绝大部分是非蛋白质 物质, 解决这个问题的很好途径便是做氨基酸组成分析以确定样品 的成分。
氨基酸(本)ppt课件

脱氨 NH3 脱羧 胺
碳链降解
其它有害物质
(1)脱羧生成胺
His 组胺 Phe 苯乙胺 Trp 色胺 Tyr 酪胺
腐胺 尸胺
胺类 门静脉吸收 入肝(单胺氧化酶或 二胺氧化酶)
-羟化
胺类
假神经递质
相应的醛
(苯乙醇胺、
-羟酪胺)
相应的酸
假神经递质,替代多巴释放, 解毒
大脑发生抑制。
(2)脱氨生成氨 • RCH(NH2)COOH RCH2COOH+NH3
-谷氨 酸环化 转移酶
氨基酸 COOH
H 2N C H R
COOH
O
R
H 2N CH
半胱氨酰甘氨酸
R 氨基酸
γ-谷 氨酰 基转
(Cys-Gly)
肽酶
5-氧脯氨酸
5-氧脯
ATP
移酶
谷胱甘肽 甘氨酸 GSH
半胱氨酸 -谷氨酰
氨酸酶 谷氨酸
ADP+Pi
ADP+Pi
谷胱甘肽 合成酶
半胱氨酸 合成酶
ATP
ATP
食物蛋白质消 化吸收 组织蛋白质分解
合成非必需氨 基酸
氨基酸 代谢库
合成蛋白质和 多肽
脱氨基作用
脱羧基作用
转变为其他含 氮物
氨基酸的分解代谢概况
特殊分解代谢→ 特殊侧链的分 解代谢
脱羧基作用→ 一般分解代谢
脱氨基作用→
CO2 胺 NH3 -酮酸
氨基酸的脱羧基作用
氨基酸的 脱氨基作用
O
脱氨基作用概述
意义:协助诊断疾病
转氨基作用特点:
反应可逆 转氨酶:种类多、分布广、活性强 辅酶:B6-P
转氨基作用的机制
生物化学第2章 氨基酸(共77张PPT)

• Ala Arg Asp
Asn
Cys Glu Gln Gly
His
Ile
Leu
Lys
Met Phe Pro
Ser
Thr
Trp
Tyr
Val
、 20种氨基酸可按其侧链分类
• 氨基酸的侧链可以按照它们的化学结构分为 三类,即:脂肪族氨基酸;芳香族氨基酸; 杂环氨基酸。
1)脂肪族氨基酸(中性)
甘氨酸 Glycine
非极性氨基酸(八种)
不带电何的极性氨基酸(八种)
带负电荷的氨基酸(2种)
带正电荷的氨基酸(2种)
➢第21种基本氨基酸是硒代半胱氨酸(Selenocysteine, Sec) ➢第22种基本氨基酸是吡咯赖氨酸(Pyrrolysine, Pyr) ➢两种罕见基本氨基酸是在特定生物的特定调控条件下生成。
O
H 2N CH C OH
CH 2
SH
C
( α-氨基-β-巯基丙酸 )
两个半胱氨酸氧化可生成胱氨酸
人头发的电子显微镜照片与模型
烫发过程:
1、加还原剂(巯基乙醇) 打开二硫键。
2、加氧化剂(双氧水) 重新生成错位二硫键。
1)、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine 苏氨酸 Threonine 半胱氨酸 Cysteine 甲硫氨酸 Methionine
O H 2N CH C OH
CH OH CH 3
T
( α-氨基-β-羟基丁酸 )
L-Threonine D-Threonine
L-alloThreonine
D-allo-
Threonine
苏氨酸的光学异构体
1)、脂肪族氨基酸(含羟基或硫)
蛋白质的构件-氨基酸(共77张PPT)

苯丙氨酸
酪氨酸
色氨酸
3、杂环aa〔2种)
组氨酸
脯氨酸
按R基的极性性质分类:
1、非极性R基aa
丙氨酸
缬氨酸
亮氨酸
异亮氨酸
苯丙氨酸 酪氨酸
蛋氨酸
脯氨酸
2、不带电荷的极性R基aa
丝氨酸
苏氨酸
酪氨酸
天冬酰胺
谷氨酰胺
半胱氨酸
甘氨酸
3、带正电荷的R基aa
赖氨酸
精氨酸
组氨酸
4、带负电荷的R基aa
天冬氨酸
逆形M流成分 Sec布hitf原f’s侧理碱〔反自响链学〕 上甲硫基:强亲核基团与烃化试剂成锍盐
氨基酸是蛋白质的根本结构单元
固定相是液体,吸附在滤纸上,将样品点在纸上,用流动相展开
K值可以用测定滴定曲线的实验方法获得
C=O + H2N CH
C=N CH
Cu2+,Fe2+,Co2+或Mn2+时,易被氧化
〔Asp+〕
COO-
CH—NH3+
CH2
COOH K2
COO-
CH—NH3+
CH2
COO-
K3
〔Asp0〕 〔Asp-〕
COO-
CH—NH2
CH2
COO-
〔Asp--〕
〔一〕氨基酸的解离
COOH
CH—NH3+
(CH2)4
NH3+
K1
〔Lys++〕
COO-
CH—NH3+
(CH2)4
NH3+
K2
〔Lys+〕
谷氨酸
〔二〕不常见的蛋白质氨基酸
氨基酸多肽及蛋白质

O
N H 2
O O+R C H 2C H C O O H
荧 光 胺
C O O H
RC H
N
+H 2 O
O O
*
食品化学 第六章 食品中的氨基酸、多肽及蛋白质类物质
生物活性肽也称作功能肽,是近年来非常活泼的研究领域,其应用涉及 到生物学、医药学、化学等多种学科,在食品科学研究及功能食品开发中 也显示出美好的前景。
去除正电荷
琥珀酸酐
O R NHCCH3
在Lys上引入正电荷
硫代仲康酸**
O C O O H 在Lys残基引入巯基
R N H C C H 2C H C H 2SH
*
食品化学 第六章 食品中的氨基酸、多肽及蛋白质类物质
官能团及反应
试剂及条件
产物
评价
6.芳基化
FDNB***
NO2
R NH
NO2
氨基酸序列测定
官能团及反应
氨基酸和蛋白质中官能团的化学反响性
试剂和条件
产物
评论
A.非α氨基 1.还原甲基化 2.胍基化 3.乙酰化 4.琥珀酰化 5.巯基化
甲醛、NaBH4 邻甲基异脲*,pH10.6,4℃,4d
+
R NHCH 32
+
NH2
R NHCNH2 O
蛋白放射性标记 Lys转换成Arg
乙酸酐
R NHCCH3
感染性疾病曾一度是人类生存所面临的最大威胁。随着抗生素的创造 和广泛使用,感染性疾病得到了一定程度的控制,但仍然是人类死亡的 一个重要原因。据WHO报告,2000年全球死亡人数5570万,其中 1440万由感染性疾病引起,占总死亡人数的15.9%。过去的几十年里, 耐药性微生物的不断产生和生物耐药性问题的日益恶化,开发新的抗感 染药物已成为治疗感染疾病的必由之路。昆虫抗菌肽因其独特的抗菌、 杀菌效果和良好的应用前景近来成为抗感染新药开发的热点。*目前国外
生物化学 第三章 氨基酸(共92张PPT)

Tyrosine
色氨酸
Trytophan
氨基酸的结构
芳香族氨基酸
H 2N
O
CH
C
OH
CH 2 CH 2 CH 2 NH
C
NH
NH 2
氨基酸的结构
精氨酸 Arginine
碱性氨基酸
O H 2 N CH C OH
CH 2 CH 2 CH 2 CH 2 NH 2
氨基酸的结构
精氨酸 Arginine
赖氨酸 Lysine
光性。而且发现主要是L型的(也有D型的,但很少)。
-氨基酸的分子构型
1、氨基酸的分类
各种氨基酸的区别在于侧链R基的不同。
20种蛋白质氨基酸按R的极性可分为非极性氨基酸 、极性性氨基酸、酸性氨基酸和碱性氨基酸;按R基的结 构可分为脂肪族氨基酸、芳香族氨基酸及杂环氨基酸3大 类。
氨基酸的三字母简写符号必背熟,单字母符号 要求认识。
芳香族氨基酸: Phe Trp Tyr
1、氨基酸的分类
组成蛋白质的氨基酸按其α-碳原子上侧链R的结构
2缬.氨酸-羧分基V参a为l与ine的反2应0种,20种氨基酸按R的结构和极性的不同有以下
生成烷基咪唑衍生物,并引起酶活性的降低或丧失
两种分类方法。 酪氨酸 tyrosine
Try Y
提问:大 多 数 氨 基 酸 在 中 性(pH=7) 时, 带
[质子供体]
乙酸
+ H
COOH
-
COO
+ H
CO-O
+ K1
H3N CH2
+
H3N CH2
K2
H2N CH2
Gl+y
Gl+-y
色氨酸
Trytophan
氨基酸的结构
芳香族氨基酸
H 2N
O
CH
C
OH
CH 2 CH 2 CH 2 NH
C
NH
NH 2
氨基酸的结构
精氨酸 Arginine
碱性氨基酸
O H 2 N CH C OH
CH 2 CH 2 CH 2 CH 2 NH 2
氨基酸的结构
精氨酸 Arginine
赖氨酸 Lysine
光性。而且发现主要是L型的(也有D型的,但很少)。
-氨基酸的分子构型
1、氨基酸的分类
各种氨基酸的区别在于侧链R基的不同。
20种蛋白质氨基酸按R的极性可分为非极性氨基酸 、极性性氨基酸、酸性氨基酸和碱性氨基酸;按R基的结 构可分为脂肪族氨基酸、芳香族氨基酸及杂环氨基酸3大 类。
氨基酸的三字母简写符号必背熟,单字母符号 要求认识。
芳香族氨基酸: Phe Trp Tyr
1、氨基酸的分类
组成蛋白质的氨基酸按其α-碳原子上侧链R的结构
2缬.氨酸-羧分基V参a为l与ine的反2应0种,20种氨基酸按R的结构和极性的不同有以下
生成烷基咪唑衍生物,并引起酶活性的降低或丧失
两种分类方法。 酪氨酸 tyrosine
Try Y
提问:大 多 数 氨 基 酸 在 中 性(pH=7) 时, 带
[质子供体]
乙酸
+ H
COOH
-
COO
+ H
CO-O
+ K1
H3N CH2
+
H3N CH2
K2
H2N CH2
Gl+y
Gl+-y
氨基酸PPT幻灯片课件
20
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
等电点(pI)
对于任何一种氨基酸来说,总存在一定的pH值,使其净 电荷为零,这时的pH值被称为等电点。pI是一个氨基酸的 特征常数。在等电点pH时,氨基酸在电场中,不向两极移 动,并且绝大多数处于兼性离子状态,少数可能解离成阳 离子和阴离子,但解离成阴、阳离子的趋势和数目相等。
21
氨基酸的主要反应性质
17
18
特殊的酸碱性质与等电点
由于氨基酸既含有碱性的氨基又含有酸性的羧 基,因此氨基酸具有特殊的解离性质,但氨基 算的碱性和酸性分别弱于单纯的胺和羧酸。一 个氨基酸分子内部的酸碱反应使氨基酸能同时 带有正负两种电荷,以这种形式存在的离子被 称为兼性离子(zwitterions)或两性离子。
19
氨基酸的两性解离
质氨基酸:含硒半胱氨酸(第21种)和吡咯赖氨酸 (第22种)
非蛋白质氨基酸——不能直接参入到蛋白质分子 之中,或者是蛋白质氨基酸翻译后修饰产物
例如:瓜氨酸、鸟氨酸和羟脯氨酸
4
氨基酸的分类
① 脂肪族 ② 芳香族 ③ 含硫族
① 极性/不带电荷 ② 碱性/酸性
疏水:非极性R基团
亲水:极性的R基团 (电中性、带负电荷、 带正电荷)
2
氨基酸的结构通式
不同的侧链基团 不同的理化性质
3
蛋白质氨基酸和非蛋白质氨基酸
蛋白质氨基酸,即标准氨基酸——在蛋白质生物 合成中,由专门的tRNA携带,直接参入到蛋白 质分子之中
共22种:20种常见+2种不常见 ① 相同的结构通式 ② 差别在侧链基团(R基团) ③ 所有的生物体都含有常见的20种;2种不常见的蛋白
5
亲水氨基酸VS疏水氨基酸
亲水氨基酸,即极性氨基酸,其R基团呈极性,一般能 和水分子形成氢键,故对水分子具有一定的亲和性。它 们包括:Ser、Thr、Tyr、Cys、Sec、Asn、Gln、Asp、 Glu、Pyl、Arg、Lys、His;
氨基酸(课件PPT)

• ----C-C(NH2)-C-C-COOH
α-氨基酸 β-氨基酸
γ-氨基酸
• 大多数AA在中性pH时呈兼 性离子状态:
COO-
NH3+
• 除甘氨酸外,19种AA都具有 旋光性。
• 除胱氨酸和酪氨酸外,其余 AA都能溶于水。
二、氨基酸的分类
(一)常见的蛋白质氨基酸
按R基的化学结构分类:
1、脂肪族aa (1)中性aa
四、氨基酸的化学反应
(一)α-氨基参加的反应
1.与亚硝酸反应 2.与酰化试剂反应
3.烃基化反应
4.形成Schiff’s碱反 应 5.脱氨基反应
NH2 R CH COOH + HNO2
OH R CH COOH+H2O+N2
Van Slyke 法测氨基氮(体积)的基础。 N2中的1/2为氨基氮。
H2N-CH-COOH 6HCOOOH CH2 S
H2N-CH-COOH
CH2
+ 6HCOOH
SO3H 磺基丙氨酸
S
CH2
2R-SH
H2N-CH-COOH
H2N-CH-COOH
CH2
+ R-S-S-R
SH
CH2SH
HOCH
+
HCOH
CH2SH
R-S-S-R
HO S
+ 2R-SH
OH S
五、AA的光学活性和光谱性质
六、氨基酸混合物的分析分离
(一)分配层析法的一般原理 ——利用AA成分分配系数的差异
固体 固定相
{ { 层析系统
附着在固相上的液体
流动相
按两相所处状态分:
固
液 体
定 相
α-氨基酸 β-氨基酸
γ-氨基酸
• 大多数AA在中性pH时呈兼 性离子状态:
COO-
NH3+
• 除甘氨酸外,19种AA都具有 旋光性。
• 除胱氨酸和酪氨酸外,其余 AA都能溶于水。
二、氨基酸的分类
(一)常见的蛋白质氨基酸
按R基的化学结构分类:
1、脂肪族aa (1)中性aa
四、氨基酸的化学反应
(一)α-氨基参加的反应
1.与亚硝酸反应 2.与酰化试剂反应
3.烃基化反应
4.形成Schiff’s碱反 应 5.脱氨基反应
NH2 R CH COOH + HNO2
OH R CH COOH+H2O+N2
Van Slyke 法测氨基氮(体积)的基础。 N2中的1/2为氨基氮。
H2N-CH-COOH 6HCOOOH CH2 S
H2N-CH-COOH
CH2
+ 6HCOOH
SO3H 磺基丙氨酸
S
CH2
2R-SH
H2N-CH-COOH
H2N-CH-COOH
CH2
+ R-S-S-R
SH
CH2SH
HOCH
+
HCOH
CH2SH
R-S-S-R
HO S
+ 2R-SH
OH S
五、AA的光学活性和光谱性质
六、氨基酸混合物的分析分离
(一)分配层析法的一般原理 ——利用AA成分分配系数的差异
固体 固定相
{ { 层析系统
附着在固相上的液体
流动相
按两相所处状态分:
固
液 体
定 相
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
保护巯基
与二硫硝基苯甲酸发生硫醇-二硫化物交换
pH8.0时412nm最大光吸收 —分光光度法测定-SH
Cys的巯基不稳定,易被氧化成二硫键
巯基在有痕量的金属离子如: Cu2+,Fe2+,Co2+或Mn2+时,易被氧化
2 R -S H + 1 /2 O 2
R -S -S -R + H 2 O
Cys中的二硫键可被氧化剂(过甲酸)以 及还原剂(巯基化合物)打开。
(二) α-羧基参加的反应
1.成盐或成酯反应 2.成酰氯反应 3.脱羧基反应 4.叠氮反应
(1)与NaOH等形成盐
(2)成酯
NH2 R CH COOH + C2H5OH
干燥,HCl 回流
R CH COOC2H5 + H2O NH3·Cl
保护羧基
HN-保护基 R— CH-COOH + PCl5
HN-保护基 R — CH-COOCl + POCl3 + HCl
等电点(pI)。 • 在pI时,AA在电场中既不向正极也不向负
极移动,即处于两性离子状态。
Ka1*Ka2=……
侧链不含离解基团的中性AA pI = (pK’1 + pK’2 )/2
甘 氨 酸 滴 定 曲 线
• 对于侧链含有可解离基团的AA
• pI取决于两性离子两边pK’值的算术平均
值
• 酸性AA:pI = (pK’1 + pK’R-COO- )/2 • 碱性AA:pI = (pK’2 + pK’R-NH2 )/2
得到各种AA的混合物 ➢酶水解一般是部分水解
得到多肽片段和AA的混合物
氨基酸是蛋白质的基本结构单元
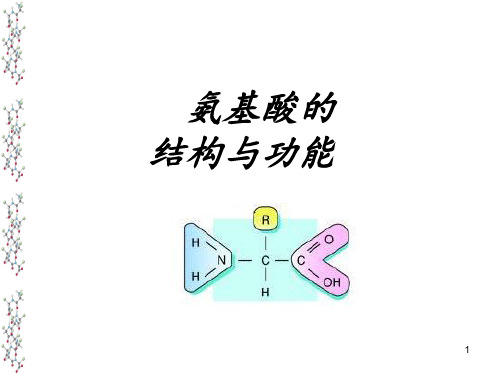
(二) 氨基酸的结构
地球上天然形成的AA300种以上。 构成蛋白质的AA只有20余种,且都 是α-氨基酸。
什么是氨基酸?
什么是α-氨基酸?
• ----C-C-C-C-COOH γβα
• ----C-C-C-C(NH2)-COOH α-氨基酸 • ----C-C-C(NH2)-C-COOH β-氨基酸
NN HO
NN
O
H2N
OH
Pauly反应
HO3S
His侧链咪唑基 与重氮苯磺酸生 HO3S 成棕红色化合物
NN HN
NN
NH2 CH2 CH COOH N
Arg侧链胍基与 环己二酮生成 缩合物
Trp侧链吲哚基能被 N-溴代琥珀酰亚胺氧化 ——分光光度法测定Trp含量
Met侧链上甲硫基:强亲核基团与烃化试剂成锍盐
保护氨基 活化羧基
NH2 R—CH-COOH
脱羧酶
R-CH2-NH2 +CO2
酰化氨基酸甲酯
YNH O R—CH—C—OCH3
肼
NH2NH2
YNH O R—CH—C—NHNH2 酰化氨基酰肼
HNO2
YNH O
R—CH—C—N -—N+ N + 2H2O 酰化氨基酰叠氮
肽的人工合成
(三)α-羧基和α-氨基都参加的反应
—N—C—N—CH—COOH
S 无水HF
PTC-氨基酸
S 苯氨基硫甲酰衍生物
—N—C
CN O
C
HR
PTH-氨基酸
苯乙内硫脲衍生物
R’ COOH
C=O + H2N CH
H
R
-H20R’ COO C=N CH
H +HR20
醛 氨基酸 Schiff’s碱
在生物体内经AA氧化酶催化 即脱去α-氨基而转变为酮酸。
(2)含羟基或硫aa
(3)酸性aa及其酰胺
(4)碱性aa
2、芳香族aa
3、杂环aa
按R基的极性性质分类:
1、非极性R基aa
2、不带电荷的极性R基aa
3、带正电荷的R基aa
4、带负电荷的R基aa
(二)不常见的蛋白质氨基酸
由常见aa经修饰而来。
(三)非蛋白质氨基酸
•150多种 •多是蛋白质中L型α-AA衍生物 •有一些是β-,γ-,δ-AA •有些是D-型AA
氨基酸定量和蛋白质水解程度的测定。
R
O2N
F + H2N—CH—COOH
NO2
DNFB
弱碱性
R
O2N
HN—CH—COOH + HF
NO2 DNP-氨基酸 (黄色)
Sanger 法测定N末端氨基酸#43; N—CH—COOH
PITC
H
pH8.3
H
HR
Edman降解法基础
四、氨基酸的化学反应
(一)α-氨基参加的反应
1.与亚硝酸反应 2.与酰化试剂反应
3.烃基化反应
4.形成Schiff’s碱反 应 5.脱氨基反应
NH2 R CH COOH + HNO2
OH R CH COOH+H2O+N2
Van Slyke 法测氨基氮(体积)的基础。 N2中的1/2为氨基氮。
鸟氨酸 瓜氨酸
三、氨基酸的酸碱性质
(一)兼性离子
(二)氨基酸的解离
R
+
H3N—CH—COOH
(pH<pI)
R
+
H3N—CH—COO(pH=pI)
R
H2N—CH—COO(pH>pI)
(三)氨基酸的等电点
• 当溶液为某一pH值时,AA主要以兼性离 子的形式存在,分子中所含的正负电荷数 目相等,净电荷为0。这一pH值即为AA的
• ----C-C(NH2)-C-C-COOH γ-氨基酸
• 大多数AA在中性pH时呈 兼性离子状态:
COO-
NH3+
• 除甘氨酸外,19种AA都具 有旋光性。
• 除胱氨酸和酪氨酸外,其余 AA都能溶于水。
二、氨基酸的分类
(一)常见的蛋白质氨基酸
按R基的化学结构分类:
1、脂肪族aa (1)中性aa
1、 与茚三酮反应 2、 成肽反应
弱酸 加热
(四) 侧链R基参加的反应
1、Tyr 22、、碱碱性性AAAA 3、带硫AA
Tyr酚基在3和5位上易发生亲电取代反应, 如碘化和硝化 黄色反应
HO
O
H2N
O
OH
HO
O
NH2
H2N
HO
O
H2N
I
HO
I
I
OH
OH
O2N NO2
HO
NO2
Pauly反应
HO3S HO3S
H2N-CH-COOH 6HCOOOH CH2 S
H2N-CH-COOH
CH2
+
6HCOOH
SO3H 磺基丙氨酸
S 2R-SH
CH2
H2N-CH-COOH
H2N-CH-COOH
CH2
+ R-S-S-R
SH
CH2SH
HOCH
+
第3章 氨基酸
(Amino Acid, AA, Aa, aa)
一、氨基酸 ——蛋白质的构件分子
Protein Architecture
(一) 蛋白质水解
蛋白质——月示——胨——多肽——肽——
AA
1*104
5*103 2*103 1000 200 100
➢蛋白质和多肽的肽键可被催化水解-500
➢酸/碱能将蛋白完全水解
与二硫硝基苯甲酸发生硫醇-二硫化物交换
pH8.0时412nm最大光吸收 —分光光度法测定-SH
Cys的巯基不稳定,易被氧化成二硫键
巯基在有痕量的金属离子如: Cu2+,Fe2+,Co2+或Mn2+时,易被氧化
2 R -S H + 1 /2 O 2
R -S -S -R + H 2 O
Cys中的二硫键可被氧化剂(过甲酸)以 及还原剂(巯基化合物)打开。
(二) α-羧基参加的反应
1.成盐或成酯反应 2.成酰氯反应 3.脱羧基反应 4.叠氮反应
(1)与NaOH等形成盐
(2)成酯
NH2 R CH COOH + C2H5OH
干燥,HCl 回流
R CH COOC2H5 + H2O NH3·Cl
保护羧基
HN-保护基 R— CH-COOH + PCl5
HN-保护基 R — CH-COOCl + POCl3 + HCl
等电点(pI)。 • 在pI时,AA在电场中既不向正极也不向负
极移动,即处于两性离子状态。
Ka1*Ka2=……
侧链不含离解基团的中性AA pI = (pK’1 + pK’2 )/2
甘 氨 酸 滴 定 曲 线
• 对于侧链含有可解离基团的AA
• pI取决于两性离子两边pK’值的算术平均
值
• 酸性AA:pI = (pK’1 + pK’R-COO- )/2 • 碱性AA:pI = (pK’2 + pK’R-NH2 )/2
得到各种AA的混合物 ➢酶水解一般是部分水解
得到多肽片段和AA的混合物
氨基酸是蛋白质的基本结构单元
(二) 氨基酸的结构
地球上天然形成的AA300种以上。 构成蛋白质的AA只有20余种,且都 是α-氨基酸。
什么是氨基酸?
什么是α-氨基酸?
• ----C-C-C-C-COOH γβα
• ----C-C-C-C(NH2)-COOH α-氨基酸 • ----C-C-C(NH2)-C-COOH β-氨基酸
NN HO
NN
O
H2N
OH
Pauly反应
HO3S
His侧链咪唑基 与重氮苯磺酸生 HO3S 成棕红色化合物
NN HN
NN
NH2 CH2 CH COOH N
Arg侧链胍基与 环己二酮生成 缩合物
Trp侧链吲哚基能被 N-溴代琥珀酰亚胺氧化 ——分光光度法测定Trp含量
Met侧链上甲硫基:强亲核基团与烃化试剂成锍盐
保护氨基 活化羧基
NH2 R—CH-COOH
脱羧酶
R-CH2-NH2 +CO2
酰化氨基酸甲酯
YNH O R—CH—C—OCH3
肼
NH2NH2
YNH O R—CH—C—NHNH2 酰化氨基酰肼
HNO2
YNH O
R—CH—C—N -—N+ N + 2H2O 酰化氨基酰叠氮
肽的人工合成
(三)α-羧基和α-氨基都参加的反应
—N—C—N—CH—COOH
S 无水HF
PTC-氨基酸
S 苯氨基硫甲酰衍生物
—N—C
CN O
C
HR
PTH-氨基酸
苯乙内硫脲衍生物
R’ COOH
C=O + H2N CH
H
R
-H20R’ COO C=N CH
H +HR20
醛 氨基酸 Schiff’s碱
在生物体内经AA氧化酶催化 即脱去α-氨基而转变为酮酸。
(2)含羟基或硫aa
(3)酸性aa及其酰胺
(4)碱性aa
2、芳香族aa
3、杂环aa
按R基的极性性质分类:
1、非极性R基aa
2、不带电荷的极性R基aa
3、带正电荷的R基aa
4、带负电荷的R基aa
(二)不常见的蛋白质氨基酸
由常见aa经修饰而来。
(三)非蛋白质氨基酸
•150多种 •多是蛋白质中L型α-AA衍生物 •有一些是β-,γ-,δ-AA •有些是D-型AA
氨基酸定量和蛋白质水解程度的测定。
R
O2N
F + H2N—CH—COOH
NO2
DNFB
弱碱性
R
O2N
HN—CH—COOH + HF
NO2 DNP-氨基酸 (黄色)
Sanger 法测定N末端氨基酸#43; N—CH—COOH
PITC
H
pH8.3
H
HR
Edman降解法基础
四、氨基酸的化学反应
(一)α-氨基参加的反应
1.与亚硝酸反应 2.与酰化试剂反应
3.烃基化反应
4.形成Schiff’s碱反 应 5.脱氨基反应
NH2 R CH COOH + HNO2
OH R CH COOH+H2O+N2
Van Slyke 法测氨基氮(体积)的基础。 N2中的1/2为氨基氮。
鸟氨酸 瓜氨酸
三、氨基酸的酸碱性质
(一)兼性离子
(二)氨基酸的解离
R
+
H3N—CH—COOH
(pH<pI)
R
+
H3N—CH—COO(pH=pI)
R
H2N—CH—COO(pH>pI)
(三)氨基酸的等电点
• 当溶液为某一pH值时,AA主要以兼性离 子的形式存在,分子中所含的正负电荷数 目相等,净电荷为0。这一pH值即为AA的
• ----C-C(NH2)-C-C-COOH γ-氨基酸
• 大多数AA在中性pH时呈 兼性离子状态:
COO-
NH3+
• 除甘氨酸外,19种AA都具 有旋光性。
• 除胱氨酸和酪氨酸外,其余 AA都能溶于水。
二、氨基酸的分类
(一)常见的蛋白质氨基酸
按R基的化学结构分类:
1、脂肪族aa (1)中性aa
1、 与茚三酮反应 2、 成肽反应
弱酸 加热
(四) 侧链R基参加的反应
1、Tyr 22、、碱碱性性AAAA 3、带硫AA
Tyr酚基在3和5位上易发生亲电取代反应, 如碘化和硝化 黄色反应
HO
O
H2N
O
OH
HO
O
NH2
H2N
HO
O
H2N
I
HO
I
I
OH
OH
O2N NO2
HO
NO2
Pauly反应
HO3S HO3S
H2N-CH-COOH 6HCOOOH CH2 S
H2N-CH-COOH
CH2
+
6HCOOH
SO3H 磺基丙氨酸
S 2R-SH
CH2
H2N-CH-COOH
H2N-CH-COOH
CH2
+ R-S-S-R
SH
CH2SH
HOCH
+
第3章 氨基酸
(Amino Acid, AA, Aa, aa)
一、氨基酸 ——蛋白质的构件分子
Protein Architecture
(一) 蛋白质水解
蛋白质——月示——胨——多肽——肽——
AA
1*104
5*103 2*103 1000 200 100
➢蛋白质和多肽的肽键可被催化水解-500
➢酸/碱能将蛋白完全水解
