乙烯使酸性高锰酸钾溶液褪色原理方程式
烃化学方程式

烃有关化学方程式必 须 记 熟烷烃:1、甲烷燃烧:CH 4+2O 2CO 2+2H 2O 2、甲烷与氯气见光:CH 4+Cl 2 CH 3Cl +HCl CH 4+2Cl 2CH 2Cl 2+2HCl CH 4+3Cl 2 CHCl 3+3HCl CH 4+4Cl 2CCl 4+4HCl 3、甲烷隔绝空气加强热:CH 4C +2H 2 4、十六烷的裂化:C 16H 34C 8H 18+C 8H 16辛烷的裂化:C 8H 18C 4H 10+C 4H 8丁烷的裂化:C 4H 10C 2H 6+C 2H 4C 4H 10C 3H 6+CH 4烯烃:5、乙烯燃烧:C 2H 4+3O 22CO 2+2H 2O 6、乙烯使溴的四氯化碳溶液褪色:CH 2=CH 2+Br 2BrCH 2CH 2Br 7、乙烯与氢气的催化加成:CH 2=CH 2+H 2催化剂 △CH 3CH 38、乙烯与氯化氢的加成:CH 2=CH 2+HCl CH 3CH 2Cl9、乙烯与水的加成:CH 2=CH 2+H 2OCH 3CH 2OH催化剂点燃加热催化剂加热 催化剂加热 催化剂加热催化剂高温光照光照光照光照点燃10、乙烯的加聚: C11、1,3—丁二烯与溴水的加成:CH 2=CH —CH=CH 2+Br 2BrCH 2CHBrCH=CH 2 CH 2=CH —CH=CH 2+Br 2BrCH 2CH=CHCH 2BrCH 2=CH —CH=CH 2+2Br 2BrCH 2CHBrCHBrCH 2Br12、1,3—丁二烯的加聚: 炔烃:13、乙炔与溴水的加成: HC CH +Br 2BrCH=CHBr HC CH +2Br 2BrCH —CHBrBr Br 14、乙炔的加聚:苯及其同系物:15、苯的燃烧:2C 6H 6+15O 212CO 2+6H 2O 16、苯在铁的作用下与液溴反应:17、苯与浓硫酸、浓硝酸的混合溶液水浴加热:+HNO 3 NO 2+H 2O18、苯与浓硫酸共热:+H 2SO 4 SO 3H +H 2O19、苯和氢气的加成: +3H 220O 2NH 3C — +3HNO 3 H 3C — NO 2+3H 2OO 2N点燃催化剂nCH 2=CH —CH=CH 2 CH 2—CH = CH —CH 2n浓硫酸 加热加热催化剂加热浓硫酸 加热21、甲苯和氢气的加成:拓 展烃:1、乙烯使酸性高锰酸钾溶液褪色(不用记,但要理解此反应只用来鉴别不能除杂原因): 5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+12MnSO 4+6K 2SO 4+28H 23 4、乙炔的燃烧:2C 2H 2+5O 24CO 2+2H 2O (可用烃的燃烧通式推出) 5、乙炔与氢气的加成:HC CH +H 2催化剂 △ CH 2=CH 2 HC CH +2H 2催化剂 △CH 3CH 36、2—甲基—1,3—丁二烯的加聚:7、1,3—丁二烯与苯乙烯的加聚:8、甲苯使酸性高锰酸钾溶液褪色(不用记,但要知道哪些苯的同系物可与酸性KMnO 4反应): 5 —CH 3+6KMnO 4+9H 2SO 45 —COOH +6MnSO 4+3K 2SO 4+14H 2O9、甲苯在铁的作用下与液溴反应:(理解不同条件下取代的H 位置不同)H 3C — +Br 2催化剂H 3C — —Br +HBrH 3C — +Br 2催化剂H 3C — +HBrH 3C 甲苯与氯气见光: CH 3+Cl 2 —CH 2Cl +HCl点燃光照CH —CH 2催化剂nCH 3 nCH 3CH=CH 2 催化剂 nCH 2=C —CH=CH 2 CH 2—C = CH —CH 2n CH 3CH 3 nCH 2=CH —CH=CH 2 +nCH=CH 2 催化剂 CH 2—CH=CH —CH 2—CH —CH 2n C 6H 5C 6H 5石油、煤炭和天然气的综合利用 10、石油的裂化如十六烷的裂化:C 16H 34催化剂 △ C 8H 18+C 8H 16 C 8H 18催化剂 △C 4H 10+C 4H 811、石油气的裂解:(理解裂解气中有烯烃)C 4H 10C 2H 6+C 2H 4C 4H 10C 3H 6+CH 412、煤炭的气化:(理解煤的气化是化学变化)C(s)+H 2O(g)高温CO(g)+H 2 (g) CO +3H 2催化剂CH 4+H 2O13、煤炭的液化:(理解煤的液化是化学变化)2C +2H 2O +2H 22CH 3OHCO +2H 2CH 3OH 14、天然气转变成合成气:CH 4+H 2O CO +3H 2高温、高压催化剂催化剂高温、高压催化剂加热催化剂加热 催化剂。
高中有机化学方程式总结

高中有机化学方程式总结高中有机化学方程式综述一、碳氢化合物甲烷烷烃通式:CnH2n-2 (1)氧化反应燃烧甲烷燃烧:CH4+2O2 CO2+2H2O甲烷不能使酸性高锰酸钾溶液和溴水变色。
(2)取代反应光线氯甲烷:CH4+Cl2 CH3Cl+HCl2.乙烯乙烯的制备:烯烃通式:(1)乙烯的氧化反应燃烧:乙烯会使酸性高锰酸钾溶液褪色并引起氧化反应。
(2)加成反应丙烯和溴水加成:丙烯和氢加成:丙烯和氯化氢加成:丙烯和水加成:(3)聚合反应丙烯加成聚合,3.1,3丁二烯向溴中加入1,3丁二烯:1:1加入1,3丁二烯:4。
乙炔乙炔的制备:(1)乙炔在氧化反应中的燃烧;乙炔会使酸性高锰酸钾溶液变色并引起氧化反应。
(2)加成反应和溴水添加:加入氢气;加入氯化氢;图2乙炔(3)聚合反应的制备丙烯加聚:5。
苯苯的同系物具有以下通式:(1)氧化反应苯的燃烧:(苯不能淡化溴水和酸性高锰酸钾溶液。
(2)取代反应①苯和溴反应(2)硝化反应高中化学方程式概述(第二部分),第2-1页,共6页(3)加成反应甲苯(1)氧化甲苯的燃烧:甲苯不能使溴水褪色,但能使酸性高锰酸钾溶液褪色。
(2)取代反应:与溴的反应甲苯硝化反应产生2,4,6-三硝基甲苯,简称三硝基甲苯,也称为三硝基甲苯,是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、采矿等。
二。
碳氢化合物衍生物烃类衍生物的重要类别及主要化学性质:卤代烃类醇酚醛羧酸酯代表物质通式为R-X R-羟基溴乙烷C2H5Br乙醇C2H5OH苯酚-羟基乙醛O | | CH3-C-H分子结构特征C-X键具有极性,易断裂的C-O键和O-H 键具有极性;-羟基直接与链烃基相连-羟基直接与苯环相连。
碳氧双键具有极性,并具有不饱和的主要化学性质。
1.取代反应:用氢氧化钠溶液进行取代反应生成乙醇;2.消除反应:与强碱醇溶液共同加热生成烯烃。
1.与钠反应生成醇钠并释放氢气;2.氧化反应:O2:产生CO2和H2O;;氧化剂:产生乙醛;3.脱水反应:140℃;乙醚;170℃:乙烯;4.酯化反应。
乙烯

一、乙烯 1.乙烯的组成与结构 分子式 电子式 结构式
乙烯
球棍模型
比例模型
C2H4
结构, 乙烯的分子构型为 平面 结构,即乙烯分子中的所有原子均 共面。 共面。
思考: 思考:乙烯结构简式为 CH2=CH2
2.乙烯的化学性质 . (1)氧化反应 氧化反应 ①在空气中燃烧 化学方程式: ——→ 化学方程式:C2H4+3O2——→2CO2+2H2O。 。
②乙设计的实验中能确定生成了乙烯的现象是
(4)乙烯通入溴水中,观察到的现象是________;其反 乙烯通入溴水中,观察到的现象是 乙烯通入溴水中 ; 应方程式为________。 。 应方程式为 (5)比赛中,当运动员肌肉挫伤或扭伤时,队医随即对 比赛中,当运动员肌肉挫伤或扭伤时, 比赛中 准球员的受伤部位喷射药剂氯乙烷(沸点 准球员的受伤部位喷射药剂氯乙烷 沸点 12.27℃), ℃, 进行局部冷冻麻醉应急处理。 进行局部冷冻麻醉应急处理。要得到较纯净的氯乙烷 应采用的制取方法是[用化学反应方程式 有机物用结 应采用的制取方法是 用化学反应方程式(有机物用结 用化学反应方程式 构简式表示)]__________________________________ 构简式表示 ____________________________________________。 。 该反应的类型是________反应。决定氯乙烷能用于冷 反应。 该反应的类型是 反应 冻麻醉应急处理的具体性质________。 。 冻麻醉应急处理的具体性质
(2)加成反应 双键 或叁键)两端的碳原子 或叁键 概念: ① 概念:有机物分子中的 双键(或叁键 两端的碳原子 直接结合生成新的化合物的反应。 与其他 原子或原子团 直接结合生成新的化合物的反应。 ② 乙烯与溴加成 褪色, 乙烯可使溴的四氯化碳溶液 (或溴水 )褪色,反应方程 式为: 式为:CH2= CH2+Br2→CH2Br—CH2Br 。 思考:乙烯使溴水或酸性 溶液褪色的原理是否相同? 思考:乙烯使溴水或酸性KMnO4溶液褪色的原理是否相同? 乙烯使溴水褪色,是加成反应, 乙烯使溴水褪色,是加成反应,乙烯双键中的一个键 断裂,两个溴原子分别加在两个不饱和的碳原子上, 断裂,两个溴原子分别加在两个不饱和的碳原子上,生成无色 液 体 1,2- 二 溴 乙 烷 , 消 耗 溴 , 而 使 其 褪 色 ; 乙 烯 使 酸 性 KMnO4溶液褪色,是因为乙烯被氧化,KMnO4被还原生成无 溶液褪色,是因为乙烯被氧化, 色物质而褪色。 色物质而褪色。
高考化学专题突破:有机化学选择题及知识点总结

高考化学专题突破:有机化学选择题 一、计算1、与Na 、NaOH 、Na 2CO 3、NaHCO 3反应醇酚羧酸酯、卤代烃Na √ √ √ × NaOH × √ √ √ Na 2CO 3 ×√ √ × NaHCO 3 ××√×备注酸性:醋酸>碳酸>苯酚>HCO 3->H 2O 重要反应:ONa OH NaHCO 3+CO 2++H 2O(现象:溶液变浑浊)例:1mol 该物质与足量的下列物质反应各消耗多少mol Na:3mol,产生H 21.5molNaOH:8mol Na 2CO 3:2mol NaHCO 3:1mol2、与H 2,HX(HCl,HBr),X 2(Cl 2,Br 2)加成 烯烃,炔烃 苯 醛,酮 羧酸,酯H 2√ √ √ × HX(HCl,HBr) √ × √ × X 2(Cl 2,Br 2)√×××例:1mol 该物质与足量的下列物质反应各消耗多少mol H 2HX(HCl,HBr)X 2(Cl 2,Br 2)3、不加条件与HX(HCl,HBr),X (Cl ,Br )取代 酚(邻位、对位可取代) 醇HX(HCl,HBr) × √ X 2(Cl 2,Br 2)√×+3 Br2→↓+3HBr+4 Br2→+4HBr +3 Br2→+3HBr CH3OH+HX→CH3X+H2O例:1mol该物质与足量的下列物质反应各消耗多少molHX(HCl,HBr):加成(5mol)取代(2mol)X2(Cl2,Br2):加成(3mol)取代(2mol)二、物理性质标况下状态熔沸点水溶性密度烃类C≦4为气态(新戊烷例外) 因为有机物均为分子晶体,所以熔沸点均随相对分子质量增大而增大。
②支链增加,熔沸点降低③醇和羧酸中含有氢键,熔沸点会增大难溶于水小于水(1)卤代烃C≦3的一氟烷烃一氯甲烷(CH3Cl,沸点 -24.2℃)氟里昂(CCl2F2沸点 -29.8℃)氯乙烯(CH2==CHCl,沸点 -13.9℃)四氟乙烯(CF2==CF2,沸点 -76.3℃)难溶于水一氟代烷、一氯代烷<1;一溴代烷,一碘代烷>1;C↑密度↓;醇非气态C≦4:互溶5≦C≦11:能溶C≧12:不溶烷烃<烷醇<1; 芳香醇>1酚非气态T<650C,不溶T>650C,互溶大于1醚甲醚(CH3OCH3,沸点为-23℃)甲醚溶于水,乙醚溶解度为10g小于1醛酮甲醛(...HCHO....,沸点... -.21..℃)..C≦4:互溶小于1羧酸非气态C≦4:互溶C≧5:不溶大于1 酯非气态难溶于水小于1 硝基化合物非气态难溶于水大于1 常见标况下22.4LCHCl3中含有的原子数鉴别:溴苯,苯,乙醇三、性质1、能使高锰酸钾溶液褪色的物质及有关化学反应原理分别为:(均为发生氧化还原反应褪色)①与烯烃、炔烃、二烯烃等不饱和烃类反应,使高锰酸钾溶液褪色;与苯的同系物(甲苯、乙苯、二甲苯等)反应,使酸性高锰酸钾溶液褪色。
21 乙烯
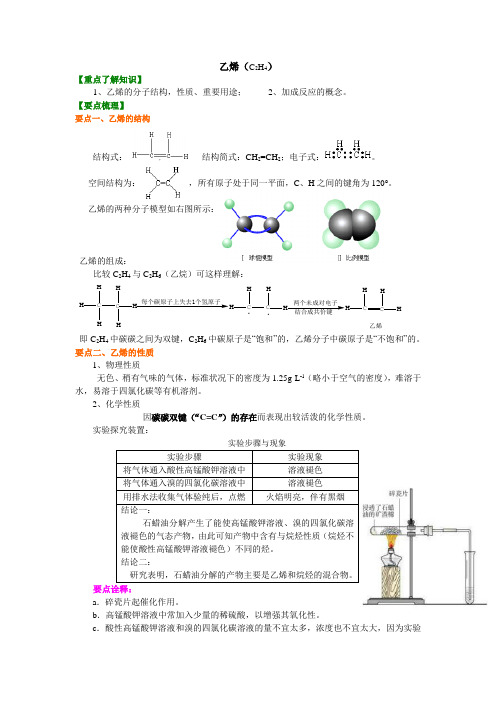
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。
高一化学硫及其化合物试题答案及解析

高一化学硫及其化合物试题答案及解析1.据报道,一辆盛浓硫酸的槽车,开至某转弯处,由于车速太快,车体倾翻,大量浓硫酸洒满路面.为了减少损害,现有如下方法:①立即调用大量的水冲洗地面;②立即从路基旁边取土将浓硫酸覆盖;③立即调用大量石灰乳覆盖.你赞成的方法是_____________,不赞成的方法是_____________,理由是_________________。
【答案】③①②硫酸有腐蚀性,用水冲洗路面、用土覆盖的办法都不能改变这一性质,并且用水冲洗还会使硫酸漫流,造成更大的危害.【解析】浓硫酸洒落后,若向地面用大量水冲洗,会产生大量的热,路面酸化;若再立即从路基旁边取土将浓硫酸覆盖;硫酸的危害依然没有消除,若立即调用大量石灰乳覆盖,不仅起到覆盖的作用,还发生反应消耗硫酸,危害进一步消除,所以最好的方法是③立即调用大量石灰乳覆盖;不赞成的方法是①②,原因是硫酸有腐蚀性,用水冲洗路面、用土覆盖的办法都不能改变这一性质,并且用水冲洗还会使硫酸漫流,造成更大的危害。
【考点】考查处理硫酸散落的方法的选择及原因的知识。
2.下列物质的俗名、化学式、主要用途都正确的是A.生石膏(2CaSO4·H2O):用于制造各种模型B.纯碱(NaHCO3):用于制玻璃、肥皂、造纸、纺织C.硫酸钡(BaSO4):作白色颜料、“钡餐”D.胆矾(CuSO4):用于制造农药【答案】C【解析】生石膏的化学式为CaSO4·2H2O,熟石膏的化学式为2CaSO4·H2O,A选项错误;纯碱的化学式为Na2CO3,B选项错误;胆矾的化学式为CuSO4·5H2O,D选项错误。
【考点】硫酸的制备和性质3.为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:请回答下列问题:(1)混合粉末A中硫粉过量的原因是。
(2)反应在“惰气环境”中进行的原因是。
(3)操作①用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明。
烃的化学方程式

烃的化学方程式一、甲烷及烷烃1、甲烷燃烧:CH 4+2O 2CO 2+2H 2O 2、乙烷燃烧:2C 2H 6+7O 2 4CO 2+6H 2O 3、丙烷燃烧:C 3H 8+5O 22CO 2+4H 2O4、丁烷燃烧:2C 4H 10+13O 28CO 2+10H 2O5、甲烷及氯气见光:CH 4+Cl 2 CH 3Cl +HCl CH 4+2Cl 2CH 2Cl 2+2HCl CH 4+3Cl 2 CHCl 3+3HCl CH 4+4Cl 2CCl 4+4HCl6、乙烷及氯气见光: CH 3CH 3+Cl 2CH 3CH 2Cl +HCl7、丙烷及氯气见光: CH 3CH 2CH 3+Cl 2 CH 3CH 2CH 2Cl +HCl CH 3CH 2CH 3+Cl 23CHCH 3+HCl8、甲烷隔绝空气加强热:CH 4C +2H 29、十六烷的裂化:C 16H 34C 8H 18+C 8H 16 10、辛烷的裂化:C 8H 18C 4H 10+C 4H 8 11、丁烷的裂化:C 4H 10C 2H 6+C 2H 4 C 4H 10C 3H 6+CH 412、加热醋酸钠及碱石灰的混合物制备甲烷:CH 3COONa +NaOH Na 2CO 3+CH 4↑二、乙烯及烯烃加热CaO 加热催化剂 加热 催化剂 加热 催化剂 加热 催化剂高温 光照光照光照 光照 光照 光照点燃点燃 点燃点燃1、乙烯燃烧:C 2H 4+3O 2 2CO 2+2H 2O2、丙烯燃烧:2C 3H 6+9O 26CO 2+6H 2O3、乙烯使酸性高锰酸钾溶液褪色: 5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+12MnSO 4+6K 2SO 4+28H 2O4、丙烯使酸性高锰酸钾溶液褪色: 5CH 3CH=CH 2+10KMnO 4+15H 2SO 45CH 3COOH +5CO 2↑+5K 2SO 4+10MnSO 4+20H 2O5、乙烯的催化氧化:2CH 2=CH 2+O 22CH 3CHO6、丙烯的催化氧化:2CH 3CH=CH 2+O 22CH 3CH 2CHO 2CH 3CH=CH 2+O 22CH 3COCH 37、乙烯使溴的四氯化碳溶液褪色:CH 2=CH 2+Br 2BrCH 2CH 2Br8、丙烯使溴的四氯化碳溶液褪色:CH 3CH 2=CH 2+Br 2CH 3CHCH 2BrBr 9、乙烯及氢气的催化加成:CH 2=CH 2+H 2CH 3CH 3 10、丙烯及氢气的催化加成:CH 3CH=CH 2+H 2CH 3CH 2CH 3 11、乙烯及氯化氢的加成:CH 2=CH 2+HCl CH 3CH 2Cl 12、丙烯及氯化氢的加成:CH 3CH=CH 2+HClCH 3CHCH 3ClCH 3CH=CH 2+HClCH 3CH 2CH 2Cl 13、乙烯及水的加成:CH 2=CH 2+H 2OCH 3CH 2OH 14、丙烯及水的加成:CH 3CH=CH 2+H 2OCH 3CH 2CH 2OHCH 3CH=CH 2+H 2OCH 3CHOHCH 3加热、加压催化剂 加热、加压催化剂 加热、加压催化剂 加热催化剂点燃 点燃 催化剂nCH 2=CH 2CH 2—CH 215、乙烯的加聚: C16、丙烯的加聚:17、乙烯及丙烯的加聚:18、实验室制备乙烯:CH 3CH 2OH CH 2=CH 2↑+H 2O三、1,3—丁二烯及二烯烃1、1,3—丁二烯的燃烧:2C 4H 6+11O 28CO 2+6H 2O2、1,3—丁二烯的燃烧的催化氧化:CH 2=CH —CH=CH 2+O 2CH 3COCOCH 3CH 2=CH —CH=CH 2+O 2OHCCH 2CH 2CHO3、1,3—丁二烯使酸性高锰酸钾溶液褪色: CH 2=CH -CH=CH 2+4KMnO 4+6H 2SO 42CO 2↑+2K 2SO 4+4MnSO 4+HOOC —COOH +8H 2O4、1,3—丁二烯及溴水的加成:CH 2=CH —CH=CH 2+Br 2BrCH 2CHBrCH=CH 2CH 2=CH —CH=CH 2+Br 2BrCH 2CH=CHCH 2BrCH 2=CH —CH=CH 2+2Br 2BrCH 2CHBrCHBrCH 2Br5、1,3—丁二烯的加聚:6、2—甲基—1,3—丁二烯的加聚:170℃浓硫酸 加热催化剂加热催化剂点燃 nCH 2=CH 2+nCH 3CH=CH 2CH 2—CH 2—CH —CH 2催化剂nCH 3CH —CH 2催化剂nCH 3nCH 3CH=CH 2催化剂nCH 2=CH —CH=CH 2 CH 2—CH = CH —CH 2n催化剂nCH 2=C —CH=CH 2 CH 2—C = CH —CH 2nCH 3CH 37、2—氯—1,3—丁二烯的加聚:8、1,3—丁二烯及丙烯腈的加聚:9、1,3—丁二烯及苯乙烯的加聚:10、1,3—丁二烯的制备:CH 3CHBrCHBrCH 3+2NaOH CH 2=CH —CH=CH 2↑+2NaBr +2H 2O四、乙炔及炔烃1、乙炔的燃烧:2C 2H 2+5O 2 4CO 2+2H 2O2、丙炔的燃烧: C 3H 4+4O 23CO 2+2H 2O3、乙炔使酸性高锰酸钾溶液褪色: C 2H 2+2KMnO 4+3H 2SO 42CO 2+K 2SO 4+2MnSO 4+4H 2O5CH 3C CH +8KMnO 4+12H 2SO 45CH 3COOH +5CO 2+8MnSO 4+4K 2SO 4+12H 2O4、乙炔及氢气的加成:HC CH +H 2CH 2=CH 2HC CH +2H 2CH 3CH 35、乙炔及溴水的加成: HC CH +Br 2BrCH=CHBr HC CH +2Br 2BrCH —CHBrBr Br 6、丙炔及氢气的加成: CH 3C CH +2H 2CH 3CH 2CH 3 CH 3C CH +2Br 2CH 3CBr 2CHBr 2点燃 点燃 加热CH 3CH 2OH 催化剂nCH 2=C —CH=CH 2CH 2—C = CH —CH 2nClClnCH 2=CH —CH=CH 2 +nCH 2=CHCN催化剂CH 2—CH=CH —CH 2—CH —CH 2nCNnCH 2=CH —CH=CH 2 +nCH=CH 2 催化剂CH 2—CH=CH —CH 2—CH —CH 2nC 6H 5C 6H 57、乙炔及氯化氢的加成:HC CH +HClCH 2=CHCl8、氯乙烯的加聚:nCH 2=CHCl CH —CH 2Cl 9、丙炔及氯化氢的加成:CH 3C CH +HClCH 3CH=CHClCH 3C CH +HClCH 3CHCl=CH 210、乙炔及水的加成:HC CH +H 2OCH 3CHO 11、丙炔及水的加成:CH 3C CH +H 2OCH 3CH 2CHOCH 3C CH +H 2OCH 3COCH 312、乙炔的加聚:nHC CH CH = CH13、丙炔的加聚:nCH 3C CH C ===CHCH 314、电石及水反应制备乙炔:CaC 2+2H 2O Ca(OH)2+C 2H 2↑五、苯和苯的同系物 1、苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 2、甲苯的燃烧:C 7H 8+9O 27CO 2+4H 2O3、甲苯使酸性高锰酸钾溶液褪色: 5 —CH 3+6KMnO 4+9H 2SO 4 5 —COOH +6MnSO 4+3K 2SO 4+14H 2O4、苯在铁的作用下及液溴反应: +Br —Br +HBr5、甲苯在铁的作用下及液溴反应:H 3C — +Br 2H 3C — —Br +HBrH 3C — +Br 2H 3C — +HBr点燃 点燃 催化剂n 催化剂n催化剂nH 3C 6—CH 3+Cl2—CH 2Cl +HCl7、苯及浓硫酸、浓硝酸的混合溶液水浴加热:+HNO —NO 2+H 2O8、甲苯和浓硫酸、浓硝酸的混合溶液水浴加热:O 2H 3C — +3HNO3 H 3C — —NO2+3H 2OO 2N 9、苯及浓硫酸共热:+H 2—SO 3H +H 2O10、苯和氢气的加成: +11、甲苯和氢气的加成: ——CH 3六、石油、煤炭和天然气的综合利用1、石油的裂化如十六烷的裂化:C 16H 34C 8H 18+C 8H 16C 8H 18C 4H 10+C 4H 82、石油气的裂解:C 4H 10C 2H 6+C 2H 4 C 4H 10C 3H 6+CH 43、煤炭的气化:C(s)+H 2O(g)CO(g)+H 2 (g) CO +3H 2CH 4+H 2O加热催化剂 加热 催化剂浓硫酸 加热4、煤炭的液化:2C +2H 2O +2H 22CH 3OHCO +2H 2CH 3OH5、天然气转变成合成气:CH 4+H 2OCO +3H 2高温、高压催化剂催化剂 高温、高压催化剂。
高中有机化学方程式总结

高中有机化学方程式总结一、烃1. 烷烃 —通式:C n H 2n -21氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O②甲烷不可使酸性高锰酸钾溶液及溴水褪色; 2取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HClCHCl 3又叫氯仿四氯化碳:CHCl 3+Cl 2 CCl 4+HCl3分解反应CH 4 C+2H 22. 烯烃 —通式:C n H 2n乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 1氧化反应①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2②乙烯可以使酸性高锰酸钾溶液褪色,2加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 32Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 3聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n3. 炔烃 —通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH↑+CaOH 2 1氧化反应①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O②乙炔可以使酸性高锰酸钾溶液褪色,2加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr CHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl 3聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2n乙炔加聚,得到聚乙炔:n HC ≡n 4. 苯 C 6H 6点燃光光光光浓硫酸170℃ 点燃催化剂 △ 催化剂加热加压 2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△催化剂△Br2—CHClCH=CH催化剂 △高温1氧化反应①苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O②苯不能使溴水和酸性高锰酸钾溶液褪色; 2取代反应 ①苯与溴反应+HO 3加成反应环己烷5. 甲苯 苯的同系物通式:C n H 2n-61氧化反应①甲苯的燃烧:C 7H 8+9O 2 7CO 2+4H 2O②甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色; 2取代反应3加成反应二、烃的衍生物点燃点燃+Br +3H CH 3| +3HNO 3浓硫酸 △ O 2N — CH 3 | —NO 2| NO 2 +3H 2O 三硝基甲苯TNT,是一种淡黄色晶体,不溶于水;它是一种烈性炸药CH 3 | + Cl 2 光CH 2Cl | + HCl CH 3 | + Cl 2 Fe CH 3 |+ HCl —Cl 甲苯和氯气在光照和铁的催化条件下发生的取代反应不一样 CH 3 |+ 3H 2 催化剂△ CH 3|烃的衍生物的重要类别和主要化学性质:6. 卤代烃1取代反应溴乙烷的水解:C 2H 5—Br+NaOH C 2H 5—OH+NaBr2消去反应溴乙烷与NaOH 溶液反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O7. 醇1与钠反应乙醇与钠反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑乙醇钠2氧化反应①乙醇的燃烧;②2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O 乙醛3取代反应乙醇与浓氢溴酸反应:CH 3CH 2OH+HBr CH 3CH 2Br+H 2O4消去反应CH 3CH 2OH H 2C=CH 2↑+H 2O 注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚; 2C 2H 5OH C 2H 5—O —C 2H 5+H 2O 乙醚5酯化反应CH 3CH 2—OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O 乙酸乙酯8. 苯酚苯酚是无色晶体,露置在空气中会因氧化显粉红色;苯酚具有特殊的气味,熔点43℃, 水中溶解度不大,易溶于有机溶剂;苯酚有毒,是一种重要的化工原料;H 2O醇△Cu 或Ag△浓硫酸140℃ 浓硫酸170℃ △浓硫酸△1苯酚的酸性苯酚钠 苯酚钠与CO 2反应:+CO 2+H 2O +NaHCO 32取代反应+3Br 2 ↓+3HBr三溴苯酚 3显色反应苯酚能和FeCl 3溶液反应,使溶液呈紫色 4缩聚反应9. 醛乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发;1加成反应 乙醛与氢气反应:CH 3—C —H+H 2 CH 3CH 2OH2氧化反应 乙醛与氧气反应:2CH 3—C —H+O 2 2CH 3COOH 乙酸乙醛的银镜反应:CH 3CHO +2AgNH 32OH CH 3COONH 4+2Ag↓+3NH 3+H 2O注意:硝酸银与氨水配制而成的银氨溶液中含有AgNH 32OH 氢氧化二氨合银, 这是一种弱氧化剂,可以氧化乙醛,生成Ag;有关制备的方程式:Ag ++NH 3·H 2O===AgOH↓++4NHAgOH+2NH 3·H 2O===AgNH 32++OH -+2H 2O乙醛还原氢氧化铜:CH 3CHO+2CuOH 2 CH 3COOH+Cu 2O↓+2H 2O10. 羧酸1乙酸的酸性乙酸的电离:CH 3COOH CH 3COO -+H+2酯化反应CH 3CH 2—OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O 乙酸乙酯注意:酸和醇起作用,生成酯和水的反应叫做酯化反应;11. 酯乙酸乙酯是一种带有香味的无色油状液体; 1水解反应—OH +NaOH +H 2O —ONa —ONa—OH—OH—BrBr — OH| Br |O || 催化剂△O || 催化剂△△△O ||浓硫酸 △无机酸催化剂酚醛树脂的制取CH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OH 2中和反应CH 3COOC 2H 5+NaOH CH 3COONa+C 2H 5OH注意:酚酯类碱水解如: 的水解 +2NaOH→CH 3COONa+ + H 2O其他1葡萄糖的银镜反应 CH 2OHCHOH 4CHO +2AgNH 32OH CH2OHCHOH 4COONH 4+2Ag +3NH 3+H 2O2蔗糖的水解 C 12H 22O 11+ H 2OC 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖 3麦芽糖的水解 C 12H 22O 11 + H 2O2C 6H 12O 6麦芽糖 葡萄糖 4淀粉的水解:5葡萄糖变酒精 CH 2OHCHOH 4CHO 2CH 3CH 2OH +2CO 26纤维素水解7油酸甘油酯的氢化8硬脂酸甘油酯水解 ①酸性条件②碱性条件皂化反应附加:官能团转化示意图CH 3COO - -ONa CH 3COO -烃三、有机合成的常用方法 1、官能团的引入:在有机化学中,卤代烃可谓烃及烃的衍生物的桥梁,只要能得到卤代烃,就可能得到诸如含有羟基、醛基、羧基、酯基等官能团的物质;此外,由于卤代烃可以和醇类相互转化,因此在有机合成中,如果能引入羟基,也和引入卤原子的效果一样,其他有机物都可以信手拈来;同时引入羟基和引入双键往往是改变碳原子骨架的捷径,因此官能团的引入着重总结羟基、卤原子、双键的引入; 1引入羟基-OH①醇羟基的引入:a.烯烃与水加成;b.卤代烃碱性水解;c.醛酮与氢气加成;d.酯的水解; ②酚羟基的引入:酚钠盐过渡中通入CO 2 、的碱性水解等;③羧羟基的引入:醛氧化为酸被新制CuOH 2悬浊液或银氨溶液氧化、酯的水解等; 2引入卤原子:a.烃与X 2取代;b.不饱和烃与HX 或X 2加成;c.醇与HX 取代; 3引入双键:a.某些醇或卤代烃的消去引入C=C ;b.醇的氧化引入C=O; 2、官能团的消除1通过加成反应消除不饱和键;2通过消去、氧化或酯化等消除羟基-OH 3通过加成或氧化等消除醛基—CHO 4通过取代或消去消除卤素原子; 3、官能团间的衍变①利用官能团的衍生关系进行衍变,如伯醇[]−→−O 醛[]−→−O 羧酸;②通过某种化学途径使一个官能团变为两个,如一元醇经过消去、加成、取代变成二元醇如CH 3CH 2OH OH 2-−−→−消去CH 2=CH 22Cl +−−→−加成Cl —CH 2—CH 2—Cl−−→−水解HO —CH 2—CH 2—OH; ③通过某种手段,改变官能团位置;如丙醇 丙烯 2-丙醇 4、有机化学中碳链的增减方法 1增长碳链的方法①加聚反应:如nCH 3CH=CH 2消去加成H 2O一定条件下催化剂②缩聚反应:如③加成反应:如④酯化反应:如⑤卤代烃的取代反应:如⑥醛酮与HCN、ROH的加成反应:如2减短碳链的方法①氧化反应;包括燃烧,烯烃、炔烃的部分氧化,丁烷直接氧化成乙酸,某些苯的同系物氧化成苯甲酸,羧酸钠盐在碱石灰条件下的脱羧反应;②水解反应;主要包括酯的水解、蛋白质的水解和多糖的水解;5、常见有机官能团的保护1物质检验中碳碳双键与醛基的先后处理检验碳碳双键时,当有机物中含有醛基、碳碳双键等多个官能团时,可以先用弱氧化剂,如银氨溶液、新制的CuOH2悬浊液等氧化醛基,再用溴水、酸性KMnO4溶液进行碳碳双键的检验;2物质合成中酚羟基的保护由于酚羟基易被氧化,在有机合成中,如果需要用氧化剂进行氧化时,经常先将酚羟基通过酯化反应,使其成为酯而被保护,待氧化过程完成后,再通过水解反应,使酚羟基恢复;也可用NaOH处理成-ONa,再加H+复原;3为防止醇-OH被氧化可先将其酯化;4芳香胺-NH2的保护:转化为酰胺保护氨基;1.能使溴水Br2/H2O褪色的物质1有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀;③通过氧化反应使之褪色:含有—CHO醛基的有机物有水参加反应注意:纯净的只含有—CHO醛基的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯2无机物①通过与碱发生歧化反应3Br2 + 6OH- =5Br- + BrO3- + 3H2O或Br2 + 2OH- = Br- + BrO- + H2O②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质1有机物:含有、—C≡C—、—OH较慢、—CHO的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物与苯不反应2无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+ 3.与Na反应的有机物:含有—OH、—COOH的有机物与NaOH反应的有机物:常温下,易与含有酚羟基...、—COOH的有机物反应加热时,能与卤代烃、酯反应取代反应与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3;含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;含有—SO3H的有机物反应生成磺酸钠并放出CO2气体;与NaHCO3反应的有机物:含有-COOH、-SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2; 4.银镜反应的有机物1发生银镜反应的有机物:含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖葡萄糖、麦芽糖等2银氨溶液AgNH32OH多伦试剂的配制:向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失;3实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出4有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3AgOH + 2NH3·H2O == AgNH32OH + 2H2O银镜反应的一般通式:RCHO + 2AgNH32OH 2 Ag↓+ RCOONH4 + 3NH3 + H2O悬浊液斐林试剂的反应5.与新制CuOH21有机物:羧酸中和、甲酸先中和,后氧化、醛、还原性糖葡萄糖、麦芽糖、甘油等多羟基化合物;2斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液;3实验现象:①若有机物只有醛基-CHO,则滴入新制的CuOH2悬浊液中,常温时无变化,加热煮沸后有砖红色沉淀生成②若有机物为多羟基醛如葡萄糖,则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有砖红色沉淀生成4有关反应方程式:2NaOH + CuSO4 == CuOH2↓+ Na2SO4RCHO + 2CuOH2RCOOH + Cu2O↓+ 2H2OHCHO + 4CuOH2CO2 + 2Cu2O↓+ 5H2O巩固练习:1,乙酸苯甲酯可用作茉莉、白兰、月下香等香精的调合香料;它可以用甲苯和乙醇为原料进行人工合成;合成路线:1C 的结构简式为__________________________;2反应②、③的反应类型为_______________,_______________; 3甲苯的一氯代物有 种;4写出反应①的化学方程式_______________________________;5为了提高乙酸苯甲酯的产率应采取的措施是写一项 ; 2,下面是一个合成反应的流程图A BCH 2=CH 2 BrCH 2-CH 2Br C请写出:1.中间产物A 、B 、C 的结构简式:A .__________B . ________ C .____________ 2.①、②、③、④各步反应所需用的反应试剂及各步反应的类型①________、_______②__________、_______③________、______④________、______3,分子式为C 12H 14O 2的F 有机物广泛用于香精的调香剂;为了合成该物质,某实验室的科技人员设计了下列合成路线:1A 物质在核磁共振氢谱中能呈现 种峰;峰面积比为 2C 物质的官能团名称3上述合成路线中属于取代反应的是 填编号;4写出反应④、⑤、⑥的化学方程式:④ ⑤ ⑥5F 有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F 相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH 2COOCH 3; 4,菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物;⑴甲一定含有的官能团的名称是 ;⑵5.8g 甲完全燃烧可产生0.3mol CO 2和0.3 mol H 2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ;⑶苯氧乙酸有多种酯类的同分异构体,其中能与FeCl 3溶液发生显色反应,且有2种一硝基取代物的同分异构体是写出任意2种的结构简式 ;CH CH 3Cl 2 光 ① CH 2OH CH 2OH ② 催化剂 CHO CHO O 2 催化剂 ③ △ NaOH 水溶液 ④COOCH 2CH 2OH COOCH 2CH 2OH⑷已知:R-CH 2-COOH 2Cl −−−→催化剂R-ONa 'Cl-R∆−−−→R-O-R′R -、R′-代表烃基 菠萝酯的合成路线如下:①试剂X 不可选用的是选填字母 ;a. CH 3COONa 溶液b. NaOH 溶液c. NaHCO 3溶液d.Na②丙的结构简式是 ,反应II 的反应类型是 ; ③反应IV 的化学方程式是 ; 5,以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G;OOAF E 2△①②③△浓硫酸△C 13H 16O 42C 2H 4C 4H 8O 21E 是一种石油裂解气,能使酸性高锰酸钾溶液褪色;同温同压下,E 的密度是H 2的21倍;核磁共振氢谱显示E 有3种不同化学环境的氢原子,其个数比为1:2:3;E 的结构简式为 ;2反应类型:① ,④ ; 3反应条件:③ ,⑥ ; 4反应②、③的目的是 ; 5反应⑤的化学方程式为 ;6B 被氧化成C 的过程中会有中间产物生成,该中间产物可能是 写出一种物质的结构简式,检验该物质存在的试剂是 ;7G 的结构简式为 ;。
