有机化学第七章(单)
有机化学课后习题答案7第七章答案
4.
V2O5, O2
一. 命名或写出结构式
1.
2. C2H5
NO2
Br2 Fe
NO2 Br
O
O
O
O
浓H2SO4
AlCl3 O
COOH
O
习题 B 答案
CH3 3.
OH 4.
SO3H
H3C
5.
6.
7. 2-乙基-9,10-蒽醌 8. 2-环丙基萘
9. 1,4-二甲基萘 10. 邻苯二甲酸酐
二.用休克尔规则判断下列化合物是否有芳香性
CHO
CHO
CH3 NBS
O2, V2O5 400-500℃
CH2MgBr 无水乙醚
CH2Br Mg 无水乙醚
CH2MgBr
O
O AlCl3
O
O Zn-Hg HCl
HOOC
H2SO4 HOOC
H3O+
H2/Ni HO CH2
H2SO4 HO CH2
O CH2
5.
O
O
Zn-Hg
浓H2SO4
O AlCl3
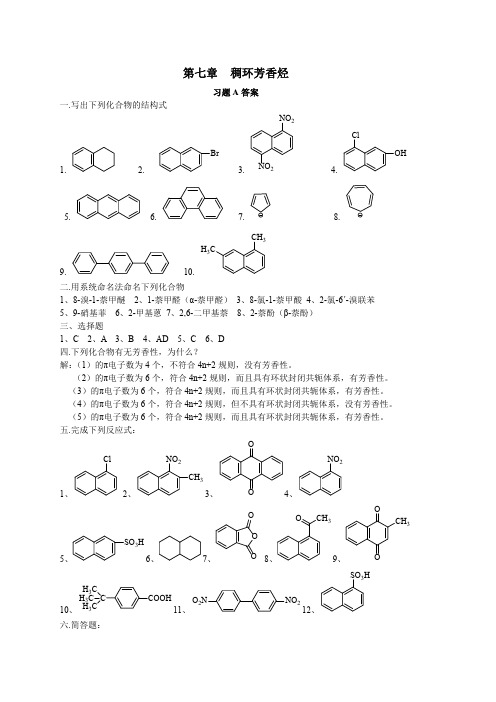
第七章 稠环芳香烃
一.写出下列化合物的结构式
习题 A 答案
NO2
Cl
Br
OH
1.
2.
3. NO2
4.
5.
6.
7.
8.
CH3 H3C
9.
10.
二.用系统命名法命名下列化合物 1、8-溴-1-萘甲醚 2、1-萘甲醛(α-萘甲醛) 3、8-氯-1-萘甲酸 4、2-氯-6ˊ-溴联苯 5、9-硝基菲 6、2-甲基蒽 7、2,6-二甲基萘 8、2-萘酚(β-萘酚) 三、选择题 1、C 2、A 3、B 4、AD 5、C 6、D 四.下列化合物有无芳香性,为什么? 解:(1)的π电子数为 4 个,不符合 4n+2 规则,没有芳香性。
有机化学第七章

A、ClCH2CH2CHO
B、CH3CH2CHO
C、CH3CHClCHO
D、C6H5CHO
答案:C
【小白菌解析】
羰基的活性顺序
4.下列化合物不能与HCN加成的是( )
A、正壬醛
B、丁酮
C、苯乙酮
D、环己酮
答案:C
【小白菌解析】
化学课本第124页,HCN与芳香酮反应困难
5.能与亚硝酸作用生成难溶于水的黄色油状物的化合物是()
A.N-甲基苯胺
B、甲胺
C、苯胺
D、三乙胺
答案:A
【小白菌解析】
仲胺会与亚硝酸作用生成黄色油状物
2.在稀碱作用下,下列哪组不能进行羟醛缩合反应? ( )
A、HCHO + (CH3)3CCHO
B、CH3CH2CHO + C6H5CHO
C、HCHO + CH3CHO
D、C6H5CH2CHO + (CH3)3CCHO
答案:A
【小白菌解析】
在稀碱溶液中,含α-H的醛的α-碳(以负碳离子存在),可以与另一醛的羰基碳加成形成新的碳碳键,生成β-羟基醛,而A项的甲醛没有α-H,所以选A
1.下列化合物不能发生碘仿反应的有( )
A、乙醇
B、乙醛
C、苯乙酮
D、正丁醇
答案:-连于H或C上的结构化合物
(2)具有CH3CHOH-R结构的化合物(能被次卤酸盐氧化为CH3CO-)
(3)烯醇(发生分子重排)满足以上条件可以发生卤仿反应,而正丁醇CH3CH2CH2CH2OH不满足条件,故选D
有机化学07芳烃_芳香性xiu

AlCl3 80°C
O CCH3 + HCl
苯乙酮 (Acetophenone)(97%)
酰氯的制备 羧酸与亚硫酰氯或PCl5反应: 羧酸与亚硫酰氯或
O CH3C OH + SOCl2
80°C
O CH3C Cl + SO2 + HCl
酸酐: 酸酐
O H O
AlCl3 80°C
7.7联苯及其衍生物 7.7联苯及其衍生物 7.8 稠环化合物 7.9杂环化合物 7.9杂环化合物
芳烃: 芳烃:指苯及其衍生物以及具有类似苯环结构和性质的 一类化合物。 一类化合物。 CH3CHCH3 CH3 CH Cl
7.1芳烃的分类: 7.1芳烃的分类: 芳烃的分类
3
CH3
甲苯 氯苯 异丙(基 苯 异丙 基)苯 邻二甲苯
Br Br + FeBr3
δ δ
Br
Br FeBr3
Br2 与FeBr3 的络合
第二步: 极化了的溴进攻苯环 第二步:
+ Br
δ
Br
FeBr3
δ
慢
Br H + Br
FeBr3
生成苯碳正离子中间体。 生成苯碳正离子中间体。此步骤是 决定反应速率的一步。 决定反应速率的一步。
烯丙基型正离子: 烯丙基型正离子 p - π 共轭 π - 电子的离域产生共振杂化体: 电子的离域产生共振杂化体:
②分子轨道理论
6 相互交盖的 2p轨道 组合成 个分子轨道 轨道 组合成6个分子轨道
图 7.2苯的π分子轨道和能级 7.2苯的π 苯的
③休克尔规则及应用 电子数为( 凡π 电子数为(4n+2)的闭合结构都具有芳香性。 )的闭合结构都具有芳香性。 π 电子数 ,有芳香性 电子数=6, π 电子数 ,无芳香性 电子数=4, ④芳香性判断 判断依据 π 电子数为(4n+2),( 电子数为( ),(n=0,1,2正整数) 正整数) ),( , , 正整数 共平面环状共轭结构
有机化学第七章 芳烃

1
一、教学目的和要求 通过对本章的学习,掌握芳烃的定义、分类、苯的结构、 闭合共轭体系、芳香性及苯的同系物的命名,掌握苯环上 的亲电取代反应及定位规则,侧链卤代和氧化反应,掌握 萘的结构及命名,萘的亲电取代反应、氧化反应;熟悉休 克尔规则及非苯芳烃的芳香性判断;了解联苯、蒽、菲的 结构及命名以及苯及其同系物的主要物理性质(易燃性)。 二、教学重点内容 芳烃的结构、闭合共轭体系、命名、亲电取代反应及其定 位规律、侧链氧化、萘的结构、命名及亲电取代反应、非 苯芳烃芳香性的判断是本章的重点。
CH3 CH3 CH3
(1)单环芳烃
苯 甲苯 间二甲苯
(2)多环芳烃
连 苯 三
C H 苯 甲
烷
(3)稠环芳烃
萘 蒽 菲
4
5.1
芳烃的构造异构和命名
5.1.1 构造异构
苯及其同系物的通式为:CnH2n-6。 例如苯有六个碳和六个氢,其六个碳和六个氢是等同的; 结构异构: 一元取代:只有一种
CH3 CH CH2 H3C CH CH3
(a)
(b) (c) (d) (e)
卤化
硝化 磺化 Friedel-Crafts反应 氯甲基化
17
(1)亲电取代反应
(a) 卤化
苯环上和卤代反应较困难,常用FeX3(Lewis酸)作催化剂。
+ Cl2
FeCl3,25oC 90%
Cl + HCl
控制苯过量,不要太激烈,避免二卤代。 因是亲电反应,所以苯的同系物(甲苯)比苯更易反应。 Cl 卤代活性: F2>Cl2>Br2>ICH CH3 CH3 CH3 2。 3
14
5.3
单环芳烃的物理性质
有机化学章节习题参考答案(7-10)
(4)
习题 10-3.出分子式为 C5H10O 的醛和酮的同分异构体,并加以命名。 答案:
CHO
CHO
CHO
C2H5 H CH3
CHO
H C2H5 CH3
CHO
戊醛 二甲基丙醛
3-甲基丁醛
R-2-甲基丁醛 S-2-甲基丁醛 2,2-
习题 10-6.用化学方法区别下列各组化合物: 答案: (1)加 Tollens 试剂并加热,能产生银镜的为苯甲醛。 (2)加 Tollens 试剂并加热,能产生银镜的为己醛。 (3)加 I2/NaOH 溶液,能产生亮黄色固体的为 2-己酮。 (4)加饱和 NaHSO3 溶液,能产生固体的为丙酮。 (5)加 Na, 有气体产生的是 2-己醇。 (6)加 I2/NaOH 溶液,能产生亮黄色固体的为 1-苯基乙醇。 (7)加饱和 NaHSO3,能产生固体的为环己酮;剩下的各加入 Na,有气体产生的 为环己醇。 (8)加饱和 NaHSO3,能产生固体的为环己酮;剩下的各加入 I2/NaOH 溶液,能 产生亮黄色固体的为 2-己醇。
COOH
NO2 NHCOCH3
NO2 CH2CH3
CH2CH3
NO2
NO2
COOH
HNO3 H2SO4
COOH OH HNO3 H2SO4 O2N
COOH
HNO3 H2SO4
CH3
OCH3
H3CO
HNO3 H2SO4
NO2
COOH OH
COOH OH
COOH
NO2
NO2
CH3 OCH3
NO2
OCH3
(3) CH3CH2CH3 + MgBr(OC2H5) (4) CH3CH2CH3 + MgBr2 (5) CH3CH2CH3 + Br Mg (C C CH2 CH2 CH3)
有机化学第7章 芳香烃

第五节 苯环上亲电取代反应的定位规律
一、一元取代苯的定位规律 苯的一元取代物只有一种。而一元取代苯 进行取代反应
时,第二个基团取代环上不同位置的氢原子,可能得到邻、 间和对位三种二元取代产物;但对一个具体反应来说,这些 位置上的氢原子被取代的机会不是均等的。
如果不考虑取代基的影响,仅从统计规律的角度来分析, 邻对位产物应为60%,间位产物为40%。
CH=CH2
C=CH
CH3-C=CHCH3
苯乙烯 (乙烯基苯)
苯乙炔
2-苯基-2-丁烯
知识拓展:常见的芳基 芳基--芳烃分子的芳环上去一个H,用 “Ar”表示. 苯基--苯分子上去一个H,用“Ph”表示. 甲苯基--甲苯分子中苯环上去一个H 苄基--甲苯的甲基上去一个H
CH2Cl
CH2OH
苄氯(氯化苄)
CH2CH2CH3
CH3CHCH3
丙苯
异丙苯(枯烯)
CH3
CH3
2.多环芳烃
CH3 CH3
CH3 CH3
联苯
3.稠环芳烃
8
1
7
2
6
3
5
4
萘
对联三苯 蒽
二、芳烃的命名
1.一元取代苯的命名
烷基为取代基,苯为母体。
CH3
C2 H5
甲苯
乙苯
CH2CH2CH3
正丙苯
H3C
CH3
CH
异丙苯
2. 苯的二元取代苯的命名
+ CH3CH CH2
无水AlCl3 痕量HCl
CH CH3 CH3
烷基化反应时,常常伴随多烷基化反应发生。为了使
一烷基苯为主要产物,制备时,苯要过量。傅 -克烷基化
有机化学课件——Chapter 07 醇、酚、醚

有机化学课件
32
第七章 醇、酚、醚
3. 醇的脱水反应
在浓硫酸催化下,醇通常发生脱水反应得到烯烃或醚. 反应涉及碳正离子中间体. 如果产物为烯烃则遵从Saytzeff规则. 较低温度下反应主要发生分子间脱水成醚, 通常低于140oC . 较高温度下主要发生分子内脱水成烯烃的反应, 通常高于 180oC.
有机化学课件 26 第七章 醇、酚、醚
醇和氢卤酸反应的局限性在于: 所期待的卤代烃不是总能 高收率地得到, 具体表现为四个方面. ① 大多数醇不能和HI反应得到碘代烷烃; ② 1o和2o醇制备氯代烷收率很低; ③ 总是有消除反应产物(烯烃)生成; ④ 碳正离子中间体经常发生重排,得到重排产物.
有机化学课件
OH CH2CH2CH2COOH
有机化学课件 5 第七章 醇、酚、醚
三、醇的物理性质
Unusually high boiling points due to hydrogen bonding between molecules. Small alcohols are miscible in water, but solubility decreases as the size of the alkyl group increases.
有机化学课件
17
第七章 醇、酚、醚
1º, 2º, 3º碳的氧化还原程度
氧化: 分子中C-H 变成C-O. 还原: 分子中C-O 变成C-H.
有机化学课件
18
第七章 醇、酚、醚
1) 仲醇的氧化
许多氧化剂都可以将2o醇氧化为酮. 常用氧化剂如: Na2Cr2O7/H2SO4 H2CrO4 可能是氧化反应的活性物种. 氧化反应伴随明显的颜色变化: 反应溶液由橙色(Cr6+) 变为深蓝色(Cr3+).
高职高专《有机化学》课后习题答案 第七章
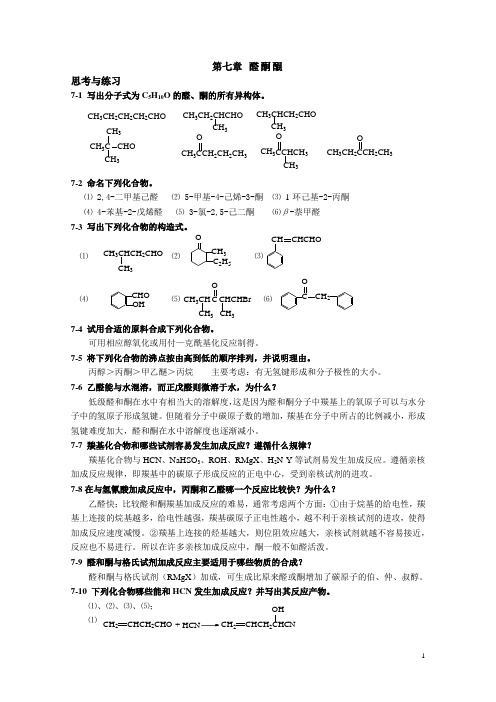
第七章 醛酮醌思考与练习7-1 写出分子式为C 5H 10O 的醛、酮的所有异构体。
7-2 命名下列化合物。
⑴ 2,4-二甲基己醛 ⑵ 5-甲基-4-己烯-3-酮 ⑶ 1-环己基-2-丙酮 ⑷ 4-苯基-2-戊烯醛 ⑸ 3-氯-2,5-己二酮 ⑹β-萘甲醛 7-3 写出下列化合物的构造式。
⑴ ⑵ ⑶⑷ ⑸ ⑹7-4 试用合适的原料合成下列化合物。
可用相应醇氧化或用付—克酰基化反应制得。
7-5 将下列化合物的沸点按由高到低的顺序排列,并说明理由。
丙醇>丙酮>甲乙醚>丙烷 主要考虑:有无氢键形成和分子极性的大小。
7-6 乙醛能与水混溶,而正戊醛则微溶于水,为什么?低级醛和酮在水中有相当大的溶解度,这是因为醛和酮分子中羰基上的氧原子可以与水分子中的氢原子形成氢键。
但随着分子中碳原子数的增加,羰基在分子中所占的比例减小,形成氢键难度加大,醛和酮在水中溶解度也逐渐减小。
7-7 羰基化合物和哪些试剂容易发生加成反应?遵循什么规律?羰基化合物与HCN 、NaHSO 3、ROH 、RMgX 、H 2N-Y 等试剂易发生加成反应。
遵循亲核加成反应规律,即羰基中的碳原子形成反应的正电中心,受到亲核试剂的进攻。
7-8在与氢氰酸加成反应中,丙酮和乙醛哪一个反应比较快?为什么?乙醛快;比较醛和酮羰基加成反应的难易,通常考虑两个方面:①由于烷基的给电性,羰基上连接的烷基越多,给电性越强,羰基碳原子正电性越小,越不利于亲核试剂的进攻,使得加成反应速度减慢。
②羰基上连接的烃基越大,则位阻效应越大,亲核试剂就越不容易接近,反应也不易进行。
所以在许多亲核加成反应中,酮一般不如醛活泼。
7-9 醛和酮与格氏试剂加成反应主要适用于哪些物质的合成?醛和酮与格氏试剂(RMgX )加成,可生成比原来醛或酮增加了碳原子的伯、仲、叔醇。
7-10 下列化合物哪些能和HCN 发生加成反应?并写出其反应产物。
⑴、⑵、⑶、⑸; ⑴CH 3CH 2CH 2CH 2CHOCH 3CH 2CHCHOCH 3CH 3CHCH 2CHOCH 3CH 3C CH 3CH 3CHOCH 3C O CH 2CH 2CH 3CH 3C O CHCH 3CH 3CH 3CHCH 2CHO 3CH CHCHOOC 2H 5CH 3CH 3CH 3CH CHCHBr C OCH 3CHO OHCH 2C O OHCH 2CHCH 2CHO CH 2CHCH 2CHCN CH 3CH 2CCH 2CH 3O⑵ ⑶⑸7-11 丙酮中混有少量丙醛,如何提纯丙酮。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、第一类定位基--邻对位定位基
电子效应: 一般为推电子基团; 活化基团(推电子基团,使苯环电子云 密度增大,亲电反应易于进行)。
- +
H3C
理论解释: 共价键理论的解释:
+
受推电子基的影响,邻对位d-,亲电试剂 易于进攻;间位d+,亲电试剂难于进攻。
2、第一类定位基--邻对位定位基
+
较稳定
X X X X X
+
E H
X
E H
X H E
E H
X H E
E H
X H E
E H
较稳定
+
E
H
5、小结:各类取代基性能特性表
性能 邻对位定位基 间位定位基
强度
最强
强
中
弱
弱
强
最强
取 代 基
O-
NR2, NHR, OCOR, NH2, NHCOR OH, OR
F, NHCHO, Cl、Br、I, C6H5, CH2Cl, CR3, CH=CHCOOH, CH3 CH=CHNO2
+
Cl H 2C Cl
Cl2, hv
1、卤代反应
实验:甲苯的溴代
2、硝化反应nitration
+ HNO3 H2SO4 50~60oC NO2 + H2O
浓硝酸、浓硫酸的混合物常称为“混酸”。
2、硝化反应
反应机理:
2H2SO4 + HONO2
O2N H
NO2+ + H3O+ + 2HSO4硝酰正离子
CH CH 2
C CH
2-甲基-3-苯基戊烷
苯乙烯
苯乙炔
苯环上有多个不同的取代基时,区别对待。
NO2 < X < R < OR <NH2 < OH <CHO< COOH phenol, benzaldehyde, benzoic acid.
例:
①一取代: ②多取代:
Cl OCH 3
NO2
硝基苯
邻氯苯甲醚
对二甲苯 p-二甲苯 Para-
C9H12
CH 2CH 2CH 3
CH(CH 3)2
单取代
正丙苯
异丙苯
CH3
CH3
CH3 Et
二取代
Et
Et
1-甲基-2-乙基苯
CH 3
CH 3
CH3
CH 3
三取代
CH 3 CH 3
CH 3
H3C
CH3
连三甲苯
偏三甲苯
均三甲苯 1,3,5- 三甲苯
3、命名
较简单的芳烃以苯环为母体 烃基较长或有不饱和键时,常将苯环作为取代基。
(3) 共振论的解释resonance theory 价键理论的缺陷:
价键理论的主要观点:自旋相反的电子配对运动在 两个成键原子之间,电子的运动只与参与成键的两 个原子有关。强调电子运动的局部性,易于掌握, 在描述离域电子时出现困难。 1、共振论的基本概念: 基本思想: 当一个分子、离子、自由基按照价键规 则可以写出一个以上的经典结构式时,它的真实结 构就是由这些可能的经典结构式叠加而成的共振杂 化体(是一种物质,不是混合物)。
三、单环芳烃的来源和制备
煤的干馏; 石油裂解产品的分离; 石油的“芳构化”: (1)、烷烃的脱氢环化:
Pt, heat, -H2 Pt, heat, -H2
Pt, heat, -H2
Pt, heat, -H2
(2)、环烷烃的异构化脱氢:
异构化 Pt, heat, -H2
四、物理性质
密度比水小;
SO3H
(保护基团、占位基团)
4、傅-克(Friedel-Crafts)反应
(1)、傅-克烷基化反应alkylation reaction
+ RCl
AlCl3
R + HCl
反应机理: RCl + AlCl 3
R+ + AlCl4R H + -络合物 - H+ R
R+
实例1:
+ CH3CH2CH2Cl AlCl3
钝化苯环:较强的吸电子诱导效应,苯环电子云 密度降低;
邻对位定位基:卤原子的p电子的推电子共轭效
应使得卤素对苯环邻对位的钝化小与对间位的钝
化,使得邻对位易与反应;也可从共振论加以解
释(如下图,与酚羟基类似)。
4、第三类定位基--卤素原子
共振论的解释:
X H X H E E X H E X H E X H E
ether
OH OCH 3
邻甲氧基苯酚
③苯环作为取代基:
NH2
苯胺anilineHO
SO3H
对羟基苯磺酸
COOH O2N
间硝基苯甲酸
基团的命名:
芳烃作为基团,统称芳基:“Ar”;
CH 3 CH 2
苯基 (Ph) phenyl
苯甲基 邻甲苯基 苄基 benzyl
二、苯的结构 1800s (1) 价键法
+
O R C Cl or (RCO) 2O
AlCl3
O C R
无水三氯化铝与酰氯络合,要加入等当量的三氯化铝
反应机理:
O R C Cl + AlCl 3
R C O
+ AlCl4-
O R R C O + -络合物 H - H+
R
C
O
4、傅-克(Friedel-Crafts)反应
(2)、傅-克酰基化反应
定位: 苯环上原有取代基对第二个取代基的取代位 置起着定位的作用。
2、第一类定位基-邻对位定位基 directing activator
X + Y X Y + Y
X
X:邻对位定位基;
Y:亲电试剂。
邻对位定位基:
O- ;NH2 ;OH;OCH3;CH3
结构特征: 基团的第一个原子一般为单键原子或负离子
C2H5
乙苯Ethylbenzene
联苯
1,4-联三苯
萘
蒽
C H
三苯甲烷
非苯芳烃:
环戊二烯负离子
2、单环芳烃的同分异构
C7H8 单取代
通式:CnH2n-6(n≥6)
Me
甲苯
CH 3 CH 3
二取代
CH 3
CH3
Et
C8H10
CH 3
CH3
乙苯
邻二甲苯 o-二甲苯 Ortho-
间二甲苯 m-二甲苯 Meta-
+N(CH ) ; 3 3
结构特征:
基团与苯环相邻的第一个原子为不饱和原子或正离 子(除-CX3);
3、第二类定位基--间位定位基
电子效应:
一般为吸电子基团; 钝化基团(吸电子性使得苯环的电子云密度降低, 亲电试剂难以进攻)。
理论解释:
O2N
共价键理论的解释:
+
+
+ -
受吸电子基的影响,邻对位d+,亲电试剂难于进 攻;间位d-,亲电试剂易于进攻。
碳原子sp2杂化,形成三个 s 键; 未杂化的六个p轨道形成66键,p66键使电子
云平均化,电子发生了“离域”;
H H
体系能量降低(主要为共
轭能),体系变得稳定
H
H
(不易发生加成反应)
结构式常写成
H
H
(2)分子轨道理论的解释
E
电 子六 在个 三未 个杂 成化 键的 轨轨 道道 上形 运成 动分 。子 轨 道 。 p
COR, CHO, COOR, +NH , CONH2, 3 +NR COOH, 3 SO3H, CN, NO2, CF3, CCl3 吸 电 子 诱 导
2、共振式的书写规则: 符合经典结构式的书写规则;
同一化合物不同的共振式中原子的位置不能改变;
成对电子数目相同。
例:
H2C CH CH CH3
H2C CH CH CH3
例二:
O
O-
OO O
-
O O O-
O-
例三:下列式子中是否互为共振结构的共振式?
H2C CH CH CH2 H3C C CH O H3C C CH3 H2C CH CH2 CH CH2 CH CH2 H2C C CH2 OH H3C C CH2 HC C CH2
-
SO3 + H 3O+ + HSO 4O3S H
+ SO3
SO3-
+ -络合物
+酸、甲苯的磺化:
SO3H 发烟H 2SO4 200~230oC
CH3 + H2SO4 CH3 SO3H + SO3H
SO3H
SO3H
CH3
磺酸基的脱除:
CH3 H3 O+
CH3
酚羟基取代:
OH H OH H E E OH H E OH H E OH H E
+
较稳定
OH OH OH OH OH
+
E H
OH
E H
OH H E
E H
OH H E
E H
OH H E
E H
较稳定
+
E
H
3、第二类定位基--间位定位基
Z +Y Y Z
Z:间位定位基; Y:亲电试剂。
间位定位基:
NO2;CN;COOH;SO3H;CHO;COR
